Содержание
Введение
Практическая часть
Выводы
Литература
Приложение 1. Процесс электролиза в растворах и расплавах электролитов
Приложение 2. Краткая биография Луиджи Гальвани
Приложение 3. Первый период физики последнего столетия
Приложение 4. Гальванические элементы
Приложение 5. Тяжелая вода
Приложение 6. Получение металлов путем электролиза
Приложение 7. Гальваническое производство
Приложение 8. Завод в Челябинске
Приложение 9. Эксперименты
Введение
Актуальность выбранной темы
Еще в восьмом классе на уроках физики мы коснулись такого процесса как электролиз. Нас особенно заинтересовал электрический ток в жидких проводниках. С этим явлением связано много непонятных до этого слов, а также имен ученых, в честь которых названы изобретения, процессы и т. д. Поэтому мы решили выяснить историю открытия электролиза, что оказалось очень занимательно.
Тема занятна еще и тем, что дает возможность интеграции школьных предметов: химии, биологии, ведь мы учимся в естественнонаучном классе.
Электролиз расплавов и растворов электролитов имеет очень широкое применение на практике. Почти в каждом заводе есть гальванический цех. В нашей жизни мы каждый день сталкиваемся с изделиями, полученными на основе этого процесса.
Кроме этого, недавно, на уроках химии мы изучали процесс получения металлов, в котором, конечно же, не обошлось без электролиза. К сожалению, этот момент был изучен недостаточно подробно, а нас он очень заинтересовал, в связи с этим подробно ознакомились с теоретической частью данного процесса, а также раскрыли его на практике.
Таким образом, тема очень актуальна в наше время, дает возможность её глубокого раскрытия, а также дальнейшего изучения и разработки.
Цели и задачи
Цель исследования:
выяснение природы электрического тока в жидких проводниках и рассмотрение его применения на практике.
Поставленная цель потребовала решения ряда взаимосвязанных задач:
изучение механизма электрического тока в жидких проводниках;
рассмотрение открытия явления электролиза;
ознакомление с краткими биографиями ученых, участвующих в исследовании этого процесса;
сравнение первых гальванических элементов с современными батарейками ведущих фирм мира;
сравнение батареек ведущих фирм мира между собой;
изучение применения электролиза (тяжёлая вода, получение металлов, гальваническое производство);
проведение экспериментов в домашних условиях с использованием процесса электролиза, создание инструкции.
Практическая часть
Сначала мы подробно изучили процесс электролиза и сделали вывод, что электрический ток в растворах (или расплавах) электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях.
Далее была рассмотрена биография Луиджи Гальвани, его открытия, пробы и ошибки. Подробное изучение первого периода физики последнего столетия помогло нам понять, как много времени, средств и сил затрачено на это открытие, выяснение его природы. Толчком к открытию процесса электролиза стали исследования Луиджи Гальвани о животном электричестве, раскрытие истинной природы данного процесса принадлежит другому учёному – Алессандро Вольту. Он же нашёл применение на практике – создал вольтов столб.
От Вольтова столба мы перешли к изучению других гальванических элементов. Их оказалось огромное множество. Со временем они усложнялись, приобретали новые особенности. Каждый из них имел свои минусы и плюсы. Например, одни были удобны для переноски, другие служили источником тока на телеграфных станциях. Изучив этот материал, мы сделали следующие выводы. Достоинство гальванического элемента измеряется силой тока, им развиваемого, и продолжительностью его действия, а именно произведением первой величины на другую. Стоимость устройства и пользование батареей имеет большое значение в технических вопросах. Почти во всех лучших элементах употребляется цинк, который во время действия элемента окисляется и растворяется в количестве, эквивалентном количеству электричества, протекающему в это время по проводникам, т. е. силе тока. Сопротивления элементов, как зависящие от размеров пластинок, величины погруженной части их в жидкость, от качества глиняных банок в элементах, где таковые содержатся, представляют величины, имеющие определенное значение лишь в конкретных частных случаях. Электровозбудительные силы не зависят от размеров элементов, но зависят от крепости кислоты и степени насыщенности солей, в которые погружены одни и те же пластинки.
Создание гальванических элементов – долгий путь к современным батарейкам.
В последние десятилетия возрос объем производства щелочных аналогов элементов Лекланше, в том числе воздушно-цинковых. Так, например в Европе производство щелочных марганцево-цинковых элементов стало развиваться в 1980 г., а в 1983 г. оно достигло уже 15% общего выпуска.
Использование свободного электролита ограничивает возможности применения автономных и в основном используется в стационарных ХИТ. Поэтому многочисленные исследования направлены на создание так называемых сухих элементов, или элементов с загущенным электролитом, свободных от таких элементов, как ртуть и кадмий, которые представляют серьезную опасность для здоровья людей и окружающей среды.
Такая тенденция является следствием преимуществ щелочных ХИТ в сравнении с классическими солевыми элементами:
существенное повышение разрядных плотностей тока за счет применения пастированного анода;
повышение емкости ХИТ за счет возможности увеличения закладки активных масс;
создание воздушно-цинковых композиций (элементы типа 6F22) за счет большей активности существующих катодных материалов в реакции электровосстановления дикислорода в щелочном электролите.
Фирма Duracell – признанный лидер в мире по производству щелочных гальванических источников одноразового действия. История фирмы насчитывает более 40 лет. Сама фирма расположена в Соединенных Штатах Америки. В Европе ее заводы находятся в Бельгии. По мнению потребителей как у нас, так и за рубежом по популярности, продолжительности использования и соотношению цены и качества батарейки фирмы Duracell занимают ведущее место. Плотности разрядного тока в литиевых источниках не велики (по сравнению с другими ХИТ), порядка 1 мА/см2
. При гарантированном сроке хранения 10 лет и разряде малым током рационально использовать литиевые элементы Duracell в высокотехнологичных системах. Запатентованная в США технология EXRA-POWER с применением двуокиси титана (TiO2) и других технологических особенностей способствует повышению мощности и эффективности использования марганцево-цинковых ХИТ фирмы Duracell. Внутри стального корпуса щелочных элементов "Duracell" расположен цилиндрический графитовый коллектор, в котором находится пастообразный электролит в контакте с игольчатым катодом. Гарантированный срок хранения элементов 5 лет, и при этом - емкость элемента, указанная на упаковке, гарантируется в конце срока хранения.
Концерн Varta – один из мировых лидеров по производству ХИТ. 25 заводов концерна расположены в более чем 100 странах мира и выпускают более 1000 наименований аккумуляторов и батареек. Основные производственные мощности занимает Департамент стационарных промышленных аккумуляторов. Однако порядка 600 наименований гальванических элементов от батареек для часов до герметичных аккумуляторов производятся на заводах концерна Департаментом приборных батарей в США, Италии, Японии, Чехии и т.д., при гарантии неизменного качества вне зависимости от географического расположения завода. В фотографической камере первого человека, ступившего на Луну, были установлены батарейки концерна Varta. Они достаточно хорошо известны нашим потребителям и пользуются устойчивым спросом. Panasonic Corporation — крупная японская машиностроительная корпорация, один из крупнейших в мире производителей бытовой техники и электронных товаров. В 2007 году компания заняла 59-е место по объёму выручки в глобальном рейтинге компаний Fortune Global 500 http://ru.wikipedia.org/wiki/Panasonic - cite_note-0. До 1 октября 2008 года носила название Matsushita Electric Industrial Co., Ltd. (Panasonic была одной из торговых марок этой компании). Штаб-квартира — в городе Кадома префектуры Осака (Япония).
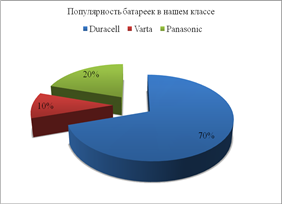
Диаграмма 1.

Диаграмма 2.
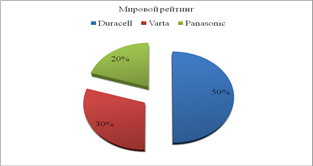
Диаграмма 3.
Важнейшее значение электролиз имеет при получении тяжелой воды Тяжёловодородная вода имеет ту же химическую формулу, что и обычная, но вместо атомов обычного лёгкого протия содержит два атома тяжёлого изотопа водорода – дейтерия. История её открытия и получения подробно раскрыта в приложении 5. Сначала тяжёлая вода была получена в малых количествах, затрачено много средств, в особенности объёмов воды, которые подвергаются электролизу. Далее процесс был усовершенствован. Тяжёлая вода нашла широкое применение. Важнейшим её свойством является то, что она практические не поглощает нейтроны, поэтому используется в ядерных реакторах для их торможения и в качестве теплоносителя. Также применяется в качестве изотопного индикатора в химии, биологии и гидрологии. В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Получение металлов также не обошлось без использования электролиза. Так, к примеру, получают алюминий из его расплава.
Более широкое применение данный процесс нашёл в гальваническом производстве. Гальваническое покрытие – это металлическая пленка толщиной от долей микрона до десятых долей миллиметра, наносимые на поверхность неметаллических изделий методом гальваники для придания им твердости, износостойкости, антикоррозийных, антифрикционных, декоративных свойств. Из самых распространённых процессов сюда относится меднение, никелирование, хроматирование и др. Существует так же и гальванопластика – осаждение толстого, массивного слоя металла на поверхности какого-либо предмета, форму которого хотят воспроизвести, скопировать.
Данные процессы широко распространены в наше время. Гальванические цеха есть на большинстве заводов. Один из таких заводов описан в приложении 8.
Некоторые механизмы гальванопластики и гальваностегии возможно осуществить и в домашних условиях. Это мы доказали, проведя некоторые опыты. (Приложение 9.) Конечным результатом работы стало создание инструкции по проведению таких опытов, которые вы можете попробовать сами.
Гальваностегия и гальванопластика
Урок гальванопластики
После анодирования алюминия естественно будет перейти к очередным электрохимическим опытам, благо под рукой есть и электролитическая ванна, и источник тока, и ключ с реостатом. В этих экспериментах мы будем извлекать металл из раствора и наносить его на поверхность. Этот процесс называют гальваностегией, а покрытия - гальваническими. Кстати, анодирование алюминия тоже относится к гальваностегии.
Сначала поучимся наносить на стальную поверхность медь. Меднение очень распространено в промышленности, и не только как самостоятельный процесс, но и (пожалуй, даже чаще) как подготовительная операция перед покрытием другими, более прочными и нарядными пленками: хромовыми, никелевыми, серебряными. Причина в том, что медь, правильно нанесенная, очень прочно держится на стали и выравнивает шероховатости и дефекты его поверхности, а другие металлы, в свою очередь, хорошо осаждаются на медной пленке.
Казалось бы, все просто: обработал стальную деталь раствором медного купороса, более активное железо вытеснило медь из раствора, и она осела на поверхность. Действительно, так и будет (можете проверить, опустив чистый гвоздь в раствор CuSO4
). Но слой меди на поверхности очень рыхлый - его легко стереть даже тряпкой. А при электрохимической обработке медный слой получается ровным и прочным.
Вот очень простой способ меднения. С одного конца мягкого многожильного провода снимите изоляцию и растеребите тонкие медные проволочки, чтобы получилась "кисть". Для удобства работы привяжите ее к деревянной палочке или карандашу, а другой конец провода подсоедините к положительному полюсу батарейки для карманного фонаря. Электролит - концентрированный раствор медного купороса, желательно слегка подкисленный, - налейте в широкую склянку, в которую удобно будет макать "кисть". Подготовьте стальную пластинку или другой небольшой предмет, желательно с плоской поверхностью. Протрите его мелкой наждачной шкуркой и обезжирьте, прокипятив в растворе стиральной соды. Положите пластинку в ванночку или кювету и подсоедините ее проводом к отрицательному полюсу батарейки. Схема собрана, осталось только ввести электролит. Обмакните "кисть" в раствор медного купороса и проведите ею вдоль пластинки, стараясь не дотрагиваться до поверхности; работайте так, чтобы между пластинкой и кистью был всегда слой электролита. Проводки все время должны быть смочены раствором. На глазах пластинка будет покрываться красным слоем металлической меди. На обработку маленькой детали уйдут считанные минуты. Если же поверхность побольше, то потребуется не только дополнительное время, но и дополнительная батарейка; соедините ее с первой параллельно. Когда покрытие нанесено, высушите деталь на воздухе и матовый слой меди натрите до блеска шерстяной или суконной тряпкой. Кстати, этот опыт можно ставить и с алюминиевой, и с оцинкованной пластинкой. Такой процесс, при котором деталь не опускают в электролитическую ванну, а обрабатывают снаружи небольшими участками, добавляя все время электролит, порой используют и на практике, особенно в тех случаях, когда деталь настолько велика, что для нее не подберешь подходящей ванны. Например, когда надо подновить покрытие на обшивке океанского корабля. Впрочем, если детали невелики, их обычно все же погружают в ванну с электролитом - это быстрее и удобнее. Вот как это делают перед никелированием, ибо без предварительного меднения в этом случае не обойтись
В банку или стакан опустите на проволочках (лучше медных) две медные пластинки - аноды. Между ними на проволочке же подвесьте деталь (все эти проволочки, напоминаем, удобнее всего обмотать вокруг карандаша и положить его на края банки). Те проволочки, которые идут от медных пластинок, соедините вместе и подключите к положительному полюсу источника тока, а деталь - к отрицательному; включите в цепь реостат или радиосопротивления на 200-300 Ом, чтобы регулировать ток, и миллиамперметр (тестер). Источник постоянного тока - две-три батарейки для карманного фонаря, соединенные параллельно, или аккумулятор с напряжением не более 6 В. Раствор электролита - 20 г медного купороса и 2-3 мл серной кислоты на 100 мл воды - налейте в стакан, раствор должен полностью покрыть электроды. Пользуясь реостатом или подбирая сопротивления, установите ток от 10 до 15 мА на каждый квадратный сантиметр поверхности детали. Минут через двадцать выключите ток и выньте деталь - она покрыта тонким слоем меди. Электролит меднения не выливайте, он еще пригодится. Далее - собственно никелирование. Приготовьте новый электролит (30 г сульфата никеля, 3,5 г хлорида никеля и 3 г борной кислоты на 100 мл воды) и налейте этот электролит в другой стакан. Для никелирования нужны никелевые электроды. Опустите их в электролит, соберите схему так же, как при меднении, и включите ток, вновь примерно на двадцать минут. Выньте деталь, промойте и просушите ее. Она покрыта сероватым матовым слоем никеля. Чтобы покрытие приобрело привычный блеск, его надо отполировать. Электролит для хромирования содержит обычно хромовую кислоту. Но так как этой кислоты у вас, вероятно, нет, прибегнем к обходному маневру. Вы уже получали зеленый хромовый пигмент. Если же вы не ставили тот опыт, то имейте в виду, что хромовый зеленый продается в магазинах. Сплавьте оксид хрома с содой на воздухе, т. е. нагрейте смесь в чистой металлической банке. Вы получили хромат натрия Na2
CrO4
. Растворите его в воде, профильтруйте и подкислите серной кислотой; в этом растворе можно проводить хромирование.
Разумеется, если у вас есть готовый хромат натрия, готовить его излишне. Небольшой предмет, который вы собираетесь хромировать, обработайте как обычно наждачной бумагой, обезжирьте, протравите слабым раствором кислоты и промойте. Он будет катодом, подсоедините его к отрицательному полюсу источника тока. Анод нужен инертный, например, графитовый. Разберите старую батарейку и извлеките из нее графитовый стержень. Чтобы получить ток, достаточный для хромирования, надо взять аккумулятор либо несколько батареек для карманного фонаря.
Время опыта и требуемый ток подберите самостоятельно. По окончании электролиза выньте деталь из электролита, тщательно промойте ее и отполируйте до блеска тряпочкой с зубным порошком.
Урок гальванопластики.
Еще один очень распространенный электрохимический процесс – гальванопластика, т.е. осаждение толстого, массивного слоя металла на поверхности какого-либо предмета, форму которого хотят воспроизвести, скопировать. Гальванопластику используют в тех случаях, когда у металлической детали очень сложная форма и обычными способами (литьем или механической обработкой) ее трудно или невозможно изготовить. Так воспроизводят иногда скульптуры по моделям (колесница Аполлона на фронтоне Большого театра сделана гальванопластикой); так же кодируют с записи-эталона металлические формы, в которых прессуют грампластинки, в точности воспроизводя тончайший рельеф бороздок.
Если у вас не осталось раствора для меднения, то приготовьте его вновь. Возьмите кусок воска или парафина, очень тщательно разгладьте его поверхность, чтобы она стала по возможности плоской. На этом гладком участке процарапайте надпись, рисунок или узор. Советуем написать свои инициалы - тогда у вас получится монограмма. Писать удобнее всего иглой, только, пожалуйста, не оставляйте слишком глубоких царапин. Мягкой кисточкой нанесите на поверхность с рисунком электропроводящий порошок. Можно, например, растолочь в ступке грифель простого карандаша или графитовый стержень батарейки. По краям рисунка прижмите к поверхности, покрытой графитом, тонкие оголенные медные проволочки (они будут служить токоотводами) и соедините их между собой. Восковой слепок подвесьте в стакан, налейте электролит, опустите медный электрод и соберите такую же схему, как и в опытах с меднением. Но в отличие от гальваностегии тут нужен намного меньший ток, примерно 5-10 мА. Поэтому придется передвинуть движок реостата или же подобрать другое радиосопротивление. Включите ток и наберитесь терпения, потому что при таком токе медь будет осаждаться на графитированной поверхности по меньшей мере пять часов, если не больше, однако увеличивать ток не надо: качество работы будет гораздо хуже. Разомкните цепь и выньте из стакана восковой слепок. Осторожно опустите воск в горячую воду – он расплавится. А у вас в руках окажется тонкий медный листок с узором.
Аккуратно оторвите от него проволочки-токоотводы. Точная копия рисунка получена. Теперь можно перейти к весьма полезному делу: к изготовлению способом гальванопластики уникальных значков. Они будут только в вашей коллекции! Если же в кружке вы сделаете двадцать-тридцать сувениров, они долго будут напоминать вам и вашим товарищам о туристическом походе, о спортивных соревнованиях. Советов художественного свойства давать не будем: эскиз придумайте сами. Не надо сложных значков: и делать труднее, и смотрятся они хуже. По эскизу вырежьте шаблон из тонкого картона - он должен повторять внешний контур значка. Положите шаблон на тонкую медную или латунную фольгу и аккуратно вырежьте по нему столько заготовок, сколько значков вы собираетесь сделать. Ваша заготовка мягкая. Чтобы она стала жесткой, покройте ее слоем меди в гальванической ванне. В принципе вы уже умеете это делать; здесь вы найдете советы применительно к изготовлению значков. Заготовки проткните у края иглой и пропустите в отверстие тонкую медную проволочку. Промойте заготовки, протрите бензином и зубным порошком, еще раз промойте и, держа за подвеску или с помощью пинцета, опустите на полминуты в разбавленный, примерно 5%-ный раствор азотной кислоты. Напоследок промойте в проточной воде и подвесьте на металлический стержень. Всю подвеску опустите в стакан с двумя медными пластинками-анодами (значки будут катодами). Листочки фольги должны быть расположены на разных уровнях, чтобы они не закрывали друг друга. В стакан налейте электролит - 25 г медного купороса и 1,5 мл серной кислоты на 100 мл воды, желательно дистиллированной. Источник тока - аккумулятор; можно использовать и трансформатор с выпрямителем. Ток в цепи около 10 мА на 1 см2
. Толщина медного слоя должна быть 0,5-0,8 мм. Когда меднение закончено, промойте детали. Если вы решили сделать на значке рельефное изображение или надписи, наметьте их иглой. Ту часть поверхности, которую покрывать не надо, закройте тонким слоем клея БФ, лака или парафина, опустите заготовки в электролит и опять включите ток, чтобы открытые участки покрылись слоем меди - тогда они станут выпуклыми. После этого клей или парафин снимите. Если сумеете, выгравируйте на значке надпись или изображение, и обязательно припаяйте с обратной стороны булавку. Наконец, придадим значку нарядный вид. Химическая окраска и никелирование вполне пригодны. Но еще лучше выглядят значки "под старое серебро". Заготовьте 2-3%-ный раствор нитрата серебра (можно растворить в воде аптечный ляписный карандаш). Небольшими порциями добавляйте соляную кислоту - три-четыре объема на один объем раствора.
С выпавшего осадка хлорида серебра слейте раствор, осадок несколько раз промойте дистиллированной водой, сливая воду очень аккуратно, по стеклянной палочке, чтобы не терять хлорид серебра. К отмытому осадку добавьте небольшими порциями 30%-ный раствор иодида калия до тех пор, пока осадок не растворится полностью. Долейте воду, чтобы довести объем раствора до первоначального. У вас должно быть столько же электролита для серебрения, сколько вы приготовили его для меднения. В этот электролит погрузите значки (они вновь будут катодами). Анодами могут служить графитовые стержни, лучше из батареек, а не из карандашей, потому что их площадь должна быть немного больше площади значков. Плотность тока небольшая, около 1 мА/см2
. Так на значках образуется слой серебра и, конечно, оно выглядит как новое. Однако не такая уж хитрость почернить значки под старое серебро... Водный раствор сульфида калия примерно 0,5-1%-ной концентрации нагрейте до 50o
С. Значки в этом растворе постепенно изменят цвет - они станут сначала серыми, потом синеватыми и, наконец, черными. Промойте значки и потрите их фетром или суконкой. Тогда выпуклые части посветлеют, остальная же поверхность останется черной, и значки будут выглядеть именно так, как изделия из старого серебра.
Экологическая составляющая
Гальваническое производство является одним из наиболее опасных источников загрязнения окружающей среды, главным образом поверхностных и подземных вод. Ввиду образования большого объёма сточных вод, содержащие вредные примеси тяжёлых металлов, неорганических кислот и щелочей, поверхностно-активных веществ и других высокотоксичных соединений, а также большого количества твёрдых отходов, особенно от реагентного способа обезвреживания сточных вод.
Экологическая опасность гальванического производства характеризуется объёмом потребляемой и сбрасываемой воды. Поэтому усилия по снижению экологической опасности должны быть направлены на проведение мероприятий, снижающих объём и токсичность образующихся отходов.
На предприятии сточные воды после гальванического производства проходят очистку на станции нейтрализации, где обезвреживаются и после нейтрализации сбрасываются на городские очистные сооружения на дополнительную очистку.
Выводы
На основе изученного нами обширного материала и собственных исследований можно сделать вывод, что электрический ток в жидких проводниках – важнейшее открытие в истории человечества, которое находит свое применение в разных средах: биологии, медицине, химии, промышленном производстве и т. д. Без этого процесса невозможно было бы получить некоторые чистые металлы, произвести обработку изделий, создать великолепные памятники (гальванопластика), ювелирные украшения и многое другое. Велико значение электролиза в получении тяжелой воды для ядерных реакторов. Применение этого процесса можно перечислять бесконечно, т. к. со временем оно становится еще более незаменимым, быстро расширяет свои границы.
Литература
1. Гальвани А., Вольта А. «Избранные работы о животном электричестве.» - М.; Л.: ОГИЗ, 1937.
2. Розенбергер Ф. «История физики.» - М.; Л.: ОНТИ, 1937.
3. Большая советская энциклопедия. В 30 тт.
4. Кудрявцев П.С. Курс истории физики. М. : Просвещение, 1982.
5. О. Ф. Кабардин, В. А. Орлов «Физика 10 класс» - М.: Просвещение, 1995.
6. Кириллова И. Г. «Книга для чтения по физике» - М.: Просвещение, 1986.
7. Интернет: http://galvan.ru/.
Приложение 1
Процесс электролиза в растворах и расплавах электролитов
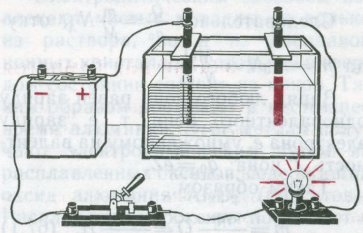
Электрический ток в металлах никакими химическими процессами не сопровождается. Это объясняется тем, что носителями тока в металлах являются электроны. Но существует такой класс проводников, в которых электрический ток всегда сопровождается определенными химическими изменениями: растворы солей, кислот и оснований, т. е. растворы электролитов, а также их расплавы.
Соединим с источником тока последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены угольные электроды. Химически чистая вода почти не проводит электрического тока. Замкнув цепь, мы увидим, что лампа не горит. Однако если мы растворим в воде какую-нибудь соль, например медный купорос, то лампа загорится, а на катоде из раствора выделится медь.
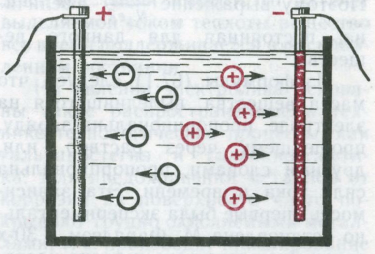
При протекании электрического тока через растворы электролитов вместе с зарядом всегда переносится вещество (это явление называется электролизом). Отсюда следует, что носителями тока в этих проводниках являются заряженные атомы, или группы атомов, т. е. ионы. При растворении в воде солей, кислот и щелочей нейтральные молекулы этих веществ расщепляются на положительные и отрицательные ионы. Это явление называется электролитической диссоциацией.
Растворы электролитов всегда содержат некоторое число ионов: катионов (положительных ионов) и анионов (отрицательных ионов). Пока электрическое поле отсутствует, ионы совершают только беспорядочное тепловое движение. Но в электрическом поле ионы, подобно электронам в металлах, начинают дрейфовать в направлении действующей на них силы: катионы — к катоду, анионы — к аноду.
Электрический ток в растворах (или расплавах) электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях.
Приложение 2
Краткая биография Луиджи Гальвани
Итальянский анатом и физиолог Луиджи Гальвани, один из основателей учения об электричестве, основоположник электрофизиологии, родился в Болонье. В 1759 г. окончил Болонский университет, в котором изучал сначала богословие, а затем медицину, физиологию и анатомию; в 1762 г. получил степень доктора медицины. Преподавал медицину в Болонском университете, откуда незадолго до смерти был уволен за то, что отказался принести присягу Цизальпинской республике, основанной в 1797 г. Наполеоном Бонапартом.
Первые работы Гальвани посвящены сравнительной анатомии. В 1771 г. он начал опыты по животному электричеству: открыл и исследовал феномен сокращения мышц препарированной лягушки под влиянием электрического тока; наблюдал сокращение мышц при соединении их металлом с нервами или спинным мозгом, обратил внимание на то, что мышца сокращается при одновременном прикосновении к ней двух разных металлов. Гальвани объяснил эти явления существованием «животного электричества», благодаря которому мышцы заряжаются подобно лейденской банке. Результаты наблюдений и теорию «животного электричества» он изложил в 1791 в работе «Трактат о силах электричества при мышечном движении» («De Viribus Electricatitis in Motu Musculari Commentarius»). Новыми опытами (опубликованы в 1797) Гальвани доказал, что мышца лягушки сокращается и без прикосновения к ней металла – в результате непосредственного её соединения с нервом. Исследования Гальвани имели значение для медицинской практики и разработки методов физиологического эксперимента.
Приложение 3
Первый период физики последнего столетия
Животное электричество (приблизительно от 1790 до 1800 г.).
После того как вызванные открытием электрической машины, лейденской банки и т. п., порывы энтузиазма улеглись и радужные надежды, связанные с этими открытиями, значительно ослабели, было произведено внезапное, без всяких предвестников и без всяких видимых причин, новое открытие в области электричества, которое повлияло на судьбу физики сильнее всех прежних. Виновника этого открытия почтили тем, что перенесли его имя на новую отрасль физической дисциплины, гальванизм.
Вопрос о новом виде электричества.
Первое известие об этом открытии Гальвани сам сообщил в небольшой работе «De viribus electricitatis musculari commentanus» (Comment. Bonon., VII, 1791) («О влиянии электрических сил на движение мускулов животных»). Многие физики относят начало работ Гальвани по этому вопросу к 1780 г.; но начальные слова Гальвани в приведенном сочинении делают это мало вероятным. «Мне хотелось,— говорит Гальвани, — издать в свет сочинения хотя бы в несовершенной и незаконченной... но, по крайней мере, не в первоначально грубой, едва начатой форме. Но так как я почувствовал, что у меня не хватит на это ни времени, ни досуга, ни умственных сил, я предпочел пользу дела своему естественному желанию». Повод к своему открытию он описывает так: «Я разрезал лягушку... и положил ее без всякого умысла на стол, где стояла электрическая машина, отдельно от кондуктора, на довольно значительном расстоянии от последнего. Но когда один из моих слушателей приблизил острие ножа к бедренному нерву, мышцы всех конечностей вдруг сократились, как от сильной судороги. Другой из присутствовавших утверждал, что это явление произошло лишь тогда, когда кондуктор дал искру. Он очень удивился этому новому явлению и рассказал мне о нем, так как я был занят в это время чем-то совершенно другим. У меня явилось желание тотчас же увидеть это новое явление и расследовать его скрытую причину». Упомянутый «другой из присутствовавших» заставлял впоследствии многих ломать себе голову над вопросом, кто бы это мог быть. В Болонье утверждали, что это была жена Гальвани, которой в сущности и принадлежит честь открытия явления. Замена слова «другой» именем определенного лица, конечно, увековечила бы последнее; но упрекать Гальвани за такую забывчивость все-таки нельзя.
То явление, которое наблюдал «другой», представляло собою не более как особую форму общеизвестного тогда влияния разрядов электричества (от трения при прохождении их через тело животного); а то обстоятельство, что здесь искра машины действовала не прямо, не должно было показаться удивительным, после того как стало известно электрическое влияние на расстоянии. Во всяком случае, сам Гальвани не разделял сильно распространенного и до сих пор, но ложного, мнения, будто в этом наблюдении уже заключалось открытие нового вида электричества. Он лично с большим усердием занялся всесторонним исследованием влияния знакомых источников электричества на мускулы животных. И только после продолжительных многократных и тщательных опытов Гальвани пришел к неожиданным результатам: он констатировал, что сокращения происходят лишь в то время, когда из машины извлекаются искры; что сокращения бывают более или менее сильны, независимо от напряжения электричества машины, смотря по тому, прикасается ли рука к костяной рукоятке ножа, или к его железной оправе, или, наконец, к железным гвоздям. Опыты с железными прутьями и сухими стеклянными палочками ясно показали, что воспроизведения явления необходимо прикосновение к нерву при помощи проводящего тела, и притом достаточно большого. Сообщение мышц с неизолированным телом или отведение их при помощи проволоки к земле в высокой степени способствовало получению сильных сокращений. В соответствии с этим Гальвани установил различие между нервными и мышечными кондукторами как факторами, необходимыми для наступления мышечных сокращений или, по крайней мере, способствующими им. Сокращение оказалось до известной степени в прямом отношении как к силе искры и животного, так и к силе кондукторов, особенно нервного; но в обратном отношении к расстоянию от кондуктора машины. Искры отрицательного электричества не отличались по своему действию от искр положительного: искры электрофора действовали так же, как искры от машины. Соприкосновение с нервами, отпрепарированными на живом животном, давало такие же сокращения, как и на умерших животных. Теплокровные животные тоже давали сокращения, но обыкновенно несколько более слабые, чем холоднокровные. Затем Гальвани исследовал действие естественных электрических искр, а именно молнии. С крыши дома была спущена длинная проволока, которая была присоединена к нервам задних конечностей лягушки.

Теплокровные животные тоже давали сокращения, но обыкновенно несколько более слабые, чем холоднокровные. Затем Гальвани исследовал действие естественных электрических искр, а именно молнии. С крыши дома была спущена длинная проволока, которая была присоединена к нервам задних конечностей лягушки.
Другой проводник (мышечный кондуктор), присоединенный к мышцам такого же препарата, был спущен в колодезь вплоть до воды. «Как только появлялись молнии, тотчас же мышцы приходили в сильные сокращения, которые совпадали по времени с молнией и предшествовали грому. Согласие явлений было настолько велико, что сокращения происходили и в случае, когда мышечного кондуктора не было или нервный был изолирован». Сокращения происходили и без молний, если только небо было покрыто тучами, или когда облака проходили невысоко над нервным кондуктором. Но тогда и поставленные рядом электрометры показывали присутствие электричества. После этого Гальвани постарался выяснить, не действует ли и нормальное атмосферное электричество на мышцы лягушки, оказавшиеся до сих пор столь чувствительным электроскопом. «Так как мне часто случалось вешать приготовленных для опытов лягушек на окружавшую наш дом железную решетку при помощи железных крючков, проткнутых через спинной мозг, и я заметил сокращения мышц не только во время молнии, но также в ясную тихую погоду, то я полагал, что причина этих явлений лежит в дневных колебаниях атмосферного электричества. Поэтому я стал наблюдать препараты в разные часы в течение нескольких дней подряд, но едва заметил несколько сокращений в мускулах. Утомленный ожиданием, я изогнул и плотно прижал к решетке крючок, пропущенный через спинной мозг, чтобы видеть, не удастся ли теперь вызвать мышечные сокращения и не получится ли каких-либо изменений в связи с различными состояниями атмосферы и электричества. Теперь сокращения появлялись нередко, однако, вне всякой связи с изменением состояния атмосферы или электричества. Но так как сокращения эти наблюдались мною лишь на открытом воздухе (в других местах я этих опытов еще не делал), то легко было приписать их атмосферному электричеству, которое входит в животное, скопляется здесь и сильно разряжается при соприкосновении с решеткой». До этих опытов мысль о новом источнике электричества еще не появлялась в уме Гальвани, поворот наступил лишь тогда, когда Гальвани решил повторить те же самые опыты в закрытом помещении. «Когда я, — продолжает Гальвани, — внес лягушку в комнату, положил ее на железную пластинку и приблизил к последней крючок, проткнутый через спинной мозг, то получились прежние движения, прежние сокращения. Затем мною было испробовано то же самое с различными металлами, в различных местах, в разные дни и часы, и всегда результат получался одинаковый; разница была лишь в том, что от различных средств получались и различные сокращения, в одних случаях сильнее, в других слабее. Непроводящие тела вовсе не давали сокращений. Этот результат нас очень удивил, и мало-помалу мы пришли к мысли о присущем животному электричестве. Предположение это усилилось еще более, когда мы во время явления стали замечать как будто перемещение тонкой нервной жидкости из нервов в мышцы, подобное такому же перемещению в лейденской банке. Именно, когда я держал препарированную лягушку одной рукой за крючок, пропущенный через спинной мозг таким образом, что ноги лягушки касались серебряной чашки, а другой рукой прикасался при посредстве металлического тела к верхнему краю или к бокам серебряной чашки, на которой находились ноги лягушки, то животное, вопреки всякому ожиданию, приходило в сильнейшие сокращения и это происходило неизменно каждый раз при повторении этого опыта». Последний опыт Гальвани видоизменил таким образом, что лягушку держал он сам, а прикасался к серебряной чашке другой. Тогда явление не имело места; но стоило наблюдателям взяться за руки и образовать цепь, сокращения появлялись при каждом прикосновении. Еще красивее, однако, был следующий опыт. «Если держать лягушечий препарат с крючком в спинном мозгу приподнятым за одну ногу и опустить на серебряную пластинку таким образом, чтобы другая нога и крючок прикоснулись к серебру, то вследствие сокращения мышц свободная нога подпрыгивает, затем опускается и, коснувшись серебряной пластинки, опять подпрыгивает и т. д., представляя к немалому удивлению и удовольствию наблюдателей подобие электрического маятника». Для удачи опыта не нужно и металлической пластинки, — достаточно соединить металлической дугой бедренный нерв с мышцами. Замечательно при этом, что если применять для этого один и тот же металл, то движения чисто получаются слабые, или их даже вовсе не бывает; но стоит только ввести в цепь кусок меди или, еще лучше, серебра, и сокращения делаются тотчас же более сильными и продолжительными. Всего сильнее получаются мышечные сокращения, если нерв обложить оловянной фольгой (станиолем) и наложить проводящую дугу. Тогда в цепь можно ввести даже несколько человек без заметного ослабления движения. Вероятно, на обкладке, как в лейденской банке, своеобразное животное электричество скопляется сильнее, чем без нее. Но где, собственно, находится это электричество, находится ли одно из них в мышце, а другое в нерве, или же оба они находятся в мышце, и из какой части оно течет, определить чрезвычайно трудно. Если, однако, можно себе позволить высказывать предположения в таком темном деле, то я склоняюсь к мысли, что местопребывание обоих электричеств следует искать в мышце... Если стать на эту точку зрения, то не покажется уже ни натянутым, ни невероятным гипотетическое уподобление мышечного волокна маленькой лейденской банке или какому-либо другому телу, заряженному двумя противоположными электрическими зарядами, а именно уподобление нерва кондуктору банки, а, следовательно, всей мышцы — значительному количеству лейденских банок». Гальвани приводит целый ряд свойств животного электричества, в подкрепление только что приведенной параллели, упоминает и о таких, которые находятся с ней в противоречии, но, в конце концов, приходит к следующему выводу: «Итак, да позволено нам будет следовать этой не слишком невероятной гипотезе, которую, однако, мы тотчас же оставим, когда другие ученые выскажут более верное суждение о предмете или установят лучшую гипотезу на основании открытий и новых опытов». После того, как Гальвани, сравнив еще открытое им животное электричество с электричеством рыб и с электричеством от трения, установил их различие, он перешел к наиболее интересному для него, как для анатома, объяснению движений животных электричеством и к применению его для лечебных целей. Из мозга исходят импульсы, нарушающие равновесие обоих электричеств сначала в нерве, а потом, так как нерв хороший проводник, и в соответствующих мышцах. Но, как показывают опыты с искусственным электричеством, каждое нарушение равновесия в мускулах вызывает сокращение мышц. Что же касается лечения болезней при помощи искусственного электричества, то оно может быть осуществлено таким образом, что искусственному электричеству, в зависимости от характера болезни, можно дать направление одинаковое или уже противоположное с естественным животным электричеством, соответственно усиливая или ослабляя этим действия последнего.
Таким образом, Гальвани с несомненной гениальностью разрешил очень большую задачу. Несмотря на трудности, он открыл существование непрерывного электрического тока в цепи, составленной из металлов и лягушечьих мышц, установил ряд его свойств и правильно определил на опыте влияние на этот ток металлов, а равно и тела животных. За то, что он ошибся в определении действительного источника этого электричества, он поплатился своею славою в большей мере, чем бы следовало; во всяком случае, сильно распространенное мнение, будто он с самого начала применил для своих опытов два разнородных металла и, следовательно, обладая известной даровитостью, должен был бы придти к мысли о контактном или металлическом электричестве, совершенно неверно. Считая металлы в этих явлениях только проводниками, он употреблял медь или серебро наряду с железом только из-за их большей проводимости. Впоследствии эти опыты удавались ему и без применения металлов, когда он даже препарирование мышц производил стеклянными ножами. Действительно открытое им и не признанное его противниками животное или физиологическое электричество помешало ему заметить, что в большинстве прежних его опытов наблюденные им явления вызывались не этим электричеством, а другим, более сильным металлическим электричеством.
Открытия Гальвани произвели огромное впечатление и вызвали ряд последователей. В письме от 5 апреля 1792 г. д-р Евсевий Валли подтверждает опыты Гальвани и описывает электричество множества различных животных, особенно таких, которые были им умерщвлены каким-нибудь необыкновенным образом. В том же письме он сообщает, что Вольта («один из первых авторитетов в области электричества, гений между физиками») очень усердно занимается этими вопросами. Сам Вольта описал эти работы в письме к миланскому врачу от 3 апреля 1782 г. Подобно Гальвани, он находит, что лягушки наиболее чувствительны, если обнаженные бедренные нервы обложить тонкой металлической пластинкой. Тогда для их сотрясения достаточны такие слабые заряды лейденской банки, которых уже нельзя измерить электрометрам, и которые, следовательно, соответствуют не более 1/10° беннетовского (с золотыми листочками) электрометра. Далее он констатирует, что лягушки действительно представляют собою самый чувствительный из всех существующих до сих пор электроскопов. Как в этом письме, так и в двух последующих, помещенных в том же 1792 г. в «Giornale fisico-medico Brugnatelli» он является сторонником животного электричества; но уже и здесь чувствуется, что он скоро покинет путь, которому следовал Гальвани. Перечисляя условия, при которых происходят сокращения мышцы, Вольта говорит: «В-третьих, эти обкладки должны состоять из разнородных металлов, одна — из свинца или олова, другая — из золота, серебра, латуни и железа. Разнородность металлов совершенно необходима; если же применяется один металл, то, по крайней мере, его необходимо прикладывать возможно различным образом». При этом, в согласии с наблюдениями Гальвани, он отмечает, что вообще наличие двух металлов способствует явлению, и полагает, что если оно происходит и при наложении дуги из одного металла, то, вероятно, в данном случае металл на всем своем протяжении не вполне однороден. Наконец, он делит металлы в зависимости от того, как они распределяют животное электричество, на три класса, а именно: 1) олово и свинец; 2) железо, медь, латунь и 3) золото, серебро и платина. Позднее Вольта указывает на то, что сокращения можно вызвать не только на целых животных или на отдельных членах, но даже на отдельных кусочках мышц, если только применить разнородные обкладки. «Если последние состоят с одной стороны из плотно наложенного листка станиоля, а с другой — из серебряной обкладки, которая лишь прикасается к члену, то опыты удаются лучше всего». Наконец, в этих же сообщениях находится совершенно новое открытие Вольты. Разнородные обкладки вызывают иногда при прохождении электрической материи через мускулы языка не сокращения, а вкусовые ощущения. Чтобы вызвать последние, лучше всего плотно наложить гладкую полоску станиоля на кончик языка, а на середину или на другую часть языка положить серебряную или золотую монету, или вообще какой-нибудь предмет, сделанный из этих металлов, и затем соединить обе эти обкладки. Тогда, смотря по роду металлов, получается более или менее сильный кислый вкус. «Замечательно, что этот вкус длится все время, пока олово и серебро сообщены между собою, и даже постоянно нарастает в силе. Это показывает, что переход электрической материи с одного места на другое происходит непрерывно... Не менее замечательно и то, что с переменой места обкладок, т. е. если на кончик языка положить серебро, а на середину языка олово или серебряную бумагу, изменяется и характер вкуса, ощущение на кончике языка тогда уже не кислое, а скорее щелочное, резко приближающееся к горькому». Вольта ожидает многого от этого открытия, но, не желая вдаваться в область предположений, пока остается исключительно на почве опытов.
И в самом деле, уже в следующем году (в том же бруньятеллевском журнале) он описывает новое интересное и многообещающее видоизменение того же опыта. «При помощи тех же различных обкладок, которыми вызывается ощущение вкуса, мне удалось вызвать и ощущение света. — Я накладываю на глазное яблоко конец оловянного листочка, беру в рот серебряную монету или ложку и затем привожу обе эти обкладки в соприкосновение при помощи двух металлических острий. Этого оказывается достаточно, чтобы тотчас же или каждый раз, как производится соприкосновение, получить явление света или преходящей молнии в глазу... Из всех этих опытов... никоим образом нельзя заключить о существовании действительного животного электричества... Я произвел опыты, которые показывают такой же переход электрической жидкости, если металлы разных родов приложены не к животным частям, а к каким-либо влажным предметам, например, бумаге, коже, сукну и т. д., пропитанным водою или, еще лучше, к самой воде. Это и составляет пока весь эффект подобного соединения металлов, причем в данном случае они являются не просто проводниками, то настоящими возбудителями электричества; в этом и заключается главное открытие». Вольта, по его собственным словам, по мере увеличения числа опытов все более и более убеждается, что электрическая материя никак не вызывается жизненною силою и не возникает в органах тела, а происходит вследствие различия, иногда крайне незначительного, металлов. «Но если это так, то что, собственно, остается от гальванического животного электричества, существование которого Гальвани как будто доказал своими прекрасными опытами. Ничего, кроме чрезвычайной чувствительности нервов..., т. е. чисто пассивной восприимчивости по отношению к всегда постороннему и искусственному электричеству, которое они ощущают в виде, так сказать, простого электрического ножа».
Наконец, в 1794 г. Вольта открыто и решительно покидает мысль о животном электричестве. Соответствующая статья его появилась в 1794 г. в журнале Бруньятелли в форме письма к доктору Вазалли. Здесь он прямо ставит основной вопрос: «Что вы думаете о так называемом животном электричестве? Что касается меня, то я уже давно убедился, что все действие исходит из металлов, от соприкосновения которых электрическая жидкость входит во влажное или водянистое тело, причем из одного металла оно истекает сильнее, чем из другого». Таким образом, Вольта утверждает, что при соприкосновении различных металлов электричества распределяются в них таким образом, что один род электричества собирается на одном металле, другой род на другом; когда же металлы приводятся в соприкосновение посредством проводящей дуги, то в последней устанавливается непрерывный ток электричества. Здесь же он дополняет свои прежние данные, указывая, что электрический ток бывает тем сильнее, чем далее отстоят примененные металлы друг от друга в следующем ряду: цинк, олово, свинец, железо, латунь, бронза, медь, платина, золото, серебро, ртуть; при этом он отмечает, что графит и твердый уголь действуют то же, как металлы. Противоречащие этому наблюдения Гальвани, согласно которым сокращения лягушек могут происходить и при наличии одного металла, он объясняет имеющейся всегда более или менее незначительной разнородностью частей в одном и том же куске металла; он показывает на прямом опыте, что металлическая дуга, не вызывающая сокращений, приобретает это свойство после того, как обе половины ее были различно закалены, выкованы или окислены. Он указывает и на то, что подобные же явления могут быть обнаружены и в электричестве от трения. Если тереть друг о друга два одинаковых тела, то они вообще не наэлектризовываются. Но иногда для получения этого эффекта достаточно только изменить поверхность одного из тел. На этом основании он считал себя вправе приписать все новые электрические явления металлам и заменить название «животного» электричества выражением «металлическое» электричество.
Однако все сказанное не убедило ни Гальвани, ни некоторых других физиков, например Карминати, Валли, Альдини (племянник Гальвани) и др. Последних и нельзя упрекать за это, так как до сих пор все явления одинаково хорошо еще объяснялись как животным, так и металлическим электричеством, но при этом за первым из них оставалось право первородства. Чтобы отстоять свое мнение, названные физики избрали правильный путь, исключив полностью из своих опытов металлы, в которых Вольта видит главных деятелей, и в самом деле, уже в 1794 г. Альдини в сочинении «De animali electricitate» (Bologna 1794) («О животном электричестве») сообщает об удаче своих опытов, которые показывают, что сокращения могут быть получены и без участия металлов — в цепи, составленной из частей животных. Несколько позднее и сам Гальвани, который, как это уже было отмечено, довел свою осторожность до того, что даже препарировал лягушек стеклянными ножами, зачастую получал сокращения, просто приводя в соприкосновение бедренный нерв лягушки с ее мышцей. Тем не менее, победа осталась не за ним. В письмах к Грену 1795 г. и в письмах к Альдини 1798 г. Вольта сообщает, что ему удалось при помощи своего конденсатора прямо доказать и измерить электричество, получающееся при соприкосновении металлов без всякого участия животных мышц; следовательно, даже те, которые признавали животное электричество, должны были признавать наряду с ним и металлическое. Гальвани сам уже не был в состоянии продолжать борьбу; уже в следующем году, удрученный невзгодами, он умер; последователи же его вынуждены были замолчать, когда вскоре затем был открыт вольтов столб.
С опытами Гальвани Германию познакомил впервые майнский профессор Аккерманн и вскоре за повторение их принялись с большим рвением и успехом многие ученые: Креве, Э. И. Шмук, Грен, И. X. Рейль, Александр фон-Гумбольдт и X. Г. Пфафф. В общем они склонялись больше в сторону Гальвани, чем Вольты; некоторые же из них, как Креве и еще в большей мере А. Гумбольдт, видели в реакциях мышц вовсе не электрические действия, а проявления особого агента жизненной силы, обнаруживавшего свое действие при соприкосновении нервов с мышцами.
Во Франции гальваническим электричеством стали заниматься позднее, когда несколько улеглись бури революции. Созванная лишь в 1798 т. комиссия Национального института подтвердила все известные до того времени факты, но не высказала определенного мнения об их причине.
В Англии Р. Фоулер произвел несколько новых опытов с гальваническим электричеством и, подобно немецким физикам, пришел к выводу, что причина, вызывающая эти явления, отлична от электричества. Другие англичане, например А. Монро, д-р И. Ч. Уэлль и Ковалло, считали, наоборот, эти явления тождественными с электрическими, таким образом и здесь, покуда, вопрос оставался нерешенным.
Но, далее, к идее о металлическом электричестве пришли также в результате новых наблюдений, имевших прямое соотношение к опытам Вольта над вкусовыми ощущениями. Фабброни уже в 1792 г. сообщил Флорентийской академии об интересных опытах, о которых более подробно он изложил лишь в 1796 г. Он нашел, что если два металла, погруженные в воду, привести в полное или частичное взаимное соприкосновение, то металл, окисляющийся вообще сильнее, в воде окисляется значительно быстрее, чем на воздухе, причем в воде окисляются в этом случае даже такие металлы, которые на воздухе не соединяются с кислородом. Подобные же явления наблюдал, независимо от Фабброни, д-р Эд. Аш в Оксфорде. Он заметил значительное ускорение окисления цинка, когда последний был положен на смоченное серебро, то же самое получилось, когда свинец был положен на ртуть и железо на медь. Гумбольдт в упомянутом выше исследовании, сообщив об опытах д-ра Аша и полностью их подтвердив, прибавил к ним новое наблюдение, касающееся разложения воды, но не объяснил его причины (вероятно, вследствие своих воззрений на животное электричество). И все-таки при некотором внимании к ходу физических исследований уже и в то время было нетрудно заметить родство этих явлений с электрическими, так как химическое действие электричества от трения было уже давно открыто и описано. Беккариа уже в 1758 г. утверждал, что металлические земли, например сурик, свинцовые белила, цинковая зола и пр., восстанавливаются электрической искрой, а граф де-Милли подтвердил эти наблюдения. Правда, другие физики, например Каде и Бриссон, полагали, что образовавшийся металл происходит от плавления проводников; но мнение их уже в 1787 г. было опровергнуто голландцами ван-Марумом и Паэтсом ван-Труствиком , которые, пропуская электрические искры через каналы, наполненные суриком и пр., наблюдали вполне определенное восстановление металлических земель при прохождении электричества. Около того же времени Генри Кавендиш заметил изменение объема воздуха при пропускании электрических искр и объяснил это химическим действием электричества. Он установил, что как в чистом дефлогистированном воздухе (в кислороде), так и в чистом флогистированном (в азоте) электрическая искра не производит действия, а в смеси этих газов она вызывает образование химического соединения, сходного с азотной кислотой. Эти опыты, в свою очередь, были подтверждены ван-Марумом, наблюдавшим, сверх того, выделение водорода из алкоголя при посредстве электрических искр и разложение аммиака на азот и водород. Наконец, Паэтс ван-Труствик и Дейман 3 в 1789 г. заметили, что при пропускании искр через воду из нее выделяются с соответственным постепенным уменьшением количества воды, газы, которые, в свою очередь, превращаются в воду, если через них пропустить электрическую искру. Однако все эти опыты обратили на себя очень мало внимания.
Такие давно известные действия электричества (от трения), как свет и теплота, конечно, должны были побудить обратиться к вопросу о сущности этого замечательного агента. Легко понять, что открытие химических действий электричества должно было еще более усилить интерес к вопросу. В том обстоятельстве, что электричеству присуще химическое действие, видели подтверждение мысли, что электричество представляет собою особое элементарное вещество, или, по крайней мере, своеобразную жидкость, состоящую из немногих элементов. Многочисленные связи, которые были установлены между электричеством, с одной стороны, и светом и теплотой, с другой — сделали эту точку зрения вероятной и приводили к мысли, что электричество состоит из светового и теплового вещества, или, по крайней мере, содержит их в себе, как элементы. (Таким образом, в сущности оставались очень близко к старой мысли, что электричество представляет собою некоторую разновидность огня.) Относительно же характера сочетания этих элементов не могли придти к какому-либо приемлемому соглашению.
Вильке принял различие между обоими элсктричествами подобным противоположности между огнем и кислотой, в связи с чем он даже предложил заменить знаки + электричества и — электричества названиями огонь и кислота. Аналогичных взглядов придерживались Кратценштейн, Люстенберг, Карстен и др. И. Ф. Мейер считал главною составною частью электричества жирную кислоту, выделяющуюся из некоторых тел при трении. Грен отождествлял электричество с световой материей; Ахард настаивал, наоборот, на тождестве его с тепловым веществом. Пристли утверждал, что электрическая жидкость должна содержать в себе флогистон, или же прямо быть флогистоном. Генли тоже смотрел на электричество, как на видоизменение того основного вещества, которое в состоянии покоя называется флогистоном, а в состоянии сильного движения — огнем. Он выставляет на вид то обстоятельство, что некоторые (растительные) вещества, богатые флогистоном, т. е. легко сгорающие, отдают при трении огонь и затем наэлектризовываются отрицательно. Наиболее подробно разработанную теорию дал Делюк, построивший электрическую теорию совершенно по образцу своей тепловой теории. Подобно тому как водяной пар состоит из воды и расширяющей жидкости, так и электричество состоит из тяжелого собственно-электрического вещества и расширяющей жидкости (fluide déférent). Тела, наэлектризованные положительно и отрицательно, отличаются друг от друга тем, что первые, при одинаковом содержании расширяющей силы, богаче электрическим веществом, чем вторые. Электрическая индукция объясняется очень удовлетворительно следующим образом. Если к телу, наэлектризованному положительно, приблизить изолированный проводник AB, то расширяющая жидкость, в силу своей природы, перейдет на этот проводник; но так как конец А проводника, ближайший к наэлектризованному телу, будет подвержен этому действию сильнее, чем конец В, то на первом напряжение электрической материи будет сильнее, чем на втором, а так как АВ является проводником, то электрическая материя будет течь от А к В, пока не установится равновесие. Поэтому, при равном напряжении, А будет содержать меньше электрической материи, чем В, т. е. A будет —, а В будет +. Подобно теории испарения и электрическая теория Делюка имела в свое время многих приверженцев. Однако последняя не могла продержаться так долго, как первая, может быть, оттого, что вообще уже больше не признавали удобным допускать существование весомой электрической материи, а скорее, пожалуй, потому, что в скором времени признали всякие суждения о сущности электричества, кроме свойственных ему притягательных и отталкивательных сил, невозможными, а потому и бесполезными. Известный электрик Пфафф в 1827 г., сделав обзор существовавших до того времени электрических теорий, приходит к следующему выводу: «Мне кажется, установленным, что в основе электрических явлений лежит особая материя, которую следует отнести к числу эфирных жидкостей... В такой же мере представляется мне выясненным, что существуют два рода электричества... Что же касается до отношения обеих этих эфирных жидкостей к прочим невесомым, особенно к тем, от которых зависит световая и тепловая деятельность, то представляется также установленным, что они не тождественны с последними... Но столь же несомненно, с другой стороны, что они находятся с указанными невесомыми в тесной связи, которая, однако, до сих пор не могла быть вполне выяснена».
Приложение 4
Гальванические элементы
Г. элементом, или гальванической парой, называется прибор, состоящий из двух металлических пластинок (одна из которых может быть заменена коксовой), погружаемых в одну или две различные жидкости, и служащий источником гальванического тока. Некоторое число Г. элементов, соединенных между собой известным образом, составляет гальваническую батарею. Простейший по устройству Г. элемент состоит из двух пластинок, погружаемых в глиняный или стеклянный стакан, в котором налита жидкость, соответствующая роду пластинок; пластинки не должны иметь металлического соприкосновения в жидкости. Г. элементы называются первичными, если они суть самостоятельные источники тока, и вторичными, если они становятся действующими лишь после более или менее продолжительного действия на них источников электричества, их заряжающих. Рассматривая происхождение Г. элементов, нужно начать с вольтова столба, родоначальника всех последующих гальванических батарей, или с чашечной батареи Вольта.
Вольтов столб. Для составления его Вольта брал пары разнородных металлических кружков, сложенных или даже спаянных по основанию, и картонные или суконные кружки, смоченные водой или раствором едкого кали. Первоначально употреблялись серебряные и медные кружки, а потом обычно цинковые и медные. Из них составлялся столб, как показано на черт. 1, а именно: сперва кладется медная и на нее цинковая пластинка (или наоборот), на которую накладывается смоченный картонный кружок; это составляло одну пару, на которую накладывалась вторая, составленная опять из медного, цинкового и картонных кружков, наложенных друг на друга в таком же порядке, как и в первой паре.


Продолжая накладывать в таком же порядке последующие пары можно составить столб; столб, изображенный на черт. 1, слева состоит из 11 вольтовых пар. Если столб установлен на пластинке изолирующего, т. е. не проводящего электричество, вещества, например, на стеклянной, то, начиная от середины его, одна половина столба (нижняя на нашем чертеже) окажется заряженной положительным электричеством, а другая (верхняя по чертежу) — отрицательным. Напряженность электричества, неощутимая посередине, растет по мере приближения к концам, на которых она наибольшая. К самой нижней и самой верхней пластинкам припаиваются проволоки; приведение в соприкосновение свободных концов проволок дает начало движению положительного электричества от нижнего конца столба через проволоку к верхнему и движению отрицательного электричества по противоположному направлению; образуется электрический, или гальванический, ток. Вольта считал парой две пластинки разнородных металлов, а жидкости приписывал только способность проводить электричество (см. Гальванизм); но по взгляду, установившемуся позднее, пара состоит из двух разнородных пластинок и жидкого слоя между ними; поэтому самая верхняя и самая нижняя пластинки столба (черт. 1 справа) могут быть сняты. Такой столб будеть состоять из 10 пар, и тогда самая нижняя пластинка его будет медная, а самая верхняя — цинковая и направление движения электричества, или направление гальванического тока, в нем останется прежнее: от нижнего конца столба (теперь от цинка) к верхнему (к меди). Медный конец столба был назван положительным полюсом, цинковый — отрицательным. Впоследствии по терминологии Фарадея положительный полюс назван анодом, отрицательный — катодом. Вольтов столб может быть уложен горизонтально в корытце, покрытое внутри изолирующим слоем воска, сплавленного с гарпиусом. Ныне вольтов столб не употребляется по причине большого труда и времени, нужных на его составление и разборку; но в прежнее время пользовались столбами, составленными из сотен и тысяч пар; в Петербург профессор В. Петров пользовался в 1801—2 гг. при своих опытах столбом, состоявшим иногда из 4200 пар, Вольта строил свой аппарат и в другой форме, которая и есть форма позднейших батарей. Батарея Вольта (corona di tazze) состояла из чашек, расположенных по окружности круга, в которые наливалась теплая вода или раствор соли; в каждой чашке находились две металлические разнородные пластинки, одна против другой. Каждая пластинка соединена проволокой с разнородной пластинкой соседней чашки, так что от одной чашки к другой по всей окружности пластинки постоянно чередуются: цинк, медь, потом опять цинк и медь и т. д. В том месте, где окружность замыкается, в одной чашке имеется цинковая пластинка, в другой — медная; по проволоке, соединяющей эти крайние пластинки, будет идти ток от медной пластинки (положительного полюса) к цинковой (отрицательному полюсу). Эту батарею Вольта считал менее удобной, чем столб, но на самом деле именно форма батареи получила всеобщее распространение. В самом деле устройство вольтова столба вскоре было изменено (Крюйкшанк): продолговатый деревянный ящик, разделенный поперек пластинками меди и цинка, спаянными между собой, на маленькие отделения, в которые наливалась жидкость, был удобнее обычного вольтова столба. Еще лучше был ящик, разделенный на отделения деревянными поперечными стенками; медная и цинковая пластинки ставились по обе стороны каждой перегородки, будучи спаяны между собой сверху, где оставлялось, кроме того, ушко. Деревянная палка, проходившая через все ушки, служила для поднятия всех пластинок из жидкости или для погружения их.
Элементы с одной жидкостью. Вскоре после того стали делать отдельные пары или элементы, которые могли быть соединены в батареи различными способами, польза которых особенно ясно обнаружилась после того, как Ом выразил формулой силу тока в зависимости от электровозбудительной (или электродвижущей) силы элементов и от сопротивлений, встречаемых током как во внешних проводниках, так и внутри элементов. Электровозбудительная сила элементов зависит от металлов и жидкостей, их составляющих, а внутреннее сопротивление — от жидкостей и от размеров элементов. Для уменьшения сопротивления и увеличения тем силы тока надо толщину слоя жидкости между разнородными пластинками уменьшать, а размеры погружаемой поверхности металлов увеличивать. Это выполнено в элементе Волластона (Wollaston — по более правильному выговору Вульстен). Цинк помещен внутри согнутой медной пластинки, в которой вставлены кусочки дерева или пробки, не допускающие соприкосновения пластинок; к каждой из пластинок припаяна проволока, обычно медная; концы этих проволок приводятся в соприкосновение с предметом, через который хотят пропустить ток, идущий по направлению от меди к цинку по внешним проводникам и от цинка к меди по внутренним частям элемента. Вообще, ток идет внутри жидкости от металла, на который жидкость действует химически сильнее, к другому, на который она действует слабее. В этом элементе обе поверхности цинковой пластинки служат для истечения электричества; такой способ удвоения поверхности одной из пластинок потом вошел в употребление при устройстве всех элементов с одной жидкостью. В элементе Волластона употребляется разведенная серная кислота, разлагающаяся во время действия тока; результатом разложения будет окисление цинка и образование цинкового купороса, растворяющегося в воде, и выделение водорода на медной пластинке, приходящей от этого в поляризованное состояние, уменьшающее силу тока. Изменчивость этого поляризованного состояния сопровождается изменчивостью силы тока. Из многих элементов с одной жидкостью называем элементы Сми (Smee) и Грене, в первом — платина или платинированное серебро среди двух цинковых пластинок, все — погруженное в разбавленную серную кислоту. Химическое действие такое же, как и в элементе Волластона, и поляризуется водородом платина; но ток менее переменчив. Электровозбудительная сила больше, чем в медно-цинковом.
Элемент Грене состоит из цинковой пластинки, помещающейся между двух плиток, выпиленных из кокса; жидкость для этого элемента приготавливается по разным рецептам, но всегда из двухромокалиевой соли, серной кислоты и воды. По одному рецепту на 2500 грамм воды надо взять 340 грамм названной соли и 925 грамм серной кислоты. Электровозбудительная сила больше, чем в элементе Волластона. Во время действия элемента Грене образуется, как и в предыдущих случаях, цинковый купорос; но водород, соединяясь с кислородом хромовой кислоты, образует воду; в жидкости образуются хромовые квасцы; поляризация уменьшена, но не уничтожена. Для элемента Грене употребляется стеклянный сосуд с расширенной нижней частью. Жидкости наливается столько, чтобы цинковую пластинку Z, которая короче коксовых С, можно было, потянув прикрепленный к ней стержень Т, вынуть из жидкости на то время, когда элемент должен оставаться без действия. Зажимы В, В, соединенные — один с оправой стержня Т, а следовательно, с цинком, а другой с оправой углей, назначены для концов проволок-проводников. Ни пластинки, ни их оправы не имеют металлического соприкосновения между собой; ток идет по соединительным проволокам через внешние предметы по направлению от кокса к цинку. Угольно-цинковый элемент может быть употребляем с раствором поваренной соли (в Швейцарии, для телеграфов, звонков) и тогда действует 9—12 мес. без ухода.
Элемент Лаланда и Шаперона, усовершенствованный Эдисоном, состоит из плитки цинка и другой, спрессованной из окиси меди. Жидкость — раствор едкого кали. Химическое действие — окисление цинка, образующего потом соединение с кали; отделяющийся водород, окисляясь кислородом окиси цинка, входит в состав образующейся воды, а медь восстанавливается. Внутреннее сопротивление малое. Возбудительная сила не определена с точностью, но меньше, чем у элемента Даниэля.
Элементы с двумя жидкостями. Так как выделение водорода на одном из твердых тел Г. элементов есть причина, уменьшающая силу тока (собственно электровозбудительную) и сообщающая ему непостоянство, то помещение пластинки, на которой водород выделяется, в жидкости, способной отдать кислород на соединение его с водородом, должно сделать ток постоянным. Беккерель первый устроил (1829) медно-цинковый элемент с двумя жидкостями для названной цели, когда еще не были известны элементы Грене и Лаланда. Позднее Даниэль (1836) устроил подобный же элемент, но более удобный в употреблении. Для разделения жидкостей нужны два сосуда: один стеклянный или глазурованный глиняный, содержит в себе цилиндрический, глиняный, слабообожженный, а потому пористый, сосуд, в который наливается одна из жидкостей и помещается один из металлов; в кольцеобразном промежутке между двумя сосудами налита другая жидкость, в которую погружена пластинка другого металла. В элементе Даниэля цинк погружен в слабую серную кислоту, а медь в водный раствор медного (синего) купороса. Фиг. 1 таблицы изображает 3 элемента Даниэля, соединенные в батарею; цилиндры, гнутые из цинка, помещены во внешние стеклянные стаканы, медные пластинки тоже в форме цилиндра или согнутые наподобие буквы S — помещены во внутренние глиняные цилиндры. Можно расположить и обратно, т. е. медь во внешних сосудах. Ток идет от меди к цинку по внешним проводникам и от цинка к меди через жидкость в самом элементе или батарее, причем разлагаются одновременно обе жидкости: в сосуде с серной кислотой образуется цинковый купорос, а водород идет к медной пластинке, в то же время медный купорос (CuSO 4
) разлагается на медь (Cu), осаждающуюся на медную пластинку, и отдельно не существующее соединение (SO4
), которое химическим процессом образует с водородом воду прежде, чем он успеет выделиться в виде пузырьков на меди. Пористая глина, легко смачиваемая обеими жидкостями, дает возможность передаваться химическим процессам от частицы к частицам через обе жидкости от одного металла к другому. После действия тока, продолжительность которого зависит от его силы (а эта последняя отчасти от внешних сопротивлений), а также от количества жидкостей, содержащихся в сосудах, весь медный купорос издерживается, на что указывает обесцвечивание его раствора; тогда начинается отделение пузырьков водорода на меди, а вместе с тем поляризация этого металла. Этот элемент называется постоянным, что однако надо понимать относительно: во-первых и при насыщенном купоросе есть слабая поляризация, но главное — внутреннее сопротивление элемента сначала уменьшается, а потом растет. По этой второй и главной причине замечается в начале действия элемента постепенное усиление тока, тем значительнейшее, чем менее ослаблена сила тока внешними или внутренними сопротивлениями. Через полчаса, час и более (продолжительность растет с количеством жидкости при цинке) ток начинает ослабевать медленнее, чем возрастал, и еще через несколько часов доходит до первоначальной силы, постепенно ослабевая далее. Если в сосуде с раствором медного купороса помещен запас этой соли в нерастворенном виде, то это продолжает существование тока, равно как и замена образовавшегося раствора цинкового купороса свежей разбавленной серной кислотой. Однако при замкнутом элементе уровень жидкости при цинке мало-помалу понижается, а при меди повышается — обстоятельство само по себе ослабляющее ток (от увеличения сопротивления по этой причине) и притом указывающее на переход жидкости из одного сосуда в другой. В сосуд с цинком просачивается медный купорос, из которого цинк чисто химическим путем выделяет медь, заставляя ее осаждаться частью на цинк, частью на стенки глиняного сосуда. По этим причинам происходит большая бесполезная для тока трата цинка и медного купороса. Однако все же элемент Даниэля принадлежит к числу самых постоянных. Глиняный стакан, хотя и смачиваемый жидкостью, представляет большое сопротивление току; употребляя пергамент вместо глины, можно значительно усилить ток путем уменьшения сопротивления (элемент Карре); пергамент может быть заменен животным пузырем. Вместо разбавленой серной кислоты можно при цинке употреблять раствор поваренной или морской соли; возбудительная сила остается почти та же. Химические действия не исследованы.
Элемент Мейдингера. Для частого и продолжительного и притом довольно постоянного, но слабого тока может служить элемент Мейдингера (фиг. 2 таблицы), составляющий видоизменение элемента Даниэля. Внешний стакан имеет расширение наверху, где на внутреннюю закраину ставится цинковый цилиндр; на дне стакана помещен другой маленький, в который поставлен цилиндрик, свернутый из листовой меди, или же кладется медный кружок на дно внутреннего сосуда, наполняемого потом раствором медного купороса. После этого осторожно наливают сверху раствор сернокислой магнезии, который заполняет все свободное пространство внешнего сосуда и не смещает раствора купороса, как имеющего больший удельный вес. Тем не менее по диффузии жидкостей купорос медленно достигает цинка, где и отдает свою медь. Для поддержания насыщенности этого раствора внутрь элемента ставится еще опрокинутая стеклянная колба с кусками медного купороса и водой. От металлов идут наружу проводники; части их, находящиеся в жидкости, имеют гуттаперчевую оболочку. Отсутствие глиняной банки в элементе позволяет пользоваться им долгое время без перемены его частей; но внутреннее сопротивление его велико, переносить его с места на место надо очень осторожно и в нем бесполезно для тока издерживается много медного купороса; в колбе даже маленького элемента помещается около 1
/2
килограмма купороса. Он весьма пригоден для телеграфов, электрических звонков и в других подобных случаях и выстаивает месяцы. Элементы Калло и Труве-Калло похожи на элементы Мейдингера, но проще последних. Крестен в Петербурге также устроил полезное видоизменение элемента Мейдингера. Элемент Томсона в форме блюда или подноса есть измененный даниэлевский; пористые плоские перепонки из пергаментной бумаги отделяют одну жидкость от другой, но можно обходиться и без перепонок. Элемент Сименса и Гальске также относится к разряду даниэлевских.
Элемент Минотто. Медный кружок на дне стеклянной банки, на который насыпаются кристаллы медного купороса, а сверху толстый слой кремнистого песку, на который накладывается цинковый кружок. Все заливается водой. Служит от 1 1
/2
до 2 лет на телеграфных линиях. Вместо песка можно взять порошок животного угля (Дарсонваль).
Элемент Труве. Медный кружок, на котором столбик кружков из пропускной бумаги, снизу пропитанный медным купоросом, сверху — цинковым купоросом. Небольшое количество воды, смачивающей бумагу, приводит элемент в действие. Сопротивление довольно большое, Действие продолжительно и постоянно.
Элемент Грове, платиново-цинковый; платина погружается в крепкую азотную кислоту, цинк в слабую серную кислоту. Выделяющийся действием тока водород окисляется за счет кислорода азотной кислоты (NHO2
), переходящей в азотный ангидрид (N2
O4
), выделяющиеся красно-оранжевые пары которой вредны для дыхания и портят все медные части аппарата, которые потому лучше делать из свинца. Эти элементы могут быть употребляемы лишь в лабораториях, где имеются вытяжные шкафы, а в обычной комнате должны быть поставлены в печь или камин; они имеют большую возбудительную силу и малое внутреннее сопротивление — все условия для большой силы тока, которая тем постояннее, чем больший объем жидкостей содержится в элементе. Фиг. 6 таблицы изображает такой элемент плоской формы; вне его справа изображена соединенная с платиновым листком элемента согнутая цинковая пластинка Zвторого элемента, в сгибе которой стоит плоский глиняный сосуд V для платины. Слева изображен платиновый листок, соединенный зажимом с цинком элемента и принадлежащий третьему элементу. При этой форме элементов внутреннее сопротивление его очень мало, но сильное действие тока не продолжительно по причине малого количества жидкостей. Ток идет от платины по внешним проводникам к цинку, согласно высказанному выше общему правилу.
Элемент Бунзена (1843), угольно-цинковый, вполне заменяет предыдущий и дешевле его, так как дорогая платина заменена коксовой плиткой. Жидкости те же, что в элементе Грове, электровозбудительная сила и сопротивление приблизительно такие же; направление тока такое же. Подобный элемент изображен на фиг. 3 таблицы; угольная плитка, обозначенная буквой С, с металлическим зажимом, при котором поставлен знак +; это положительный полюс, или анод, элемента. От цинкового цилиндра Z с зажимом (отрицательный полюс, или катод) идет пластинка с другим зажимом, накладываемым на угольную плитку второго элемента в случае составления батареи. Грове первый заменил платину в своем элементе углем, но его опыты были забыты.
Элемент Дарсонваля, угольно-цинковый; при угле смесь азотной и соляной кислоты по 1 объему с 2 объемами воды, содержащей 1
/20
серной кислоты.
Элемент Фора. Вместо коксовой плитки употребляется бутылка из графита и глины; туда наливается азотная кислота. Это, по-видимому, внешнее изменение элемента Бунзена делает употребление азотной кислоты более полным.
Элемент Сосновского. Цинк в растворе едкого натра или едкого кали; уголь в жидкости, состоящей из 1 объема азотной кислоты, 1 объема серной, 1 объема соляной, 1 объема воды. Замечателен очень высокой электровозбудительной силой.
Элемент Каллана. Уголь бунзеновских элементов заменяется железом; возбудительная сила остается та же, что при употреблении угля. Железо не подвергается действию азотной кислоты, находясь в пассивном состоянии. Вместо железа можно с пользой употреблять чугун с некоторым содержанием кремния.
Элемент Поггендорфа отличается от элемента Бунзена заменой азотной кислоты жидкостью, подобной той, которая употребляется в элементе Грене. На 12 весовых частей двухромовокислого кали, растворенных в 100 частях воды, прибавляется 25 частей крепкой серной кислоты. Возбудительная сила такая же, как в элементе Бунзена; но внутреннее сопротивление больше. Кислорода в названной жидкости, отдаваемого на окисление водорода, меньше, чем в азотной кислоте при том же объеме. Отсутствие запаха при пользовании этими элементами в соединении с другими достоинствами сделало его самым удобным к употреблению. Однако поляризация не вполне устранена.
Элемент Имшенецкого, угольно-цинковый. Графитовая (углерод) пластинка в растворе хромовой кислоты, цинк — в растворе серноватистонатриевой соли. Большая возбудительная сила, малое внутреннее сопротивление, почти полная утилизация цинка и весьма хорошее пользование хромовой кислотой.
Элемент Лекланше, угольно-цинковый; вместо окисляющей жидкости содержит при угольной плитке порошок (крупный) перекиси марганца, смешанный с порошком кокса (фиг. 5 табл.) во внутренней, проницаемой для жидкости, глиняной банке; снаружи в одном из углов склянки особенной формы помещается цинковая палочка. Жидкость — водный раствор нашатыря — наливается снаружи и проникает внутрь глиняной банки до угля (кокса), смачивая перекись марганца; верх банки обычно заливается смолой; оставлены отверстия для выхода газов. Возбудительная сила — средняя между даниэлевским и бунзеновским элементами, сопротивление большое. Элемент этот, оставленный замкнутым, дает ток быстро убывающей силы, но для телеграфов и домашнего употребления выстаивает один-два года при подливании жидкости. При разложении нашатыря (NH 4
Cl) хлор выделяется на цинк, образуя хлористый цинк и аммиак при угле. Перекись марганца, богатая кислородом, переходит мало-помалу в соединение низшей степени окисления, но не во всех частях массы, наполняющей глиняный сосуд. Для более полного пользования перекисью марганца и уменьшения внутреннего сопротивления устраивают эти элементы без глиняной банки, а из перекиси марганца и угля спрессовывают плитки, между которыми помещают коксовую, как показано на фиг. 4 таблицы. Этого рода элементы могут быть сделаны закрытыми и удобными к переноске; стекло заменяется роговым каучуком. Видоизменил этот элемент также Гефф, заменяя раствор нашатыря раствором хлористого цинка.
Элемент Mapиe-Деви, угольно-цинковый, содержит при угле тестообразную массу из сернокислой закиси ртути (Hg2
SO4
), смоченной водой, помещенную в пористую глиняную банку. К цинку наливается слабая серная кислота или даже вода, так как первая и без того выделится из соли ртути действием тока, при чем водород окисляется, а при угле выделяется металлическая ртуть, так что по истечении некоторого времени элемент становится цинково-ртутным. Электровозбудительная сила не изменяется от употребления чистой ртути вместо угля; она несколько больше, чем в элементе Лекланше, внутреннее сопротивление большое. Пригоден для телеграфов и вообще для прерывистого действия тока. Эти элементы употребляются и для медицинских целей, причем предпочитают заряжать их сернокислой окисью ртути (HgSO4
). Удобная для медицинских и других целей форма этого элемента представляет высокий цилиндр из рогового каучука, верхняя половина которого заключает в себе цинк и уголь, а нижняя — воду и сернокислую ртуть. Если элемент перевернуть верхом вниз, он действует, а в первом положении — не образует тока.
Элемент Варрена Деларю — цинково-серебряный. Узкая серебряная полоска выступает из цилиндрика плавленого хлористого серебра (AgCl), помещенного в трубочке из пергаментной бумаги; цинк имеет форму тонкого стерженька. Оба металла помещаются в стеклянной трубке, закупоренной парафиновой пробкой. Жидкость — раствор нашатыря (23 части соли на 1 литр воды). Электровозбудительная сила почти такая же (немного больше), как в элементе Даниэля. Из хлористого серебра осаждается металлическое серебро на серебряную полоску элемента, и поляризация не происходит. Батареи, составленные из них, служили для опытов над прохождением света в разреженных газах. Гефф дал этим элементам устройство, делающее их удобными для переноски; употребляются для медицинских индукционных катушек и для постоянных токов.
Элементы Дюшомена, Парца, Фигье. Первый — цинково-угольный; цинк в слабом растворе поваренной соли, уголь — в растворе хлорного железа. Непостоянен и мало исследован. Парц заменил цинк железом; раствор поваренной соли имеет плотность 1,15, раствор хлорного железа плотности 1,26. Лучше предыдущего, хотя электровозбудительная сила меньше. Фигье употребляет в железно-угольном элементе одну жидкость, получаемую пропусканием струи хлора через насыщенный раствор железного купороса.
Элемент Ниоде, угольно-цинковый. Цинк имеет форму цилиндра, окружающего пористый глиняный цилиндр, содержащий в себе коксовую плитку, засыпанную хлорной известью. Элемент закупорен пробкой, залитой воском; через отверстие в ней наливается раствор поваренной соли (24 части на 100 частей воды). Электровозбудительная сила большая; при постоянном, несколько продолжительном действии на внешнее малое сопротивление скоро ослабевает, но через час или два бездействия элемента она достигает прежней величины.
Сухие элементы. Это название можно дать элементам, в которых присутствие жидкости неявно, когда она всасывается в пористые тела элемента; скорее следовало бы их назвать влажными. К таким можно отнести вышеописанный медно-цинковый элемент Труве и элемент Лекланше, измененный Жерменом. В этом последнем употребляется клетчатка, извлекаемая из кокосовых орехов; из неё приготавливается масса, сильно поглощающая жидкость и газы, на вид сухая и только при давлении принимающая влажный вид. Легко переносимы и пригодны для походных телеграфных и телефонных станций. Элементы Гаснера (угольно-цинковые), в состав которых входит гипс, пропитанный, вероятно, хлористым цинком или нашатырем (держится в секрете). Возбудительная сила приблизительно такая, как в элементе Лекланше, спустя некоторое время после начала действия последнего; внутреннее сопротивление меньше, чем у Лекланше. В сухом элементе Лекланше-Барбье промежуток между внешним цинковым цилиндром и внутренним полым цилиндром из агломерата, в состав которого входит перекись марганца, наполнен гипсом, насыщенным раствором неизвестного состава. Первые, довольно продолжительные испытания этих элементов были благоприятны для них. Желатиново-глицериновый элемент Кузнецова есть медно-цинковый; состоит из картонного, пропитанного парафином ящичка с дном, выклеенным оловом внутри и снаружи. На олово насыпают слой толченого медного купороса, на который наливают желатино-глицериновую массу, содержащую серную кислоту. Когда эта масса застынет, насыпают слой измельченного амальгамированного цинка, опять заливаемый тою же массой. Из таких элементов составляют батарею наподобие вольтова столба. Предназначается для звонков, телеграфов и телефонов. Вообще же число различных сухих элементов очень значительно; но в большинстве по причине секретного состава жидкостей и агломератов суждение о них возможно только практическое, но не научное.
Элементы большой поверхности и малого сопротивления. В тех случаях, когда нужно накаливать короткие, довольно толстые проволоки или пластинки, как, например, при некоторых хирургических операциях употребляют элементы с большими металлическими поверхностями, погруженными в жидкости, что уменьшает внутреннее сопротивление и тем усиливает ток. Волластонов способ удвоения поверхности применяется к составлению поверхностей из большого числа пластинок, как показано на черт. 2, где y, y, y — пластинки из одного металла помещены в промежутках между пластинками ц, ц, ц, ц другого металла.

Все пластинки параллельны между собой и не соприкасаются, но все одного наименования соединены внешними проволоками в одно целое. Вся эта система равномерна элементу из двух пластинок, каждая шестикратной поверхности сравнительно с изображенными, при толщине слоя жидкости между пластинками, равной расстоянию между каждыми двумя пластинками, изображенному на чертеже. Уже в начале нынешнего столетия (1822) устраивались приборы с большой металлической поверхностью. К числу их относится большой элемент Гаре, названный дефлагратором. Цинковый и медный листы большой длины, отделенные фланелью или деревянными палочками, свертываются в каток, в котором листы не соприкасаются между собой металлически. Этот каток погружается в кадку с жидкостью и дает ток весьма большой силы при действии на очень малые внешние сопротивления. Поверхность каждого листа — около 50 кв. футов (4 кв. метра). В наше время вообще стараются уменьшить внутреннее сопротивление элементов, но дают им особенно большую поверхность для некоторых частных применений, например в хирургии для срезания болезненных наростов раскаленной проволокой или пластинкой, для прижиганий. Так как накаливаются проводники малого сопротивления, то можно получить ток именно уменьшением внутреннего сопротивления. Поэтому в гальванокаустических элементах помещают большое число пластинок, расположенных подобно тому, как изображено на черт. 2 текста. Устройство не представляет особенностей, но приспособлено к удобному употреблению; таковы, например, угольно-цинковые элементы или батареи Шардена с хромовой жидкостью, применяемые в Париже, Лионе, Монпелье и Брюсселе. Следует обратить внимание операторов на необходимость употребления измерителя силы тока с весьма малым сопротивлением (амперметра, или омметра), чтобы иметь уверенность в исправности батареи перед операцией. Нормальные элементы должны сохранять свою электровозбудительную силу или иметь разность потенциалов постоянной в продолжение возможно долгого времени, когда они хранятся разомкнутыми для того, чтобы служить нормальной единицей меры при сравнении электровозбудительных сил между собой. Ренье предложил для этой цели медно-цинковую пару, в которой поверхность меди очень велика сравнительно с цинковой. Жидкость есть раствор 200 частей сухой поваренной соли в 1000 частях воды. При этом условии поляризация меди очень слаба, если этот элемент вводится в цепь с большим сопротивлением и на короткое время. Нормальный элемент Латимера Кларка состоит из цинка в растворе цинкового купороса, ртути и сернортутной соли (Hg2
SO4
). Нормальный элемент Флеминга, медно-цинковый, с растворами медного купороса и цинкового купороса определенной, всегда постоянной плотности. Нормальный элемент лондонского почтово-телеграфного ведомства, медно-цинковый, с раствором цинкового купороса и кристаллами медного купороса при меди весьма пригоден.
Вторичные элементы, или аккумуляторы, ведут происхождение от вторичных столбов Риттера, в продолжение 50 лет остававшихся без особенного внимания. Столб Риттера, состоявший из медных пластинок, погруженных в некоторую жидкость, после действия на него вольтова столба становился поляризованным, и после этого сам мог образовать ток, направление которого было противоположно первичному току. В 1859 г. Планте устроил элемент, состоявший из двух свинцовых листов, свернутых спирально наподобие дефлагратора Гаре, без взаимного металлического соприкосновения и погруженных в слабую серную кислоту. Соединив один свинцовый лист с анодом (положительным полюсом), а другой с катодом батареи по меньшей мере из 2 элементов Бунзена или Поггендорфа, соединенных последовательно, и пропуская таким образом ток, идущий в жидкости от свинца к свинцу, вызывают тем отделение кислорода на свинцовой пластинке, соединенной с анодом, и водорода на листе, соединенном с катодом. На анодной пластинке образуется слой свинцовой перекиси, тогда как катодная совершенно очищается от окислов. Вследствие разнородности пластинок они образуют пары с большой электровозбудительной силой, дающей ток, по направлению противоположный прежнему. Большая возбудительная сила, развивающаяся во вторичном элементе и направленная противоположно возбудительной силе первичной батареи, и есть причина требования, чтобы последняя превосходила первую. Два элемента Поггендорфа, соединенные последовательно, имеют возбудительную силу около 4 вольт, а элемент Планте лишь около 2 1
/2
. Для заряжания 3 или 4 элементов Планте, соединенных параллельно, собственно, было бы достаточно прежних 2 элементов Поггендорфа, но действие их было бы очень медленно для окисления такой большой поверхности свинца; поэтому для одновременного заряжения, например, 12 элементов Планте, соединенных параллельно, нужно действие 3-4 элементов Бунзена с возбудительной силой 6-8 вольт в продолжение нескольких часов. Заряженные элементы Планте, соединенные последовательно, развивают электровозбудительную силу в 24 вольта и производят большее, например, накаливание, чем заряжающая батарея, но зато действие вторичной батареи будет кратковременнее. Количество электричества, приведенного в движение вторичной батареей, не более количества прошедшего через нее электричества от первичной батареи, но, будучи пропущено через внешние проводники при большей напряженности или разности потенциалов, издерживается в более короткое время.
Элементы Планте после различных практических улучшений получили название аккумуляторов. В 1880 г. Фор придумал покрывать свинцовые пластинки слоем сурика, т. е. готового свинцового окисла, который от действия первичного тока еще более окислялся на одной пластинке и раскислялся на другой. Но способ прикрепления сурика потребовал технических улучшений, существенно заключавшихся в употреблении свинцовой решетки, в которой пустые клетки наполняются тестом из сурика и глета на слабой серной кислоте. В аккумуляторе Фиц-Джеральда употребляются плитки из окислов свинца без всякой металлической основы; вообще систем аккумуляторов имеется очень много и здесь дается изображение лишь одной из лучших (фиг. 8 таблицы). Свинцовая решетка Гагена сложена из двух обращенных друг к другу выступами, что препятствует кускам свинцового окисла выпадать из рамы; особо изображенные разрезы по линиям ab и cd главного чертежа объясняют устройство этой рамы. Одна рама заполняется суриком, другая глетом (низшая степень окисления свинца). Нечетное число, обычно пять или семь, пластинок соединяется наподобие того, как объяснено на черт. 2; в первом случае 3, во втором 4 покрыты глетом. Из русских техников принесли пользу устройству аккумуляторов Яблочков и Хотинский. Эти вторичные элементы, представляющие одно техническое неудобство — очень большой вес, получили разнообразные технические применения, между прочим, к домашнему электрическому освещению в тех случаях, когда нельзя пользоваться прямо током динамо-машин для этой цели. Аккумуляторы, заряженные в одном месте, могут быть перевезены в другое. Их заряжают теперь не первичными элементами, а динамо-машинами, с соблюдением некоторых специальных правил.
Составление гальванических батарей. Батарея составляется из элементов тремя способами: 1) последовательным соединением, 2) параллельным соединением, 3) сложенным из обоих предыдущих. На фиг. 1 таблицы изображено последовательное соединение 3 элементов Даниэля: цинк первой пары, считая справа, соединен медной лентой с медью второй пары, цинк второй пары — с медью третьей. Свободный конец меди первой пары есть анод, или положительный полюс батареи; свободный конец третьей пары есть катод, или отрицательный полюс батареи. Для параллельного соединения этих же элементов надо все цинки соединить между собой металлическими лентами и все медные листы соединить лентами или проволоками в одно отдельное от цинков целое; сложная цинковая поверхность будет катодом, сложная медная — анодом. Действие такой батареи одинаково с действием одного элемента, который имел бы поверхность втрое большую, чем единичный элемент батареи. Наконец, третий способ соединения может быть приложен не менее как к 4 элементам. Соединяя их по двое параллельно, получим два сложных анода и таких же два катода; соединяя первый сложный анод со вторым сложным катодом, получим батарею из двух элементов удвоенной поверхности. На черт. 3 текста изображены два различных сложных соединения из 8 элементов, представленных каждый двумя концентрическими кольцами, разделенными черными промежутками. Не входя в подробности, заметим, что по внешнему виду способ составления этих батарей отличается от только что описанных.

В (I) по 4 элемента соединены последовательно, но с одного конца два крайних цинка соединены металлической полоской КК, а с противоположного две крайние медные пластинки соединены пластинкой АА, которая и есть анод, тогда как КК —
катод сложной батареи, равносильной последовательно соединенным 4 элементам удвоенной поверхности. На чертеже 3 (II) изображена батарея, равносильная последовательно соединенным двум элементам учетверенной поверхности. Случаи, когда нужны батареи, определенным образом составленные, совершенно выясняются формулой Ома (гальванический ток) при соблюдении проистекающего из нее правила, что для получения наилучшего действия на какой-нибудь проводник данным числом гальванических элементов надо из них составить батарею таким образом, чтобы внутреннее ее сопротивление было равно сопротивлению внешнего проводника или по крайней мере по возможности к нему приближалось. К этому надо еще прибавить, что при последовательном соединении внутреннее сопротивление возрастает пропорционально числу соединенных пар, а при параллельном сопротивление, напротив, уменьшается пропорционально этому числу. Поэтому на телеграфных линиях, представляющих большое сопротивление гальваническому току, батареи состоят из последовательно соединенных элементов; в хирургических операциях (гальванокаустика) нужна батарея из параллельно соединенных элементов. Изображенная на черт. 3 (I) батарея представляет наилучшее соединение из 8 элементов для действия на внешнее сопротивление, которое вдвое больше внутреннего сопротивления единичного элемента. Если бы внешнее сопротивление было вчетверо меньше, чем в первом случае, то батарее надо дать вид черт. 3 (II). Это следует из расчетов по формуле Ома.
Приложение 5
Тяжелая вода
После фундаментальных работ Уошберна и Юри исследования нового изотопа стали развиваться быстрыми темпами. Уже вскоре после открытия дейтерия в природной воде была обнаружена ее тяжелая разновидность. Обычная вода состоит в основном из молекул 1
Н2
О. Но если в природном водороде есть примесь дейтерия, то и в обычной воде должны быть примеси НDO и D2
O. И если при электролизе воды Н2
выделяется с большей скоростью, чем НD и D2
, то со временем в электролизере должна накапливаться тяжелая вода. В 1933 Гилберт Льюис и американский физикохимик Роналд Макдональд сообщили, что в результате длительного электролиза обычной воды им удалось получить не виданную никем до этого новую разновидность воды – тяжелую воду.
Открытие и выделение весовых количеств новой разновидности воды – D2
O произвело большое впечатление на современников. Всего за два года после открытия было опубликовано более сотни работ, посвященных исключительно тяжелой воде. О ней читались популярные лекции, печатались статьи в массовых изданиях. Практически сразу же после открытия тяжелую воду стали использовать в химических и биологических исследованиях. Так, было обнаружено, что рыбы, микробы и черви не могут существовать в ней, а животные погибают от жажды, если их поить тяжелой водой. Не прорастают в тяжелой воде и семена растений.
Однако технически получение значительных количеств D2
О представляло собой трудную задачу. Для обогащения воды дейтерием на 99% необходимо уменьшить объем воды при электролизе в 100 тысяч раз. Льюис и Макдональд взяли для своих опытов 10 л воды из проработавшей несколько лет большой электролитической ванны, в которой содержание дейтерия было повышенным. Пропуская через эту воду ток большой силы – 250 ампер (для увеличения электропроводности вода содержала щелочь), они за неделю уменьшили ее объем в 10 раз. Чтобы жидкость при электролизе таким огромным током не закипела, ее приходилось непрерывно охлаждать холодной водой, пропускаемой по металлическим трубкам внутри электролизера. Остаток объемом 1 л перенесли в электролизер поменьше и снова путем электролиза снизили объем в 10 раз. Затем в третьей ячейке объем был уменьшен до 10 мл, и, наконец, в четвертой он был доведен до 0,5 мл. Отогнав этот остаток в вакууме в небольшую колбочку, они получили воду, содержащую 31,5% D2
O. Ее плотность (1,035) уже заметно отличалась от плотности обычной воды.
В следующей серии опытов из 20 л воды, также в несколько этапов, получили 0,5 мл воды с плотностью 1,075, содержащей уже 65,7% D2
O. Продолжая такие опыты, удалось, наконец, получить 0,3 мл воды, плотность которой (1,1059 при 25°С) уже больше не увеличивалась при уменьшении объема при электролизе до 0,12 мл. Эти несколько капель и были первые за всю историю Земли капли почти чистой тяжелой воды. Соответствующие расчеты показали, что прежние оценки соотношения обычного и тяжелого водорода в природе были слишком оптимистическими: оказалось, что в обычной воде содержится всего 0,017% (по массе) дейтерия, что дает соотношение D:Н = 1:6800.
Чтобы получать заметные количества тяжелой воды, необходимой ученым для исследований, необходимо было подвергать электролизу уже огромные по тем временам объемы обычной воды. Так, в 1933 группе американских исследователей для получения всего 83 мл D2
O 99%-ой чистоты пришлось взять уже 2,3 тонны воды, которую разлагали в 7 стадий. Было ясно, что такими методами ученые не смогут обеспечить всех желающих тяжелой водой. А тут выяснилось, что тяжелая вода является прекрасным замедлителем нейтронов и потому может быть использована в ядерных исследованиях, в том числе для построения ядерных реакторов. Спрос на тяжелую воду вырос настолько, что стала ясна необходимость налаживания ее промышленного производства. Трудность состояла в том, что для получения 1 тонны D2
O необходимо переработать около 40 тысяч тонн воды, израсходовав при этом 60 млн кВт-ч электроэнергии – столько уходит на выплавку 3000 т алюминия!
Первые полупромышленные установки были маломощными. В 1935 на установке в Беркли еженедельно получали 4 г почти чистой D2
O, стоимость которой составляла 80 долларов за грамм – это очень дорого, если учесть, что за прошедшие годы доллар «подешевел» в десятки раз. Более эффективной была установка в химической лаборатории Принстонского университета – она давала ежедневно 3 г D2
O ценой по 5 долларов за грамм (через 40 лет стоимость тяжелой воды снизилась до 14 центов за грамм). Наиболее трудоемким оказался самый первый этап электролиза, в котором концентрация тяжелой воды повышалась до 5–10%, поскольку именно на этом этапе приходилось перерабатывать огромные объемы обычной воды. Дальнейшее концентрирование можно было уже без особых проблем провести в лабораторных условиях. Поэтому преимущества получали те промышленные установки, которые могли подвергать электролизу большие объемы воды.
Теоретически можно вместо электролиза использовать простую перегонку, поскольку обычная вода испаряется легче, чем тяжелая (ее температура кипения 101,4°С). Однако этот способ еще более трудоемкий. Если при электролизе коэффициент разделения изотопов водорода (т.е. степень обогащения в одной стадии) теоретически может достигать 10, то при перегонке он составляет всего 1,03–1,05. Это означает, что разделение путем перегонки исключительно малоэффективно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация D2
О всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1O30
тонн воды, что в 300 млн. раз превышает массу Земли!
Масса молекулы D2
O на 11% превышает массу Н2
О. Такая разница приводит к существенным различиям в физических, химических и, что особенно важно, биологических свойствах тяжелой воды. Тяжелая вода кипит при 101,44°С, замерзает при 3,82°С, имеет плотность при 20°С 1,10539 г/см3
, причем максимум плотности приходится не на 4°С, как у обычной воды, а на 11,2°С (1,10602 г/см3
). Кристаллы D2
O имеют такую же структуру, как и обычный лед, но они более тяжелые (0,982 г/см3
при 0°С по сравнению с 0,917 г/см3
для обычного льда). В смесях с обычной водой с большой скоростью происходит изотопный обмен: Н2
О + D2
O 2HDO. Поэтому в разбавленных растворах атомы дейтерия присутствуют в основном в виде HDO. В среде тяжелой воды значительно замедляются биохимические реакции, и эта вода не поддерживает жизни животных и растений. 2HDO. Поэтому в разбавленных растворах атомы дейтерия присутствуют в основном в виде HDO. В среде тяжелой воды значительно замедляются биохимические реакции, и эта вода не поддерживает жизни животных и растений.
В настоящее время разработан ряд эффективных методов получения тяжелой воды: электролизом, изотопным обменом, сжиганием обогащенного дейтерием водорода. В настоящее время тяжелую воду получают ежегодно тысячами тонн. Ее используют в качестве замедлителя нейтронов и теплоносителя в ядерных реакторах (для заполнения одного современного крупного ядерного реактора требуется 100–200 тонн тяжелой воды чистотой не менее 99,8%); для получения дейтронов D+
в ускорителях частиц; как растворитель в спектроскопии протонного магнитного резонанса (обычная вода своими протонами смазывает картину). Не исключено, что роль тяжелой воды значительно возрастет, если будет осуществлен промышленный термоядерный синтез.
Приложение 6
Получение металлов путем электролиза
Используемые в промышленности цветные металлы, такие как алюминий, медь, магний, цинк, свинец, ввиду многообразия руд, содержащих их, получают самыми различными способами. Рассмотрим подробнее электротермию на примере получения алюминия.
Алюминий получают из бокситов-руды, содержащей около 55-65% А12
О3
, не более 28% Fe2
O3
и до 24% SiO2
. Измельченный, высушенный и перемолотый боксит превращают в алюминат натрия. Это осуществляется либо воздействием на него едкого натра под давлением в 6-8 раз больше атмосферного (способ Бауера), либо путем спекания с содой во вращающихся трубных печах (способ Левига). Из раствора алюмината можно осадить гидроксид алюминия, который затем в таких же печах при 1300-1400°С превращается в чистый глинозем (А12О3
). После растворения полученного таким образом глинозема в соли (криолит) начинается важнейшая стадия процесса получения алюминия, электролиз расплава. При этом на дно электролизной ячейки выпадает шлаковый алюминий, из которого путем переплавки получают чистый алюминий (до 99-99,8% А1). Другой специфический способ электролиза приводит к получению сверхчистого алюминия (99,99% А1).
Приложение 7
Гальваническое производство
Гальваническое покрытие – это металлическая пленка толщиной от долей микрона до десятых долей миллиметра, наносимые на поверхность неметаллических изделий методом гальваники для придания им твердости, износостойкости, антикоррозийных, антифрикционных, декоративных свойств.
Изменение характеристик поверхностных слоев не металлических и металлических изделий приобретает все большую актуальность. Современные требования к надежности оборудования при увеличении нагрузок на него, необходимость в защите металлических деталей от агрессивных сред и очень высоких или, наоборот, низких температур приводят к возрастающему интересу всех областей промышленности к применению гальванических покрытий.
Более всего гальванические покрытия находят применение в автомобилестроении, строительстве, авиационной, радиотехнической и электронной промышленности. Но эстетичный вид и большая цветовая гамма вместе с защитой от неблагоприятного внешнего воздействия приковывают внимание и дизайнеров помещений, например, при отделке ручек дверей, мебели и карнизов, деталей интерьера и экстерьера. Тонкие (от 2-6 до 12-20 микрон) и прочные слои хромовых и никелевых гальванических покрытий увеличивают срок службы и улучшают качество бытовых, медицинских, штамповочных и прессовых инструментов, деталей узлов трения.
Гальванические покрытия были открыты в 1836 г. русским физиком и изобретателем в области электротехники Б. С. Якоби и основаны на электрокристаллизации – электрохимическом осаждении на катоде (в роли которого выступает основное изделие) положительно заряженных ионов металлов при пропускании через водный раствор их солей постоянного электрического тока. При этом соли металлов распадаются на ионы под воздействием электрического тока направляются к разным полюсам: отрицательно заряженные – к аноду, а положительно заряженные ионы металла – к катоду, то есть к изделию, поверхностный слой которого мы хотим изменить нанесением гальванического покрытия.
Одна из важнейших функций анодов в этой системе – восполнять разряжающиеся на катоде ионы, поэтому качество металла, играющего роль анода, должно быть очень высоким, с минимальным количеством посторонних примесей. На практике аноды, за редким исключением, изготавливают из металла, слой которого хотят получить в качестве гальванического покрытия. Процессы хромирования, золочения, платинирования, родирования и др. протекают с нерастворимыми анодами из металла или сплава, устойчивого в данном электролите.
Электролиты на основе простых соединений проще и дешевле, но при получении качественных гальванических покрытий с мелкокристаллической структурой и равномерной толщиной на всех участках изделий сложной формы применяют электролиты на основе комплексных соединений или на основе простых солей с добавками поверхностно-активных веществ. Для сохранения постоянства состава электролита введение солей или других соединений осаждаемого металла осуществляется периодически.
Количественно гальванотехнические процессы регулируются по законам Фарадея с учётом побочных процессов, качественно — составом электролита, режимом электролиза, температурой и интенсивностью перемешивания. Все электрохимические процессы получения гальванических покрытий проводят в гальванических ваннах, футерованных свинцом или винипластом, полипропиленом, или другого материала, в зависимости от размера ванны и агрессивности электролита. Ванны, для получения гальванических покрытий бывают стационарными, полуавтоматическими (изделия в такой ванне вращаются или перемещаются по кругу или подковообразно) или представляют собой целый комплекс, в котором автоматически производится загрузка, выгрузка и транспортировка изделий вдоль ряда отдельных ванн.
Прочность сцепления гальванических покрытий с основным изделием обеспечивается, прежде всего, тщательной подготовкой поверхности, очистка поверхности от окислов и жировых загрязнений путём механической пескоструйной обработки, и химической обработкой травлением или обезжириванием, удалением шероховатости шлифованием и полированием.
Покрытия, применяемые в гальванике, очень разнообразны. При выборе следует учитывать назначение и материал детали, условия эксплуатации покрываемого изделия, назначение и необходимые свойства покрытия, способ его нанесения, допустимость контактов сопрягаемых металлов и экономическую целесообразность применения гальванического покрытия. Гальванические покрытия могут обеспечивать повышенную коррозионную стойкость (оцинкованием, хромированием, лужением, свинцеванием), износостойкость трущихся поверхностей (хромированием, железнением), защитно-декоративную функцию отделки поверхности (меднением, никелированием, хромированием, серебрением, золочением, анодированием). Гальванические покрытия изделий из полимеров, оргстекла, пластика или композита применяются для придания эстетичного вида, увеличения прочности поверхности изделия, приданию деталям электропроводящих свойств.
Хромирование увеличивает твердость металлических изделий, сопротивление механическому износу и высоким температурам, придает декоративный вид и светоотражающие свойства. Сами по себе хромовые гальванические покрытия достаточно пористые, поэтому чаще для предотвращения коррозии на изделие наносят несколько слоев, например, медь-никель-хром или никель-медь-никель-хром. Аноды при хромировании используют свинцовые. Свойства хромовых гальванических покрытий сильно зависят от концентрации и температуры электролита, плотности тока. Например, при температуре электролита 35-55ºС покрытие будет блестящим, при 55-80 ºС – молочным, ниже 35 ºС – матовым. Меняя состав электролитов, можно получить декоративное покрытие (от темно-голубого цвета до темно-синего и даже черного) или износостойкое для обработки деталей двигателей, редукторов и других механизмов.
Цинкование может быть щелочным, слабокислым, цианистым. Цианистое цинкование в последнее время не применяется в виду его вредности. Цинк хорошо сцепляется с поверхностью других металлов, а со временем на цинковом покрытии образуется тонкая пленка окислов, обладающая прекрасными защитными свойствами. Нанесение цинкового гальванического покрытия с использованием бесцветного и радужного хроматирования обеспечивает изделиям красивый вид и защиту от различных видов коррозии и механических воздействий.
Кадмирование для защиты поверхности металлов все еще широко применяется, хотя в последнее время оно начинает заменяться более дешевым и доступным, и менее вредным цинкованием. По стойкости к атмосферным и химическим факторам между этими металлами нет большой разницы. Для кадмирования изделий применяются, как правило, цианистые электролиты.
Меднение металлических изделий производят в декоративно-защитных целях, для улучшения приработки трущихся деталей, уплотнения зазоров, восстановления изношенных поверхностей и защиты инструмента от искрообразования, а также для создания на поверхности металла токопроводящего слоя с малым сопротивлением. При меднении используются кислые, цианистые или щелочные нецианистые электролиты.
Никелированию подвергаются преимущественно изделия из стали и сплавов, а также меди, латуни, цинка для защиты от коррозии, повышения износостойкости деталей, в защитно-декоративных целях, а также для формирования промежуточного слоя при многослойных покрытиях. Никелевые гальванические покрытия отличаются красивым внешним видом, стойкостью к атмосферным воздействиям, легкостью нанесения на металлические изделия. Для получения матовых и блестящих никелевых покрытий без дополнительной полировки используют разные гальванические ванны. Электролиты для никелирования бывают сернокислые матовые, сернокислые блестящие и редко применяемые в гальваностегии сульфаматные.
Железнение как гальваническое покрытие распространено очень мало. Главным образом оно используется в полиграфической промышленности для покрытия матриц, а в последнее время также при окончательной обработке деталей машин или при ремонте изношенных инструментов. Кроме того, этим способом можно приготовить особо чистое железо для физических и химических исследований. Основным элементом электролита является сернокислое или хлористое железо.
Латунирование– это нанесение на поверхность металлических (главным образом стальных) изделий слоя латуни толщиной в несколько мкм (примерный состав: 70% меди и 30% цинка). Применяется для защиты изделий от коррозии, для обеспечения прочного сцепления стальных и алюминиевых изделий с резиной при горячем прессовании, для создания промежуточного слоя при никелировании или лужении стальных деталей (что более эффективно, чем непосредственное покрытие никелем или оловом). Латунирование — один из способов повышения антифрикционных свойств титана и его сплавов.
Лужение приобретает в промышленности все большее значение, благодаря стойкости олова к коррозии. Применяется чаще всего к железным и стальным деталям. Гальванические покрытия из драгоценных металлов и их сплавов широко применяются при заключительной обработке ювелирных изделий для придания им определенного цвета, тона и блеска, создания цветовой гармонии при изготовлении изделий с драгоценными камнями, коррозионной защиты, повышения прочности и твердости. При золочении из экономических соображений пользуются нерастворимыми (угольными, платиновыми или стальными) анодами. Наилучшими свойствами обладают гальванические покрытия из золота, серебра и их сплавов, полученные из цианистых электролитов, содержащих свободный цианистый калий. Однако при этом возникают проблемы с утилизацией промывных вод и отработанных электролитов, которые содержат свободные цианиды, не говоря уже про особые меры предосторожности в процессе получения самих гальванических покрытий. Покрытия, нанесенные с использованием нецианистых электролитов (гексаферроцианидных, роданидных, йодидных, пирофосфатных при серебрении и трилонатных, сульфитных, тиосульфатных, триполифосфатных при золочении) не требуют столь строгих мер по соблюдению экологической безопасности, но дают матовые гальванические поверхности и требуют дополнительной полировки, поэтому применяются на изделиях относительно простой конфигурации. В связи с этим сейчас в промышленности уделяют особое внимание разработке новых полностью бесцианистых электролитов для нанесения блестящих гальванических покрытий.

Радужное хроматирование
 
 
Блестящее белое и голубое хроматирование
Приложение 8
Новые технологии в Челябинске. Компания Цинк Сервис.
Гальваника в Челябинске представлена многими предприятиями. Но этот производственный цех не затерялся среди многих, а входит в лидеры по качеству и скорости обслуживания. Предприятие работает с 2000 года. За это время проделан сложный путь от кустарного производства, до гальванического цеха, производящего высококачественное гальваническое покрытие. Продукция гальванического производства обладает высоким декоративным эффектом и антикоррозийными защитными функциями. Качеством гальваники находится на уровне мировых образцов.
Цинкование метизов – основной род деятельности, мощности цеха позволяют цинковать до двух тонн метизов в сутки. Так же оцинковка деталей машин, деталей рециклируемой техники и деталей производственных предприятий. Начиная от запасных частей транспортной техники, частей гидравлического оборудования, электрических шкафов, заканчивая деталями приборов для атомной станции. Первая линия – цинкование в ваннах на подвесках. Линия позволяет оцинковать металлические конструкции и изделия. Например: мебельную фурнитуру, элементы замков, приборов, стальные листы, ленту, крепежные детали, детали машин, трубопроводов и др. (габариты подвески 1000 х 250 х 700мм). Вторая линия – цинкование в барабанах. Линия позволяет оцинковать мелкие металлические изделия и конструкции длина которых не превышает 110 мм. Также всю метизную продукцию. Например: болты, гвозди, металлическую фурнитуру и др. Улучшение товарного вида приобретается за счет пассивирования оцинкованных изделий в хроматных растворах, придающих покрытиям радужную окраску, либо блестящую голубую. На всех этапах техпроцессов осуществляется тщательный контроль, что позволяет достигать безупречного качества покрытий. На предприятии имеется так же и участок токарной обработки.
 
Гальванические ванны
  
Выпрямители
Приложение 9
Эксперименты
 
Меднение стальной пластинки с помощью «кисти» провода, когда между пластинкой и кистью слой электролита.

Меднение стальных ножниц, а затем неудачная попытка их никелирования ввиду отсутствия никелевых электродов.

Заготовка из воска для опыта по гальванопластике.

Опыт по гальванопластике. Заготовка с нашими инициалами, посыпанная электропроводящим порошком графитом подвешена на медных проволочках в растворе медного купороса.
|