Вятский государственный гуманитарный университет
Кафедра химии
Контрольный синтез
Mg
(
NO
3
)2
–
MgO
–
MgCl
2
Киров 2007
Цель работы: Изучить цепочку синтеза Mg(NO3
)2
- MgO - MgCl2
, и осуществить ее на практике. Рассмотреть физико-химические характеристики веществ, участвующих в химических реакциях при синтезе MgCl2
из Mg(NO3
)2 ,
их химические свойства, и методы качественного и количественного анализа соединений магния.
1). Химический синтез оксида магния (
MgO
) из нитрата магния
Mg
(
NO
3
)2
Mg
(
NO
3
)2
→
MgO
Физико – химическая характеристика
Mg
(
NO
3
)2
:
1. Встречается в природе в небольших количествах в виде нитромагнезита (гидрат), или магнезиевой селитры.
2.
Нитрат магния при обычных условиях кристаллогидрат состава Mg(NO3
)2
·
nH2
O, где n- 2, 6, 9, n зависит от способа выделения нитрата магния и температурного режима.
3.
Соединение Mg(NO3
)2
·
2H2
O представляет собой бесцветные кристаллы с плотностью 2,025 г/см3
, плавятся при 129,5 °С, растворимы в воде, спирте и концентрированной азотной кислоте.
4.
Mg(NO3
)2
·
6H2
O – бесцветные призматические кристаллы моноклинной формы с плотностью 1,464 г/см3
; они плавятся при температуре 95°С, кипят при 143°С, также растворимы в воде, спирте и концентрированной азотной кислоте.
5.
Mg(NO3
)2
·
9H2
O бесцветные кристаллы с плотностью 1,356 г/см3
плавятся при 74°С, плотность 1,302 г/см3
6.
Растворимость безводной соли в воде (на 100 г) при 20°С 73,3 г (42,3 %), при повышении температуры растворимость повышается и при 80°С она составляет 110,1 г (52,4 %).
7.
Выделен также неустойчивый кристаллогидрат состава Mg(NO3
)2
·
4H2
O плавящийся при температуре 52 °С.
8. Легко теряет кристаллизационную воду по следующей схеме:

При температуре выше 380° разлагается.
9. При неполном разложении кристаллогидратов получаются продукты различного состава 2Mg(NO3
)2
· MgO, Mg(NO3
)2
· Mg(OН)2
, Mg(NO3
)2
·3Mg(OН)2
·8H2
O, Mg(NO3
)2
·2Mg(OН)2
·4H2
O и т. д.
10. Растворяется в безводном жидком аммиаке и абсолютизированном спирте, образуя аддукты различного состава:
Mg(NO3
)2
+ nNH3
= Mg(NO3
)2
·
nNH3
(n=1, 2, 4, 6)
Mg(NO3
)2
+ 6CH3
OH = Mg(NO3
)2
·
6CH3
OH
Mg(NO3
)2
+ 6C2
H5
OH = Mg(NO3
)2
·
6C2
H5
OH.
11. Водный раствор Mg(NO3
)2
имеет кислую среду раствора вследствие гидролиза по катиону: Mg(NO3
)2
+ H2
O ↔MgOHNO3
+ 2HNO3
Mg2+
+ H2
O ↔ MgOH+
+ H+
(гидролиз по первой ступени)
MgOHNO3
+ H2
O ↔ Mg(OH)2
↓+ HNO3
MgOH+
+ H2
O ↔ Mg(OH)2
↓+ H+
(гидролиз по второй ступени)
12. При взаимодействии с растворами щелочей выпадает белый осадок гидроксида магния Mg(OH)2.
Mg(NO3
)2
+2NaOH = Mg(OH)2
↓+ 2Na NO3
.
13. Не растворяется в растворах плавиковой, фосфорной, угольной, кремниевой кислот, химически взаимодействует с ними с образованием нерастворимых в воде солей:
Mg(NO3
)2
+ 2HF = MgF2
↓+ 2HNO3
;
3Mg(NO3
)2
+ 2H3
PO4
= Mg3
(PO4
)2
↓+ 6HNO3
;
Mg(NO3
)2
+ CO2
+ H2
O = MgCO3
↓+2HNO3
;
Mg(NO3
)2
+ H2
SiO3
= MgSiO3
↓+2HNO3
Сильно (все выпавшие осадки белого цвета). разбавленная
Физико – химическая характеристика
MgO
1. Белая или жженая магнезия -MgO белый рыхлый порошок (кристаллы октаэдрической формы) плавится при температуре 2800°С, кипит при t = 3600°С;
2. В электрической печи сублимируется при температуре 1600 - 1800°С, а затем вновь осаждается в виде кристаллов уже кубической формы с кристаллической решеткой подобной NaCl с межионным расстоянием 2,11А, плотностью 3,58 г/см3
и твердостью 4 по шкале Мооса.;
3. Плотность 3,67 г/см3
,
твердость по шкале Мооса равна 6.
4. MgO плохо проводит тепло и электричество, трудно растворим в воде, но легко в метиловом спирте, разбавленных кислотах, расплавленном криолите Na3
[AlF6
];
5. MgOочень медленно взаимодействует с водой при нагревании:
MgO + H2
O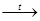 Mg(OH)2
↓ , Mg(OH)2
↓ ,
(Белый порошок)
6. Хорошо растворяется в кислотах и метиловом спирте:
MgO + 2HCl = MgCl2
+ H2
O,
MgO + 2CH3
OH = (CH3
O)2
Mg + H2
O.
Метилат магния
7. На воздухе при действии углекислого газа и влаги легко переходит в основной карбонат магния:
2MgO + CO2
+ H2
O = (MgOH)2
CO3
.
8. При высоких температурах восстанавливается калием, кальцием, кремнием, карбидом калия и др:
MgO + 2K = K2
O + Mg,
MgO + Сa = CaO + Mg,
2MgO + K4
C = 2K2
O + Mg +C.
Физико – химическая характеристика
MgCl2
1. Безводная соль MgCl2
кристаллизуется в виде бесцветных очень гигроскопичных гексагональных кристаллов со слоистой структурой и горьким вкусом;
2. Плотность кристаллов безводного MgCl2
2,32 г/см3
,
плавится при температуре 715°С, кипит при 1412°С;
3. MgCl2
хорошо растворима в воде (54,5 г на 100 г воды) и ацетоне;
4. При выделения из раствора в зависимости от температуры кристаллизуется стабильный при обычных условиях гексагидрат MgCl2
·6H2
O или при быстром выпаривании — продукт, содержащий меньшее количество молекул воды (1, 2, 4); известны также кристаллогидраты хлорида магния с 8 и 12 молекулами воды;
5. MgCl2
·6H2
O существует в интервале температур от —3,4 до 116,7°. Он образует расплывающиеся на воздухе моноклинные кристаллы с плотностью 1,56 г/см3
;
6. Воду из хлорида магния нельзя полностью удалить без разложения соли, так как при нагревании отщепляется хлористый водород и образуется основной хлорид
(оксохлорид) переменного состава
2MgCl2
+ Н2
О = Mg2
OCI2
+ 2HC1.
7. Водный раствор MgCl2
имеет слабокислую реакцию:
MgСl2
+ H2
O ↔MgOHCl+ 2HCl
Mg2+
+ H2
O ↔ MgOH+
+ H+
(гидролиз по первой ступени)
MgOHCl+ H2
O ↔ Mg(OH)2
↓+ HCl
MgOH+
+ H2
O ↔ Mg(OH)2
↓+ H+
(гидролиз по второй ступени)
8. Если в концентрированный раствор MgCl2
внести сильно прокаленный оксид магния, то получившееся тесто через несколько часов застывает в твердую массу, образуя так называемый магнезиальный цемент
(цемент Сореля), причем происходит соединение окисла с хлоридом с образованием основных хлоридов MgCl2
·5Mg(OH)2
·8H2
O, MgCl2
·3Mg(OH)2
·8H2
O, MgCl2
·2Mg(OH)2
·4H2
O и т.д.
9. При действии паров воды на нагретый безводный хлорид магния может образоваться основной хлорид магния или оксид магния:
MgCl2
+ H2
O 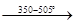 Mg(OH)Cl + 2HCl, Mg(OH)Cl + 2HCl,
MgCl2
+ H2
O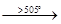 MgO + 2HCl. MgO + 2HCl.
10. Растворяется в спиртах с образованием аддуктов:
MgCl2
+ 6C2
H5
OH = MgCl2
·6C2
H5
OH,
11. При нагревании кристаллогидраты теряют воду по следующей схеме:
MgCl2
·12 H2
O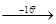 MgCl2
·8H2
O MgCl2
·8H2
O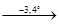 MgCl2
·6H2
O MgCl2
·6H2
O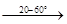 MgCl2
·4H2
O MgCl2
·4H2
O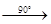 MgCl2
·2H2
O MgCl2
·2H2
O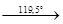 MgCl2
·H2
O MgCl2
·H2
O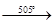 MgO + 2HCl. MgO + 2HCl.
Физико – химическая характеристика
HCl
1. Хлористый водород — бесцветный газ с резким запахом и вкусом.
2. Плотность газа относительно кислорода равна 1,1471, что соответствует молекулярному весу 36,71, в то время как рассчитанный по формуле НС1 молекулярный вес оказывается равным 36,47. Следовательно, хлористый водород при обычной температуре состоит из простых молекул HС1. Его можно достаточно легко перевести в жидкое состояние. Даже вблизи температуры сжижения плотность газа все еще близка к нормальной.
3. Хлористый водород жадно поглощается водой в больших количествах и с сильным выделением тепла. При атмосферном давлении 1 об. воды при комнатной температуре может растворить около 450 об. хлористого водорода.
4. При сильном охлаждении в зависимости от состава раствора из растворов кристаллизуются различные гидраты: НС1·ЗН2
О (т. пл. —24,9°), НС1·2Н2
О (т. пл. —17,6°) и НС1·Н2
О (т. пл. —15,3°). Правда, из раствора, насыщенного при 0° хлористым водородом под давлением 1 атм,
может выделиться только тригидрат (с содержанием 40,3% НС1). Остальные гидраты выделяются из растворов, насыщенных хлористым водородом под давлением выше атмосферного. Раствор, насыщенный хлористым водородом при атмосферном давлении, при 0° содержит 45,4 вес.% НС1, а при 15° — 42,7 вес.%. Если такой раствор нагреть, то сначала выделяется хлористый водород, а затем при температуре около 110° перегоняется смесь постоянного состава с содержанием хлористого водорода 20,24%. Смесь того же состава можно получить, если исходить из более разбавленных растворов. Однако состав смеси, кипящей при постоянной температуре, зависит от давления, при котором производится перегонка.
5. Водные растворы хлористого водорода обычно называют соляной кислотой.
Содержание в ней хлористого водорода устанавливают чаще всего посредством ареометра.
Соляная кислота плотностью 1,060 1,124 1,16 1,19
при 15° содержит, 12,2 24,8 31,5 37,2% НС1
6. Помимо воды, хлористый водород сильно растворим также в спирте, в эфире и еще во многих других жидкостях. Наоборот, жидкий хлористый водород может служить растворителем для спирта, эфира и многих других веществ.
7. На большинство металлов жидкий хлористый водород не действует, он не реагирует в общем также с оксидами, сульфидами и карбонатами. Газообразный хлористый водород при температуре каления реагирует с выделением водорода с металлами, причем даже с такими металлами, на которые водная соляная кислота без доступа воздуха не действует, например с медью и серебром. (Водный раствор HCl взаимодействует только с металлами, стоящими в ряду СЭП до водорода)
Сu + 2HCl = CuCl2
+ H2
↑
CuCl2
+ 2HCl = H2
[CuCl4
],
2Ag + 4HCl = 2H[AgCl2
] + H2
↑
8. C фтором хлористый водород взаимодействует уже при обычной температуре с образованием пламени, с кислородом воздуха он реагирует только в присутствии катализаторов:
2HCl + F2
= Cl2
↑ + 2HF,
4HCl + O2
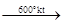 2H2
O + 2Cl2
↑.
2H2
O + 2Cl2
↑.
9. В водном растворе HCl полностью диссоциирована на ионы, поэтому соляную кислоту относят к сильным кислотам.
HCl↔H+
+ Cl-
10. Соляная кислота взаимодействует с основными оксидами:
2HCl + MgO = MgCl2
+ H2
O
Так же она способна при взаимодействии с сильными окислителями проявлять восстановительные свойства:
4HCl + MnO2
= MnCl2
+ Cl2
↑+2H2
O
Физико - химическая характеристика
NO
2
1. Бурый газ. Выше 135° С — мономер, при комнатной температуре — красно-бурая смесь NO2
и его димера (тетраоксида диазота) N2
O4
. В жидком состоянии димер бесцветен, в твердом состоянии белый. Хорошо растворяется в холодной воде (насыщенный раствор — ярко-зеленый), полностью реагирует с ней. Реагирует со щелочами:
2NaOH + 2NO2
= NaNO2
+ NaNO3
+ H2
O.
3NO2
+ H2
O(
горяч
)
= 2HNO3
+ NO↑,
2NO2
+ H2
O(
холод
)
= HNO3
+ HNO2
.
2. Очень сильный окислитель. Вызывает коррозию металлов.
3. Плотность 2,0527 г/л.
4. Температура плавления тетраоксида азота -11,2°С, растворимость в воде при 0°С – 1,491г.
5. При температуре от -11,2°С до +20,7°С находится в равновесии:
6. В интервале температур выше 135 °С и до температуры равной 620°С оксид азота (IV) распадается с образованием кислорода и оксида азота (II):
7. При растворении в воде в присутствии кислорода воздуха окисляется до азотной кислоты:
Физико – химическая характеристика воды:
1. Чистая вода не имеет ни запаха, ни вкуса и бесцветна, однако в толстом слое она имеет голубоватый цвет. При достаточно сильном охлаждении она замерзает, превращаясь в лед. Температура, при которой лед и вода образуют при нормальном давлении (760 мм рт. ст.)
устойчивую систему, принята за нулевую точку шкалы термометра Цельсия. Температура 100° определяется точкой кипения воды при нормальном давлении.
2. Температура кипения воды сильно зависит от давления, так при 760 мм рт. ст
она равна 100°, при увеличении давления температура кипения воды возрастает. При росте давления на 1 мм. рт. ст.
температура кипения возрастает на 0,3—0,4°.
3. Физические константы воды:
- температура замерзания воды (точка тройного равновесия) —0° (н.у.);
- температура кипения —100° (н.у.);
- плотность льда при 0° равна 0,9168 г/см3
;
- плотность воды при 4° равна 1 г/см3
, при повышении или понижении температуры, плотность воды уменьшается.
4. При температуре около 1000° вода термически распадается на простые вещества:
2H2
O 2H2
↑ + O2
↑,
а при действии радиоактивного излучения при высоких температурах наблюдается распад воды по схеме:
H2
O®H0
, H2
, O0
, O2
, OH0
, H2
O2
, HO2
0
.
Физико – химическая характеристика О2
1. Кислород – при обычных условиях газ без цвета и запаха, в толстых слоях – голубой.
2. Плотность жидкого кислорода 1,429 г/см3
.
3. Температура плавления -218,8°С.
4. Температура кипения -183,0 °С.
5. Сильный окислитель, особенно атомарный кислород (в момент выделения).
Получение
MgO
:
На аналитических весах взять навеску шестиводного кристаллогидрата нитрата магния (Mg(NO3
)2
·
6H2
O) массой 13,5 г и поместить в фарфоровый тигель. Тигель поставить в муфельную печь, нагретую до 400 – 450° С. Прокаливать до тех пор, пока не прекратится выделение оксида азота (IV) бурого цвета.
2Mg(NO3
)2
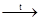 2MgO + 4NO2
↑+O2
↑ 2MgO + 4NO2
↑+O2
↑
Взвесить полученный оксид и рассчитать выход продукта по следующей формуле:
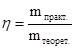 , масса теоретическая равна 2,11г. , масса теоретическая равна 2,11г.
Получение
MgCl
2
.
К полученному оксиду магния прилить 9,37 мл соляной кислоты (r = 1,174 г/мл) до полного его растворения. Полученный раствор упаривают до появления корки кристаллов на поверхности. Дальнейшее нагревание ведут осторожно, не допуская перегрева смеси выше 200° С. При перегреве хлорида магния выше этой температуры возможно его частичное разложение с образованием оксохлорида магния (Mg2
OCI2
).
MgO + 2HCl = MgCl2
+ H2
O
2MgCl2
+ H2
O = Mg2
OCI2
+ 2HCl
(полностью воду хлорид магния теряет при температуре 505° С с разложением, при 200° С. существует его кристаллогидрат MgCl2
×H2
O)
Качественный анализ
ионов магния (
Mg
2+
).
1. Гидроксиды КОН и
NaOH
образуют с катионом Mg2+
белый аморфный осадок гидроксида магния Mg(OH)2
, растворимого в кислотах и солях аммония.
Опыт.
В первую пробирку возьмите 4 капли раствора соли магния, прибавьте 4 капли насыщенного раствора хлорида аммония NH4
C1.
Во вторую пробирку возьмите 4 капли раствора соли магния и прибавьте 4 капли воды (чтобы концентрация растворов была одинаковая).
Затем в обе пробирки прибавьте осадитель — гидроксид аммония NH4
OH. В первой пробирке осадок не вападает так как образуется комплексное соединение.
2. Гидрофосфат натрия
Na
2
HPO
4
дает с катионом
Mg
2+
в присутствии гидроксида и хлорида аммония NH4
OH и NH4
C1 белый кристаллический осадок фосфата магния-аммония MgNH4
PO4
:
MgSO4
+ Na2
HPO4
+ NH4
OH ® MgNH4
PO4
¯ + Na2
SO4
+ H2
O
Mg2+
+ НРО2-
+ NH4
OH®MgNH4
PO4
¯ + Ha
O
Хлоридаммониядобавляют, чтобыневыпаламорфныйосадокгидроксидамагния Mg(OH) 2
.
Опыт.
Возьмите 3—4 капли раствора соли магния и смешайте с 4—6 каплями 2 н. раствора хлороводородной кислоты и 3—5 каплями раствора гидрофосфата натрия Na2
HPO4
. После этого прибавьте к раствору по одной капле 2 н. раствора аммиака, перемешивая раствор после каждой капли. Вначале аммиак нейтрализует прибавленную кислоту, причем образуется хлорид аммония NH4
C1, препятствующий образованию гидроксида магния Mg(OH)2
. После окончания реакции выпадает характерный кристаллический осадок—фосфат магния-аммония MgNH4
PO4.
1.Реакция проводится в аммиачной среде при рН 8.
2. Избыток катионов NH4
+
мешает выпадению осадка MgNH4
PO4
.
3.Не следует брать избыток хлороводородной кислоты.
3.Магнезон
I
(napa-нитробензолазорезорцин) или магнезон
II
(пара-нитробензолазо-a-нафтол) в щелочной среде дает красную или красно-фиолетовую окраску. Эта реакция основана на свойстве гидроксида магния адсорбировать некоторые красители.
Опыт.
На фарфоровую пластинку (предметное стекло) поместите 1—2 капли анализируемого на катион Mg2+
раствора и добавьте 1—2 капли щелочного раствора реактива. Появляется синяя окраска или синий осадок. Если раствор имеет сильнокислую реакцию, то появляется желтая окраска. В данном случае к раствору надо добавить несколько капель щелочи.
Условия проведения опыта.
1.
Реакцию необходимо проводить в щелочной среде при рН>10.
2.Реакции мешает наличие солей аммония.
Количественный анализ ионов магния (
Mg
2+
).
Из полученного хлорида магния приготовить 100 мл 0,1н. раствора (растворить 0,0476 г MgCl2
в 100 мл воды). Отдельно готовят 250 мл 0,1 н. раствора этилендиаминтетраацетата натрия (трилона Б) (4,65 г в 250 мл воды), и 0,1 н. раствор сульфата магния ( 1,23 г MgSO4
×7H2
O в 100 мл воды). Устанавливают титр трилона Б по сульфату магния. Для этого отбирают аликвоту сульфата магния (25 мл), прибавляют 50 мл воды, 25 мл аммиачной буферной смеси (100 мл 20-процентного раствора хлорида аммония и 100 мл 20-процентного раствора аммиака доводят водой до одного литра), 20-30 мг сухой смеси индикатора хромогена черного с хлоридом натрия и титруют из бюретки приготовленным раствором трилона Б до перехода красной окраски в синюю. Так поступают 3 раза, по среднему значению высчитывают нормальную концентрацию трилона Б по формуле Сн1
*V1
=Cн2
*V2
.
Установив титр трилона Б по сульфату магния, приступают к определению концентрации приготовленного раствора хлорида магния. По выше приведенной формуле рассчитывают нормальную концентрацию хлорида магния. И по формуле mx
=Сн
*V(р)
*Mэ
(в 100 мл воды) рассчитывают истинную массу хлорида магния в полученном в ходе синтеза соединении. Процентное содержание MgCl2
находят по формуле h=mx
/0,0476.
Качественный анализ ионов хлора С
l
-
.
1. Нитрат серебра AgNO3
образует с анионом С1-
белый творожистый осадок хлорида серебра, нерастворимый в воде и кислотах. Осадок растворяется в аммиаке, при этом образуется комплексная соль серебра [Ag(NH3
)2
]C1. При действии азотной кислоты комплексный ион разрушается и хлорид серебра снова выпадает в осадок. Реакции протекают в такой последовательности:
Cl-
+ Ag+
®AgCl¯
AgCl + 2NH4
OH ®[Ag(NH3
)2
]Cl + 2H2
O
[Ag(NH3
)2
]Cl + .2H+
® AgCl¯+ 2NH4
+
Опыт.
В коническую пробирку к 2—3 каплям раствора хлорида магния прибавьте 1—2 капли раствора нитрата серебра. Выпавший осадок отделите центрифугированием. К осадку добавьте раствор аммиака до полного растворения. В полученном растворе откройте хлорид-ион С1-
действием 3—5 капель 2 н. раствора азотной кислоты.
2. Оксид марганца МnО2
, оксид свинца РЬО2
и другие окислители при взаимодействии с анионом С1-
окисляют его до свободного хлора, который легко обнаружить по запаху и. посинению бумаги, смоченной раствором иодида калия и крахмального клейстера:
2Сl-
+МnО2
+ 4Н+
®Cl2
↑ + Мn2+
+ 2Н2
О,
Сl2
+ 2I-
®I2
+ 2Сl-
.
|