1. Литературный обзор
1.1 Свойства и применение ацетальдегида
Ацетальдегид (этаналь, уксусный альдегид) СНзСНО представляет собой бесцветную легкокипящую жидкость с резким удушливым запахом, с температурой кипения 20,2°С, температурой замерзания -123,5 °С и плотностью 783 кг/м3
. Критическая температура ацетальдегида 188 °С, температура самовоспламенения 156°С. С воздухом ацетальдегид образует взрывчатые смеси с пределами воспламеняемости при 400°С 3,97 и 57,0% об. Смеси с кислородом воспламеняются при более низкой температуре - около 140 °С. Токсичен, пары ацетальдегида вызывают раздражении слизистых оболочек удушье, головную боль, ПДК составляет 5 мг/м3
. Относится к 3-му классу опасности.
Ацетальдегид смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром и другими органическими растворителями, с некоторыми образует азеотропные смеси.[1, с. 299 ].
Ацетальдегид - это один из важнейших многотоннажных продуктов переработки ацетилена и этилена. Он применяется в широких масштабах в промышленности органического синтеза. Важнейшие направления использования ацетальдегида:
o окисление в уксусную кислоту и уксусный ангидрид;
o получение циангидрина с последующей переработкой его в акрилонитрил, эфиры акриловой кислоты, молочную кислоту;
o альдольная конденсация и переработка альдоля в бутандиол-1,3 и бутадиен-1,3, н-бутанол, кротоновый альдегид;
o конденсация с аммиаком с образованием гомологов пиридина и винилпиридинов;
o конденсация с формальдегидом до пентаэритрита.
В настоящее время на производство уксусной кислоты и ее ангидрида, этилацетата и 2-этилгексанола расходуется в мире 95%, а в нашей стране 75% всего производимого ацетальдегида. [1, с. 300]
Помимо этого ацетальдегид или его триммер паральдегид применяют в производстве ацетатов целлюлозы, пероксиуксусной кислоты, этилацетата, глиоксаля, 2-этилгексанола, алкиламинов, алкилпиридинов, хлораля; как восстановитель применяется в производстве зеркал.[2, с.224]
1.2 Методы получения ацетальдегида
Известен ряд методов получения ацетальдегида. Рассмотрим эти методы.
1.2.1 Получение ацетальдегида гидратацией ацетилена на ртутных катализаторах
Реакция гидратации ацетилена на ртутных катализаторах была открыта М.Г. Кучеровым в 1881 г. и использовалась в промышленности с целью получения ацетальдегида более 60 лет:

Реакция сильно экзотермична. До 300 °С она практически необратима, но с дальнейшим ростом температуры равновесие смещается в сторону разложения ацетальдегида. Она протекает в нужном направлении с приемлемой скоростью в присутствии катализаторного раствора (10-20%-ная H2SO4, содержащая 0,5-0,6% HgO в виде HgSO4). Реакция протекает через промежуточное образование комплекса ацетилена с Hg2+
. Дальнейшее его разложение приводит к образованию ацетальдегида[3, с.440]:
Скорость реакции увеличивается с повышением концентрации H2SO4 и температуры процесса, однако при этом возрастает и выход побочных продуктов, прежде всего за счет кротоновой конденсации с образованием кротонового альдегида: и альдольной конденсации с образованием смол (в том числе и с последующей полимеризацией кротонового альдегида).


С целью сокращения образования побочных продуктов в реакционную зону подается избыток ацетилена, с которым получающийся ацетальдегид уносится из зоны реакции. Это приводит и к увеличению производительности установки. Вместе с тем подача в избытке ацетилена приводит к уменьшению выхода ацетальдегида за один проход через катализаторный раствор и увеличению рециркуляционных потоков. Конверсия ацетилена в ацетальдегид за один проход составляет 30-50 %.
Ацетальдегид является сильным восстановителем. В данном случае в его присутствии Hg2+
вначале восстанавливается до Hg+
, а затем до металлической ртути:

в результате образуется ртутный шлам. Восстановителями также могут выступать H2S, РН3 и др. Этот процесс является крайне нежелательным, поскольку металлическая ртуть имеет высокое давление насыщенных паров, которые уносятся с реакционными газами, дезактивируя катализатор и загрязняя окружающую среду. Для предотвращения восстановления ртути в катализаторный раствор добавляют соли трехвалентного железа (в избытке по сравнению с солями ртути). Этим обеспечивается протекание реакции
Fe3+
+ Hg+
 Fe2+
+ Hg2+ Fe2+
+ Hg2+
поддерживающей ртуть в максимальной степени окисления.
Соль железа добавляют в избытке по отношению к ртути (~4%: в расчете на Fe2O3), поэтому катализаторный раствор работает достаточно длительное время. Однако в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении азотной кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1-1,5 кг на 1 т ацетальдегида.[4, с. 195]
В промышленности процесс проводят при температуре 75-100 °С, пропуская ацетилен через водный катализаторный раствор. При 50 % конверсии ацетилена выход альдегида составляет 92-93% от прореагировавшего ацетилена. Основную реакцию осуществляют в полой футерованной колонне, заполненной катализаторным раствором и имеющей расширение в верхней части (заполненной насадкой).[3, с. 442]
Большим недостатком процесса синтеза ацетальдегида по Кучерову является необходимость применения дорогостоящей и весьма токсичной металлической ртути и ее соединений. Металлическая ртуть летуча; несмотря на высокую температуру кипения (357°С), она испаряется уже при комнатной температуре. При повышенной температуре в условиях процесса гидратации ртуть проникает почти во все аппараты установки и в получаемые продукты. Следствием этого являются значительные потери ртути и возможность профессиональных заболеваний у обслуживающего персонала.[5, с. 489]
Вместе с тем этот способ обладает многими преимуществами, которые могут быть успешно реализованы в других технологиях. В частности, этот процесс является одностадийным, обладает хорошей селективностью, может обеспечить одновременное получение двух целевых продуктов (ацетальдегид и кротоновый альдегид). Кроме того, реактор обеспечивает не только проведение собственно реакции, но и отделение продуктов от катализаторного раствора. Эффективное применение рециркуляции как по воде, так и ацетилену обеспечивает не только полное использование сырья, но и служит для подавления побочных реакций, повышая выход целевого продукта. Все это делает процесс достаточно привлекательным, однако высокотоксичная каталитическая система делает его бесперспективным.[3, с. 446]
1.2.2 Получение ацетальдегида гидратацией ацетилена в паровой фазе
Для этого процесса в качестве катализатора предлагались различные оксиды металлов и соли, в том числе фосфаты, вольфраматы, ванадаты, молибдаты, хроматы. Наибольшую активность и стабильность показал кадмийкальцийфосфатный катализатор, разработанный Ю.А.Гориным и С. М. Момозоном, состава CdHPO4•Ca3(PO4)2, обладающий кислотными свойствами. Этот катализатор активен при 350-400 °С, регенерируется воздухом и водяным паром при 400-450°С [3, с. 446], не токсичен, однако быстро теряет активность и требует регенерации через каждые 100 часов работы.
Гидратация ацетилена в паровой фазе представляет гетерогенно-каталитическую экзотермическую реакцию, протекающую по уравнению:
С2Н2 + Н2О = СНзСНО ΔН = –162,8 кДж
Реакция гидратации протекает через образование промежуточного комплекса ацетилена с ионом кадмия, который затем разлагается с образованием ацетальдегида:

Одновременно с основной реакцией гидратации протекают побочные реакции дезактивации катализатора за счет его восстановления:

кротоновой конденсации:

и реакции последующего смолообразования.
При парофазной гидратации удаление ацетальдегида по мере его образования невозможно, а накопление его в реакционной зоне увеличивает вероятность побочных реакций, особенно кротоновой конденсации. Для подавления побочных реакций необходимо устранение местных перегревов, при которых развивается реакция кротоновой конденсации, имеющая более высокую энергию активации, применение избытка водяного пара, способствующего выводу ацетальдегида из сферы реакции, и проведение процесса при невысокой степени конверсии ацетилена.
Поэтому, процесс парофазной гидратации ацетилена проводят при объемном отношении водяного пара к ацетилену (7- 10): 1 и степени конверсии не выше 0,5. Образующийся ацетальдегид сорбируется из реакционной смеси водой. В этих условиях выход ацетальдегида чистотой до 99,5% мас. достигает 90%. В качестве побочных продуктов образуется 0,5-1,0% кротонового альдегида, 0,5-1,0% уксусной кислоты и 0,3% ацетона.[1, с. 302]
Активность катализатора снижается вследствие образования смолистых продуктов и зауглероживания. Поэтому к концу цикла (через 70-100 час) температуру увеличивают до 400-410°С, после чего катализатор подвергают регенерации.
Непрореагировавший ацетилен возвращается на синтез, 15- 20% ацетилена отводят для очистки от инертных газов. Продукты, выходящие из реактора, конденсируют, отгоняют от воды и подвергают ректификации. В итоге получается 99,5%-ный ацетальдегид и 85%-ный кротоновый альдегид в виде азеотропа с водой.
Вместе с тем этот процесс не нашел широкого распространения из-за небольшого срока службы катализатора без регенерации, его низкой механической прочности, токсичности (из-за наличия кадмия). С точки зрения принципов создания безотходных производств в нем плохо используется тепло реакции.[3, с. 446]
1.2.3 Получение ацетальдегида из ацетилена через бутилвиниловый эфир
Производство ацетальдегида из ацетилена этим методомпредставляет двухстадийный процесс винилирования н-бутанола ацетиленом с образованием винилбутилового эфира (ВБЭ):
С2Н2 + С4Н9ОН  СН2=СН–О–С4Н9 СН2=СН–О–С4Н9
и последующего гидролиза ВБЭ:
СН2
=СН–О–С4
Н9
+ Н2
О  СН3СНО + С4
Н9
ОН СН3СНО + С4
Н9
ОН
Таким образом, в этом процессе бутанол находится в рецикле и добавляется только для пополнения производственных потерь, а на получение ацетальдегида расходуется только ацетилен.
Реакция винилирования протекает в присутствии гидроксида калия при температуре 400-440°С. Конверсия ацетилена составляет 0,6-0,8 при расходном коэффициенте по ацетилену 0,39-0,5 т/т ВБЭ. Реакционная смесь, содержащая 75- 80% ВБЭ, около 20% непрореагировавшего бутанола, воду и легкую фракцию, перед гидролизом разделяется методами ректификации или экстракции. На гидролиз направляется фракция, содержащая 99,5% винилбутилового эфира.
Реакция гидролиза ВБЭ протекает в парожидкостной среде при температуре, близкой к температуре кипения смеси «ВБЭ-вода», в присутствии катионнообменного катализатора КУ-2ФПП, который обеспечивает степень конверсии ВБЭ, близкую к единице. В результате гидролиза образуется система «ацетальдегид-вода-бутанол», из которой ректификацией выделяется целевой продукт - ацетальдегид, а бутанол возвращается в процесс.[1, с.304]
1.2.4 Получение ацетальдегида окислительным дегидрированием этилового спирта
При окислительном дегидрировании этилового спирта протекают последовательно две реакции:
CH3 – CH2–OH  CH3–CHO + H2 ΔН=15 ккал CH3–CHO + H2 ΔН=15 ккал
H2 + 0,5O2  H2OΔН= –58 ккал H2OΔН= –58 ккал
Для уменьшения теплового эффекта процесса вводят меньше воздуха. Например, спирт можно смешивать с воздухом в отношении 1 : 1,1, что соответствует расходу кислорода 44% от теоретического. При пропускании такой смеси над серебряным катализатором при 450-550°С очень интенсивно протекает дегидрирование этилового спирта и выходящий из контактного аппарата газ содержит 10% водорода.[5, с.491]
1.2.5 Получение ацетальдегида дегидрированием этилового спирта
При каталитическом дегидрировании этилового спирта образуется уксусный альдегид:
CH3 – CH2–OH  CH3–CHO + H2 CH3–CHO + H2
При получении ацетальдегида этим методом применяют медные или медно-цинковые катализаторы. Медь для данного процесса является высокоактивным катализатором, но она быстро теряет активность. Хорошим стойким катализатором является медь с добавками 5% оксида кобальта и 2% оксида хрома, нанесенная на асбест. В присутствии этого катализатора процесс можно проводить при сравнительно низких температурах (275-300° С). Степень превращения спирта в этих условиях составляет 33-50% за один проход через катализатор.
Достоинством процесса дегидрирования спирта по сравнению с процессом окислительного дегидрирования является относительно малое образование побочных продуктов и высокое содержание ацетальдегида в контактных газах. Контактные газы процесса дегидрирования в основном состоят из паров ацетальдегида и водорода (примерно 1 : 1), в то время как контактные газы окисления спирта разбавлены азотом, вводимым с воздухом. Поэтому выделение ацетальдегида из контактных газов дегидрирования спирта легче и сопряжено с меньшими потерями альдегида. Кроме того, при дегидрировании этилового спирта образуется ценный побочный продукт– этилацетат (9-10% от количества ацетальдегида).[5, с. 492]
1.2.6 Получение ацетальдегида окислением этилена
Образование ацетальдегида при взаимодействии этилена с водным раствором хлористого палладия наблюдал Филлипс ещё в 1894 г. Образующийся в безводной среде комплекс этилена с хлористым палладием был описан Карашем в 1938 г. При взаимодействии палладиевого комплекса с водой происходит окисление активированного олефина с образованием ацетальдегида, выделением палладия и хлорида водорода. [6, с.302]
Непрерывный процесс получения ацетальдегида, в котором восстановление до металлического Pd совмещается с непрерывным его окислением кислородом воздуха, был предложен в 1959 г. Я. К. Сыркиным, И.И. Моисеевыми, М.Н. Варгафтиком. Этот процесс может протекать в одну стадию (в одном аппарате происходит как окисление этилена, так и выделяющегося палладия) или в две стадии: окисление (карбонилирование) олефина через стадию образования активного комплекса и восстановление Pd протекает в одном аппарате, а окисление металлического Pd - в другом:
CH2=CH2 +PdCl2 + H2O CH3CHO + Pd + 2HCl CH3CHO + Pd + 2HCl
Pd + 2HCl + 0,5O2  PdCl2 + H2O PdCl2 + H2O
В первом (одностадийном) варианте условия процесса и соотношение реагентов должны быть такими, чтобы скорости окисления этилена и Pd были одинаковыми (или последняя выше). Вместе с тем скорость второй реакции значительно ниже, чем первой, поэтому активность катализатора в таком варианте процесса быстро падает.
Для повышения скорости окисления Pd были предложены промоторы (это главное достижение в промышленной реализации данного процесса) – соли меди или железа в среде хлороводородной кислоты, играющие роль переносчиков кислорода, окисляя палладий, медь или железо, восстанавливаются по реакциям:
Pd + 2HCl + 0,5O2 PdCl2 + H2O PdCl2 + H2O
Cu2Cl2 + 2HCl + 0,5O2 2CuCl2 + H2O 2CuCl2 + H2O
или Pd + 2FeCl3  PdCl2 + 2FeCl2 PdCl2 + 2FeCl2
2FeCl2 + 2HCl + 0,5O2  2FeCl3 + H2O 2FeCl3 + H2O
Соли Cu2Cl2 и FeCl2 легко окисляются кислородом воздуха, при этом металл переходит в свое исходное высшее валентное состояние. Следовательно, совмещение этих реакций создает предпосылки для осуществления в промышленном масштабе получения ацетальдегида прямым окислением этилена молекулярным кислородом.[3, с. 455]
При этом, если процесс осуществляется в одном аппарате, то во избежание разбавления непрореагировавшего этилена окисление необходимо проводить чистым кислородом. Избыток же этилена вводится как с целью быстрого вывода ацетальдегида из зоны реакции, так и для создания соотношения компонентов за пределами взрывоопасных концентраций. В случае двухстадийного процесса (когда реакции получения ацетальдегида и окисления Pd проходят в одном аппарате, а окисление Сu2С12 или FeCl2 – в другом) можно использовать кислород воздуха, так как подача этилена и воздуха разделена.
Суммарная реакция образования ацетальдегида сопровождается выделением значительного количества тепла:
СН2
= СН2
+ 0,5О2
 СН3
СНО, ΔН = –221,5 кДж/моль СН3
СНО, ΔН = –221,5 кДж/моль
Скорость отдельных реакций и, соответственно, скорость образования побочных продуктов зависит от условий проведения процесса. На скорость суммарной реакции, селективность процесса и выход ацетальдегида существенно влияет состав катализаторного раствора (содержание PdCl2
, CuCl2
и FeCl2
), кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
Соотношение между общим суммарным содержанием металлов окислительно-восстановительной системы (Сu, Fe или смеси) и Pd должно быть не меньше 15:1. На практике используется соотношение (25 :1)-(50:1). Такой избыток меди или железа обусловливается высокой стоимостью Pd.
Конверсия олефина зависит также от мольного соотношения в катализаторе меди (железа) и галогена; оно поддерживается в узком диапазоне (1:1,4-1:1,8). Поэтому добавляемый в ходе процесса галоген в виде хлорида или этилхлорида должен дозироваться достаточно точно, так как при соотношении меньшем, чем 1:1, снижается конверсия этилена, а при соотношении 1;2 и выше реакция замедляется. В этом случае добавляют ацетат меди [3, с. 457].
Процесс следует проводить в кислой (рН=0,8-3,0) или нейтральной среде (рН= 6,0-7,5), так как при повышении рН из катализаторного раствора будет выпадать хлорид меди (I), что приводит к снижению выхода ацетальдегида и забивки отверстий газораспределительного устройства. Растворимость хлорида Сu(I) можно повысить добавлением в катализаторный раствор муравьиной, уксусной, а лучше - трихлоруксусной кислоты. Однако их следует добавлять в незначительном количестве (особенно уксусную кислоту), так как карбоновые кислоты образуют с Сu малоактивные соли. Кроме того, уксусная кислота растворяет продукты синтеза, что приводит к образованию побочных хлорированных продуктов.
Растворимость солей в воде ограничена, поэтому образуются разбавленные растворы катализатора, что приводит к его низкой удельной производительности. В связи с этим выгоднее работать с катализатором, находящимся в виде суспензии в воде или в разбавленной уксусной кислоте (шламовый катализатор). Применение шламового катализатора позволяет сочетать высокую концентрацию катализатора с хорошим отводом тепла; образовывать стабильную пену, что в свою очередь приводит к хорошему диспергированию газа.
В качестве сырья можно использовать как концентрированный этилен, так и этан-этиленовую фракцию. Наличие малых количеств водорода, оксида и диоксида углерода, предельных углеводородов не мешает протеканию процесса. Содержание непредельных углеводородов и серы должно быть незначительным (ацетилена <0,005 %, высших олефинов <0,03 %, серы <0,001 %) во избежание образования побочных продуктов.
Превращение этилена в ацетальдегид при 20 °С протекает с низкой скоростью. Реакция проходит сравнительно интенсивно при 100-130°С.
Для поддержания реакционной массы в жидком состоянии при такой температуре требуется повышенное давление (0,3-1,1 МПа), которое способствует и ускорению процесса за счет улучшения растворимости газов. Для повышения растворимости олефина и кислорода в водных растворах рекомендуется применять реакционные устройства, в которых осуществляется турбулизация жидкости и обеспечивается максимальная поверхность контакта фаз.[3, с. 458]
Для полного окисления олефинов в соответствующие альдегиды или кетоны мольное соотношение олефины:кислород должно составлять 2 :1. С целью безопасности работают обычно с недостатком кислорода (соотношение олефин:кислород от 2,5:1 до 4:1).
Во избежание побочных реакций (конденсации и хлорирования) предусматривается непрерывный отвод ацетальдегида из зоны реакции по мере его образования.
Выход ацетальдегида в зависимости от условий проведения реакций и состава катализатора колеблется в пределах 84-98%. При этом в качестве побочных продуктов образуются уксусная и муравьиная кислоты, хлорсодержащие вещества (метилхлорид, этилхлорид, хлорацетальдегид), кротоновый альдегид, диоксид углерода и др.
Процесс прямого окисления этилена в ацетальдегид может осуществляться как с использованием жидкого катализаторного раствора (гомогенно-каталитический процесс), так и на твердом катализаторе (гетерогенно-каталитический процесс). При гомогенном процессе хорошие результаты получаются при использовании водного раствора, содержащего 0,3-0,5% PdCl2, 12-33% СuС12•Н2О, 2-3% Сu(СН3СОО)2•Н2О. В небольших количествах иногда добавляется уксусная кислота.
Гетерогенный процесс может проводиться на катализаторе, представляющем смесь хлоридов Pd и Сu на носителе (оксид алюминия, силикагель, пемза, активированный уголь), например может использоваться катализатор следующего состава: 2% PdCl2 и 10% СuС12, нанесенные на активированный уголь. Гетерогенно-каталитический процесс может осуществляться как на катализаторе с неподвижным слоем (в трубчатом аппарате и в колонном аппарате с катализатором на полках), так и на катализаторе в псевдоожиженном состоянии. Гетерогенно-каталитический процесс сопряжен с трудностями, связанными с отводом теплоты реакции, но они могут быть устранены. В частности, одним из вариантов может быть отвод тепла за счет испарения впрыскиваемого между слоями катализатора водного конденсата. Однако это дает дополнительное количество загрязненной воды, требующей очистки. Поэтому лучше отводить тепло в обычном трубчатом аппарате, выполняющем одновременно роль котла-утилизатора.[3, с. 459]
Таким образом, в одностадийном способе процесс проводится при температуре 90-100°С и давлении 1 МПа, а в двухстадийном - окисление этилена проводится при температуре 100-120°С и давлении 0,8-1,3 МПа. Конверсия этилена в одностадийном способе за один проход составляет 30-50% (остальное возвращается в реактор в виде рецикла), выход ацетальдегида на пропущенный этилен в двухстадийном способе составляет 95 % (дополнительно образуется 1,0-1,5% уксусной кислоты и 1,0-1,3% хлорпроизводных).
Основное различие двух вариантов процесса состоит в том, что конверсия этилена за один проход при двухстадийном способе составляет около 100 % и, следовательно, не требуется его рециркуляция. В двухстадийном варианте может использоваться менее чистый этилен, чем в одностадийном. В первом случае требования по технике безопасности менее жесткие, однако двухстадийный способ требует больших капитальных затрат.[3, с. 460]
1.2.7 Новое в области синтеза ацетальдегида
Изложенные выше методы давно уже применяются на практике. Тем не менее, наука и технология не стоят на месте, постоянно происходит совершенствование старых методов и открытие новых. В данном разделе будет рассмотрено то, что появилось за последние годы в области синтеза уксусного альдегида.
Разработано и предложено достаточно большое количество альтернативных методов синтеза ацетальдегида. Так описан метод получения ацетальдегида взаимодействием водорода и кетена в присутствии катализатора, содержащего металл, выбранный из IX и X группы периодической системы.
CH2=C=O + H2  CH3CHO CH3CHO
Процесс проводится при температуре 50-200°С. Рассмотрены способы выделения ацетальдегида из реакционной смеси [7].
Исследована возможность получения ацетальдегида окислением н-бутанола кислородсодержащим газом в присутствии гетерогенного катализатора, в качестве которого используется гранулированный ортофосфат железа с размерами гранул 1-2 мм:
СН3 – СН2 – СН2 – СН2 – ОН + О2 2СН3СНО + Н2О 2СН3СНО + Н2О
Процесс проводится при температуре 380-420°С, время контакта 0,8-1 с. Так при температуре 400°С и времени контакта 0,87 с, пропуская смесь 20% н-бутана, 20% кислорода и 60% кислорода селективность процесса достигала 63%.[8]
Рассмотрен процесс превращения этиленгликоля в ацетальдегид. Предложены возможные варианты механизма этого процесса [9].
СН2 – ОН  СН3СНО + Н2О СН3СНО + Н2О
СН2 – ОН
Предложен метод получения ацетальдегида селективным гидрированием уксусной кислоты на катализаторе α-Fe2O3, нанесённом на основу SBN-15.
СН3СООН + Н2  СН3СНО + Н2О СН3СНО + Н2О
Получена серия катализаторов, содержащих 20-60% α-Fe2O3. Рассмотрен механизм процесса, изучены активность и селективность образцов катализатора [10].
В области совершенствования уже используемых методов синтеза ацетальдегида следует упомянуть следующее.
При окислении этанола в ацетальдегид в качестве катализатора были предложены СаО и γ-Al2O3. Было рассмотрено влияние концентрации кислорода на выход ацетальдегида[11]. Для этого метода были также предложены катализаторы на основе родия [12].
На основе анализа факторов, влияющих на каталитическое окисление этилена кислородом в растворе PdCl2 и CuCl2, была разработана математическая модель технологического процесса производства ацетальдегида. Это позволило оптимизировать рабочие параметры и увеличить на 127% степень загрузки завода по производству ацетальдегида по сравнению с проектной мощностью[13].
Одним из перспективных методов синтеза ацетальдегида рассматривается гидролиз винилбутилового эфира. Предложен способ с непрерывным совмещённым реакционно-ректификационным процессом получения ацетальдегида гидролизом винилбутилового эфира. То есть в ректификационной колонне одновременно происходит синтез и отделение ацетальдегида. При температуре 72-85°С, соотношении эфир : вода 1:3 (моль) выход ацетальдегида составил 99% [14].
Выводы.
Из рассмотренных методов получения ацетальдегида наиболее удобен метод окисления этилена в водном растворе хлорида палладия. Процесс проходит с высоким выходом ацетальдегида (до 98%). Этилен является относительно дешёвым и доступным сырьём. В процессе производства не используются ядовитые вещества, такие как ртуть при гидратации ацетилена. Аппаратное оформление процесса достаточно простое и требует относительно небольших капитальных затрат. Себестоимость ацетальдегида, произведённого из этилена почти вдвое ниже себестоимости продукта, получаемого гидратацией ацетилена. Поэтому в качестве метода получения и выбран именно этот метод.
1.3 Анализ основной реакции
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2
= СН2
+ 0,5О2
 СН3
СНО СН3
СНО
1.3.1Физические свойства реагентов и продуктов реакции
В следующей таблице приведены основные физические свойства реагентов и продуктов реакции[
15]:
| Вещество |
Фазовое состояние |
Плотность, кг/м3
|
Ткип /Тпл, °С |
Примечание |
| Ацетальдегид |
жидкость |
773 |
20,8 / -123,5 |
Токсичен, ПДК составляет 5 мг/м3
. Неограниченно растворим в воде. |
| Этилен |
газ |
1,26 |
-103,7/-169,15 |
| Кислород |
газ |
1,43 |
-182,98/-218,7 |
1.3.2 Электронная структура реагентов и продуктов реакции
1.3.2.1.Электронная структура этилена
Главным структурным элементом, определяющим реакционную способность этилена, как и всех олефинов, является двойная связь, представляющая собой сочетание σ- и π-связей ( sp2
-гибридизация).
При образовании двойных связей в молекулах ненасыщенных соединений встречают с гибридизацию одной s- и двух р-орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемую sp2
-орбиталями. Каждая из них имеет цилиндрическую симметрию относительно одной из трех осей, расположенных в плоскости под углом 120°, В реальной молекуле этилена угол Н-С-Н равен 116,7°[16, с.30].

Рис. 1 Схема образования sp2
-гибридного состояния электронной оболочки атома углерода
Ось четвертой атомной р-орбитали, не затронутой гибридизацией, расположена под прямым углом к плоскости, в которой лежат три оси sp2
-гибридных орбиталей.
Перекрывание трех гибридизованных орбиталей с орбиталями других атомов дает σ-связи. Перекрывание двух негибридизованных p-орбиталей между собой дает так называемую π-связь.
π-Связь менее прочна, чем σ-связь, так как p-электронные орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p-электронами или s-электронами σ -связи (перекрывание по оси орбиталей). Общая прочность (σ + π)-связей в этилене составляет 607,1 кДж/моль, в то время как для σ -связи между двумя углеродными атомами в этане она составляет 350,0 кДж/моль. Разница 257,1 кДж/моль является приблизительной мерой прочности π -связи.
Таким образом, двойная связь представляет собой сочетание σ- и π-связей. Последняя обладает максимальной прочностью, когда молекула имеет пленарную (плоскостную) конфигурацию. Для поворота в молекуле этилена одной группы СН2 относительно другой группы СН2 вокруг оси С - С необходимо приложить энергию, достаточную, чтобы разорвать π-связь и вернуть два электрона на отдельные p-орбитали. Энергия молекулярных столкновений при обычной температуре для этого недостаточна и потому вокруг двойной связи нет свободного вращения[16, с. 31].

Рис.2 Схематическое изображение строения молекулы этилена
Длина олефиновой связи (σ + π-связь) между двумя ненасыщенными углеродами в алкенах меньше, чем длина простой σ-связи в насыщенных углеводородах (0,154 нм), и составляет 0,134 нм. Это понятно: чем больше концентрируется электронное облако между ядрами, тем более сильно они стягиваются.
При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее ординарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерна реакция электрофильного присоединения. [16, с.79]
1.3.2.2Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с < 2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С-О-связей (2• 358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы - около 9•10-30
Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. [16, с. 166]

Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3Электронная структура кислорода
Кислород О имеет электронную конфигурацию невозбужденного атома

Is-2s2
2p4
:
В молекуле О2
на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2
можно передать следующими структурными формулами:

Тремя точками обозначены связи, обусловленные двумя πсв
- и одним πразр
-электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают πразр
-электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).[17, с. 337]
1.3.2.4Электронная структура катализатора PdCl2
В процессе окисления этилена в ацетальдегид как правило применяется катализатор PdCl2, в качестве промотера применяется CuCl2, либо FeCl3.
Структурной единицей соединений Pd (II) является квадрат. Кристаллы PdCl2 (рис. 4) имеют цепное строение с квадратной структурной единицей PdCl4 [17, с. 649]:


Рис. 4. Структура PdCl2
1.3.3 Химические свойства реагентов и продуктов реакции
1.3.3.1 Химические свойства этилена
1. Гидрирование.
Алкены непосредственно молекулярный водород не присоединяют. Эту реакцию можно осуществить только в присутствии гетерогенных (Pd, Pt, Ni) или гомогенных (например, хлортристрифенилфосфин родия RhCl(Ph3P)3) катализаторов. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
СН2=СН2 + Н2  СН3 – СН3; ΔН = – 137.3 кДж/моль. СН3 – СН3; ΔН = – 137.3 кДж/моль.
2. Галогенирование.
Олефины легко присоединяют галогены:
СН2=СН2 + Вг2  СН2Вг – СН2Вг. СН2Вг – СН2Вг.
Скорость реакции зависит от природы галогена и строения олефина. Фтор реагирует с воспламенением, иод - медленно на солнечном свету.[16, с.79]
Присоединение происходит по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделяется отрицательный ион галогена. К возникающему карбениевому или бромониевому катиону (присоединяется отрицательный ион галогена.
3. Гидрогалогенирование.
Олефины присоединяют все галогеноводороды:
CH2 = СН2 + НС1  СН2Сl-СН3. СН2Сl-СН3.
Наиболее легко реагирует йодистый водород. Фтористый водород часто (особенно в присутствии влаги) присоединяется с одновременной полимеризацией олефина. С хорошими выходами алкилфториды получаются при действии на алкены растворов HF в третичных аминах (триэтиламин, пиридин) и тетрагидрофуране при О°С. Присоединение хлористого водорода требует обычно нагревания или присутствия катализаторов.
Механизм электрофильного присоединения галогеноводородов двухступенчатый, как и механизм присоединения галогенов, однако π-комплексы в этом случае, вероятно, не образуются: реакции идут через карбениевые ионы и, следовательно, должны быть нестереоспецифичными. Наблюдаемая в ряде случаев стереоспецифичность объясняется тем, что в реакции участвуют не свободные карбениевые ионы, а ионные пары карбениевый ион - анион.[16, с. 81]
4. Гипогалогенирование.
Присоединение к олефинам гипогалогенитных кислот и их эфиров осуществляется согласно следующей реакции:
CH2 = СН2 + НОС1  СН2Сl-СН2ОН. СН2Сl-СН2ОН.
5. Гидратация
. В присутствии катализаторов олефины присоединяют воду, образуя спирты [16, с. 83]:
СН2=СН2 + НОН CH3-CH2OH CH3-CH2OH
6. Окисление
. Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
а) Кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических оксидов:
2СН2=СН2 + О2  CH2–CH2 CH2–CH2
О
б) Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (CrO3, OsO4 и др.) с олефинами образуют гликоли. По месту двойной связи присоединяются два гидроксила:
3СН2=СН2 + 2KMnO4 + H2O 3CH2OH–CH2OH +2MnO2 +2KOH 3CH2OH–CH2OH +2MnO2 +2KOH
СН2=СН2 + H2O2 CH2OH–CH2OH CH2OH–CH2OH
в) При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула этилена разрывается по месту двойной связи, образуя муравьиную кислоту:
CH2 = СН2  2СНООН. 2СНООН.
д) Прои реакции озонолиза, озон присоединяется по месту двойной связи, образуя нестойкое соединение, озонид, при обработке водой из него образуется пероксид водорода и муравьиный альдегид:
CH2 = СН2 + О3 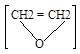  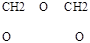  2CH2O +H2O2 2CH2O +H2O2
7. Полимеризация.
Одним из наиболее важных для современной техники превращений олефинов является реакция полимеризации. Полимеризация олефинов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов [16, с. 87].
n CH2=CH2 [-CH2-CH2 -]n [-CH2-CH2 -]n
1.3.3.2 Химические свойства ацетальдегида
1. Гидрирование.
Присоединение водорода к происходит в присутствии катализаторов гидрирования (Ni, Со, Си, Pt, Pd и др.). При этом он переходит в этиловый спирт:
CH3CHO + H2 C2H5OH C2H5OH
При восстановлении альдегидов или кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамированного магния) образуются наряду с соответствующими спиртами в незначительных количествах образуются также гликоли:
2 CH3CHO + 2Н CH3 – CH – CH – CH3 CH3 – CH – CH – CH3
ОН ОН
2. Реакции нуклеофильного присоединения
2.1 Присоединение магнийгалогеналкилов [16, с.168]
СН3 – СН2 – MgBr + CH3CHO BrMg – O – CH – C2H5 BrMg – O – CH – C2H5
CH3
2.2 Присоединение синильной кислоты приводит к образованию нитрила α-гидроксипропионовой кислоты:
OH
CH3CHO + HCN  CH3 – CH – CN CH3 – CH – CN
2.3 Присоединение гидросульфита натрия дает кристаллические вещество – производное ацетальдегида:
OH
CH3CHO + HSO3Na CH3 – C – SO3Na CH3 – C – SO3Na
H
2.4 Взаимодействие с аммиаком приводит к образованию ацетальдимина [16, 169] :
CH3CHO + NH3 CH3–CH=NH CH3–CH=NH
2.5 С гидроксиламином ацетальдегид, выделяя воду, образует ацетальдоксимоксим:
CH3CHO + H2NOH  H2O + CH3–CH =NOH H2O + CH3–CH =NOH
2.6 Особый интерес представляют реакции ацетальдегида с гидразином и его замещенными [16, с. 171]:
CH3CHO + H2N – NH2 + OCHCH3  CH3–CH=N–N=CH–CH3 + 2H2O CH3–CH=N–N=CH–CH3 + 2H2O
Альдазин
2.7 Ацетальдегид способен присоединять по карбонильной группе воду с образованием гидрата - геминального гликоля. При 20˚С ацетальдегид в водном растворе на 58% существует в виде гидрата
–C– + HOH  HO–C–OH HO–C–OH
O
2.8При действии на ацетальдегид спиртов образуются полуацетали:
OH
CH3CHO + HOR  CH3–CH CH3–CH
OR
В присутствии следов минеральной кислоты образуются ацетали[16, с. 172]
OH OR
CH3 – CH + ROH  CH3 – CH + H2O CH3 – CH + H2O
OROR
2.9 Ацетальдегид при взаимодействии с РС15 обменивает атом кислорода на два атома хлора, что используется для получения геминального дихлорэтана:
CH3CHO + РС15 CH3CHСl2 + POCl3 CH3CHСl2 + POCl3
3. Реакции окисления
Ацетальдегид окисляются кислородом воздуха до уксусной кислоты. Промежуточным продуктом являются надуксусная кислота:
CH3CHO + O2 CH3CO-OOH CH3CO-OOH
CH3CO-OOH + CH3CHO CH3-C-O-O-CH-CH3 CH3-C-O-O-CH-CH3
OOH
2CH3COOH
Аммиачный раствор гидроксида серебра при легком нагревании с альдегидами окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности - образуется серебряное зеркало [16, 173]:
CH3 CHO + 2[Ag(NH3)2]OH CH3COONH4 + 3NH3 + H2O + 2Ag CH3COONH4 + 3NH3 + H2O + 2Ag
4. Реакции полимеризации
При действии на ацетальдегид кислот происходит его тримеризация, образуется паральдегид:
CH – CH3
O O
3CH3CHO СH3 – CH CH – CH3 СH3 – CH CH – CH3
O
5. Галогенирование
Ацетальдегид реагирует с бромом и иодом с одинаковой скоростью независимо от концентрации галогена. Реакции ускоряются как кислотами, так и основаниями.
CH3CHO + Br2 CH2BrCHO + HBr CH2BrCHO + HBr
6. Декарбоксилирование
При нагревании с трис(трифенилфосфин)родийхлоридом претерпевают декарбонилирование с образованием метана:
CH3CHO + [(C6H5)P]3RhCl CH4 + [(C6H5)3P]3RhCOCl CH4 + [(C6H5)3P]3RhCOCl
7. Конденсация
7.1
Альдольная конденсация
В слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) ацетальдегид подвергаются альдольной конденсации по А. П. Бородину с образованием альдегидоспирта (3-гидроксибутаналя), сокращенно называемого альдолем. Альдоль образуется в результате присоединения альдегида к карбонильной группе другой молекулы альдегида с разрывом связи С — Н в α-положеиии к карбонилу:
CH3CHO + CH3CHO  CH3–CHOH–CH2–CHO CH3–CHOH–CH2–CHO
Альдоль при нагревании (без водоотнимающих веществ) отщепляет воду с образованием непредельного кротонового альдегида (2-бутеналя) [16, с. 176]:
CH3–CHOH–CH2–CHO CH3–CН=CH–CHO + Н2О CH3–CН=CH–CHO + Н2О
Поэтому переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией. Дегидратация происходит благодаря очень большой подвижности водородных атомов в α-положении по отношению к карбонильной группе (сверхсопряжение), причем разрывается, как и во многих других случаях, р-связь по отношению к карбонильной группе.
7.2 Сложноэфирная конденсация
Проходит с образованием уксусноэтилового эфира при действии на ацетальдегид алкоголятов алюминия в неводной среде (по В. Е. Тищенко):
O
2CH3CHO CH3–CH2–O–C–CH3 CH3–CH2–O–C–CH3
7.3 Конденсация Клайзена— Шмидта.
Эта ценная синтетическая реакция состоит в катализируемой основаниями конденсации ароматического или иного альдегида, не имеющего водородных атомов, с алифатическим альдегидом или кетоном. Например, коричный альдегид может быть получен встряхиванием смеси бензальдегида и ацетальдегида примерно с 10 частями разбавленной щелочи и выдерживанием смеси в течение 8—10 суток. В этих условиях обратимые реакции приводят к двум альдолям, но один из них, в котором 3-гидроксил активирован фенильной группой, необратимо теряет воду, превращаясь в коричный альдегид[18, с. 554]:
C6H5—CHO + CH3CHO C6H5–CHOH–CH2–CHO C6H5–CHOH–CH2–CHO   C6H5–CH=CH–CHO C6H5–CH=CH–CHO
1.3.3.3 Химические свойства кислорода
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды. Лишь по отношению к фтору кислород проявляет восстановительные свойства.
Подобно фтору кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). С галогенами, криптоном, ксеноном, золотом и платиновыми металлами он непосредственно не реагирует, и их соединения получают косвенным путем. Со всеми остальными элементами кислород соединяется непосредственно. Эти процессы обычно сопровождаются выделением теплоты.
Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений принимается равной -2. Кроме того, кислороду приписывают степени окисления +2 и + 4, а также +1(F2O2) и -1(Н2О2) [17, с. 337].
Наиболее активно окисляются щелочные и щелочноземельные металлы, причем в зависимости от условий образуются оксиды и пероксиды:
О2 + 2Са = 2СаО
О2 + Ва = ВаО2
Некоторые металлы в обычных условиях окисляются лишь с поверхности (например, хром или алюминий). Образующаяся пленка оксида препятствует дальнейшему взаимодействию. Повышение температуры и уменьшение размеров частиц металла всегда ускоряют окисление. Так, железо в нормальных условиях окисляется медленно. При температуре же красного каления (400 °С ) железная проволока горит в кислороде:
3Fe + 2О2 = Fe3 O4
Тонкодисперсный железный порошок (пирофорное железо) самовоспламеняется на воздухе уже при обычной температуре.
С водородом кислород образует воду:
Н2 + O2 = Н2O
При нагревании сера, углерод и фосфор горят в кислороде. Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:
N2 + O2 = 2NO
Водородные соединения горят в кислороде, например:
2H2S + ЗО2 = 2SO2 + 2Н2О (при избытке О2)
2Н2S + О2 = 2S + 2Н2О (при недостатке О2)
СН4 + 2О2 = СО2 + 2Н2О
2. Термодинамический анализ основной реакции
2.1 Исходные данные для термодинамических расчётов
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2
= СН2
+ 0,5О2
 СН3
СНО СН3
СНО
Справочные данные термодинамических величин исходных веществ и продукта реакции имеют следующие значения[19]:
| Вещество |
ΔН°f, 298, кДж/моль |
S°298, Дж/моль•К |
с°р= f(T) |
| a |
b•103
|
c'•10-5
|
c•106
|
| СН3СНО |
-166 |
264,20 |
13,00 |
153,50 |
— |
-53,70 |
| С2Н4 |
52,30 |
219,45 |
11,32 |
122,01 |
— |
-37,90 |
| О2 |
0 |
205,04 |
31,46 |
3,39 |
-3,77 |
— |
2.2 Расчёт термодинамических функций
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc'T-2
+ ΔcT2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10-3
Δc'= Σ(υc')j – Σ(υc')i = 1,88•105
Δc= Σ(υc)j – Σ(υc)i = –15,8•10-6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298<0, следовательно реакция экзотермична
ΔS°298 = Σ(υ S°298)j – Σ(S°298)i = –57,77 Дж/моль•К
Согласно уравнению Гиббса-Гельмгольца
ΔG°298 = ΔН°298 – T• ΔS°298 = –201,08 кДж/моль
ΔG°298 <0, следовательно при стандартных условиях реакция может протекать в прямом направлении.
Определим зависимость ΔН°T= f(T), подставив Δср= f(T) в уравнение Кирхгофа:
ΔН°T= ΔН°298 + Δc°pdt = ΔН°298 + Δa(T – 298) + Δb(T2
– 2982
)/2 – Δc'(T-1
– 298-1
)+ Δc(T3
– 2983
)
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
| Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
| –ΔН° Т , кДж/моль |
218,37 |
218,43 |
218,49 |
218,55 |
218,57 |
218,63 |
218,68 |
218,74 |
218,82 |
218,86 |
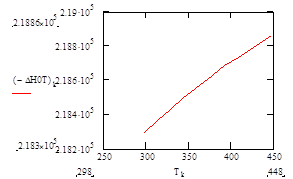
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc'/2(T-
2
– 298-
2
)+ + Δc/2(T2
– 2982
)
| Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
| –ΔS° Т , Дж/моль |
57,98 |
58,19 |
58,37 |
58,54 |
58,60 |
58,75 |
58,89 |
59,03 |
59,22 |
59,32 |
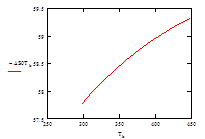
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
| Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
| –ΔG° Т , кДж/моль |
200,22 |
199,35 |
198,47 |
197,59 |
197,30 |
196,42 |
195,54 |
194,65 |
193,18 |
192,29 |
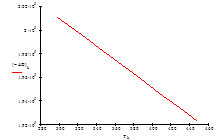
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
вычислим значения констант равновесия:
lnkp = – ΔG/(RT)
| Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
| lnkp |
76,9388 |
73,1007 |
69,5973 |
66,3866 |
65,7352 |
62,5208 |
59,8453 |
57,3843 |
53,6606 |
51,6252 |
| kp |
2,59•1033
|
5,59•1031
|
1,68•1030
|
6,78•1028
|
2,47•1028
|
1,39•1027
|
9,78•1025
|
8,35•1024
|
2,02•1023
|
2,63•1022
|
Сведём полученные данные в таблицу термодинамических функций реакции:
| Т, КТ, К |
298 |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
| –ΔН° Т кДж/моль |
218,3 |
218,37 |
218,43 |
218,49 |
218,55 |
218,57 |
218,63 |
218,68 |
218,74 |
218,82 |
218,86 |
| –ΔS° Т Дж/моль |
57,77 |
57,98 |
58,19 |
58,37 |
58,54 |
58,60 |
58,75 |
58,89 |
59,03 |
59,22 |
59,32 |
| –ΔG° Т кДж/моль |
201,08 |
200,22 |
199,35 |
198,47 |
197,59 |
197,30 |
196,42 |
195,54 |
194,65 |
193,18 |
192,29 |
| kp |
1,77•1035
|
2,59•1033
|
5,59•1031
|
1,68•1030
|
6,78•1028
|
2,47•1028
|
1,39•1027
|
9,78•1025
|
8,35•1024
|
2,02•1023
|
2,63•1022
|
Выводы
1. Выполненные расчёты термодинамических функций показывают, что реакция окисления этилена в ацетальдегид идёт с выделением теплоты. Причём с увеличением температуры реакционной массы абсолютное значение ΔН°Т немного увеличивается. Согласно принципу Ле-Шателье для увеличения выхода продукта реакции, идущей с выделением теплоты, необходимо осуществлять отвод тепла от реакционной смеси.
2. Изменение энтропии для данной реакции во взятом интервале температур отрицательно. То есть в изолированной системе самопроизвольное протекание данной реакции в прямом направлении невозможно. Значение ΔS° Т с повышением температуры возрастает, следовательно возрастают и термодинамические трудности протекания процесса. Однако на практике имеют дело с неизолированными системами и этот параметр в нашем случае не может служить критерием направленности химической реакции.
3. О направленности химической реакции в изобарно-изотермических условиях судят по значению изменения свободной энергии Гиббса ΔG° Т. Расчёт показывает, что ΔG° Т во всём изученном интервале температур отрицательно, следовательно в пределах этих температур возможно самопроизвольное протекание реакции в прямом направлении. При увеличении температуры абсолютное значение изменения свободной энергии Гиббса уменьшается, значит с увеличением температуры возникают трудности для протекания процесса в прямом направлении. Следовательно при проведении процесса необходимо отводить тепло, выделяющееся в ходе реакции.
4. Константы равновесия для всего интервала температур значительно больше единицы, поэтому в реакционной смеси при достижении состояния равновесия продукты реакции будут существенно преобладать над исходными веществами. С увеличением температуры соотношение между продуктами реакции и исходными веществами в равновесном состоянии будет уменьшаться (уменьшается значение kp), следовательно и выход продукта уменьшится. Для увеличения выхода необходимо постоянно охлаждать реакционную смесь, отводя выделяющуюся теплоту.
Таким образом для получении максимально возможного выхода ацетальдегида при проведении окисления этилена кислородом следует выбрать реактор, оснащённый теплообменной рубашкой.
3. Механизм реакции получения ацетальдегида
Процесс синтеза ацетальдегида из этилена в присутствии палладиевого катализатора относится к гомогенно-каталитическим.
Гомогенные каталитические процессы, типа:

обычно начинаются с образования промежуточного комплекса Akt в результате обратимого воздействия между катализатором (kt) и одним из исходных реагентов (А):

Во второй стадии, образовавшийся промежуточный комплекс взаимодействует со вторым реагентом, образуя активированный комплекс [АВ]** kt:

В третьей стадии в результате распада [АВ]**kt образуются продукты реакции[20, с. 70]:

3.1 Механизм реакции
Каталитическое окисление этилена до ацетальдегида в гомогенном водном растворе на палладиево-медном катализаторе при 20—60°С известно как вакер-процесс, по названию компании, в которой в конце пятидесятых годов этот процесс был разработан Шмидтом. Этот процесс является одним из ранних примеров промышленного использования гомогенного катализа. В последующие годы значительное внимание исследователей было уделено реакционному механизму и возможностям влияния на состав образующихся продуктов
Стехиометрическая реакция, в которой Pd(II) восстанавливается до металла, была описана еще в 1894 г. Открытие Шмидта заключалось в том, что он сумел окислить Pd(0) действием CuCl2:
Pd° + 2CuCl2  PdCl2 + CuCl PdCl2 + CuCl
Этот факт в сочетании с простым окислением соли меди кислородом или воздухом:
2CuCl + 2HCl + 1/2O2 2CuCl2 + H2O; 2CuCl2 + H2O;
позволил использовать данную реакцию в промышленно важном производстве.
Общая реакция окисления этилена воздухом приведена в суммарном уравнении:
C2H4 + 1/2O2 CH3CHO CH3CHO
Окисление Pd° ионом Cu2+
облегчается присутствием избытка ионов Сl, так как окислительный потенциал Pd° Pd2+
существенно понижается при образовании хлоро-комплекса [PdCl4]2-
, и делается возможным растворение металлического палладия. Pd2+
существенно понижается при образовании хлоро-комплекса [PdCl4]2-
, и делается возможным растворение металлического палладия.
Общая экспериментальная скорость определяется уравнением [21, с. 246]:
rOx= – d[C2H4]/dt=k[PdCl2-
][C2H4]/[H+
][Cl-
] 2
На начальной стадии происходит очень сильное поглощение этилена, затем этилен поглощается медленнее. Объем поглощаемого вначале этилена превышает количество, необходимое для насыщения реакционного раствора этиленом (установлено в отсутствие палладиевой соли). Это четко свидетельствует об образовании этилен-палладиевого комплекса. Избыточный объем поглощаемого этилена уменьшается по мере увеличения в растворе концентрации ионов С1-
но на него не влияет изменение концентрации кислоты. Довольно правдоподобное объяснение этого заключается в том, что начальную реакцию можно представить равновесной реакцией обмена лигандов:
[PdCl4]2-
+ C2H4 [PdCl3(C2H4)] -
+ Cl- [PdCl3(C2H4)] -
+ Cl-
Очевидно, избыток С1-
сдвигает равновесие влево. Последующее более медленное поглощение этилена определяется уравнением скорости, приведённым выше.
Если предположить, что плоскоквадратный комплекс [PdCl3(C2H4)]-
является основным промежуточным соединением в общем процессе, то становится понятным дополни то становится понятным дополнительное ингибирование С1-
ионами и Н+
-ионами и результате следующих двух равновесий:
[PdCl3(C2H4)] -
+ H2O [PdCl2(H2O)(C2H4)] + Cl- [PdCl2(H2O)(C2H4)] + Cl-
[PdCl2(H2O)(C2H4)]  [PdCl2(OH)(C2H4)]-
+ H+ [PdCl2(OH)(C2H4)]-
+ H+
Следующей, определяющей скорость реакции стадией, будет внедрение координационно связанного алкена в связь Pd—ОН с образованием палладийорганического промежуточного соединения:
[PdCl2(OH)(C2H4)]-
 [PdCl2(CH2CH2OH)] - [PdCl2(CH2CH2OH)] -
Затем быстрое разложение последнего продукта дает альдегид и металлический палладий:
[PdCl2(CH2CH2OH)] -
 CH3CHO + Pd° + HCl + Cl- CH3CHO + Pd° + HCl + Cl-
Детали именно этой реакции до сих пор являются предметом разнообразных спекуляций. Существует доказательство, что имеет место перенос водорода от β-атома углерода к α-атому углерода у палладия; предполагается также, что происходит взаимодействие металл—водород[21, с. 247]:
[PdCl2(CH2CH2OH)] -
 H2C=CHOH H2C=CHOH [PdCl2(CH(CH3)OH)] – [PdCl2(CH(CH3)OH)] –
Cl2PdH
 CH3CHO + Pd° + HCl + Cl- CH3CHO + Pd° + HCl + Cl-
3.2 Анализ факторов, влияющих на протекание реакции окисления этилена
3.2.1 Влияние строения субстрата
Вакер-процесс применим для большинства алкенов; в общем случае α-алкены дают метилкетоны и некоторое количество альдегидов:
RCH=CH2 RCOCH3 RCOCH3
Замещенные алкены с электроноакцепторными группами (Y = =CN, NO2) непосредственно при двойной связи присоединяют кислород к углероду, удаленному от этой группы:
YCH=CH2  YCH2CHO YCH2CHO
Как было сказано наиболее важной стадией вакер-процесса является внедрение алкена в полярную связь Pd
+
—ОH
-
. Направление присоединения кислорода предсказывается правилом Марковникова.
Алкены с карбоксильной группой и винилгалогениды теряют заместитель в процессе реакции, давая метилкетоны:
RCH=CH–COOH ROCH3 ROCH3
RCCl=CH2  RCOCH3 RCOCH3
Циклические алкены, вплоть до циклогептена, дают циклические кетоны:
CH CH2
(CH2)n  (CH2)n (CH2)n
CH CO
Диеновые углеводороды реагируют с миграцией двойной связи:
CH2=CH – CH=CH2 CH3–CH=CH–CHO CH3–CH=CH–CHO
CH2=CH –CH2–CH=CH2 CH3 – CH2–CH=CH=CHO CH3 – CH2–CH=CH=CHO
Высшие алкены требуют более высоких температур. Они имеют тенденцию давать смесь кетонов (по причине миграции двойной связи)[21, c. 246].
3.2.2 Влияние строения атакующей частицы. Влияние строения уходящей группы
Замещение С1-
на ОН-
предположительно затрагивает Cl-лиганд в транс-положении по отношению к этилену. С другой стороны, внедрение согласно современным представлениям требует взаимного цис-положения для алкена и ОН-лиганда. Предполагают, что значительная концентрация цис-молекул обеспечивается обратимой изомеризацией, которая идет через образование промежуточного пентакоординационного соединения[21, с. 249]:

3.2.3 Влияние растворителя
Процесс окисления этилена является гомогенным каталитическим, протекает при действии соли палладия (другие окисляющие агенты , например Fе3+
и К2
Сг07
, тоже можно в принципе использовать, но все же Сu2+
предпочтительнее из-за легкости окисления Сu+
кислородом). По этой причине проведение превращения требует наличия полярного растворителя, хорошо растворяющего соль палладия.
В промышленности в качестве растворителя применяют воду. Как было показано выше замещение С1-
на ОН-
в лиганде [PdCl4]2-
является одной из стадий процесса. При замене растворителя ион ОН-
заменяется на другой. Соответственно применение других растворителей может привести к изменению течения реакции, получению совершенно других продуктов.
Так, Если этилен окислить в уксусной кислоте в качестве растворителя, то получается винилацетат с примесью побочных продуктов[21, с. 246]:
CH3 – COOPd + C2H4 CH3 – COOCH2CH2Pd CH3 – COOCH2CH2Pd
 PdH + CH3 – COOCH=CH2 PdH + CH3 – COOCH=CH2
4. Выбор типа реактора
При изучении процесса синтеза ацетальдегида окислением этилена кислородом были выявлены ряд особенностей данного процесса, основываясь на этих особенностях следует выбрать тип аппарата для проведения реакции.
Процесс окисления этилена в ацетальдегид идёт при действии соли палладия, растворённой в воде, то есть он относится к группе гомогенно-каталитических процессов. Для проведения синтеза необходимо пропускать газообразный этилен, либо смесь кислорода и этилена, через раствор катализатора. Это предполагает выбор такого реактора, в котором создаются условия для перехода газообразного этилена в водный раствор, содержащий катализатор. Требуется обеспечить эффективный контакт газа с жидкость, который может обеспечить газораспределительное устройство. Для интенсификации процесса аппарат целесообразно заполнить насадкой.
Раствор катализатора приготовляется с использованием соляной кислоты, поэтому он обладает сильными коррозионными свойствами. В условиях такой агрессивной среды для изготовления корпуса аппарата пригоден не любой материал, а лишь обладающий кислотоупорными свойствами. Таким материалом может быть, например, титан. В случае необходимости применения насадки, при её выборе также следует учесть коррозионную устойчивость её материала. Например, в качестве насадки могут быть выбраны керамические кольца.
Синтез идёт при избыточном давлении 0,8-1,3 МПа, поэтому должно выполняться условие герметичности аппарата. Аппарат должен быть спроектирован таким образом, чтобы выдерживать это давление, особое внимание следует уделять прочности сварных швов.
Процесс ведётся при 100–120°С, в этих условиях, как показывает термодинамический анализ, тепловой эффект реакции синтеза ацетальдегида будет равен –218,6 - –218,68 кДж/моль. То есть реакция идёт со значительным выделением тепла. Величина теплового эффекта влияет на поверхность теплообмена реактора. С другой стороны тепло реакции расходуется на нагрев реагентов и свежих порций катализаторного раствора. В условия проведения реакции катализаторный раствор кипеть не будет, поэтому для отвода избыточного количества тепла необходимо оборудовать реактор рубашкой.
Побочные реакции последовательны, то есть для большей селективности процесса следует как можно быстрее выводить продукт основной реакции из реактора. Реактор следует выбрать из той группы аппаратов, где процесс по гидродинамическому режиму приближен к реактору идеального вытеснения.
Проведению процесса синтеза ацетальдегида окислением этилена кислородом с учётом всех этих особенностей наиболее полно удовлетворяют аппараты барботажного типа. В них создаются оптимальные условия для перехода этилена в раствор катализатора. Гидродинамический режим аппаратов этого типа по газовой фазе приближен к РИВ, по жидкой – к РИС. Как было показано выше, корпус аппарата должен быть выполнен из титана.
5. Расчёт реактора
5.1 Материальный баланс
Проведём расчёт материальных потоков процесса получения ацетальдегида окислением этилена кислородом воздуха.
Основная реакция:
СН2=СН2 + 0,5О2  СН3СНО (1); СН3СНО (1);
Побочные:
СН2=СН2 + О2  СН3СООН (2); СН3СООН (2);
СН2=СН2 + 3О2  2СО2 + 2Н2О (3). 2СО2 + 2Н2О (3).
Производительность реактора по этилену 50 кг/час.
Число дней работы реактора в году n=340.
Технологический выход продукта 89%;
Степень превращения этилена 92%.
Селективность (1) – 90%, (2) – 3%, (3) – 7%.
Состав этилено-воздушной смеси: этилен – 10%, об.; воздух – 90%, об.
Состав воздуха: О2 – 21%, об., N2 и др. инертные примеси – 79%, об.
Приход
1. Производительность реактора по этилену в кмоль/час:
GC2H4= GC2H4/М C2H4=50/28=1,786 кмоль/час
2. Производительность по этаналю согласно стехиометрии реакции:
G'''CH3СНО= GC2H4=1,786 кмоль/час (78,58 кг/час)
С учётом степени превращения этилена:
G''CH3СНО= G'''CH3СНО ·XC2H4= 1,786 · 0,92=1,643 кмоль/час (72,29 кг/час)
С учётом селективности реакции:
G'CH3СНО= G''CH3СНО · Ф CH3СНО= 1,643· 0,9=1,479 кмоль/час (65,08 кг/час)
С учётом технологического выхода:
GCH3СНО= G'CH3СНО ·fCH3СНО=1,479·0,89=1,316 кмоль/час (57,90 кг/час)
Технологические потери ацетальдегида:
Gпотерь = G'CH3СНО – GCH3СНО= 65,08 – 57,90= 7,18 кг/час
3. Этилен, идущий на побочные реакции (согласно стехиометрии):
GC2H4= G''CH3СНО – G'CH3СНО=1,643 – 1,479=0,164 кмоль/час
В том числе на реакцию (2):
GC2H4= [Ф(2)/(Ф(2)+Ф(3))] · GC2H4=[3/10] ·0,164=0,049 кмоль/час
GC2H4= [Ф(3)/(Ф(2)+Ф(3))] · GC2H4=[7/10] ·0,164=0,115 кмоль/час
4. Количество непрореагировавшего этилена (согласно стехиометрии реакции (1)):
G0ст.C2H4= G'''CH3СНО – G''CH3СНО=1,786 – 1,643=0,143 кмоль/час (4,00 кг/час)
5. Количество воздуха:
Gвозд= (G'''CH3СНО·90)/10=(1,786·22,4·90)/10=360,06 м³/час
В том числе азота:
GN2= Gвозд·0,79=360,6·0,79=284,45 м³/час (12,698 кмоль/час; 355,54 кг/час)
кислорода:
GО2= Gвозд·0,21=360,6·0,21=75,61 м³/час (7,367 кмоль/час; 108,02 кг/час)
6. Кислород, расходуемый на химические реакции:
на реакцию (1):
G(1)
О2= (ν О2/ ν CH3СНО ) ·G' CH3СНО=(1/2) ·1,479= 0,739 кмоль/час (23,65 кг/час)
на реакцию (2):
G(2)
О2= (ν О2/ ν C2H4 ) ·GC2H4=(1\1) ·0,049=0,049 кмоль/час (1,57 кг/час)
на реакцию (3):
G(3)
О2= (ν О2/ ν C2H4 ) ·GC2H4=(3\1) ·0,115=0,345 кмоль/час (11,04 кг/час)
Расход
1. Непрореагировавший кислород:
G'О2= GО2 – (GО2+ GО2+ GО2) = 108,03 – (23,65 – 1,57 – 11,04)=71,77 кг/час (2,243 кмоль/час)
2. Количество СН3СНО:
GCH3СООН = (ν CH3СООН/ ν C2H4 ) GC2H4= (1/1) ·0,049 кмоль/час (2,95 кг/час)
3. Количество СО2:
GCО2 = (ν CО2/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (10,12 кг/час)
4. Количество Н2О:
GН2О = (ν Н2О/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (4,14 кг/час)
Полученные данные сведём в таблицу материального баланса:
Приход:
| Состав сырья |
Кг/час |
%,масс |
Кмоль/час |
%, моль |
м³/час |
%, об. |
| С2Н4 |
50 |
9,7 |
1,786 |
10 |
40,0 |
10 |
| N2 |
355,54 |
69,2 |
12,698 |
71,1 |
284,45 |
71,1 |
| O2 |
108,03 |
21,1 |
3,376 |
18,9 |
285,61 |
18,9 |
| Итого |
513,57 |
100 |
17,86 |
100 |
400,06 |
100 |
Расход:
| Состав реакц. смеси |
Кг/час |
%,масс |
Кмоль/час |
%, моль |
м³/час |
%, об. |
| С2Н4 |
4,00 |
0,8 |
0,143 |
0,8 |
3,1 |
0,8 |
| N2 |
355,54 |
69,2 |
12,698 |
74,4 |
284,48 |
74,4 |
| O2 |
71,77 |
14,0 |
2,243 |
13,1 |
50,2 |
13,1 |
| СН3СНО |
57,90 |
11,2 |
1,316 |
7,7 |
29,5 |
7,7 |
| потери СН3СНО |
7,18 |
1,4 |
0,163 |
0,9 |
3,6 |
0,9 |
| СН3СООН |
2,93 |
0,6 |
0,049 |
0,3 |
1,1 |
0,3 |
| СО2 |
10,12 |
2,0 |
0,230 |
1,4 |
5,1 |
1,4 |
| Н2О |
4,14 |
0.8 |
0,230 |
1,4 |
5,1 |
1,4 |
| Итого |
513,58 |
100 |
17,072 |
100 |
382,15 |
100 |
Массовые потоки приходной и расходной части совпадают, следовательно материальный баланс составлен верно.
5.2 Расчет параметров реактора
Определим количество катализаторного раствора, необходимое для окисления 50 кг/час этилена. Согласно литературным данным катализаторный раствор содержит 0,3 – 0,5 % PdCl2. Примем содержание PdCl2 равным 0,5 %.
Согласно стехиометрии реакции:
CH2=CH2 +PdCl2 + H2O CH3CHO + Pd + 2HCl; CH3CHO + Pd + 2HCl;
количество вещества PdCl2 равно:
GPdCl2 = GC2H4 = 1,786 кмоль/час
Тогда масса катализатора m
PdCl2 = GPdCl2 · MPdCl2 = 1,786 · 177 = 316,12 кг/час
Расход катализаторного раствора:
mр = 316,2 · 100/0,5 = 63224,4 кг/час
Плотность раствора 1281,6 кг/м³ [22, с. 106], тогда объёмный расход катализаторного раствора:
Gkt = mр/ρ = 63224,4/1281,6 = 49,33 м³/час
Коэффициент газонасыщения: k = GC2H4/ Gkt = 40/49,33 = 0,81 м³/м³
Пользуясь методикой для расчёта барботажных колонн [23, с. 265], рассчитаем параметры реактора.
Диаметр барботажной колонны:
D = 4Vг/πωг,
где ωг – приведённая скорость (ωг 0,1), примем ωг = 0,01
Vг – расход барботирущего газа, приведённый к рабочим условиям
Vг = Vг,0 TрP0/T0Рр = (40/3600) · (383/298) · (0,1/1,0) = 1,43 · 10-3
м³/с
D = 4 · 1,43 · 10-3
/(3,14 · 0,01) = 0,43 м
Примем в = 0,5 м, действительная скорость газа в колонне составит:
ωг =4Vг/πD2
= 4 · 1,43 · 10-3
/(3,14 · 0,52
) = 0,007 м/с
Плотность этилена при рабочих условиях:
ρ C2H4 = ρ C2H4,0 T0Pр/TрР0 = 1,26 · (298/383) · (1,0/0,1) = 9,80 кг/м3
Объёмное газосодержание системы
φг = 0,4(ρг/ ρж) 0,15
[ωг Δρ/σg ] 0,68
=
0,4 · (9,8/ 1281,6) 0,15
[0,007 · 1272,8/58,6 · 10-3
· 9,8] 0,68
= 0,024
Высота газожидкостной смеси:
Hсм = (Vж – Vдн)4/[ πD2
a(1 – φг)]
где Vж – объём жидкости в колонне
Vдн – объём днища
a – коэффициент, учитывающий заполнение колонны
Hсм = (1 – 0,1) · 4/[ 3,14 · 0,52
· 0,9(1 – 0,024)] = 5,2 м
Общая высота колонны:
Hк = Hсм + hц + Hсеп + 2hдн = 5,2 + 0,1 + 0,5 + 2 · 0,3 = 6,4 м
где hц – расстояние от барботёра до днища колонны,
Hсеп – высота сепарационной части колонны,
Hдн – высота крышки днища.
5.3 Определение тепловой нагрузки на реактор
Примем температуру реакции Tк =110°С, а температуру исходных веществ Tн = 30°С.
Для расчёта теплоёмкостей веществ при температуре реакции и начальной температуре веществ-участников реакции воспользуемся уравнениями вида сp=a + bT + cT² + c' T‾². Согласно справочным данным [19] соответствующие коэффициенты в уравнении для веществ будут равны:
| Вещество |
a |
b·10³ |
c·10
. |
c´·10-
5
. |
| С2Н4 |
11,32 |
122,01 |
–37,9 |
– |
| O2 |
31,46 |
3,39 |
– |
–3,77 |
| СН3СНО |
13,00 |
153,5 |
–53,7 |
– |
| СН3СООН |
14,82 |
196,7 |
–77,7 |
– |
| СО2 |
44,14 |
9,04 |
– |
–8,54 |
| Н2О |
3,00 |
10,71 |
– |
0,33 |
| N2 |
27,88 |
4,27 |
– |
– |
Рассчитаем теплоёмкости исходных веществ и продуктов реакции при заданных температурах:
cp
( C2H4)=11,32 + 122,01·10-3
·303 – 37,9·10-
·3032
=44,81 кДж/кмоль
cp
8
( C2H4)=11,32 + 122,01·10-3
·383 – 37,9·10-
·3832
=52,49 кДж/кмоль
cp
( О2)=31,46 + 3,39·10-3
·303 – 3,77·105
·303-2
=28,38 кДж/кмоль
cp
8
( О2)=31,46 + 3,39·10-3
·383 – 3,77·105
·383-2
=24,04 кДж/кмоль
cp
8
( CH3СНО)=13,00 + 153,5·10-3
·383 – 53,7·10-
·3832
=80,46 кДж/кмоль
cp
8
( CH3СООН)=14,82 + 196,7·10-3
·383 – 77,7·10-
·3832
=78,76 кДж/кмоль
cp
8
( СО2)=44,14 + 9,04·10-3
·383 – 8,54·105
·383-2
=41,78 кДж/кмоль
cp
8
( Н2О)=30,00 + 10,71·10-3
·383 + 0,33·105
·383-2
=34,36 кДж/кмоль
cp
0
( N2)=27,88 + 4,27·10-3
·303 =29,17 кДж/кмоль
cp
8
( N2)=27,88 + 4,27·10-3
·383 =29,51 кДж/кмоль
Приход тепла
1. Тепло, приходящее с исходными веществами:
Qисх. в-в = ΣGni · cpi · Tн = G C2H4· cp
( C2H4) · Tн + G О2· cp
( О2) · Tн + G N2 · cp 0
( N2) · Tн =
=1,786 ·44,81· 303 + 3,376· 28,38· 303 + 12,698· 29,17· 303 = 165511,4 кДж/час
2. Тепло химических реакций:
Qр= Qобр
кон – Qобр
исх
Теплота образования конечных веществ:
Qобр
кон = Σ(–ΔН°j) · Gnj
Qобр
C2H4 = –52,3 · 0,143 · 10
= –7478,9 кДж/час
Qобр
CH3СНО = 166,00 · (1,316 + 0,163) · 10
= 245 514 кДж/час
Qобр
CH3СООН = 434,84 · 0,049 · 10
= 21307,2 кДж/час
Qобр
СО2 = 393,51 · 0,23 · 10
= 90507,3 кДж/час
Qобр
Н2О = 241,81 · 0,23 · 10
= 55616,3 кДж/час
Теплота образования исходных веществ:
Qобр
кон = Σ(–ΔН°i) · Gni
Qобр
C2H4 = –52,3 · 1,786 · 10
= –93407,8 кДж/час
Qр=495465,9 – (– 93407,8 ) =498873,3 кДж/час
3. Тепло фазовых переходов.
В условиях реакции фазовых переходов продуктов реакции и реагентов не происходит.
4. Итого, приход тепла:
Qприх = Qисх. в-в + Qр = 165511,4 + 498873,7 = 664385,1 кДж/час
Расход тепла
1. Тепло, уносимое из реактора продуктами реакции и непрореагировавшими веществами:
Qпрод= ΣGnj· cpj · Tк = GC2H4· cp
8
( C2H4) · Tк + G О2 · cp
8
(О2) · Tк + GN2 · cp
8
( N2) · Tк + G СО2 · cp
8
( СО2) · Tк + G Н2О · cp
8
(Н2О) · Tк = (0,143·52,49 + 2,243·24,04+ 12,698·29,51 + 0,23·41,78 + 0,23·34,36)·383 = 173751,0 кДж/час
2. Тепло, затрачиваемое на подогрев исходных реагентов:
Qнагр = ΣGni· cpi · (Tк – Tн) = [GC2H4· cp
(C2H4) + GN2 · cp
0
(N2) + G О2· cp
( О2)]· (Tк – Tн) = (1,786·44,81 + 12,698·29,17 + 3,376·28,38) · (383 – 303) = 43699,4 кДж/час
3. Потери тепла:
Δ Q= 0,04·Qприх = 0,04·664385,1 = 26575,4 кДж/час
4. Тепловая нагрузка:
QF = Qприх – Qпрод – Qнагр – Δ Q = = 664385,1– 173751,0 – 43699,4 – 26575,4 = 420 359,3 кДж/час
Таблица теплового баланса:
| Приход тепла |
кДж/час |
% |
Расход тепла, кДж/моль |
кДж/час |
% |
| Тепло, приходящее с исходными веществами Qисх.в-в |
165511,4 |
24,9 |
Тепло, уносимое из реактора продуктами реакции Qпрод |
173751,0 |
26,1 |
| Тепло химических реакций Qр |
498873,7 |
75,1 |
Тепло, затрачиваемое на подогрев исходных реагентов Qнагр |
43699,4 |
6,6 |
| Тепло фазовых переходов |
– |
– |
потери Δ Q |
26575,4 |
4,0 |
| Тепловая нагрузка QF |
420 359,3 |
63,3 |
| Итого |
664385,1 |
100 |
Итого |
664385,1 |
100 |
Поверхность реактора:
Примем разность температур реакционной массы и теплоносителя равной Δtср = 50 К, коэффициент теплопередачи k = 150 вт/м2
·К , тогда площадь поверхности реактора составит
F = QF/(k· Δtср) = (420 359,3 · 1000)/(150 · 50 · 3600) = 15,57 м2
Список литературы
1. Соколов Р.С. Химическая технология в 2-х т.: Учебное пособие для вузов Т.2:Металлургические процессы. Переработкам химического топлива. Производство органических веществ и полимерных материалов. - М. «Владос», 2000 - 447 с.
2. Химическая энциклопедия: в 5 т., Т.1 под ред. Кнукянц И.Л., М: Советская энциклопедия, 1988 - 623 с.
3. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза: Учеб. Пособие для вузов - 2-е изд., перераб. - М.: Высш. шк., 2003. - 536 с.
4. Лебедев Н.Н. Химия и технология основного органического синтеза. - М. Химия, 1988, 582 с.
5. Юкельсон И.И. Технология основного органического синтеза. - М. Химия, 1968 - 848 с.
6. Паушкин Я.Н., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза. В 2-х ч. Ч.1 Углеводородное сырьё и продукты его окисления. - М.: «Химия», 1973 - 352 с
7. Реферативный журнал «Химия», 1999 №9 Патент 5679870 США МПК6
С07С45/00 TustinGeraldCharles, DepewLeslieSharon; EastmanChemicalCo. -- № 619385; Заявл 21.3.96.; Опубл. 21.10.97; НПК 568/489
8. Реферативный журнал «Химия», 2000 №13 Патент 23981 Украина МПК6
С07С47/06 Осiйський Едуард Йосипович, Гомонал Василь Iванович: Ужгород, держ. цн-т – № 961124485. Заявл. от 02.12.1996. Опубл. 31.08.1998 Бюл. №20
9. Реферативный журнал «Химия», 2003 №24. Превращение этиленгликоля до ацетальдегида – дегидратация или согласованный механизм. Ethyleneglycol to acetaldehyde – dehydration or a concered mechanism. Smith William B. (Department of Chemistry, Texas) Texas Christian University, Fort Worth, TX, 76129 USA Tetrahedron, 2002, 58 №11, с. 2091-2094
10.Реферативный журнал «Химия», 2003 №19 Селективное гидрирование уксусной кислоты в ацетальдегид на нанесённых на SBA-15 оксидах железа. Zhang Xue-Zheng, Yue Ying-Hong, Gao Zi Gaodeng xuexiao huahxun xuebao= Chem J. Chin. Univ. 2003 24, № 1, с 121-124
11.Реферативныйжурнал «Химия», 1998 №7 Влияниеконцентрациикислороданавыходацетальдегидаприокисленииэтанолавприсутствииоксидовкальцияиалюминия. Oxidation of concentration on acetaldehyde yield/Karafyllis J. Phillipponlos C. Grigoroponlon H.//Chem and Biochem – Eng., Quart – 1997 – 11, №3 – с. 121-125
12.Реферативныйжурнал «Химия», 2002 №2 Different mechanism for the formation of acetaldehyde and ethanol on the Rh-based catalysts. Wang Xi, Luo Hongyuan, Liang Dongbai, Bao Xinhe J Catal, 2000. 190 №1 с.46-55
13.Реферативный журнал «Химия», 2002 №6 Оптимизация процесса производства ацетальдегида. Wu Xuan-chun Nanjing huegong daxue xuebao= J. Nanjing Univ. Chem Technol. 2001 23, №4, с. 47-49
14.О. К. Бабакова, Ю.А. Писаренко, В.С. Тимофеев, А.С. Шувалов Разработка узла гидролиза производства ацетальдегида косвенной гидратацией ацетилена. 2002 Химическая промышленность с. 16-20
15.Краткий справочник по химии под ред. А. Т. Пилипенко, Киев: «Наукова думка», 1987
16.Петров А.А. , Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для ВУЗов.//Под ред. Стадничука М.Д. - 5-е изд., перераб. и доп. - СПб.: «Иван Фёдоров», 2002. - 624 с., ил.
17.Ахметов Н.С. Неорганическая химия. Учебное пособие для вузов. М., «Высшая школа», 1975
18.Физер Л., Физер М.Органическая химия. Углубленный курс. В 2-х т., Т.1/ Пер с англ. Под ред. Вульфсона - М. «Химия», 1966. - 680 с.
19.Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономарёвой А. М., - Спб.: «Иван Федоров», 1999
20.Попов Ю.В., Но Б.И. Инженерная химия: Учебное пособие / Волгоградский Государственный Технический Университет, Волгоград, 2003.
21.Хенреце-Оливе Г., Оливе С. Координация и катализ. М., «Мир», 1980
22.Краткий справочник физико-химических величин под ред. К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. – 200 стр.
23.Машины и аппараты химических производств: Примеры и задачи. Учеб. пособие для студентов втузов, обучающихся по специальности «Машины и аппараты химических производств» под ред. В.Н. Соколова – Л.: Машиностроение ,1982.
|