СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1.АНАЛИТИЧЕСКИЙ ОБЗОР
1.1 Теоретические сведения об уксусной кислоте
1.2 Применение уксусной кислоты
1.3 Основные способы получения уксусной кислоты
1.3.1 Получение уксусной кислоты окислением ацетальдегида
1.3.2 Получение уксусной кислоты окислением н-бутана
1.3.3 Производство уксусной кислоты окислением н-бутенов
1.3.4 Производство уксусной кислоты окислением парафинов С4-С8 в кислоты
1.3.5 Производство уксусной кислоты из метанола и оксида углерода
2. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
2.1 Химизм процесса
2.2 Описание технологической схемы
2.3 Технико-технологические расчёты
2.3.1 Материальный баланс реактора и стадии синтеза уксусной кислоты
ЗАКЛЮЧЕНИЕ
ВВЕДЕНИЕ
Уксусная кислота — первая из органических кислот, которая стала известна человеку. Впервые она была получена И.Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных растворов и разложением ацетата кальция серной кислотой Г.Шталем в 1666—1667 гг. Элементный состав уксусной кислоты был установлен Я.Берцелиусом в 1814 г. До начала XIX века уксусную кислоту производили исключительно из природного сырья: пирогенетической обработкой древесины и окислительным уксуснокислым брожением пищевого этанола. В настоящее время производство уксусной кислоты из лесохимического сырья имеет второстепенное значение, хотя масштабы его измеряются сотнями тысяч тонн. В этом методе уксусную кислоту выделяют из сконденсированной части парообразных продуктов термической обработки древесины (жижки), получаемой в процессе углежжения. Выход кислоты составляет около 20 кг на 1 м3 древесины.
Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса.
Появление синтетических методов производства уксусной кислоты связано с разработкой и промышленной реализацией реакции получения ацетальдегида по Кучерову. В1910—1911 гг. патентуется способ производства уксусной кислоты окислением ацетальдегида, а в годы первой мировой войны в Германии и Канаде по этому методу было организовано промышленное производство. С некоторыми технологическими изменениями этот метод сохранил свое значение и в течение более пятидесяти лет является одним из основных.
Уксусная кислота была единственной, которую знали древние греки.Отсюда и ее название: «оксос» - кислое, кислый вкус. Уксусная кислота это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса. Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен удар господствовавшей тогда электрохимической теории Берцелиуса. Последний, распределяя элементы на электроположительные и электроотрицательные, не признавал возможности замещения в органических веществах, без глубокого изменения их химических свойств, водорода (элемента электроположительного) хлором (элементом электроотрицательным), а между тем по наблюдениям Дюма ("Comptes rendus" Парижской академии, 1839) оказалось, что "введение хлора на место водорода не изменяет совершенно внешних свойств молекулы почему Дюма и задается вопросом "покоятся ли электрохимические воззрения и представления о полярности, приписываемой молекулам (атомам) простых тел, на столь ясных фактах, чтобы их можно было считать предметами безусловной веры; если же их должно рассматривать как гипотезы, то подходят ли эти гипотезы к фактам? Должно признать, продолжает он, что дело обстоит иначе.Берцелиусу пришлось допустить возможность замещения водорода хлором без изменения химической функции первоначального тела, в котором происходить замещение. Не останавливаясь на приложении его воззрений к другим соединениям, переходим к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот нашел ряд фактов, гармонировавших со взглядами Берцелиуса (Жерара). Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4
SO2
, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2
и образовавшегося у Кольбе при действии на CS2
влажного хлора. При действии света и хлора на C2
Cl4
, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2
Сl4
может быть получен из CCl4
при пропускании его через накаленную) трубку, а ССl4
образуется при действии, при нагревании, Cl2
на CS2
то реакция Кольбе была первым по времени синтезом уксусной кислоты из элементов. Работами Кольбе строение уксусной кислоты, а вместе с тем и всех других органических кислот было окончательно выяснено и роль последующих химиков свелась только к делению - в силу теоретических соображений и авторитета Жерара, формул Кольбе пополам и к переведению их на язык структурных воззрений, благодаря чему формула C2
H6
.C2
O4
H2
превратилась в CH3
CO(OH).Мировое производство уксусной кислоты составляет в настоящее время свыше 3,5 млн. т в год, в нашей стране в 1980 г. было произведено 250 тыс. т. Основная масса уксусной кислоты производится из ацетальдегида, окислением бутановой и бензиновой фракций.
Первая установка по производству синтетической уксусной кислоты каталитическим окислением ацетальдегида была пущена на Чернореченском химическом заводе в 1932 г., а в 1948 г. было организовано ее промышленное производство. К 60-м годам уксусная кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза.
В 1963 г. были введены в строй новые предприятия по совместному производству уксусной кислоты и уксусного ангидрида каталитическим окислением ацетальдегида в жидкой фазе и к 1965 г. производство уксусной кислоты этим методом составляло уже 17% от общего объема ее производства в стране. В эти же годы было освоено в промышленном масштабе производство уксусной кислоты карбонилированием метанола.
1. АНАЛИТИЧЕСКИЙ ОБЗОР
1.1 Теоретические сведения об уксусной кислоте
Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом. Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга: кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.С увеличением молекулярной массы растворимость кислот в воде уменьшается.Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.Уксусная кислота (этановая кислота) представляет бесцветную жидкость с резким запахом, с температурой кипения 118,1°С, температурой плавления 16,75°С и плотностью 1,05 т/м3. Безводная, так называемая «ледяная» уксусная кислота образует за счет водородных связей димер циклического строения.

Критическая температура составляет 321,6°С. Уксусная кислота смешивается во всех отношениях с этанолом, диэтиловым эфиром, бензолом и другими органическими растворителями и с водой. Растворяет некоторые неорганические и органические вещества, например, серу, фосфор, ацетаты целлюлозы. С воздухом уксусная кислота образует взрывчатые смеси с пределами воспламенения от 3,3 до 22,0% об. Температура вспышки равна 34°С, температура самовоспламенения 354°С.
Уксусная кислота слабая. Константа ее диссоциации 1,75*10-5
. Образует многочисленные растворимые в воде соли (ацетаты) и этерифицируется спиртами с получением сложных эфиров. Уксусная кислота обладает высокой коррозионной активностью по отношению ко многим металлам, особенно в парах и при температуре кипения, что необходимо учитывать при выборе материалов для аппаратуры. В ледяной кислоте стойки как на холоду, так и при температуре кипения, алюминий, кремнистый и хромистый чугуны, некоторые сорта нержавеющей стали, но разрушается медь. Техническая уксусная кислота обладает большей коррозионной активностью, которая усиливается в контакте с воздухом. Из неметаллических материалов стойки по отношению к уксусной кислоте специальные сорта керамики и эмали, кислотоупорные цементы и бетоны и некоторые виды полимерных материалов (полихлорвиниловые и фенолальдегидные пластмассы). Ингибитор коррозии в растворах уксусной кислоты — перманганат калия.
В парах уксусная кислота обладает раздражающим действием на дыхательные пути, ПДК для нее составляет 5 мг/м3.
Синтетическая пищевая уксусная кислота – легковоспламеняющаяся жидкость, по степени воздействия на организм относится к веществам 3-го класса опасности. При работе с уксусной кислотой следует применять индивидуальные средства защиты (фильтрующие противогазы). Первая помощь при ожогах - обильное промывание водой.Синтетическую пищевую уксусную кислоту заливают в чистые железнодорожные цистерны, автоцистерны с внутренней поверхностью из нержавеющей стали, в контейнеры, емкости и бочки из нержавеющей стали вместимостью до 275 дм3
, а также в стеклянные бутыли и полиэтиленовые бочки вместимостью до 50 дм3
. Полимерная тара пригодна для залива и хранения уксусной кислоты в течение одного месяца. Синтетическую пищевую уксусную кислоту хранят в герметичных резервуарах из нержавеющей стали. Контейнеры, емкости, бочки, бутыли и полиэтиленовые фляги хранят в складских помещениях или под навесом. Недопускается совместное хранение с сильными окислителями (азотная кислота, серная кислота, перманганат калия и др.).Транспортируется в ж/д цистернах, изготовленных из нержавеющей стали марки 12Х18H10Т или 10Х17H13М2Т, с верхним сливом. Физические свойства уксусной кислоты Таблица 1| 1. Внешний вид |
Бесцветная, прозрачная жидкость без механических примесей |
| 2. Растворимость в воде |
Полная, раствор прозрачный |
| 3. Массовая доля уксусной кислоты, %, не менее |
99,5 |
| 4. Массовая доля уксусного альдегида, %, не более |
0,004 |
| 5. Массовая доля муравьиной кислоты, %, не более |
0,05 |
| 6. Массовая доля сульфатов (SO4), %, не более |
0,0003 |
| 7. Массовая доля хлоридов (Cl),%, не более |
0,0004 |
| 8. Массовая доля тяжелых металлов осаждаемых сероводородом (Pb), %, не более |
0,0004 |
| 9. Массовая доля железа (Fe), %, не более |
0,0004 |
| 10. Массовая доля нелетучего остатка, %, не более |
0,004 |
| 11. Устойчивость окраски раствора марганцовокислого калия, мин, не менее |
60 |
| 12. Массовая доля веществ, окисляемых двухромовокислым калием, cm3 раствора тиосульфата натрия, концентрация с (Na2
SO3
*5H2
O) = 0,1 моль/дм3 (0,1H), не более |
5,0 |
1.2 Применение уксусной кислоты Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.Яблочный уксус ( 4% уксусной кислоты )Яблочный уксус содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, пропионовую, молочную и лимонную кислоты, целый ряд ферментов и аминокислот, ценные балластные вещества, такие, как поташ, пектин. Яблочный уксус широко применяется при приготовлении различных блюд и консервировании. Он прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нем можно мариновать мясо, огурцы, капусту, каперсы, портулак, а также трюфели. Однако, на Западе яблочный уксус известен больше своими лечебными свойствами. Он применяется при повышенном кровяном давлении, мигренях, астме, головной боли, алкоголизме, головокружении, артрите, болезнях почек, высокой температуре, ожогах, пролежнях и др.Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.Уксус широко используется в домашнем консервировании для приготовления маринадов различной крепости. В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды - 3-4 ложки уксуса).Уксус виноградный ( 4% уксусной кислоты )Виноградный уксус широко используется ведущими поварами не только Словении, но и всего мира. В Словении его традиционно используют при приготовлении различных овощных и сезонных салатов (2-3 ст. ложки на салатницу), т.к. он придает неповторимый и изысканный вкус блюду. Также виноградный уксус прекрасно сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков из различных сортов мяса, но особенно из свинины, виноградный уксус просто незаменим.Уксусная кислота применяется также для производства лекарственных средств. Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты. Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).При нагревании с гидроксидом натрия (NaOH) в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия. При закислении среды салициловая кислота выпадает в осадок и может быть идентифицирована по температуре плавления (156-1600С). Другим методом идентификации салициловой кислоты, образующейся при гидролизе, является окрашивание её раствора в тёмно-фиолетовый цвет при добавлении хлорида железа (FeCl3). Уксусная кислота, присутствующая в фильтрате, превращается при нагревании с этанолом и серной кислотой в этоксиэтанол, который можно легко распознать по его характерному запаху. Кроме того, ацетилсалициловая кислота может быть идентифицирована при помощи различных хроматографических методов. Ацетилсалициловая кислота кристаллизуется с образованием бесцветных моноклинных многогранников или игл, немного кислых на вкус. Они стабильны в сухом воздухе, однако во влажной среде постепенно гидролизуются до салициловой кислоты и уксусной кислоты (Leeson и Mattocks, 1958; Stempel,1961). Чистое вещество представляет собой белый кристаллический порошок, почти не обладающий запахом. Запах уксусной кислоты свидетельствует о том, что вещество начало гидролизоваться. Ацетилсалициловая кислота подвергается эстерификации под действием щелочных гидроксидов, щелочных бикарбонатов, а также в кипящей воде.Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее, а также болеутоляющее действие, и ее широко применяют при лихорадочных состояниях, головной боли, невралгиях и др. и в качестве противоревматического средства.Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.1.3 Основные способы получения уксусной кислоты
1.3.1 Получение уксусной кислоты окислением ацетальдегида
Процесс получения уксусной кислоты окислением ацетальдегида разработан фирмой Shawinigan (США). Окисление проводится кислородом в колоннах, футерованных алюминием, при 50—70°С и давлении до 0,7 МПа. В качестве растворителя используется уксусная кислота или ее водный раствор. Повышенное давление способствует поддержанию необходимой концентрации альдегида в жидкой фазе н увеличению надежности работы конденсационной системы. В качестве катализатора используется ацетат марганца. Окислительная колонна в нижней части снабжена перфорированной перегородкой для равномерного распределения кислорода по ее сечению. Процесс окисления протекает через стадию образования надуксусной кислоты, и катализатор играет активную роль в предотвращении ее накопления в значительных количествах.
Основными побочными продуктами окисления ацетальдегида являются ме-тилацетат, формальдегид, муравьиная кислота, ацетон, диацетил, этилиденди-ацетат. Это требует тщательной очистки товарного продукта от примесей.
В случае окисления ацетальдегида с использованием сложных катализаторов Со—Сu, Мn—Сu и в присутствии водоотводящих агентов (диизопропиловый эфир, этилацетат и т. д.) одновременно с уксусной кислотой образуется уксусный ангидрид.
Окисление ацетальдегида молекулярным кислородом представляет гомогенную каталитическую реакцию, протекающую в жидкой фазе и выражаемую общим уравнением:
СН3
СНО + 0,5О2
= СНзСООН -∆Н (1)
Реакция протекает по цепному механизму через стадию образования надуксусной кислоты (НУК):
СНз-СНО + О2
→СНз-С-ООН (2)
II
O
Которая, являясь сильным окислителем, окисляет ацетальдегид до уксусного ангидрида:
СНз-СНО + СНз-С-ООН →(СН3
СО)2
О + Н2
О (3)
II
O
Уксусный ангидрид при достаточном количестве воды гидролизуется до уксусной кислоты:
(СН3
СО)2
O + Н2
O→ 2СН3
СНО
Таким образом, в системе всегда сосуществуют уксусная кислота, уксусный ангидрид и вода.
Технологическая схема производства уксусной кислоты окислением ацетальдегида
На рис. 1.1 представлена технологическая схема производства уксусной кислоты из ацетальдегида на марганцевом катализаторе.

1-смеситель катализаторного раствора,2-смеситель раствора ацетальдегида,3-окислительная колонна(реактор),4-брызгоулавитель,5- рассольный конденсатор, 6-сепаратор жидкости и газа, 7-ректификационная колонна
Рисунок 1.1 Технологическая схема производства уксусной кислоты окислением ацетальдегида
Технологический процесс производства уксусной кислоты окислением ацетальдегида состоит из трех последовательных стадий:
1) окисление ацетальдегида,
2) выделение непрореагировавшего ацетальдегида из паро-газа,
3) выделение уксусной кислоты из реакционной смеси и ее очистка.
Растворы катализатора и ацетальдегида в циркуляционной уксусной кислоте подаются из смесителей 1 и 2 в нижнюю часть окислительной колонны — реактора барботажного типа 3. Температурный режим в колонне поддерживается с помощью размещенных в ней охлаждающих змеевиков, по которым циркулирует вода. По всей высоте в колонну через несколько труб подается под давлением 4*105
Па кислород, который барботирует через жидкость, заполняющую колонну. Парогазовая смесь, содержащая продукты окисления, выводится из колонны 3 через брызгоуловитель 4 и поступает в конденсатор 5, охлаждаемый рассолом, и из него в сепаратор 6. Из сепаратора конденсат, состоящий из уксусной кислоты и ацетальдегида, возвращается в окислительную колонну, а несконденсировавшиеся газы промываются водой и выпускаются в атмосферу. Для предотвращения возможности взрыва НУК парогазовая смесь, выходящая из колонны, разбавляется азотом, который подается в брызгоуловитель 4. Жидкая уксусная кислота, выходящая из брызгоуловителя колонны 3, делится на два потока. Меньший из них (циркуляционная кислота) направляется в смесители 1 и 2 для приготовления растворов катализатора и ацетальдегида, а больший поступает на ректификацию в колонну 7 для получения товарного продукта. Из нижней части колонны 7 выводится в виде кубового остатка раствор катализатора, поступающий на регенерацию.
Основной аппарат технологической схемы — окислительная колонна. Она представляет цилиндр с расширенной верхней частью, играющей роль брызгоуловителя, высотой 12 и диаметром 1 м. Колонна изготовлена из алюминия или хромоникелевой стали, мало подверженных коррозии в уксуснокислой среде. Внутри колонна имеет полки, между которыми размещены змеевиковые холодильники для отвода реакционного тепла и несколько труб для подачи кислорода.
Товарным продуктом в этом методе является уксусная кислота концентрацией после двухкратной ректификации 97,5— 98,5% мас. Выход уксусной кислоты составляет 92% при степени превращения ацетальдегида 0,98.
1.3.2 Получение уксусной кислоты окислением н-бутана
Промышленные установки по получению уксусной кислоты имеются в США, Англии, ФРГ и других странах.
В Советском Союзе процесс жндкофазного окисления н-бутана разработан Н. М. Эмануэлем с сотр., исследованиями которых было установлено, что жидкофазное окисление н-бутана является автокаталитической цепной реакцией с вырожденным разветвлением цепи. Под влиянием кислорода происходит зарождение цепи с образованием сначала втор-бутилового, а затем втор-бутилпер-оксидного радикалов

Продолжение цепи идет в двух направлениях. Первое направление — это взаимодействие вгор-бутилпероксида с н-бутаном

Образующийся гидропероксид может распадаться, причем получающийся метилэтилкетон при дальнейшем окислении дает α-кетогидропероксид:

α-Кетогидропероксид, в свою очередь распадается с образованием уксусной кислоты и ацетальдегида
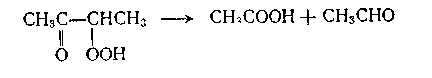
С целью сокращения индукционного периода окисления первоначально процесс проводился в присутствии солей металлов переменной валентности (СО, Ni и др.), в последнее время чаще это достигается за счет частичного возврата продуктов окисления.
Энергия активации при гомогеннокаталптическом окислении углеводородов в жидкой фазе составляет 50—81 кДж/моль против 105—147 кДж/моль при термическом пли инициированном окислении.
Снижение периода индукции при добавлении в сырье незначительных количеств продуктов окисления происходит за счет большей их скорости окисления и разложения образующихся гидропероксидов по реакциям, рассмотренным выше.
Критические температура и давление для н-бутана соответственно равны 152 °С и 3,5 МПа. Жидкофазное окисление н-бутана при температуре, близкой к критической, малоэффективно из-за небольшой скорости реакции. Кроме того, очень трудно управлять процессом, так как требуется поддерживать температуру во всем объеме реактора в очень узких пределах. В связи с этим окисление н-бутана проводят в растворе. Наиболее подходящими растворителями оказались уксусная кислота, получаемая в самом процессе, и продукты реакции, возвращаемые в реактор вместе с непрореагировавшим н-бутаном. Раствор н-бутана в такой смеси имеет критическую температуру около 195 °С. Применение других растворителей, например бензола, менее эффективно.
Технология процесса
Сырьем для получения уксусной кислоты является выделяемый из бутан-бутеновой фракции 96%-ный н-бутан. Содержание пропана, изобутана и углеводородов С5
и выше допускается не более 0,5, 2 и 1 % соответственно, содержание сернистых соединений не более 0,0005%, полное отсутствие 2-метил-пропена.
Примесь изобутана способствует увеличению выхода малоценных продуктов — ацетона и метилацетата; при наличии непредельных углеводородов значительно снижается выход уксусной кислоты за счет образования гликольдиацетатов и возрастания количества продуктов полного окисления.
Окисление н-бутана проводится при 140—170 °С и 5,1 МПа, массовом соотношении свежий н-бутан : возвратный к-бутан : воздух 1 : 1,5—2: 10—12 и подаче с возвратным н-бутаном продуктов окисления в количестве около 10 % (масс.) от суммарного количества н-бутана.
Технологическая схема жидкофазного окисления н-бутана представлена на рис.1.2.

1,3-смесители;2,4-подогреватели; 5-реактор окисления; 6,8 холодильники;7-насос для перегретой воды;9-сборник перегретой воды;10,19-газосепараторы;11-сборник циркуляционного н-бутана;12,13,14,16,17-холодильники-конденсаторы;15,20,22-скрубберы;18-дебутанизатор;21-отпарная калонна
Рисунок 1.2. Технологическая схема жидкофазного окисления н-бутана
Свежий жидкий н-бутан подается в смеситель 1, куда поступают циркулирующий к-бутан из емкости 11 и так называемый кислый н-бутан из емкости 19. Смесь свежего и циркулирующего н-бутана и кислых продуктов, пройдя теплообменник 2, где она нагревается до 140—150 °С, поступает в нижнюю часть реактора окисления 5. Свежий воздух и кислородсодержащий газ из скруббера 20 смешиваются в аппарате 3, нагреваются в подогревателе 4 и тремя потоками подаются в реактор окисления 5. Реактор представляет собой аппарат колонного типа, в который вмонтированы змеевики для съема тепла и распределительное устройство для воздуха.
Реакция окисления сопровождается выделением значительного количества тепла — 20900 кДж на 1 кг н-бутана. Съем тепла осуществляется перегретой водой, циркулирующей по замкнутому циклу — сборник 9, насос 7, змеевики реактора окисления, холодильник 6 и опять сборник 9.
Отходящая из верхней части реактора парогазовая смесь направляется на конденсацию в системе водяных и рассольных холодильников-конденсаторов 12, 13, 14, из которых конденсат самотеком сливается в емкость 11. Смесь паров и газов, не сконденсировавшаяся в конденсаторе 14, поступает на нейтрализацию кислых продуктов в скруббер 15, орошаемый 2—5%-ным раствором щелочи, а затем на промывку водой в скруббер 20. Промытая паровоздушная смесь частично идет на смешение со свежим воздухом, частично на отдувку. Промывная жидкость из скрубберов 15 и 20 поступает в отпарную колонну 21, где отпариваются органические примеси, сбрасываемые на факел, сбросная вода спускается в канализацию.
Оксидат (содержащий до 43 % уксусной кислоты, 10 % метил-этилкетона, 8—9% этилацетата и других продуктов), выходящий с низа реактора окисления 5, через холодильник 8 поступает в сепаратор 10. Выделяющиеся в сепараторе 10 газообразные продукты реакции присоединяются к парогазовой смеси, отходящей из верхней части реактора окисления. Жидкость из сепаратора 10 после снижения давления до 0,2 МПа путем дросселирования поступает в дебутанизатор 18 (температура верха 35—60°С, низа 120—160°С, давление 0,4 МПа), где отгоняется н-бутан, растворенный в продуктах окисления. Пары н-бутана конденсируются и часть конденсата возвращается на орошение дебутанизатора 18, а остальное количество (так называемый кислый н-бутан) через сепаратор 19 подается в смеситель 1. Несконденсировавшиеся газы из сепаратора 19 нейтрализуются щелочью в скруббере 22, после чего сбрасываются на факел.
Кубовая жидкость колонны-дебутанизатора 18 направляется на ректификацию в систему колонн, где происходит выделение концентрированной (99—100%-ной) и технической (85%- ной) уксусной кислоты, муравьиной кислоты (86,5 %-ной) и двух фракций: ацетоно метилацетатной фракции (23 % ацетона, 68 % метилацетата), выкипающей до 56 °С и метилэтилкетоно-этилацетатной фракции (45,8% метилэтилкетона, 38,3 % этилацетата), выкипающей в пределах 57—88 °С.
Из 1 т н-бутана при окислении образуется свыше 1,6 т полезных кислородсодержащих продуктов, в том числе 872 кг уксусной кислоты и 190 кг метилэтилкетона.
Основными преимуществами процесса являются одностадийность и непрерывность, дешевизна углеводородного сырья и окислителя. К недостаткам следует отнести высокую коррозионность среды и образование побочных продуктов.
1.3.3 Производство уксусной кислоты окислением н-бутенов
В последние годы в промышленности осуществлено окисление н-бутенов в уксусную кислоту. Процесс разработан фирмой Вауег и отличается высокой селективностью. Селективность окисления достигается путем ослабления центральной связи бутеновой цепочки при превращении смеси н-бутенов во втор-бутилацетат. При окислительном крекинге втор-бутилацетата образуется три молекулы уксусной кислоты, одна из которых возвращается в цикл для образования ацетата:
[CH2
=CHCH2
CH3
]
+CH3
COOH → CH3
CH2
CHCH3
+ 2O2
→ 3CH3
COOH
[CH3
CH=CHCH3
] I
OCOCH3
Сырьем для такого процесса служит смесь н-бутенов.
Из фракции С4
газов пиролиза извлекают (обычно экстракцией) бутадиен и 2-метилпропен. Остаток состоит из н-бутенов (~80%) и н-бутана (20%). При непосредственном окислении этой фракции получается сложная смесь продуктов, содержащая много смолистых веществ. Превращение же н-бутенов во втор-бутилацетат создает условия для преимущественного образования уксусной кислоты.
Бутен-1 реагирует с уксусной кислотой быстрее, чем бутен-2, поэтому последний составляет основную массу н-бутенов, возвращаемых в цикл. Для ускорения процесса присоединения к олефину уксусной кислоты ее берут в полуторном избытке.
Схема производства уксусной кислоты через втор-бутилацетат показана на рис. 1.1.
Процесс состоит из трех стадий: образования втор-бутилацетата, окислительного крекинга втор-бутилацетата, дистилляции продуктов реакции.
Первая стадия — присоединение уксусной кислоты к н-бу-тенам проводится в жидкой фазе в реакторе 1 с мешалкой при 110°С и 1,5 — 2 МПа. Катализатор (анионообменная смола).

1-реактор; 2, 8',,14,,20- газосепараторы; 3 — центрифуга; 4 — колонна с фильтрующей насадкой; 5 — ректификационная колонна; 6 — циркуляционный насос; 6' — сырьевой насос стадии окисления; 7,,12 — теплообменники; 8 — реактор окислительного крекинга; 8' — сепаратор реактора; 9 — котел-утилизатор; 10 — скруббер; 11 — печь; 13 — компрессор; 15 — колонна азеотропной дистилляции; 16,,17 — отстойники; 18 — испаритель; 19 — колонна выделения муравьиной кислоты; 21 — колонна товарной уксусной кислоты.
Рисунок 1.3 Схема производства уксусной кислоты окислением н-бутенов вводится в реактор в виде 20 %-ной суспензии в продуктах реакции этой стадии
Концентрация катализатора поддерживается на уровне 10 % (масс.), что достигается рециркуляцией с добавлением свежего катализатора. Продукты реакции после снижения давления до 0,7 МПа и разделения в газосепараторе 2 поступают на центрифугу 3, где происходит отделение катализатора, и, пройдя через колонну с фильтрующей насадкой 4, поступают в ректификационную колонну 5 (давление 0,5 МПа). В колонне 5 отгоняются непрореагировавшие углеводороды С4
, а снизу отбирается смесь втор-бутилацетата и уксусной кислоты, направляемая на окислительный крекинг.
Сырьем для окислительного крекинга являются: смесь втор-бутилацетата и уксусной кислоты с первой стадии, смесь непревращенного втор-бутилацетата и промежуточных продуктов (верхний погон после азеотропной дистилляции) (см. ниже). Эта смесь вместе с рециркулирующим потоком через теплообменник 7 подается в реактор 8 окислительного крекинга, представляющий собой безнасадочную колонну, имеющую в верхней части сепаратор 8'. Воздух нагнетается компрессором 13 через сопла в нижнюю часть реактора 8. Окислительный крекинг проводят без катализатора при 200°С и 6 МПа. Так как отношение циркулирующее сырье: свежее сырье выше 100: 1, температура в реакторе повышается за счет тепла реакции не более чем на 10 °С.
Продукты реакции из реактора 5 поступают в сепаратор. 8'. Несконденсировавшийся газ из сепаратора 8' проходит котел-утилизатор 9 и после снижения давления поступает в скруббер 10, орошаемый уксусной кислотой для извлечения продуктов реакции. Отходящий газ из скруббера- 10 сжигается в печи 11 (температура 400 °С), а горячие топочные газы используются для нагрева в теплообменнике 12 отработанного газа и для привода воздушного компрессора 13 (за счет энергии, получаемой при расширении отработанного газа).
Жидкие продукты реакции из сепаратора 8', инжектируемые воздухом, подаваемым в реактор 8, частично возвращаются в цикл. Основной поток продуктов реакции охлаждается в теплообменнике 7 и после дросселирования поступает в сепаратор 14 для отделения растворенных газов.
Сырая уксусная кислота по выходе из сепаратора 14 смешивается с уксусной кислотой из скруббера 10 и поступает в колонну азеотропной перегонки 15. Сверху из колонны 15 отводится азео-тропная смесь вгор-бутилацетата — вода совместно с летучими продуктами, поступающая после конденсации в отстойники 16 и 17. Непрореагировавший втор-бутилацетат и летучие продукты из отстойника 17 возвращаются в реактор 8, а водная фаза в колонну 15. Выходящая снизу из колонны 15 уксусная кислота отгоняется в испарителе 18 от присутствующих в небольшом количестве высококипящих примесей и поступает для удаления муравьиной кислоты в ректификационную колонну 19. Муравьиная кислота по возможности используется или сжигается в печи 11.
Окончательная очистки уксусной кислоты производится в ректификационной колонне 21, кубовый остаток которой возвращают в испаритель 18. Часть уксусной кислоты из колонны 19 без окончательной очистки направляют в скруббер 10 для промывки реакционных газов и в реактор 1 для связывания н-бутенов во втор-бутилацетат.
Товарная уксусная кислота содержит 99,7 % основного продукта и очень мало примесей (0,01 % муравьиной кислоты, 0,0003 % ацетальдегида 0,0001 % железа и серы). На 1 т товарной уксусной кислоты расходуется 1,260 т бутан-бутеновой фракции с содержанием 84,4 % н-бутенов. Выход уксусной кислоты за проход составляет 44 % от пропущенных н-бутенов.
Окислением н-бутепов в последние годы в промышленности стали получать малеиновый ангидрид, который раньше получался исключительно окислением бензола. Малеиновый ангидрид широко используется в производстве полимеров, фармацевтических препаратов, присадок, сельскохозяйственных химикатов и т. д.
Окисление осуществляют в газовой фазе на твердом ванадий-фосфорсодержащем катализаторе, промотированном, добавками меди, лития и др.
Выход малеинового ангидрида составляет 55 % (мол.).
1.3.4 Производство уксусной кислоты окислением парафинов С4
-С8
в кислоты
Одним из промышленных методов синтеза низкомолекулярных монокарбоновых кислот с преимущественным выходом уксусной кислоты является метод жидкофазного окисления индивидуальных углеводородов С4
-С8
или их технических смесей под давлением. Впервые промышленное окисление н-бутана в растворе уксусной кислоты осуществлено в США фирмой Celanese.
Окисление проводится в реакторе из нержавеющей стали О2
воздуха в присутствии солей кобальта или марганца. Основной продукт реакции – уксусная кислота, побочные продукты – муравьиная и пропионовая кислоты, метиловый и этиловый спирты, метилэтиленкетон, этилацетат, ацетон. На 1 тону уксусной кислоты расходуется 752-875 кг бутана, причём уксусная кислота составляет 80-90% от всех кислородсодержащих продуктов реакции.
Очевидно, что при использовании бензиновых фракций продукты окисления будут представлены еще более широкой гаммой веществ.
Полное разделение продуктов окисления бензиновых фракций представляет собой сложную задачу из-за наличия ряда бинарных и тройных азеотропов. Однако подавляющее большинство нейтральных кислородсодержащих продуктов образуете водой азеотролы, кипящие нижеТкип
наиболее низкокипящей муравьиной кислоты. Поэтому отделение этой части оксидата от водного раствора кислот реализуется сравнительно легко. Нейтральные кислородсодержащие продукты возвращаются на повторное окисление и превращаются в низкомолекулярные кислоты. По этому принципу в Англии в 1961 г. был реализован процесс получения уксусной кислоты жидкофазным окислением бензиновой фракции С5
—С8
(рисунок 1.4.).
Окисление проводится в реакторе 1 из нержавеющей стали в интервале температур 160—190 °С и при давлении 4,8 МПа без катализатора или в присутствии солей кобальта, меди, магния, ванадия. Воздух подается в нижнюю часть реактора в таком количестве, чтобы содержание кислорода в отдувочном газе составляло не более 4% (об.). Пары продуктов реакции и непрореагировавшие углеводороды поступают совместно с отработанным воздухом в конденсационную систему 2—4, приспособленную для утилизации теплоты. Отсюда жидкий конденсат возвращается в зону реакции. Отработанный воздух поступает в турбодетандер 5, где охлаждается до — 60 °С. Полученный холод используют на установке. Оксидат из реактора поступает в ректификационную колонну 7, в которой отделяются нейтральные кислородсодержащие продукты, возвращаемые на доокисление в реактор 1. На колонне 8 происходит отделение воды и кислот С1
—С4
, а тяжелый кубовый остаток, пройдя блок выделения янтарной кислоты 9, поступает на повторное окисление. Вода от кислот отгоняется с помощью азеотропной перегонки (блок 10). Товарные муравьиная, уксусная и пропионовля кислоты выделяются с применением азеотропной и обычной ректификации (блоки 11—13). Суммарный выход кислот С1
—С3
и янтарной кислоты в расчете па превращенный бензин находится на уровне 100—110%, причем выход уксусной кислоты составляет 60—75% от товарной продукции и зависит от технологии проведения процесса и используемого для окисления сырья.

1 — реактор окисления;2 — котел-утилизатор;3 — водяной холодильник конденсатор;4-воздушный холодильник-конденсатор;5 турбодетандер; 6 — сепараторы;7-колонна отгонки легких продуктов;8 — колонна отделения водно-кислотной фракции;9 — блок выделения янтарной кислоты;10—ректификационный блок осушки; 11 — 13 — ректификационные блоки выделения муравьиной, уксусной и пропионовой кислот;I— фракция углеводородов С5
—С8
; II— воздух; III — вода; IV— вторичный пар;V— отработанный воздух на сжигание;VI— возвратный конденсат;VII— возвратный кубовый продукт;VIII— янтарная кислота;IX—муравьиная кислота; X— уксусная кислота;XI— пропионовая кислота.
Рисунок 1.4. Схема окисления бензина в жидкой фазе в кислоты С1
—С3
1.3.5 Производство уксусной кислоты из метанола и оксида углерода
Производство уксусной кислоты жидкофазным карбонилированием метанола осуществляется при 250°С и 63,7 МПа в присутствии в качестве катализатора карбонила и иодида кобальта:
CH3
OH + CO → CH3
COOH
Побочными продуктами являются пропионовая кислота и более высококипящие продукты, а также оксид и диоксид углерода. На 1 т уксусной кислоты расходуется 0,6 т метанола и 620 м3
оксида углерода. Одновременно получается 20 кг пропионовой кислоты и 20 кг высококипящих продуктов.
Синтез уксусной кислоты из метанола впервые был разработан и осуществлен в промышленном масштабе фирмой ВАSF.

1 — колонна синтеза;2 — сепаратор высокого давления;3 — сепаратор низкого давления;4, 5 и 6—ректификационные колонны;
I— метанол + катализатор; II— окись углерода;II— продукты синтеза;IV — отработанный газ; V— раствор катализатора;VI— метанол;VII— кислота-сырец;VIII— товарная уксусная кислота;IX— кубовый остаток на сжигание.
Рисунок 1.5 Технологическая схема синтеза уксусной кислоты карбонилированием метанола
На рисунке 5 приведена технологическая схема синтеза уксусной кислоты из метанола, освоенная в промышленном масштабе фирмой ВАSF в Людвигс-хафене. Процесс проводят с применением каталитической системы кобальт + иод. Раствор катализатора в метаноле поступает в верх колонны синтеза 1, а снизу подается окись углерода.
Синтез осуществляется при 250 °С и 70—75 МПа. Реакционная смесь из колонны синтеза поступает вначале в сепаратор высокого давления 2, а затем — в сепаратор низкого давления 3. Непрореагировавшая окись углерода из сепаратора 3 снова возвращается в процесс. Жидкие продукты далее отделяются на колонне 4 от катализатора и подаются на ректификационную колонну 5. Раствор катализатора возвращается в колонну синтеза. С верха колонны 5 отбирается непрореагировавший метанол, а кислота-сырец подастся в колонну б, где выделяется товарная уксусная кислота. Кубовый остаток колонны 6 периодически отводится на сжигание.
Выход уксусной кислоты составляет 90% в расчете на метанол
2. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
2.1 Химизм процесса
Синтез уксусной кислоты из метанола впервые был разработан и осуществлен в промышленном масштабе фирмой ВАSF. Предполагается, что при синтезе кислот из спиртов первоначально происходит расщепление связи углерод — кислород с образованием галогеналкила:
RСН2
ОН+НХ →RСН2
Х+ Н2
О
Галогеналкил далее взаимодействует с гпдрокарбоннлом металла с образованием алкилкарбонилов, ацилкарбоннлов и кислот
RCН2
Х+НМе (СО)4
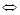 RCН2
Ме (СО)4
+НХ RCН2
Ме (СО)4
+НХ
RCН2
Ме(СО)4
→ RCН2
СОМе(СО)3
+СО (-СО) → RCН2
СОМе(СО)4
RCН2
СОМе(СО)3,4
+Н2
О→RCН2
СООН +НМе(СО)3,4
Гидрокарбонил металла получается по уравнению:
Ме2
(СО)8
+СО+Н2
О→2НМе(СО)4
+СО2
По-видимому, промотирующес влияние галогеноводородных кислот объясняется образованием в их присутствии галогензамещенных гидрокарбоннлов металла
НХ + Ме(СО)4
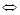 НМе(СО)2
Х +2СО НМе(СО)2
Х +2СО
которые обладают большей кислотностью п каталитической активностью по сравнению с незамещенными гидрокарбониламн.
Реакцию карбонилирования спиртов могут катализировать как кислые (фосфорная и серная кислоты, смесь трехфтористого бора с водой), так и щелочные (алкоголяты щелочных металлов) агенты.
Однако наиболее эффективными катализаторами являются соединения никеля, кобальта, железа, родия, рутения и палладия. Эти элементы вводятся в реакционную зону в виде карбонилов, галогенидов или комплексных солей.
В качестве промоторов используются иод, йодистый метил, иодистоводородная кислота.
Особенно эффективны катализаторы на основе родия, промотированного иодом. В их присутствии синтез уксусной кислоты из метанола успешно протекает при сравнительно низких давлениях (3 МПа и ниже), причем достигается практически количественный выход уксусной кислоты (~99%). Катализатор может быть использован многократно.
2.2 Описание технологической схемы
Процесс получения уксусной кислоты включает следующие основные стадии: синтез уксусной кислоты; улавливание легких фракций; очистку уксусной кислоты; приготовление и регенерацию катализатора. Схема потоков стадий синтеза и отгонки легких фракций приведена на рисунке 2.2.

1 — оксид углерода; 2 — метанол; 3 — дистиллят;4 — кубовые остатки;5, 7, 9 — отдувочные газы;6, 8, 10 — жидкая фаза;
РТ1 — реактор; АТ1, АТ2 — подогреватели; АТ3 — холодильник конденсатор; С1, С2, СЗ — сепараторы; КЛ1 — колонна отгонки легких фракций
Рисунок 2.1 Схема потоков стадия синтеза уксусной кислоты
В реактор синтеза барботажного типа РТ1, снабженный перемешивающим устройством, насосом из сборника подают метанол, который предварительно нагревают водяным паром от 40 до 140—180°С в подогревателе АТ1. Оксид углерода поступает в реактор через барботажиое кольцо, в результате чего образуется дисперсная фаза, способствующая быстрому растворению газа в реакционной смеси. Время пребывания веществ в реакционной зоне (0,25—0,30 ч) регулируют уровнем жидкости в реакторе (75—80% от его вместимости), а полноту процесса синтеза при давлении 2,8 МПа и температуре 185°С — тщательным перемешиванием всех потоков, поступающих в реактор, с помощью мешалки.
Реакционная жидкость (уксусная кислота и раствор катализатора с промотором) из реактора РТ1 поступает в сепаратор С2, где за счет снижения давления до 62 кПа происходит частичное испарение жидкости и снижение температуры до 116°С. Здесь же происходит отделение пара от жидкости. Жидкость, содержащую катализатор, из нижней части сепаратора С2 возвращают в реактор РТ1, а пары, выходящие из верхней части сепаратора, поступают в колонку отгонки легких фракций КЛ1. Эти пары содержат уксусную кислоту, метилиодид, иодоводород, воду и незначительные количества метанола, метилацетата, несконденсировавшихся газов.
Из верхней части колонны КЛ1 отбирают метилиодид с парами воды и уксусной кислоты, конденсируют в холодильнике-конденсаторе и разделяют в сепараторе СЗ на две фазы: тяжелую и легкую. Тяжелую фазу, содержащую в основном метилиодид, возвращают в реактор РТ1; часть легкой фазы используют в качестве флегмы для орошения колонны КЛ1, а часть возвращают в реактор синтеза.
Из куба колонны КЛ1 выводят тяжелую фазу, состоящую из метилиодида и уксусной кислоты; этот поток самотеком поступает в сепаратор С2 и таким образом иодоводород и родий возвращают в цикл.
Сырую уксусную кислоту отбирают из средней части колонны легких фракций КЛ1 и направляют на стадию очистки.
Из верхней части реактора синтеза РТ1 выводят отдувочные газы, содержащие пары метилиодида, уксусной кислоты и воды. После охлаждения в холодильнике-конденсаторе АТЗ газовую фазу отделяют от жидкой в сепараторе С1, после чего жидкость возвращают в реактор синтеза, а газ направляют на очистку.
2.3 Технико-технологические расчёты
2.3.1 Материальный баланс реактора и стадии синтеза уксусной кислоты
Исходные данные:
годовая производительность агрегата в расчете на 100%-ю. уксусную кислоту 120000 т; годовой фонд рабочего времени 8450 ч; состав материальных потоков:
технический оксид углерода — поток 1 (т, %): Н2
— 1; N2
— 2,0; СО — 97,0;
метанол — поток 2 (ф, %): СН3
ОН — 99,9; Н2
О —0,1;
дистиллят колонны отгонки легких фракций — поток 3 (w, %): СН3
I —48,9; СН3
СООН — 22,4; СН3
СООСН3
— 4,0; Н2
О — 24,7;
кубовые остатки колонны отгонки легких фракций — поток 4 (w, %); СН3
СООН — 90,3; С2
Н5
СООН —0,1; Н2
О — 7,7; НI — 1,9;
отдувочные газы реактора — поток 5 (φ, %): Н2
— 5,2; N2
— 4,2; СО —30,1; СО2
— 2,7; СН3
I — 26,0; СН3
СООН — 11,2; СН3
СООСН3
— 1,1; Н2
О — 19,5;
жидкая фаза из реактора — поток 6 (w, %): СН3
I — 9,7;СНзСООН — 70,0; СН3
СООСН3
— 0,9; С2
Н5
СООН — 0,1; Н2
О— 16,3; HI — 3,0;
отдувочные газы сепаратора СI — поток 7 (φ, %): Н2
— 12,0; N2 —9,7; СО —68,8; СО2
— 4,9; СН3
I — 4,1; СН3
СООН —0,1; СН3
СООСН3
—0,1; Н2
О 0,3;
количество пропионовой кислоты, образующейся в процессе, 1 кг на 1 т уксусной кислоты;
избыток оксида углерода от стехиометрического расхода 16,4%.
Последовательность расчета:
а) рассчитывают расход сырья и количество продуктов по реакциям получения уксусной кислоты и побочных продуктов;
б) определяют состав материальных потоков 1 — 4 и состав реакционной массы;
в) рассчитывают состав отдувочных газов реактора синтеза, газовой и жидкой фаз сепаратора C1;
г) определяют состав жидкой фазы из реактора, газовой и жидкой фаз сепаратора C2;
д) составляют материальный баланс реактора и стадии синтеза уксусной кислоты.
Часовая производительность реактора по 100%-и уксусной кислоте:
120000*1000/8450=14201,2 кг/ч или 236,687 кмоль/ч
В соответствии с исходными данными образуется пропионовой кислоты:
1*14,2=14,2 кг/ч или 0,192 кмоль/ч
По реакциям
СН3
ОН+СО = СН3
СООН, (1)
СН3
ОН+2СО + 2Н2
= С2
Н5
СООН + Н2
0 (2)
расходуется:
метанола: 236,687 + 0,192=236,879 кмоль/ч или 7580,1 кг/ч;
оксида углерода: 236,687+ 0,192*2 = 237,071 кмоль/ч или 6638,0 кг/ч;
водорода: 0,192*2=0,384 кмоль/ч или 0,8 кг/ч;
образуется водяного пара 0,192 кмоль/ч или 3,5 кг/ч.
По реакции
СО + Н2
О = СО2
+Н2
(3)
расходуется 1,85% от общего расхода оксида углерода, что составляет:
237,071 *1,85/(100,00 — 1,85) =4,468 кмоль/ч или 125,1 кг/ч.
Расходуется водяного пара: 4,468 кмоль/ч или 80,4 кг/ч;
образуется
диоксида углерода: 4,468 кмоль/ч или 196,6 кг/ч;
водорода: 4,468 кмоль/ч или 8,9 кг/ч.
Всего расходуется по реакциям (1)—(3)
оксида углерода: 237,071+4,468=241,539 кмоль/ч или 6763,1 кг/ч;
водяного пара: 4,468—0,192=4,276 кмоль/ч или 77,0 кг/ч;
образуется водорода: 4,468—0,384=4,084 кмоль/ч или 8,2 кг/ч.
Фактически подают сырья:
технического метанола: 7580,1*100,0/99,9=7587,7 кг/ч, в том числе воды:
7587,7—7580,1=7,6 кг/ч;
оксида углерода:
241,539* (100+16,4)/100=281,151 кмоль/ч или 7872,2 кг/ч,
где 16,4 — избыток оксида углерода от стехиометрического расхода, %.
Рассчитывают состав технического оксида углерода (поток 1):
H2
N2
CO Сумма
φi(xi), % 1,0 2,0 97,0 100,0
nτ, кмоль/ч2,898 5,797 281,151 289,846
М, кг/кмоль2 28 28 -
mτ,кг/ч 5,796 162,316 7872,2 8040,312
Остается оксида углерода в реакционной массе:
281,151—241,539=39,612 кмоль/ч или 1109,1 кг/ч.
Расходуется:
дистиллята колонны отгонки легких фракций:
14201,2*1,8= = 25562,2 кг/ч;
кубовых остатков
14201,2*0,0665=944, 4 кг/ч;
где 1,8 и 0,0665 — массовые отношения подаваемых на синтез продуктов очистки уксусной кислоты и 100%-и уксусной кислоты.
Определяют расход и состав потоков 3 и 4.
Наличие метилацетата в дистилляте колонны отгонки легких фракций объясняется тем, что, хотя на стадии синтеза он практически не образуется, на последующих стадиях вследствие протекания реакций
СН3
ОН + СН3
СООН = СН3
СООСН3
+Н2
О (4)
СН3
СООСН3
+ HI = СН3
СООН + СН3
I (5)
метилацетат накапливается в системе, так как реакция 5 протекает медленнее реакции 4.
Рассчитывают состав дистиллята (поток 3):
CH3
ICH3
COOHCH3
COOCH3
H2
OСумма
wi,% 48,09 22,4 4,0 24,7 100,0
mτ, кг/ч 12499,9 5725,9 1022,5 6313,9 25562,2
Рассчитывают состав кубовых остатков (поток 4):
CH3
COOH C2
H5
C00H H2
O HI Сумма
wi,% 90,3 0,1 7,7 1,9 100,0
mτ, кг/ч 852,8 0,9 72,7 17,9 944,4
Состава реакционной массы Таблица 4
| mτ,кг/ч |
| H2
|
5,796+8,2=13,996 |
| N2
|
162,316 |
| CO |
1109,1 |
| CO2
|
196,6 |
| CH3
I |
12499,9 |
| CH3
COOH |
14201,2+5725,9+852,8=20779,9 |
| CH3
COOCH3
|
1022,5 |
| C2
H5
COOH |
0,9+14,2=15,1 |
| H2
O |
7,6+6313,9+72,7-77,0=6317,2 |
| HI |
17,9 |
| Сумма |
42134,512 |
Молярный поток отдувочных газов реактора синтеза:
39,612*89,0/30,1 = 117,125 кмоль/ч,
Где39,612 — количество оксида углерода в реакционной массе, кмоль/ч; 89,0 — степень отдувкн оксида углерода, %; 30,1—объемная доля оксида углерода в отдувочных газах, %.
Состав отдувочных газов реактора (поток 5) Таблица 5
| φi,% |
nτ,кмоль/ч |
Мi,кг/кмоль |
mτ,кг/ч |
| H2
|
5,2 |
6,091 |
2 |
12,2 |
| N2
|
4,2 |
4,919 |
28 |
137,7 |
| CO |
30,1 |
35,255 |
28 |
987,1 |
| CO2
|
2,7 |
3,162 |
44 |
139,1 |
| CH3
I |
26,0 |
30,453 |
142 |
4324,3 |
| CH3
COOH |
11,2 |
13,118 |
60 |
787,1 |
| CH3
COOCH3
|
1,1 |
1,288 |
74 |
95,3 |
| H2
O |
19,5 |
22,839 |
18 |
411,1 |
| Сумма |
100,0 |
117,125 |
- |
6893,9 |
Определяют молярный поток отдувочных газов из сепаратора С1:
35,255*98,5/68,8=50,474 кмоль/ч,
где 98,5 — степень отдувки оксида углерода, %;
68,8 — объемная доля оксида углерода в отдувочных газах из сепаратора С1, %.
Состав отдувочных газов сепаратора С1 (поток 7) Таблица 6
| φi,% |
nτ, кмоль/ч |
mτ, кг/ч |
| H2
|
12,0 |
6,057 |
12,1 |
| N2
|
9,7 |
4,896 |
137,1 |
| CO |
68,8 |
34,726 |
972,3 |
| CO2
|
4,9 |
2,473 |
108,8 |
| CH3
I |
4,1 |
2,069 |
293,8 |
| CH3
COOH |
0,1 |
0,050 |
3,0 |
| CH3
COOCH3
|
0,1 |
0,050 |
3,7 |
| H2
O |
0,3 |
0,151 |
2,7 |
| Сумма |
100,0 |
50,474 |
1533,5 |
Учитывая составы потоков 5 и 7, рассчитывают состав жидкой фазы сепаратора С1 (поток 10), mτ
,кг/ч:
H2
- 0,1 ;N2
- 0,6; СО - 14,8;С02
- 30,3;СН3
I -4030,5;CH3
COOH – 784,1; СН3
СООСН3
-91,6; Н2
О - 408,4; что в сумме составляет 5360,4 кг/ч.
В реактор подают:
7587,7 кг/ч метанола (поток 2), 8040,312 кг/ч технического оксида углерода (поток 1), 25562,2 кг/ч дистиллята (поток 3). Всего поступает в реактор 41190,212 кг/ч.
Уходит из сепаратора С1: 1533,5 кг/ч отдувочного газа (поток 7), 41190,212—1533,5=39656,712 кг/ч жидкой фазы.
Время пребывания веществ в реакторе составляет 15— 18 мин, следовательно, количество жидкой фазы, отбираемой из реактора с целью обеспечения максимальной степени конверсии метанола (с растворенными в ней газами), составляет:
39656,712*60/18=132189,04 кг/ч.
Учитывая количество газов в реакционной массе и в отдувочных газах сепаратора С1 (поток 7), рассчитывают количество газов, растворенных в жидкой фазе, mτ, кг/ч:
Н2
- 1,896; N2
-25,216; СО-136,8; СО2
– 87,8; что в сумме составляет – 251,712 кг/ч
Отбирают из реактора жидкой фазы:
132189,04 – 251,712=131937,328 кг/ч
Рассчитывают состав жидкой фазы из реактора (поток 6) Таблица 7
| CH3
I |
CH3
COOH |
CH3
C00CH3 |
C2
H5
COOH |
H2
0 |
HI |
Сумма |
| wi,% |
9,7 |
70,0 |
0,9 |
0,1 |
16,3 |
3,0 |
100,0 |
| mτ,кг/ч |
12797,9 |
92356,1 |
1187,4 |
131,9 |
21505,8 |
3958,1 |
131937,328 |
В сепаратор С2 подают также кубовые остатки (поток 4) в количестве 944,4 кг/ч. Жидкую фазу из реактора дросселируют и разделяют в сепараторе С2. В отдувочные газы на выходе из сепаратора переходит 251,712 кг/ч всех растворенных газов, 17,9 кг/ч иодоводорода из кубовых остатков (см. состав потока 4), 15,1 кг/ч прошюповой кислоты (см. состав реакционной массы), что в сумме составляет 284,712 кг/ч.
Учитывая состав реакционной массы и отдувочных газов сепаратора С1(поток 7),рассчитывают количество остальных компонентов отдувочных газов (поток 9),mτ
,кг/ч:
Н2
-1,896;N2
- 25,216; СО - 136,8; СО2
– 87,8; СН3
I – 12206,1;
СH3
СООН – 20776,9; СН3
СООСН3
– 1018,8; С2
Н5
СООН – 15,1;Н2
0 – 6314,5; HI - 17,9;что в сумме составляет 40601,012 кг/ч.
Учитывая составы потоков 4, 6 и 9, рассчитывают состав жидкой фазы сепаратора С2 (поток 8) кг/ч:
CH3
I – 591,8; СН3
СООН – 72432,0; СН3
СООСН3
– 168,6; С2
Н5
СООН – 117,7; Н2
О - 15264,0; НI - 3958,1; что в сумме составляет 92532,2 кг/ч.
Материальный баланс реактора Таблица 8
| Входит |
кг/ч |
кг/с |
% |
Выходит |
кг/ч |
кг/с |
% |
| Метанол |
Отдувочные газы: |
| CH3
OH |
7587,7 |
99,9 |
H2
|
12,2 |
0,19 |
| H2
O |
7,6 |
0,1 |
N2
|
137,7 |
2,12 |
| Итого… |
7595,3 |
2,110 |
100,0 |
CO |
987,1 |
15,23 |
| Техн.оксид углерода |
CO2
|
139,1 |
2,15 |
| CO |
7872,2 |
97,91 |
CH3
I |
4324,3 |
66,70 |
| H2
|
5,796 |
0,07 |
CH3
COOH |
787,1 |
12,14 |
| N2
|
162,316 |
2,02 |
CH3
COOCH3
|
95,3 |
1,47 |
| Итого… |
8040,312 |
2,233 |
100,0 |
H2
O |
411,1 |
См.* |
| Дистиллят: |
Итого… |
6893,9 |
1,915 |
100,00 |
| CH3
I |
12499,9 |
48,9 |
Жидкая фаза: |
| CH3
COOH |
5725,9 |
22,4 |
H2
|
1,896 |
- |
| CH3
COOCH3
|
1022,5 |
4,0 |
N2
|
25,216 |
0,02 |
| H2
O |
613,9 |
24,7 |
CO |
136,8 |
0,10 |
| Итого… |
25562,2 |
7,101 |
100,0 |
CO2
|
87,8 |
0,07 |
| Ж.ф. из сепаратора С1: |
CH3
I |
12797,9 |
9,68 |
| N2
|
0,6 |
- |
CH3
COOH |
92356,1 |
69,87 |
| CO |
14,8 |
0,28 |
CH3
COOCH3
|
1187,4 |
0,90 |
| CO2
|
30,3 |
0,57 |
C2
H5
COOH |
131,9 |
0,10 |
| CH3
I |
4030,5 |
75,19 |
H2
O |
21505,8 |
16,27 |
| CH3
COOH |
784,1 |
14,63 |
HI |
3958,1 |
2,99 |
| CH3
COOCH3
|
91,6 |
1,71 |
Итого… |
132189,04 |
34,721 |
100,00 |
| H2
O |
408,4 |
7,62 |
| Итого… |
5360,4 |
1,489 |
100,00 |
| Ж.ф. из сепаратора С2: |
| CH3
I |
591,8 |
0,64 |
| CH3
COOH |
72432,0 |
78,28 |
| CH3
COOCH3
|
168,6 |
0,18 |
| C2
H5
COOH |
117,7 |
0,13 |
| H2
O |
15264,0 |
16,49 |
| HI |
3958,1 |
4,28 |
| Итого… |
92532,2 |
25,703 |
100,00 |
| Всего… |
139090,412 |
36,636 |
- |
Всего… |
139090,412 |
36,636 |
Материальный баланс стадии синтеза Таблица 9
| Входит |
кг/ч |
Выходит |
кг/ч |
| Метанол: |
Отдувочные газы из сепаратора С1: |
| CH3
OH |
7587,7 |
H2
|
12,1 |
| H2
O |
7,6 |
N2
|
137,1 |
| Итого… |
7595,3 |
CO |
972,3 |
| Технический оксид углерода: |
CO2
|
108,8 |
| CO |
7872,2 |
CH3
I |
293,8 |
| H2
|
5,796 |
CH3
COOH |
3,0 |
| N2
|
162,316 |
CH3
COOCH3
|
3,7 |
| Итого… |
8040,312 |
H2
O |
2,7 |
| Дистиллят: |
Итого… |
1533,5 |
| CH3
I |
12499,9 |
Отдувочные газы из сепаратора С2: |
| CH3
COOH |
5725,9 |
H2
|
1,896 |
| CH3
COOCH3
|
1022,5 |
N2
|
25,216 |
| H2
O |
613,9 |
CO |
136,8 |
| Итого… |
25562,2 |
CO2
|
87,8 |
| Кубовые остатки: |
HI |
17,9 |
| CH3
COOH |
852,8 |
CH3
I |
12206,1 |
| C2
H5
COOH |
0,9 |
CH3
COOH |
20776,9 |
| H2
O |
72,7 |
CH3
COOCH3
|
1018,8 |
| HI |
17,9 |
C2
H5
COOH |
15,1 |
| Итого… |
944,4 |
H2
O |
6314,5 |
| Всего… |
42134,512 |
Итого… |
40601,012 |
| Всего… 42134,512 |
Расчёт основных расходных коэффициентов
Расходные коэффициенты:
по метанолу техническому: 7595,3/14201,2=0,535 кг/кг
по оксиду углерода: 8040,312/14201,2=0,566 кг/кг
ЗАКЛЮЧЕНИЕ
В курсовой работе разработана технология производства уксусной кислоты из метанола и оксида углерода. Проведён обзор типового и современного технологического оборудования, который был подобран по стандартам, проведены проверочные, точные расчёты. Рассчитан и составлен материальный баланс реактора и стадии синтеза уксусной кислоты.
|