1.
Стехиометрические законы. Закон кратных отношений. Закон постоянства состава
Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами. Исключительное значение для развития химии имело установление основных стехиометрических законов.
Закон кратных отношений
(Д. Дальтон)
: Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах; их составы N2
O, NO, N2
O3
, NO2
, N2
O5
.Закон постоянства состава вещества (Ж. Л. Пруст, 1808 г.).
Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Например, воду можно получить по любой из следующих реакций:
2Н2+О2=2Н2О
Са(ОН)2=СаО+Н2О
CuSO4•5Н2О=CuSO4+5Н2О
Химически чистая вода содержит 11,19% водорода и 88,81% кислорода, независимо от способа ее получения, то есть на один атом кислорода приходится два атома водорода. Иной состав свидетельствует либо о наличии примесей, либо о том, что это другое вещество (например, Н2О2). Ж. Пруст писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании».В этой формулировке закона, как и в приведенном выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
2. Строение внешнего электронного уровня атома калия и кальция. 1 правило Клечковского. Строение внешнего электронного уровня атома скандия. 2правило Клечковского
У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого.Первое и второе правила Клечковского часто не разделяют, а считают одним совместным правилом правила Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главного * и орбитального * квантовых чисел (n+l) к орбиталям с большим значением этой суммы
. Следовательно, 4s-подуровень (n
+l
=4) должен заполняться раньше, чем 3d (n+l
=5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+l
для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым. Первое и второе правила Клечковского часто не разделяют, а считают одним совместным правилом правилом Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n
. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2
np6
.
3. Скорость химических реакций. Факторы, влияющие на скорость. Влияние катализаторов на скорость протекания реакции
Скорость химической реакции определяется как изменение молярной концентрации одного из реагирующих веществ за единицу времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:
A + B → C + D
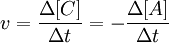 . .
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Для элементарных реакций показатель степени при значении концентрации каждого вещества равен его стехиометрическому коэффициенту, для более сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ,
· наличие катализатора,
· температура (правило Вант-Гоффа),
· площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C , то мы заметим, что мгновенная
скорость химической реакции величина непостоянная.
Зависимость скорости химической реакции от катализаторов. Катализ – явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции); отрицательный катализ называют ингибированием
, а вещества, уменьшающие скорость химической реакции, – ингибиторами
.
4. Вода как растворитель. Свойства воды
Как известно, жизнь зародилась в воде и по-прежнему остается тесно связанной с водой. Поэтому физико-химические свойства воды имеют фундаментальное значение для процессов жизнедеятельности.
Вода и метан
Уникальные свойства воды H2
O становятся очевидными при сравнении с метаном (CH4
). Обе молекулы одинаковы по массе и размерам. Тем не менее температура кипения воды на 250о
С выше по сравнению с температурой кипения метана. В результате вода на поверхности Земли находится в жидком, а метан — в газообразном состоянии. Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды. Молекула воды имеет форму тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра заняты свободными электронными парами атома кислорода (зеленого цвета), а остальные две — атомами водорода. Поэтому связи H—О—H расположены под углом друг к другу. Кроме того, из-за высокой электроотрицательности атома кислорода связь О—H полярна (см. с. 14). Атомы водорода несут частичный положительный заряд около +0,4, а атом кислорода — частичный отрицательный заряд около -0,6, т. е, молекула воды представляет собой электрический диполь. Поэтому каждая молекула воды, подобно маленькому магниту, притягивает к себе за счет образования водородных мостиков (Б) еще четыре молекулы. При испарении воды разрушение зтих многочисленных водородных связей требует больших затрат энергии. Молекулы метана неполярны, не являются диполями и относительно слабо взаимодействуют друг с другом. Вследствие этого жидкий метан испаряется при очень низких температурах.
Структура воды и льда
Биполярное строение молекул воды благоприятствует образованиюводородных связей.При этом каждая молекула проявляет свойства как донора, так и акцептора водорода. Поэтому у воды в жидком состоянии многие молекулы связаны между собой водородными «мостиками» (связями). причем образующиеся ассоциаты находятся в динамическом равновесии. Часто образуются тетраэдрические структуры, так называемые "кластеры" воды. При понижении температуры доля кластеров возрастает вплоть до начала кристаллизации. При нормальном атмосферном давлении вода кристаллизуется при 0o
C. при этом большинство молекул воды оказываются встроенными в гексагональную решетку . Поскольку в твердом состоянии расстояние между молекулами в среднем больше, чем в жидкости, плотность льда меньше по сравнению с плотностью воды. Это свойство воды очень важно в экологическом отношении хотя бы потому, что зимой на поверхности водоемов образуется слой льда и они редко промерзают до дна.
Гидратация
В отличие от большинства других жидкостей вода является идеальнымрастворителем для диссоциирующих веществ.В электрическом поле того или иного иона молекулы воды образуют регулярные структуры в соответствии с зарядом иона. Эта гидратная оболочка экранирует ион от ионов противоположного заряда. Вода имеет высокую константу диэлектрической проницаемости (78), т.е. в воде электростатическое притяжение двух противоположно заряженных ионов снижается примерно в 80 раз (1/78). Молекулы воды, находящиеся во внутренней сфере непосредственно около иона, практически иммобилизованы (привязаны к этому иону) и перемещаются вместе с центральным ионом. Хорошо растворимы в воде и нейтральные соединения с несколькими гидроксильными группами, такие, как глицерин или сахара, поскольку они способны образовывать водородные связи с молекулами растворителя.
5. Возникновение тока в гальваническом элементе. Электродвижущая сила. Преимущества и недостатки гальванических элементов
Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент
.
Возникновение электрического тока гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается глубокими химическими превращениями, протекающими на электродах. Покажем это на примере работы медно - цинкового элемента.
На цинковом электроде, опущенном в раствор сульфата цинка, происходит окисление атомов цинка в ионы (растворение цинка):
Zn - 2e = Zn2+
электроны при этом поступают во внешнюю цепь. На медном электроде, погруженном в раствор сульфата меди, происходит восстановление ионов металла в атомы:
Cu2+
+ 2e = Cu
Одновременно часть ионов SO4
2-
переходит через “электролитический мостик” в сосуд с раствором сульфата цинка,
Суммарное уравнение процесса получим:
Zn - 2e = Zn2
+
анодный процесс
Cu2+
+ 2e = Cuкатодный процесс
Zn + Cu2+
= Zn2+
+ Cu суммарный процесс
Электрод, на котором протекает процесс окисления, называется анодом
(в нашем случае цинковый),а электрод, на котором протекает процесс восстановления -
катодом
(медный). Гальванический элемент можно записать в виде краткой электрохимической схемы:
(-) Zn | Zn2+
|| Cu2+
| Cu (+)в ионном виде или
(-) Zn / ZnSO4
//CuSO4
/ Cu (+) в молекулярном
Обычно анод записывается слева, а катод - справа.
Необходимым условием работы гальванического элемента возникновение разности потенциалов на его электродах.
При вычислении напряжения гальванического элемента принято потенциал с меньшей алгебраической величиной вычитать из потенциала с большей алгебраической величиной; другими словами, из потенциала положительного полюса (катода) вычитать потенциал отрицательного (анода)
x = jo
катод
- jo
анод
Напряжение медно - цинкового гальванического элемента определяется
x = j o
Cu /Cu
2+ - jo
Zn/Zn
2+= (+0,34) - ( - 0,76 ) = +1,10 в
Положительный знак напряжения определяет направление самопроизвольного протекания реакции слева направо. Как известно, движущей силой химической реакции является убыль энергии Гиббса. Для реакций, осуществляемых в условиях гальванического элемента, работа, производимая системой, равна работе электрического тока:
A = IUt = QU
где I - ток в цепи;
U - падение напряжения;
t - время;
Q- количество электричества
В случае, если реакция протекает обратимо в равновесных условиях, U = E (напряжение элемента равно напряжению на электродах при токе равном нулю) и работа будет максимальная:
Amax
= QE
Для одного моля вещества, вступающего в реакцию, Q = nF, где n - число электронов, принимаемых или отдаваемых веществом; F = 96500 Кл/моль, число Фарадея, это количество электричества, необходимое для выделения 1 моль вещества. С учетом этого можно записать:
DG = Amax
= nF x
В стандартных условиях:
DG = - nF x .
Взаимосвязь между напряжением гальванического элемента и значением DG дает возможность непосредственно определить величину DG.
Для медно - цинкового элемента
Amax
= -DG298
o
+ 2*96500*1,1 = 212300 Дж = 212,3 кДж
Это значение DG совпадает с измеренной стандартной энтальпией для этой реакции, равной -212,3 кДж. Большое влияние на величину электродного потенциала оказывает концентрация катионов, одноименных с металлом электрода. Электродный потенциал с учетом этого влияния вычисляется по формуле Нернста:
j = jo
+( RT/nF) lnC
где j0
- нормальный потенциал металла, В;
n - его валентность (ряд иона металла);
C - концентрация катионов этого же металла в моль /л;
Для газообразных веществ под знаком логарифма вместо Ci
входят парциальные давления соответствующих веществ. Учитывая, что обычно гальванические элементы работают при стандартных условиях, уравнение Нернста можно записать:
j = j o
+ (0,059/n )lg C
Электродвижущая сила
(ЭДС) — физическая величина, характеризующая работу сторонних (непотенциальных) сил в источниках постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль контура.
ЭДС можно выразить через напряжённость электрического поля сторонних сил (Eex
). В замкнутом контуре (L
) тогда ЭДС будет равна:
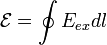 , ,
где dl
— элемент длины контура.
ЭДС, так же как и напряжение, измеряется в вольтах.
Гальванические элементы как источники электрической энергии обладают существенными преимуществами: они могут быть различных размеров и форм, не имеют макроскопически подвижных, подверженных износу частей, относительно легки и автономны, мало чувствительны к вибрации и колебаниям температуры, работают бесшумно, хорошо регулируются. Их КПД довольно высок (до 90%), так как превращение химической энергии в электрическую совершается в них без промежуточной тепловой стадии, а электродные процессы в некоторых случаях близки к обратимым.
Существенным недостатком гальванических элементов является саморазряд - расходование ими электрохимически активных веществ при отсутствии внешнего тока. Причиной этого может быть- например, растворение металла электродов вследствие образования tax называемых локальных элементов, или протекание процесса, генерирующего ток, "непосредственным химическим" путем, или же недостаточная изолирующая способность диэлектрических деталей элемента. Саморазряд уменьшает срок службы элемента, последний со временем становится непригодным, даже если он вообще не использовался для получения энергии.
6. Процесс производства аминокислот
Аминокислоты
(аминокарбоновые кислоты
) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
1. Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы -COOH, так и основные свойства, обусловленные аминогруппой -NH2
. Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3
+
, а карбоксигруппа — в виде -COO-
. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
2. Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66.
3. Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
4. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Получение
 . получают галогенированием карбоновых к-т или эфиров в
. получают галогенированием карбоновых к-т или эфиров в -положение с послед. заменой галогена на аминогруппу при обработке амином, аммиаком или фталимидом калия (по Габриелю). -положение с послед. заменой галогена на аминогруппу при обработке амином, аммиаком или фталимидом калия (по Габриелю).
По Штреккеру - Зелинскому . получают из альдегидов: . получают из альдегидов:
Этот метод позволяет также получать нитрилы и амиды соответствующих . .
В этой р-ции вместо альдегидов м. б. использованы кетоны, а вместо диалкилфосфитов - диалкилтиофосфиты, кислые эфиры алкил(арил)фосфонистых к-т RP(OH)OR и диарилфосфиноксиды Аr2
НРО. Таким путем получен широкий набор комплексонов.
Альдегиды и кетоны или их более активные производные - кетзли служат исходными соед. для синтеза А. с увеличением числа углеродных атомов на две единицы. А. с увеличением числа углеродных атомов на две единицы.
Удобные предшественники .-аминомалоновый эфир и нитроуксусный эфир. К их .-аминомалоновый эфир и нитроуксусный эфир. К их углеродным атомам можно предварительно ввести желаемые радикалы методами алкилирования или конденсации. углеродным атомам можно предварительно ввести желаемые радикалы методами алкилирования или конденсации. Кетокислоты превращ. в Кетокислоты превращ. в . гидрированием в присут. NH3
или гидрированием их оксимов или гидразонов. . гидрированием в присут. NH3
или гидрированием их оксимов или гидразонов.
Нек-рые L А. ввиду сложности синтеза и разделения оптич. изомеров получают микробиол. способом (лизин, триптофан, треонин) или выделяют из гидролизатов прир. белковых продуктов (пролин, цистин, аргинин, гистидин). А. ввиду сложности синтеза и разделения оптич. изомеров получают микробиол. способом (лизин, триптофан, треонин) или выделяют из гидролизатов прир. белковых продуктов (пролин, цистин, аргинин, гистидин).
 Аминосульфоновые к-ты получают при обработке аммиаком продуктов присоединения NaHSO3
к альдегидам: Аминосульфоновые к-ты получают при обработке аммиаком продуктов присоединения NaHSO3
к альдегидам:
 . синтезируют присоединением NH3
или аминов к . синтезируют присоединением NH3
или аминов к ненасыщенным к-там, а также по методу Родионова - конденсацией альдегидов с малоновой к-той в присут. NH3
: ненасыщенным к-там, а также по методу Родионова - конденсацией альдегидов с малоновой к-той в присут. NH3
:
 . получают гидролизом соответствующих лактамов (напр., . получают гидролизом соответствующих лактамов (напр., капролактама), к-рые образуются в результате перегруппировки Бекмана из оксимов циклич. кетонов под действием H2
SO4
. капролактама), к-рые образуются в результате перегруппировки Бекмана из оксимов циклич. кетонов под действием H2
SO4
. Аминоэнантовую, Аминоэнантовую, аминопеларгоновую и аминопеларгоновую и аминоундекановую к-ты синтезируют из аминоундекановую к-ты синтезируют из тетрахлоралканов путем их гидролиза конц. H2
SO4
до тетрахлоралканов путем их гидролиза конц. H2
SO4
до хлоралкановых к-т с послед. аммонолизом: хлоралкановых к-т с послед. аммонолизом:
Литература
1. Гринштейн Дж., Виниц М., Химия аминокислот и пептидов, пер. с англ., [М.], 1965
2. Общая и неорганическая химия. Т.1. Теоретические основы химии: Учебник для вузов в 2 томах. Под ред. А.Ф. Воробьева. – М.: ИКЦ "Академкнига", 2004. – 371 с.: ил.
3. Цивадзе А.Ю., Воробьев А.Ф., Савинкина Е.В. и др. Неорганическая химия. 1 и 2 часть. - М., "Наука", 2004.
4. http://www.xumuk.ru/
|