Муниципальное общеобразовательное учреждение
«Основная общеобразовательная школа №10»
Определение диаметра молекул
Лабораторная работа
Исполнитель: Масаев Евгений
7 класс «А»
Руководитель: Резник А. В.
Гурьевский район
2010
Введение
В этом учебном году я начал изучать физику. Я узнал, что тела, которые нас окружают, состоят из мельчайших частиц – молекул. Меня заинтересовало, каковы размеры молекул. Из-за очень малых размеров молекулы нельзя увидеть невооруженным глазом или с помощью обыкновенного микроскопа. Я прочитал, что молекулы можно увидеть только с помощью электронного микроскопа. Ученые доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Мне захотелось на практике измерить диаметр молекулы. Но к сожалению, в школьной программе не предусматривает изучение проблем такого рода, а рассмотреть её одному оказалось нелёгкой задачей и пришлось изучать литературу о методах определения диаметра молекул.
Глава
I
. Молекулы
1.1 Из теории вопроса
Молекула в современном понимании – это наименьшая частица вещества, обладающая всеми его химическими свойствами. Молекула способна к самостоятельному существованию. Она может состоять как из одинаковых атомов, например кислород О2
, озон О3
, азот N2
, фосфор P4
, сера S6
и т. д., так и из различных атомов: сюда относятся молекулы всех сложных веществ. Простейшие молекулы состоят из одного атома: это молекулы инертных газов – гелия, неона, аргона, криптона, ксенона, радона. В так называемых высокомолекулярных соединениях и полимерах каждая молекула может состоять из сотен тысяч атомов.
Экспериментальное доказательство существования молекул первым наиболее убедительно дал французский физик Ж. Перрен в 1906 г. при изучении броуновского движения. Оно, как показал Перрен, является результатом теплового движения молекул – и ничем иным.
Сущность молекулы можно описать и с другой точки зрения: молекула – устойчивая система, состоящая из ядер атомов (одинаковых или различных) и окружающих электронов, причем химические свойства молекулы определяются электронами внешних оболочек в атомах. Атомы объединяются в молекулы в большинстве случаев химическими связями. Обычно такая связь создается одной, двумя или тремя парами электронов, которыми владеют сообща два атома.
Атомы в молекулах соединены друг с другом в определенной последовательности и определённым образом распределены в пространстве. Связи между атомами имеют различную прочность; она оценивается величиной энергии, которую необходимо затратить для разрыва межатомных связей.
Молекулы характеризуются определёнными размером и формой. Различными способами было определено, что в 1 см3
любого газа при нормальных условиях содержится около 2,7x1019
молекул.
Чтобы понять, насколько велико это число, можно представить, что молекула – это «кирпич». Тогда если взять количество кирпичей, равное числу молекул в 1 см3
газа при нормальных условиях, и плотно уложить ими поверхность суши всего земного шара, то они покрыли бы поверхность слоем высотой 120 м, что почти в 4 раза превосходит высоту 10-этажного дома. Огромное число молекул в единице объёма указывает на очень малые размеры самих молекул. Например, масса молекулы воды m=29,9 x 10-27 кг. Соответственно малы и размеры молекул. Диаметром молекулы принято считать минимальное расстояние, на которое им позволяет сблизиться силы отталкивания. Однако понятие размера молекулы является условным, так как на молекулярных расстояниях представления классической физики не всегда оправданы. Средний размер молекул порядка 10-10
м.
Молекула как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекулы одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул.
Обычно молекулой называют электрически нейтральную частицу. В веществе положительные ионы всегда сосуществуют вместе с отрицательными.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомов в молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса. По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
1.2
Методы измерения диаметра молекул
В молекулярной физике главные «действующие лица» — это молекулы, невообразимо маленькие частицы, из которых состоят все на свете вещества. Ясно, что для изучения многих явлений важно знать, каковы они, молекулы. В частности, каковы их размеры.
Когда говорят о молекулах, их обычно считают маленькими упругими твердыми шариками. Следовательно, знать размер молекул, значит знать их радиус.
Несмотря на малость молекулярных размеров, физики сумели разработать множество способов их определения. В «Физике 7» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
Строение молекул изучают различными экспериментальными методами. Электронография, нейтронография и рентгеновский структурный анализ позволяют получать непосредственную информацию о структуре молекул. Электронографии, метод, исследующий рассеяние электронов на пучке молекул в газовой фазе, позволяет рассчитать параметры геометрической конфигурации для изолированных сравнительно простых молекул. Нейтронография и рентгеновский структурный анализ ограничены анализом структуры молекул либо отдельных упорядоченных фрагментов в конденсированной фазе. Рентгенографические исследования кроме указанных сведений дают возможность получить количественные данные о пространственном распределении электронной плотности в молекулах.
Спектроскопические методы основаны на индивидуальности спектров химических соединений, которая обусловлена характерным для каждой молекулы набором состояний и отвечающих им энергетических уровней. Эти методы позволяют проводить качественный и количественный спектральный анализ веществ.
Спектры поглощения или испускания в микроволновой области спектра позволяют изучать переходы между вращательными состояниями, определять моменты инерции молекул, а на их основе - длины связей, валентные углы и другие геометрические параметры молекул. Инфракрасная спектроскопия исследует, как правило, переходы между колебательно-вращательными состояниями и широко используется для спектрально-аналитических целей, поскольку многие частоты колебаний определенных структурных фрагментов молекул являются характеристическими и слабо меняются при переходе от одной молекулы к другой. В то же время инфракрасная спектроскопия позволяет судить и о равновесной геометрической конфигурации. Спектры молекул в оптическом и ультрафиолетовом диапазонах частот связаны главным образом с переходами между электронными состояниями. Результатом их исследований являются данные об особенностях потенциальных поверхностей для различных состояний и значения молекулярных постоянных, определяющих эти потенциальные поверхности, также времена жизни молекул в возбужденных состояниях и вероятности переходов из одного состояния в другое.
О деталях электронного строения молекул уникальную информацию дают фото- и рентгеноэлектронные спектры, а также оже-спектры, позволяющие оценить тип симметрии молекулярных орбиталей и особенности распределения электронной плотности. Широкие возможности для изучения отдельных состояний молекул открыла лазерная спектроскопия (в различных диапазонах частот), отличающаяся исключительно высокой селективностью возбуждения. Импульсная лазерная спектроскопия позволяет анализировать строение короткоживущих молекул и их превращения в электромагнитное поле.
Разнообразную информацию о строении и свойствах молекул дает изучение их поведения во внешних электрических и магнитных полях.
Существует, однако, очень простой, хотя и не самый точный, способ вычисления радиусов молекул (или атомов) Он основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V
некоторой массы m
вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V
на число молекул N
.
Число молекул в теле массой m
равно, как известно, 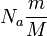 , где М
— молярная масса вещества N
A
— число Авогадро. Отсюда объем V
0
одной молекулы определяется из равенства , где М
— молярная масса вещества N
A
— число Авогадро. Отсюда объем V
0
одной молекулы определяется из равенства
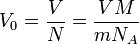 . .
В это выражение входит отношение объема вещества к его массе. Обратное же отношение 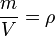 есть плотность вещества, так что есть плотность вещества, так что
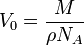 . .
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Объем одной молекулы, если считать ее шариком, равен 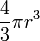 , где r
- радиус шарика. Поэтому , где r
- радиус шарика. Поэтому
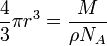 . .
откуда мы и получаем выражение для радиуса молекулы:
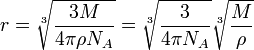 . .
Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9
моль1/3
, поэтому формула для r
принимает вид
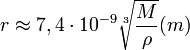 . .
Например, радиус молекулы воды, вычисленный по этой формуле, равен r
В
≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул- шариков были бы невозможны молекулярные движения. Тем не менее вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
Глава
II
. Определение диаметра молекулы
2.1 Метод Ленгмюра и Дево
Оборудование: микропипетка со шкалой, ванна размером 40х30 см, раствор жидкости в спирте с концентрацией 1:400 (олеиновая кислота и др.), тальк (ликоподий, пудра, порошок мела), линейка измерительная, лист бумаги.
Цель работы: определить приблизительно диаметр молекулы.
Исследуемая жидкость должна растворяться в спирте (эфире) и быть легче воды, не растворяясь в ней. При попадании капли раствора на поверхность воды спирт растворяется в воде, а исследуемая жидкость образует пятно площадью S и толщиной в (порядка диаметра молекул).
Если допустить, что молекула имеет форму шара, то объем одной молекулы равен: 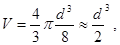 где в – молекулы. где в – молекулы.
В лабораторной работе необходимо определить диаметр молекулы d. В микропипетку набираю 0,5 мл раствора и, расположив ее над сосудом, отсчитываю число капель n, содержащихся в этом объеме. Проделав опыт несколько раз, нахожу среднее значение числа капель в объеме 0,5 мл, а затем подсчитываю объем исследуемой жидкости в капле:
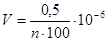 м3
, м3
,
где n – число капель в объеме 0,5 мл, 1:400 – концентрация раствора.
В ванну наливаю воду толщиной 1 – 2 см. Насыпаю тальк тонким слоем на лист бумаги, ударяя слегка пальцем по коробочке. Расположив лист бумаги выше и сбоку от ванны на расстоянии 10 – 20 см, тальк сдуваю с бумаги. На поверхность воды в ванне из пипетки капаю одну каплю раствора. Линейкой измеряю, средний диаметр образовавшегося пятна в и подсчитываю его площадь. Опыт повторяю 2- 3 раза, а затем подсчитываю диаметр молекул d.
При выполнении лабораторной работы следует иметь в виду, что иногда вода из городской сети имеет примеси, затрудняющие растекание капли.
В этом случае необходимо тщательно промыть ванну и использовать дистиллированную воду.
Спирт, имеющий примеси, может легко растекаться по поверхности воды, поэтому для раствора необходим чистый этиловый спирт.
Для приготовления раствора необходимой концентрации нужно отмерить 0,5 мл жидкости и добавить в нее 4,5 мл спирта, затем в 0,5 мл полученного раствора с концентрацией 1:10 добавить 4,5 мл спирта; в 0,5 мл полученного раствора с концентрацией 1:100 добавить 1,5 мл спирта. Получившийся раствор будет иметь концентрацию 1:400. Если применять раствор большей концентрации, то необходимо иметь ванну больших размеров.
Вывод
В результате работы я изучил литературу о строении молекул, о методах определения диаметра молекул. Используя метод Ленмюра и Дево, я провел исследования по определению приблизительного диаметра молекулы олеиновой кислоты и получил следующие результаты: d=9,3×10-10 м.
Данный результат не может быть точным, так как шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул- шариков были бы невозможны молекулярные движения. Тем не менее вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
Список литературы
молекула атом размер диаметр
1. Анциферов, Л. И. Самодельные приборы для физического практикума в средней школе [Текст] / Л. И. Анциферов.- М.: Просвещение, 1985.
2. Блудов, М. И. Беседы по физике [Текст] / М. И. Блудов. – М.: Просвещение, 1992. - 140 с.
3. Физика. Большой справочник для школьников и поступающих в вузы [Текст]/ - М.: Дрофа, 1999. - 688 с.
4. Физический энциклопедический словарь [Текст]/ - М.: Советская энциклопедия, 1983. - 928 с.
5. Энциклопедический словарь юного физика [Текст]/ - М.: Педагогика, 1984.
|