Введение
Основными источниками загрязнения атмосферного воздуха являются промышленные предприятия, транспорт, тепловые электростанции, животноводческие комплексы. Каждый из этих источников связан с выделением большого количества специфических токсичных веществ, иногда не поддающихся сразу идентификации, хотя номенклатура многотоннажных загрязнений сравнительно мала.
Для снижения загрязнения атмосферы от промышленных выбросов совершенствуют технологические процессы, осуществляют герметизацию технологического оборудования, применяют пневмотранспорт, строят различные очистные сооружения.
Наиболее эффективным направлением снижения выбросов является создание безотходных технологических процессов, предусматривающих, например, внедрение замкнутых газообразных потоков, однако до настоящего времени основным средством предотвращения вредных выбросов остается разработка и внедрение эффективных систем очистки газов. При этом под очисткой газа понимают отделение газа или превращение в безвредное состояние загрязняющего вещества, поступающего от промышленного источника.
Для обезвреживания отходящих газов от газообразных и парообразных токсичных веществ применяют следующие методы: абсорбции, адсорбции, каталитические, термические, конденсации и компримирования.
Каталитические методы очистки основаны на химических превращениях токсичных компонентов в нетоксичные на поверхности твердых катализаторов. Очистке подвергаются газы, не содержащие пыли и катализаторных ядов. Методы используются для очистки газов от оксидов азота, серы, углерода и от органических примесей. Их проводят р реакторах различной конструкции.
1.
Литературный обзор
1.1 Оксиды азота, их некоторые свойства и источники
В природе известны следующие оксиды азота
Оксид азота (I) N2
O представляет собой бесцветный газ со слабым запахом и сладковатым вкусом. Он известен как «веселящий газ», выделяется из почвы при внесении азотных удобрений. Оксид азота (1) довольно хорошо растворяется в воде (один объем воды поглощает при 0°С около 1,3, а при 25°С — 0,6 объема N2
O), однако с ней химически не взаимодействует. Он не взаимодействует также с кислотами и щелочами. При высоких концентрациях вызывает удушье вследствие вытеснения кислорода из легких. Оксид азота (I) малотоксичен, вдыхание его в смеси с воздухом вызывает характерное состояние опьянения, сопровождающееся ослаблением болевых ощущений. Поэтому смесь оксида азота (1) с кислородом может применяться для наркоза (80% N0 и 20%О2
). При температурах выше 500°С оксид азота (1) разлагается с образованием молекулы азота и кислорода
2N2
O 2N2
+О2 2N2
+О2
Оксид азота (II) N0 — бесцветный токсичный газ. ПДК с.с.
=0.06 мг/м3
. Фоновые концентрации N0 составляют до 7,4 мкг/ м3
. Оксид азота плохо растворяется в воде (в одном объеме воды при 0°С растворяется лишь 0,007 объемов N0) и в химическую реакцию с ней не вступает. Температура плавления оксида азота равна -164°С, а температура кипения составляет 151°С. В твердом и жидком состояниях оксид азота имеет синий цвет. Оксид азота под действием сильных окислителей окисляется, а в присутствии восстановителей — восстанавливается. Так, он легко окисляется с кислородом и озоном.
Диоксид азота (IV) NO2
представляет собой в обычных условиях газ бурого цвета, обладает раздражающим и прижигающим действием на дыхательные пути. Более токсичен, чем NO. ПДКс.с.
=0,04 мкг/ м3
. Фоновые концентрации NO2
изменяются в пределах 0,4-9,4 мкг/ м3
.Он хорошо растворим в воде, один моль воды растворяет два моля диоксида азота.
Диоксид азота легко переходит в жидкость, кипящую при 21 °С. При температуре ниже 11 °С жидкий диоксид азота застывает с образованием бесцветной кристаллической массы в которой молекулы NO2
образуют димеры N2
O4
. Полный распад димеров на молекулы диоксида азота происходит лишь при температурах выше 140°С. Таким образом, каждой температуре в промежутке между -11° и +140°С отвечает определенное состояние равновесия обратимой реакции
NO2
+NO2
 N2
O4
N2
O4
кроме них в различных производственных условиях могут образоваться следующие стабильные оксиды: N2
O3
и N2
O5
.
NO и NO2
в атмосфере и составе газовых выбросов всегда присутствуют вместе и поэтому обобщенно обозначаются как NOX
(NO +NO2
=NOX
).
Они относятся к массовым загрязнителям атмосферы. Установлено что даже сравнительно небольшие концентрации оксидов азота в воздухе при постоянном воздействии на организм человека вызывают не благоприятную реакцию с гемоглобином крови. При концентрациях 1000-5000 мг/м3
оксид азота токсичнее диоксида азота.
Особую опасность представляет взаимодействие оксидов азота с кислородом и находящимися в воздухе углеводородами, приводящее в присутствии солнечного излучения к протеканию следующих реакций:
2NO + O2
 2NO2
2NO2
NO 2
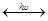 NO + O О+О2
NO + O О+О2
 Оз
Оз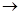 альдегиды альдегиды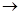 кетоны кетоны
Оз+RCH3
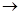 органические кислоты органические кислоты 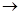 свободные радикалы свободные радикалы
O3
+ N02
+ RCH3
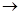 RCOONO2
// О RCOONO2
// О
Видно, что в результате этих реакций, лежащих в основе фотохимического смога, образуется пероксиацетилнитрат, вызывающий резь в глазах, раздражающий легочную ткань.
Оксиды азота представляют опасность для озонового слоя в связи с тем, что они попадают в стратосферу в составе выхлопных газов реактивных самолетов, особенно боевых, летающих на высоте 20-50 км. Содержание оксидов азота в таких выбросах достигает 0.1% об. Под действием мягкого УФ-излучения Солнца, которое в стратосфере озоном почти не задерживается, диоксид азота разлагается с выделением оксида азота, а последний окисляется озоном. В результате ряда последовательных реакций одна молекула оксида азота способствует уничтожению в среднем 10 молекул озона.
В природных условиях оксиды азота образуются в количествах порядка 700 млн. тонн в год в результате извержения вулканов, лесных пожаров, грозовых разрядов, а также в почве и поверхностных слоях океана - вследствие протекания анаэробных процессов. Однако такое количество оксидов азота равномерно распределяется в атмосфере и образует лишь фоновые концентрации, не представляющие опасности для растений и живых организмов. Часть атмосферного диоксида азота взаимодействует с дождем и в виде азотной кислоты поступает в почву. Вероятность выпадения диоксида азота в виде кислотных дождей составляет 0,4. Азотная кислота в почве превращается в нитраты и поглощается растениями, являясь азотным удобрением природного происхождения. Полагают, что таким путем ежегодно в почву вносится до 150 кг связанного азота на гектар.
Наиболее опасны для окружающей среды и человека оксиды азота, образующиеся в результате производственной деятельности человека. Общая масса антропогенных выбросов оксидов азота составляет около 75 млн. тонн в год, т. е. примерно в 10 раз меньше природных выбросов. Несмотря на это, антропогенные выбросы представляют серьезную опасность для растений и живых организмов из-за образования локальных высоких концентраций, превышающих предельно-допустимые в десятки и более раз. Антропогенные выбросы оксидов азота образуются:
1. В процессе горения топлива в тепловых электростанциях, котельных агрегатах, двигателях внутреннего сгорания. При температурах 1000°С и выше между азотом и кислородом воздуха идет следующая реакция:
О2
+ N2
 2NO
2NO
Часть N0 при выходе из дымовой трубы окисляется в N0: за счет взаимодействия с озоном и кислородом воздуха:
N0 + О3
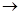 N02
+ 02 N02
+ 02
2NO + О2
 2NO2
2NO2
Ежегодно в составе дымовых газов в атмосферу выбрасывается порядка 50 млн. тонн оксидов азота; 2. В процессах получения и применения азотной кислоты, при производстве взрывчатых веществ, алифатических и ароматических нитросоединений, азотных удобрений, серной кислоты нитрозным способом, анилиновых красителей, вискозного волокна, травления металлов и др.. а также в газовых выбросах химической промышленности объем оксидов азота составляет порядка 25 млн. тонн в год. Например, заводы, производящие азотные удобрения, выбрасывают 5-12 т/сутки NOх
и NH3
, и их концентрации на расстоянии 500 м от предприятия могут достигать 1.3 мг/м3
. Такие концентрации представляют опасность не только для здоровья людей, но и для растений, поскольку оксиды азота поглощаются листьями растений, нарушая при этом обмен веществ. При концентрациях от 0.2 до 0.56 мг/м3
NO2
повреждает томаты и бобовые культуры.
Способы очистки промышленных газовых выбросов от оксидов азота
Существующие способы очистки газовых выбросов от оксидов азота подразделяются на следующие: - абсорбционные процессы очистки с хемосорбцией NOх
и их превращением в другие продукты, например, в азотную кислоту, нитраты, нитриты и др. - адсорбционные методы улавливания оксидов азота с одновременным частичным или полным превращением в другие продукты, например в HNO3
. - термические и термокаталитические методы восстановления оксидов азота домолекулярного азота.
2. Термокатал
итические методы восстановления оксидов азота
Процессы термокаталитического восстановления NOх
характеризуются низкой температурой, меньшим расходом газа-восстановителя и высокой степенью очистки отходящих газов, удовлетворяющей санитарным нормам. В основе этих процессов лежат реакции термического окисления и восстановления, однако число возможных восстановителей при этом значительно больше. В качестве восстановителей при термокаталитических процессах могут быть использованы метан и другие газообразные углеводороды, оксид углерода, водород, пары жидких углеводородов, аммиак, а также промышленные газы, содержащие эти компоненты. Катализаторами термокаталитических процессов восстановления NOX
могут быть: платина, палладий, рутений, родий, никель, медь, хром, железо, сплавы никеля с хромом, меди с хромом и др., нанесенные на оксиды алюминия, цинка, силикагель.
В зависимости от избирательного характера действия восстановителя по отношению к NOх
термокаталитические методы подразделяются на селективные и неселективные.
Остановимся более подробно на неселективных методах. Оксиды азота относят к умеренно опасным газам (третий класс опасности). В рабочих зонах ПДК оксидов азота в пересчете на NO2
равна 2 мг/м3
, а в приземном слое среднесуточная ПДК составляет 0,085 мг/м3
.
Содержание оксидов азота на выходе из абсорбционных колонн значительно превышает санитарные нормы. Для обезвреживания отходящих газов от оксидов азота применяют высокотемпературное каталитическое восстановление, селективное каталитическое восстановление и разложение гетерогенными восстановителями.
2.1
Высокотемпературная каталитическая очистка
В качестве восстановителей предложены: водород, азотоводородная смесь, оксид углерода (II), природный, нефтяной, коксовый и богатые газы, пары керосина, мазута и др.. Практическое применение в промышленности нашел природный газ, содержание серы в котором не должно превышать 20 мг/м3
.
В качестве катализаторов применяют металлы Pt, Pd, Rh, Ru, Ni, Cu, Cr, Fe и сплавы Ni—Cr, Cu- -Cr, Zn—Cr и др., нанесенные на оксиды алюминия, цинка, силикагель, керамику и природные материалы. В агрегатах УКЛ-7,3 и АК-72 применяют палладиевый катализатор АПК-2 (А12
О3
с 2% Pd). Процесс восстановления N0х
протекает при 720—7700
С, объемной и линейной скоростях газа соответственно 15000—25000 ч-1
и 1,0—1,5 м/с. Для достижения остаточной концентрации оксидов азота в пределах 0,002— 0,008% (об.) поддерживают 10%-ный избыток природного газа от стехиометрического.
В качестве второго каталитического слоя используется таблетированный А12
О3
. Срок службы катализатора 3 года, потери Pd составляют 3—5% в год (от массы нанесенного). За период эксплуатации активность катализатора снижается, и концентрация оксидов азота повышается от 0,002—0,003 до 0,008—0,01% при содержании NOх
на входе 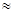 0,1% (об.). 0,1% (об.).
Первой стадией процесса является горение и конверсия метана кислородом
СН4
+ 2О2 СО2
+ 2Н2
О +804,58 кДж.
СО2
+ 2Н2
О +804,58 кДж.
При неполном сгорании метана образуются водород и моноксид углерода:
СН4
+ 0,5О2
= СО+ 2Н2
+35,13 кДж.
оксид азот промышленный восстановление
Последние могут окисляться кислородом до диоксида углерода и воды.
Выделяемое по этим реакциям тепло приводит к значительному повышению температуры газа. Адиабатический разогрев парогазовой смеси при окислении 1% кислорода составляет 160 °С. Поэтому во избежание перегрева катализатора и одновременного обеспечения температуры его зажигания (450—550 С
С), содержание кислорода в отходящем газе поддерживают в пределах 3,2%. При восстановлении водородом содержание кислорода составляет 4,4% О2
, так как в этом случае адиабатический разогрев равен 130—140 °С.
Таким образом, в восстановлении оксидов азота участвуют все три восстановителя: Н2
, СО, СН4
.
Но с большей вероятностью с оксидами азота реагирует на катализаторе водород. Причем на первой стадии диоксид азота восстанавливается до оксида азота N0, а затем последний до N2
Н2
+ NO2
= Н2
О + N0 + 184,9 кДж,
Н2
+ NO = H2
O+0,5N2
+ 332,45 кДж.
Аналогично взаимодействует N0х
с моноксидом углерода. Суммарные реакции природного газа с оксидами азота можно представить в виде:
СН4
+ 4N02
= CO + 4NO+2H2
O+ 574,4 кДж,
СH4
+ 4N0 = C02
+ 2N2
+ 2H2
O + 11 646 кДж.
По условиям эксплуатации катализатора АПК.-2 оптимальным является соотношение
[СН4
] : [О2
]=0,55- 0,56. Дефиксация окислов азота в восстановительной среде (избыток СН4
над О2
) приводит к появлению в выхлопном газе наряду с СО [до 0,15% (об.)] аммиака и водорода.
Активность катализаторов восстановления оксидов азота водородом на основе благородных металлов убывает в последовательности: Ru>Os>Rh>Ir>Pt>Pd.
Восстановление оксидов азота моноксидом углерода в присутствии кислорода затрудняется и может прекратиться полностью при превышении стехиометрического содержания кислорода над оксидом углерода. При восстановлении смеси оксидом углерода он взаимодействует только с N02
- По активности испытанные катализаторы этой реакции располагают в следующий ряд.
Fe2
O3
>CuCr2
O4
>Cu2
O>Cr2
O3
>NiO>Pt>Al2
O3
+ SiO2
>MnO>V2
O5
.
Высокотемпературный процесс каталитической очистки органически связан с технологией получения азотной кислоты. При его осуществлении можно не только организовать замкнутый энерготехнологический цикл, но и выдать значительное количество пара на сторону (Гкал/т 100%-ной HNO3
):
2.2
Селективное каталитическ
ое восстановление оксидов азота
Сущность селективного термокаталитического восстановления NOX
до молекулярного азота заключается в том, что аммиак при определенных условиях селективно взаимодействует с оксидами азота и не реагирует с кислородом:
4NH3
+ 6NO = 5N2
+ 6Н2
О
8NH3
+ 6NO2
= 7N2
+ 12H2
O
Однако в зависимости от типа катализатора возможно также восстановление NO2
до N0 и окисление аммиака кислородом до N2
и N2
O:
2NH3
+8NO=5N2
O + 3H2
O
4NH3
+ 4O2
= 2N2
O +6H2
O
4NH3
+3O2
= 2N2
+ 6H2
O
Сопоставление констант равновесия основных и побочной реакций
указывает на предпочтительность реакций восстановления оксидов азота аммиаком по сравнению с реакцией аммиака с кислородом.. В России селективная каталитическая очистка используется в агрегатах, оборудованных низкотемпературной рекуперативной турбиной. Селективное восстановление NO2
и N0 аммиаком до молекулярного азота происходит с равной скоростью при температурах 250 - 450°С на катализаторах из платины, оксидов меди, ванадия, магния и др. в отличие от неселективного термокаталитического процесса селективное восстановление оксидов азота осуществляется при любых концентрациях кислорода в хвостовых газах с достижением степени очистки 98% и более. Например, алюмованадиевый катализатор АВК-10М (10% ванадия) при объемной скорости газового потока 15000 ч-1
, линейной скорости до 1 м/с и температуре 375 - 450 °С обеспечивает степень восстановления NOX
98 – 98,5 % и имеет срок службы 2 – 3 года. При соотношении NH3
: NOх
равном (1,1-1,5):1, содержание оксидов азота в выхлопных газах не превышает 0,002– 0,003 %. Время пробега катализатора 2—3 года, за этот период степень очистки снижается до 96%, содержание остаточного аммиака в очищенном газе не превышает 0.01% (об). Расход аммиака при 25—30%-ном избытке против стехиометрии составляет 2,5—3,0 кг на каждую десятую долю процента оксидов азота, содержащихся в исходном газе.Небольшой избыток аммиака объясняется тем, что часть его все же взаимодействует с кислородом:
4NH3
+3O2
= 2N2
+ 6H2
O
В качестве катализаторов селективного восстановления оксидов азота испытаны различные металлы (в том числе и благородные), оксиды металлов, шпинели, перовскиты в чистом, смешанном и нанесенном видах. Каталитическая активность катализаторов процесса при 200—350°С и скорости 10 тыс. ч-1
убывает в последовательности:
Pt>MgO>V2
О5
>CuO>Fe2
O3
>Cr2
O3
>Co2
O3
>MoO3
>NiO>Ag2
O>ZnO>Bi2
O3
>Al2
O5
>SiO2
>PbO2
.
Палладий резко снижает свою активность в ходе процесса. Высокой активностью обладают оксиды марганца, ванадия, железа, хрома, меди и кобальта.
К недостаткам этого вида очистки относятся трудность точной дозировки небольших количеств аммиака в газ после абсорбционных колонн и равномерного распределения его в газовом потоке, а также образования в трактах после очистки нитрит-нитратов аммония. Для исключения образования последних температуру газов, выбрасываемых в атмосферу после рекуперационных турбин, поддерживают выше 200 °С.
Схема технологического процесса селективного восстановления NOX
в производстве азотной кислоты приведена на рис. 1.
Хвостовые газы из абсорбера поступают в подогреватель и с температурой 50°С направляются в блок нагрева газов БНГ – 172. последний состоит из регенератора тепла, конвективного и радиантного подогревателей и воздухоподогревателя.
В блоке нагрева хвостовые газы вначале проходят через регенератор, где нагреваются до 290°С. Для этого используется тепло расширенных газов после газовой турбины, температура которых понижается от 370 до 146°С. После регенератора хвостовые газы проходят через конвективный подогреватель, обогреваемый дымовыми газами. При этом температура хвостовых газов повышается от 290 до 453°С, а дымовых – понижается от 935 до 390°С. Затем хвостовые газы поступают в радиантный подогреватель, обогреваемый также дымовыми газами, где нагреваются от 453 до 780°С и подаются в смеситель газов 5. для более полной утилизации тепла дымовых газов воздух, подаваемый в горелки природного газа, предварительно нагревается до 200°С, а дымовые газы при этом охлаждаются от 390 до 250°С.
В смесителе горячие хвостовые газы смешиваются с аммиаком и поступают в реактор каталитической очистки. Реактор представляет собой горизонтальный цилиндрический аппарат со слоем алюмомедьцинкового катализатора (АЦМ-10) высотой 800 мм и объемом 22,8 м3
. продолжительность работы катализатора – 3 года. Селективное каталитическое восстановление NOX
аммиаком происходит при температуре порядка 350°С и давлении 1,14 МПа. При этом линейная скорость газов составляет 0,4 м/с, а объемная скорость – 7500 м3
/ч на 1 м3
катализатора. После рекуперации тепла в блоке нагрева и энергии давления в газовой турбине очищенные газы смешиваются с дымовыми газами и выбрасываются в атмосферу. Назначение турбин 8-10 такое же, как при неселективном восстановлении оксидов азота.
Содержание NOX
в выхлопных газах не превышает 0,006% об., аммиака – 0,01%.
По сравнению с неселективными методами, данный способ позволяет снизить расход природного газа на 15%, исключает применение дорогостоящего катализатора АПК-2, в выхлопных газах отсутствуют оксид углерода и метан.
Очистка газов от оксидов азота в производстве неконцентрированной азотной кислоты на алюмованадиевом оксидном катализаторе АВК-10 в присутствии аммиака не всегда удовлетворяет требованиям по остаточному содержанию аммиака в очищенном газе. Использование так называемого двухслойного катализатора позволяет достигать высокие степени очистки от оксидов азота и аммиака.
Двухслойный катализатор состоит из слоя алюмованадиевого (АВК-10, АВК-10М, АВК-10Ш) и слоя железохромового (СТК-1, СТК-2, СИК-482, СТК-482-МФ) катализатора. Соотношение объемов составляет 1:1. оптимальные условия очистки следующие: Т = 250-290°С; Р = 0,4 МПа; объемная скорость составляет 7000 ч-1
. содержание оксидов азота в исходном газовом потоке 0,1-0,3 об., соотношение NOх
: NH3
= 1: (0,8-1,1).
2.3 Разложение оксидов азота гетерогенными восстановителями
При высоких температурах (500-1300°С) дефиксация азота в отходящих газах может быть проведена на твердых углеродсодержащих материалах, в частности на угле, коксе, графите. В таких процессах углерод выполняет функции как катализатора, так и топлива. Каталитическое действие углерода связано с образованием комплексов углерод – кислород:
С + NO = (С-О) + 1/2N2
(С-О) + NO = СО2
+ 1/2N2
Однако сравнительно быстрая потеря активности такими катализаторами приводит к тому, что разложение оксидов азота, особенно в начальном интервале указанной температурной области, происходит неполно. В этой связи с целью увеличении степени разложения NOх
предложено, например, вводить в графит карбонат натрия. С увеличением температуры степень и скорость процесса восстановления возрастают: при 800°С степень восстановления NOх
при использовании кокса может достигать 96%, а при 1000°С приближается к 100%. Высокие температуры таких процессов отрицательно сказываются на их технико-экономических показателях, хотя значительная часть энергетического потенциала обезвреживаемых газов может быть полезно использована.
Сравнительный анализ эффективности восстановителей
Очистка дымовых газов путем восстановления оксида азота до азота и кислорода на катализаторах представляет собой сложную задачу в связи со следующими обстоятельствами:
1) наличием в дымовых газах золы и оксидов серы, загрязняющих и отравляющих катализатор;
потребностью в более высокой температуре газов у катализатора (обычно порядка 400°С по сравнению с температурой золоулавливания). На практике в теплоэнергетике преимущественно развиваются два направления очистки дымовых газов от окислов азота: селективное некаталитическое восстановление окислов азота (СНКВ-процесс) и селективное каталитическое восстановление окислов азота (СКВ-процесс). В качестве восстановителя используются аммиак или химические соединения, способные легко разлагаться с выделением аммиака. В табл. 1 приведены физико-химические свойства некоторых сравнительно допустимых азотсодержащих соединений, которые могут быть использованы при СНКВ и СКВ-процессе. Основное преимущество веществ представленных в табл.1, по сравнению с аммиаком и аммиачной водой – значительно меньшая токсичность, что порой оказывается определяющим при согласовании размещения склада реагента с местными природоохранными организациями. Сложности с применением азотсодержащих соединений начинаются при проектировании систем дозирования и раздачи реагента в котле. В отличие от аммиака и моноэтаноламина, названные в табл.1, реагенты не удается перевести в газообразное состояние, поскольку при температурах плавления они начинают разлагаться, образуя высокомолекулярные соединения с повышенной температурой плавления. В связи с этим принятая в случае использования аммиака технологическая схема с разбавлением реагента пором, воздухом или дымовыми газами не может быть применена. Все эти реагенты должны непосредственно вводиться в соответствующую температурную область котла или в виде водных растворов (растворимые в воде ацетамид, моноэтаноламин, мочевина и уротропин), или в виде суспензий (циануровая кислота и меламин). Они перед подачей в реактор должны быть конвертированы до аммиака. Это ограничение существенно, и поэтому набор реагентов в основном ограничивается сжиженным аммиаком (несколько изменяется лишь схема дозированной подачи), аммиачной водой и мочевиной, которая сравнительно легко гидролизуется при умеренных температурах. Механизм реакции гидролиза и разложение реагентов:
CH3
CONH2
+ H2
O = NH3
+ CH3
COOH
(H 2
CN) 2
+6 H 2
O = 6 NH 3
+ 3 CO 2
(NH 2
) 2
CO + H 2
O = 2 NH 3
+ CO 3
(H NCO) 3
+3 H 2
O = 3 NH 3
+ 3 CO 2
(CH 2
) 6
N 4
+ 6 H 2
O = 4 NH 3
+ 6 CH2
O
В таблице также приведены минимальные расходы реагентов на 1 т нейтрализованного NOх
(100%-я селективность). Из этих данных следует, что удельный расход всех перечисленных реагентов значительно выше, чем при использовании аммиака. В наименьшем количестве расходуется меламин. Аммиак является единственно доступным восстановителем избирательного действия, способным восстановить примеси оксида азота до азота (или малотоксичной закиси азота) при наличии кислорода в дымовых газах.
4NH3
+ 6NO = 5N2
+ 6Н2
О
8NH3
+ 6NO2
= 7N2
+ 12H2
O
2NH3
+ 8NO= 5N2
О+ 3H2
O
Заключение
В настоящее время ведут интенсивные исследования методов очистки выхлопных газов от оксидов азота, позволяющих не только обезвредить выхлопные газы но и увеличить степень использования связанного азота.
Представляет интерес очистка газов на цеолитах. Так, высококремнеземные цеолиты обладают значительной емкостью и длительное время сохраняют работоспособность.
Разрабатываются новые перспективные способы очистки газов от оксидов азота, основанные на применении комплексных металлоорганических катализаторов в растворе.
Попытки исследователей заменить токсичный аммиак на другие реактанты в течение длительного времени оказывались безуспешными. В настоящее время, наконец, найдены катализаторы, реализующие процессы селективного восстановления в присутствии углеводородов. Однако, пока эти работы не вышли за рамки академических исследований, и на сегодня трудно оценить их практическую значимость.
Список используемой литературы
1. Мухутдинов А.А. «Способы очистки газов от диоксида серы и оксидов азота», учебное пособие.- Казань, КГТУ-2002г.
2. Тимонин А.С. «Инженерно-экологический справочник», Том 1.-Калуга, Изд-во Бочкаревой Н.-2003г.
3. Мухутдинов А.А. «Основы и менеджмент промышленной экологии», учебное пособие.-Казань: Магариф-1998г.
4. Мухутдинов А.А., Сольяшинова О.А. «Технология очистки газов», учебное пособие.- Казань, КГТУ-2007.
5. Исмагилов З.Р. «Очистка дымовых газов от оксидов азота методом селективного каталитического восстановления».-Минск, 1988.-155с.
6. Справочник азотчика / под ред. Мельникова Е.Я. Москва: Химия-1987г.
7. Торочешников Н.С., Родионов А.И., Кельцев Н.В., Клушин В.Н. «Техника защиты окружающей среды».- Москва: Химия-1981г. Вилесов Н. Г., Костюковская А.А. «Очистка выбросных газов».-Киев: Техника-1971г.
8. Сигал И. Я. «Термокаталитическая очистка и снижение токсичных выбросов в атмосферу».-Киев, Наукова думка-1989г.
9. Мухутдинов А.А. «Лабораторные методы очистки газов».- Казань, КГТУ-2002г.
10. Мазур И.И. «Курс инженерной экологии».- Москва, Высшая школа-1999г.
11. Родионов А.И. «Технологические процессы экологической безопасности».- Калуга, Изд-во Бочкаревой Н.-2003г.
12. Антоновский В.Л. «Химия пероксинитратов-компонентов фотохимического смога».-Москва, Химия-1989г.
13. Сигал И.Я «Защита воздушного бассейна при сжигании топлива».- Л.: Недра1988г.
|