Реферат на тему:
Сульфиды железа (
FeS
,
FeS
2
) и кальция (
CaS
)
Выполнил Иванов И.И.
Оглавление
Введение
Свойства
Происхождение (генезис)
Сульфиды в природе
Пирит
Свойства
Происхождение (генезис)
Распространение
Применение
Пирротин
Свойства
Происхождение (генезис)
Применение
Марказит
Свойства
Происхождение (генезис)
Месторождения
Применение
Ольдгамит
Получение
Физические свойства
Химические свойства
Применение
Химическое выветривание
Термический анализ
Термогравиметрия
Дериватография
Дериватографический анализ пирита
Сульфиды
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов. В химическом отношении рассматриваются как соли сероводородной кислоты H2
S. Ряд элементов образует с серой полисульфиды, являющиеся солями полисернистой кислоты H2
Sx
. Главнейшие элементы, образующие сульфиды — Fe, Zn, Cu, Mo, Ag, Hg, Pb, Bi, Ni, Co, Mn, V, Ga, Ge, As, Sb.
Кристаллическая структура сульфидов обусловлена плотнейшей кубической и гексагональной упаковкой ионов S2-
, между которыми располагаются ионы металлов. основные структуры представлены координационными (галенит, сфалерит), островными (пирит), цепочечными (антимонит) и слоистыми (молибденит) типами.
Характерны следующие общие физические свойства: металлический блеск, высокая и средняя отражающая способность, сравнительно низкая твёрдость и большой удельный вес.
Широко распространены в природе, составляя около 0,15 % от массы земной коры. Происхождение преимущественно гидротермальное, некоторые сульфиды образуются и при экзогенных процессах в условиях восстановительной среды. Являются рудами многих металлов — Cu, Ag, Hg, Zn, Pb, Sb, Co, Ni и др. К классу сульфидов относят близкие к ним по свойствам антимониды, арсениды, селениды и теллуриды.
В природных условиях сера встречается в двух валентных состояниях аниона S2
, образующего сульфиды S2-
, и катиона S6+
, который входит в сульфатный радикал S04
.
Вследствие этого миграция серы в земной коре определяется степенью её окисленности: восстановительная среда способствует образованию сульфидных минералов, окислительные условия — возникновению сульфатных минералов. Нейтральные атомы самородной серы представляют переходное звено между двумя типами соединений, зависящими от степени окисления или восстановления.
Пирит
Пирит - минерал, дисульфид железа FeS2
, самый распространенный в земной коре сульфид. Другие названия минерала и его разновидностей: кошачье золото, золото дурака, железный колчедан, марказит, бравоит. Содержание серы обычно близко к теоретическому (54,3%). Часто присутствуют примеси Ni, Со (непрерывный изоморфный ряд с CoS; обычно кобальт-пирит содержит от десятых долей % до нескольких % Со), Cu (от десятых долей % до 10%), Au (чаще в виде мельчайших включений самородного золота), As (до нескольких %), Se, Tl (~ 10-2 %) и др.
Цвет светлый латунно и золотисто-желтый, напоминающий золото или халькопирит; иногда содержит микроскопические включения золота. Пирит кристаллизуется в кубической сингонии. Кристаллы в форме куба, пентагон-додекаэдра, реже – октаэдра, встречается также в виде массивных и зернистых агрегатов.
Твердость по минералогической шкале 6 - 6,5, плотность 4900-5200 кг/м3. На поверхности Земли пирит неустойчив, легко окисляется кислородом воздуха и грунтовыми водами, переходя в гетит или лимонит. Блеск сильный, металлический.
Установлен почти во всех типах геологических образований. В виде акцессорного минерала присутствует в изверженных породах. Обычно является существенным компонентом в гидротермальных жилах и метасоматических месторождениях (высоко-, средне- и низкотемпературных). В осадочных породах пирит встречается в виде зерен и конкреций, например, в черных глинистых сланцах, углях и известняках. Известны осадочные породы, состоящие преимущественно из пирита и кремня. Часто образует псевдоморфозы по ископаемой древесине и аммонитам.
Пирит - самый распространенный в земной коре минерал класса сульфидов; встречается чаще всего в месторождениях гидротермального происхождения, колчеданных залежах. Крупнейшие промышленные скопления пиритовых руд находятся в Испании (Рио-Тинто), СССР (Урал), Швеции (Булиден). В виде зерен и кристаллов распространен в метаморфических сланцах и других железосодержащих метаморфических породах. Месторождения пирита разрабатывают преимущественно для извлечения содержащихся в нем примесей: золота, кобальта, никеля, меди. В некоторых богатых пиритом месторождениях содержится уран (Витватерсранд, ЮАР). Медь извлекается также из массивных сульфидных залежей в Дактауне (штат Теннеси, США) и в долине р. Рио-Тинто (Испания). Если никеля в минерале больше, чем железа, его называют бравоитом. Окисляясь, пирит переходит в лимонит, поэтому погребенные месторождения пирита можно обнаружить по лимонитовым (железным) шляпам на поверхности.Основные месторождения: Россия, Норвегия, Швеция, Франция, Германия, Азербайджан, США.
Пиритовые руды являются одним из основных видов сырья, используемого для получения серной кислоты и медного купороса. Из него попутно извлекаются цветные и драгоценные металлы. Благодаря своему свойству высекать искры, пирит использовался в колесцовых замках первых ружей и пистолетов (пара сталь-пирит). Ценный коллекционный материал.
Пирротин огненно-красный или тёмно-оранжевый цвет, магнитный колчедан, минерал из класса сульфидов состава Fe1-x
S. В виде примеси входят Ni, Со. Кристаллическая структура имеет плотнейшую гексагональную упаковку из атомов S.
Структура дефектна, т.к. не все октаэдрические пустоты заняты Fe, в силу чего часть Fe2+
перешла в Fe3+
. Структурный дефицит Fe в пирротине различен: даёт составы от Fe0,875
S (Fe7
S8
) до FeS (стехиометрический состав FeS — троилит). В зависимости от дефицита Fe меняются параметры и симметрия кристаллической ячейки, и при x~0,11 и ниже (до 0,2) пиротин из гексагональной модификации переходит в моноклинную. Цвет пирротина бронзово-жёлтый с бурой побежалостью; блеск металлический. В природе обычны сплошные массы, зернистые выделения, состоящие из прорастаний обеих модификаций.
Твёрдость по минералогической шкале 3,5—4,5; плотность 4580—4700 кг/м3. Магнитные свойства меняются в зависимости от состава: гексагональные (бедные S) пирротины — парамагнитны, моноклинные (богатые S) — ферромагнитны. Отдельные минералы пиротина обладают особой магнитной анизотропией — парамагнетизмом в одном направлении и ферромагнетизмом в другом, перпендикулярном первому.
Пирротин образуется из горячих растворов при понижении концентрации диссоциированных ионов S2-
.
Имеет широкое распространение в гипогенных месторождениях медно-никелевых руд, связанных с ультраосновными породами; также в контактно-метасоматических месторождениях и гидротермальных телах с медно-полиметаллическим, сульфидно-касситеритовым и др. оруденением. В зоне окисления переходит в пирит, марказит и бурые железняки.
Играет важную роль в производстве железного купороса и крокуса; как руда для получения железа менее значима чем пирит. Используется в химической промышленности (производство серной кислоты).В пирротине обычно содержатся примеси различных металлов (никель, медь, кобальт и др.), что делает его интересным сточки зрения промышленного применения. Во-первых, этот минерал является важной железной рудой. А во-вторых, некоторые его разновидности используются в качестве руды никеля.. Ценится коллекционерами.
Название происходит от арабского "marcasitae", которым алхимики обозначали соединения серы, в том числе и пирит. Другое название - "лучистый колчедан". Спектропиритом назван за сходство с пиритом в цвете и радужной побежалости.
Марказит, как и пирит, является сульфидом железа - FeS2, но отличается от него внутренним кристаллическим строением, большей хрупкостью и меньшей твёрдостью. Кристаллизуется в ромбической сингонии. Марказит непрозрачен, имеет латунно-жёлтый цвет, часто с зеленоватым или сероватым оттенком, встречается в виде таблитчатых, игольчатых и копьевидных кристаллов, которые могут образовывать красивые звёздообразные радиально-лучистые сростки; в виде шаровых конкреций (величиной от размеров ореха до размеров головы), иногда натёчных, почковидных и гроздевидных образований, корочек. Часто замещает органические останки, например, раковины аммонитов.
Цвет черты тёмный, зеленовато-серый, блеск металлический. Твёрдость 5-6, хрупок, спайность несовершенная. Марказит не очень устойчив в поверхностных условиях, со временем, особенно при высокой влажности, он разлагается, превращаясь в лимонит и выделяя серную кислоту, поэтому его следует хранить отдельно и с особой осторожностью. При ударе марказит испускает искры и запах серы.
В природе марказит встречается гораздо реже, чем пирит. Наблюдается в гидротермальных, преимущественно жильных месторождениях, чаще всего в виде друз мелких кристаллов в пустотах, в виде присыпок на кварце и кальците, в виде корок и натёчных форм. В осадочных породах, в основном угленосных, песчаноглинистых отложениях, марказит встречается преимущественно в виде конкреций, псевдоморфоз по органическим останкам, а также тонкодисперсного сажистого вещества. По макроскопическим признакам марказит часто принимают за пирит. Кроме пирита в ассоциации с марказитом обычно находятся сфалерит, галенит, халькопирит, кварц, кальцит и другие.
Из гидротермальных сульфидных месторождений можно отметить Блявинское в Оренбургской области на Южном Урале. К числу осадочных относятся Боровичекие угленосные отложения песчаных глин (Новгородская область), содержащие различной формы конкреции. По разнообразию форм славятся также Курьи-Каменские и Троицко-Байновские месторождения глинистых отложений на восточном склоне Среднего Урала (к востоку от Свердловска). Следует отметить месторождения в Боливии, а также Клаусталь и Фрейберг (Вестфалия, Северный Рейн, Германия), где встречаются хорошо образованные кристаллы. В виде конкреций или особенно красивых, радиально-лучистых плоских линз в некогда илистых осадочных породах (глинах, мергелях и бурых углях) залежи марказита найдены в Богемии (Чехия), Парижском бассейне (Франция) и Штирии (Австрия, образцы до 7 см). Марказит разрабатывается в Фолькстоуне, Довере и Тевистоке в Великобритании, во Франции, в США отличные образцы получены из Джоплина и других мест горнодобывающего региона ТриСтейт (штатов Миссури, Оклахома и Канзас).
В случае наличия больших масс марказит может разрабатываться для производства серной кислоты. Красивый, но хрупкий коллекционный материал.
Кальция сульфид, сернистый кальций, CaS - бесцветные кристаллы, плотность 2,58 г/см3, температура плавления 2000 °С.
Известен как минерал Ольдгамит состоящий из сульфида кальция с примесями магния, натрия, железа, меди. Кристаллы бледно-коричневого цвета, переходящего в темно-коричневый.
Прямой синтез из элементов:

Реакцией гидрида кальция в сероводороде:

Из карбоната кальция:
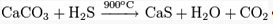
Восстановлением сульфата кальция:
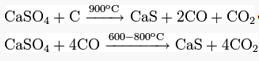
Белые кристаллы, кубическая гранецентрированная решётка типа NaCl (a=0.6008 нм). При плавлении разлагается. В кристалле каждый ион S2-
окружен октаэдром, состоящим из шести ионов Са2+
, в то время как каждый ион Са2+
окружен шестью S2-
ионами.
Малорастворим в холодной воде, кристаллогидратов не образует. Как и многие другие сульфиды, сульфид кальция в присутствии воды подвергается гидролизу и имеет запах сероводорода.
При нагревании разлагается на компоненты:
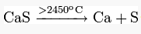
В кипящей воде полностью гидролизуется:
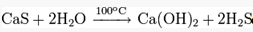
Разбавленные кислоты вытесняют сероводород из соли:

Концентрированные кислоты-окислители окисляют сероводород:
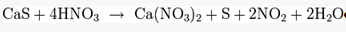
Сероводород слабая кислота и может вытесняться из солей даже углекислым газом:
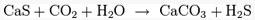
При избытке сероводорода образуются гидросульфиды:
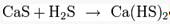
Как и все сульфиды, сульфид кальция окисляется кислородом:

Применяют для приготовления люминофоров, а также в кожевенной промышленности для удаления волос со шкур, также применяется в медицинской промышленности в качестве гомеопатического средства.
Химическое выветривание
Химическое выветривание — это совокупность различных химических процессов, в результате которых происходит дальнейшее разрушение горных пород и качественного изменения их химического состава с образованием новых минералов и соединений. Важнейшими факторами химического выветривания являются вода, углекислый газ и кислород. Вода — энергичный растворитель горных пород и минералов.
Реакции, протекающей при обжиге сульфида железа в кислороде:
4FeS + 7O2
→ 2Fe2
O3
+ 4SO2
Реакции, протекающей при обжиге дисульфида железа в кислороде:
4FeS2
+ 11O2
→ 2Fe2
O3
+ 8SO2
При окислении пирита в стандартных условиях образуется серная кислота:
2FeS2
+7O2
+H2
O→2FeSO4
+H2
SO4
При попадании сульфида кальция в топку могут происходить следующие реакции:
2CaS + 3O2
→ 2CaO + 2SO2
CaO + SO2
+ 0,5O2
→ CaSO4
с образованием в качестве конечного продукта сульфата кальция.
При взаимодействии сульфида кальция с углекислым газом и водой образуется карбонат кальция и сероводород:
CaS + CO2
+ H2
O → CaCO3
+ H2
S
Метод исследования физико-химических и химических превращений, происходящих в минералах и горных породах в условиях заданного изменения температуры. Термический анализ позволяет идентифицировать отдельные минералы и определять их количественное содержание в смеси, исследовать механизм и скорость протекающих в веществе изменений: фазовые переходы или химические реакции дегидратации, диссоциации, окисления, восстановления. С помощью термического анализа регистрируется наличие процесса, его тепловой (эндо- или экзотермичность) характер и температурный интервал, в котором он протекает. С помощью термического анализа решается широкий круг геологических, минералогических, технологических задач. Наиболее эффективно использование термического анализа для изучения минералов, испытывающих фазовые превращения при нагревании и содержащих H2
O, CO2
и другие летучие компоненты либо участвующих в окислительно-восстановительных реакциях (оксиды, гидроксиды, сульфиды, карбонаты, галогениды, природные углеродистые вещества, метамиктные минералы и др.).
Метод термического анализа объединяет ряд экспериментальных методов: метод температурных кривых нагревания или охлаждения (термический анализ в первоначальном понимании), производный термический анализ (ПТА), дифференциальный термический анализ (ДТА). Наиболее распространён и точен ДТА, при котором изменяется температура среды по заданной программе в контролируемой атмосфере и регистрируется разность температур между исследуемым минералом и веществом сравнения как функция времени (скорость нагревания) или температуры. Результаты измерения изображают кривой ДТА, откладывая по оси ординат разность температур, по оси абсцисс - время или температуру. Метод ДТА часто объединяют с термогравиметрией, дифференциальной термогравиметрией, термодилатометрией, термохроматографией.
Метод термического анализа, основанный на непрерывной регистрации изменения массы (взвешивании) образца в зависимости от его температуры в условиях программированного изменения температуры среды. Программы изменения температуры могут быть различны. Наиболее традиционным является нагревание образца с постоянной скоростью. Однако нередко используются методы в которых температура поддерживается постоянной (изотермические) или меняется в зависимости от скорости разложения образца (например метод постоянной скорости разложения).
Наиболее часто термогравиметрический метод используется при изучении реакций разложения или взаимодействия образца с газами, находящимися в печи прибора. Поэтому современный термогравиметрический анализ всегда включает в себя строгий контроль атмосферы образца с использованием встроенной в анализатор системы продува печи (контролируются как состав так и расход продувочного газа).
Метод термогравиметрии представляет собой один из немногих абсолютных (т.е. не требующих предварительной калибровки) методов анализа, что делает его одним из наиболее точных методов (наряду с классическим весовым анализом).
Комплексный метод исследования химических и физико-химических процессов, происходящих в образце в условиях программированного изменения температуры. Основан на сочетании дифференциального термического анализа (ДТА) с термогравиметрией. Во всех случаях наряду с превращениями в веществе, происходящими с тепловым эффектом, регистрируют изменение массы образца (жидкого или твердого). Это позволяет сразу однозначно определить характер процессов в веществе, что невозможно сделать по данным только ДТА или другого термического метода. В частности, показателем фазового превращения служит тепловой эффект, не сопровождающийся изменением массы образца. Прибор, регистрирующий одновременно термические и термогравиметрические изменения, называют дериватографом.
Объектами исследования могут быть сплавы, минералы, керамика, древесина, полимерные и другие материалы. Дериватография широко используется для изучения фазовых превращений, термического разложения, окисления, горения, внутримолекулярных перегруппировок и других процессов. По дериватографическим данным можно определять кинетические параметры дегидратации и диссоциации, изучать механизмы реакций. Дериватография позволяет исследовать поведение материалов в различной атмосфере, определять состав смесей, анализировать примеси в веществе и проч.сульфид пирит ольдгамит минерал
Использующиеся в дериватографии программы изменения температуры могут быть различны, однако при составлении таких программ необходимо учитывать, что скорость изменения температуры влияет на чувствительность установки по тепловым эффектам. Наиболее традиционным является нагревание образца с постоянной скоростью. Кроме того могут использоваться методы в которых температура поддерживается постоянной (изотермические) или меняется в зависимости от скорости разложения образца (например метод постоянной скорости разложения).
Наиболее часто дериваетография (как и термогравиметрия) используется при изучении реакций разложения или взаимодействия образца с газами, находящимися в печи прибора. Поэтому современный дериватограф всегда включает в себя строгий контроль атмосферы образца с использованием встроенной в анализатор системы продува печи (контролируются как состав, так и расход продувочного газа).
Дериватографический анализ пирита
5-секундная активация пирита приводит к заметному увеличению площади экзотермы, уменьшению температурного интервала окисления и большей потере массы при нагревании. Увеличение времени обработки в печи до 30 с вызывает более сильные превращения пирита. Конфигурация ДТА- и направление ТГ-кривых заметно изменяются, температурные интервалы окисления продолжают уменьшаться. На дифференциальной кривой нагревания появляется излом, соответствующий температуре 345º
С, что связано с окислением сульфатов железа и элементарной серы, являющихся продуктами окисления минерала. Вид ДТА- и ТГ-кривых пробы минерала, обработанной в течение 5 мин в печи, значительно отличается от предыдущих. Новый четко выраженный экзотермический эффект на дифференциальной кривой нагревания с температурой в примерно 305º
С следует отнести к окислению новообразований в интервале температур 255 - 350º
С. То, что фракция, полученная в результате 5-минутной активации, представляет собой смесь фаз.
|