Вступ
Тема реферату «Технологія зв’язаного азоту» з дисципліни «Загальні хімічні технології».
Мета роботи – розглянути наступні теми:
- Одержання водню конверсією метану.
- Технологічну схему двоступінчатого методу конверсії природного газу.
- Високотемпературну некаталітичну конверсію метану.
- Одержання водню та азотоводневої суміші газіфікацією твердих палив.
- Електрохімічні методи одержання водню.
- Технологію аміаку.
- Фізико-хімічні основи процесу синтезу аміаку.
- Промислові способи синтезу аміаку.
- Технологію азотної кислоти.
- Промислові установки для одержання азотної кислоти.
1. Одержання водню конверсією метану. Фізико-хімічні основи процесу конверсії
Основним промисловим методом одержання водню є каталітична конверсіявуглеводневих газів (природний, попутний, нафтовий та ін.) Природний газ містить метан, вищі вуглеводні, деяку кількість азоту і вуглекислоти, а також домішки сірчистих сполук.
В процесі конверсії метан окислюється водяною парою, вуглекислотою або киснем по основним реакціям:
1. СН4+ Н2О Û СО + 3Н2 – 206,4 кДж (49,3 ккал)
2. СН4 + СО2 Û 2СО + 2Н2 – 248,3 кДж (8,5 ккал)
3. СН4 + 0,5О2 Û СО + 2Н2 + 35,58 кДж (8,5 ккал)
4. СО + Н2О Û СО2 + Н2 + 41,02 кДж (9,8 ккал)
Реакції окислення гомологів метану протікають аналогічно. Так взаємодія їх з водяною парою в загальному вигляді описується рівнянням:
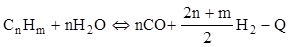
Вибір окислювача та їх можливих сполученнь визначають, як за цільовим призначенням процесу, так і за техніко-економічними розрахунками.
Якщо, необхідно одержати водень, проводять реакцію 1 або 3 з наступною конверсією СО по реакції 4. Для одержання азото-водневої суміші (технологія аміаку) необхідну кількість азоту додають з повітрям на стадії конверсії, або промивкою конвертованого газу рідким азотом, яку використовують для видалення залишків СО.
Для одержання синтез-газу (СО + Н2) комбінують реакції 1,2,3, вибираючи співвідношення Н2О:СО2 в вихідній суміші, так, щоб співвідношення Н2:СО було (2-2,3):1.
Для проведення в промислових умовах ендотермічних реакцій 1 та 2 необхідно підводити тепло ззовні. Якщо в конверторі протікає реакція 3 процес можливо провести автотермічно.
Склад конвертованого газу визначається положенням рівноваги реакцій 1 та 4. Константи рівноваги цих реакцій при будь якій температурі можна розрахувати за рівняннями:
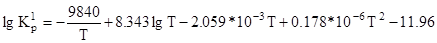
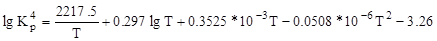
Здійснення конверсії метану та оксиду вуглецю (ІІ) водяною парою в одному конверторі з високим виходом водню неможливо, тому що ендотермічну реакцію 1 невигідно проводити при низький температурі, а екзотермічну реакцію 4 при високій. Тому на практиці одержання водню з природного газу проводять в два етапи:
1.Конверсія метану при високих температурах – для забезпечення високого ступеня перетворення метану в оксид вуглецю (ІІ);
2.Конверсія оксиду вуглецю при низьких температурах.
Найкращим каталізатором для процесу конверсії вуглеводневих газів є нікелеві, активовані оксидами алюмінію, магнію й ін. На відновлених промислових нікель-алюмінієвих каталізаторах в інтервалі температур 500—1000°С при низькому і підвищеному тисках та великих об'ємних швидкостях досягається практично рівноважне перетворення СН4. Під дією сірчистих сполук, що утримуються в газі, нікелевий каталізатор отруюється, причому зі зниженням температури процесу конверсії отруйна дія зростає. Загальний зміст сірки у вихідному углеводородном газі не повинне перевищувати 1 мг/м3 при 600—800°С и 20, 100, 300 мг/м3 відповідно при 900, 1000 і 1100°С.
2.
Промислові види каталітичної конверсії
У промисловості застосовують два основних методи каталітичної конверсії газоподібних або рідких вуглеводнів: з підведенням тепла ззовні і автотермічний метод. По першому методу необхідне для процесу тепло підводиться до зовнішньої поверхні труб, виготовлених з жароміцного сплаву і заповнених нікелевим каталізатором. Тепло надходить від розпечених стінок топкової камери, де спалюється газоподібне або рідке паливо з надлишком повітря. Суміш вуглеводню з водяною парою або з О2 безупинно проходить через труби з каталізатором.
Для одержання технічного Н2, застосовуваного для різних процесів гідрування, параметри процесу парової конверсії СН4 вибирають з розрахунку одержання після трубчатої печі конвертованого газу зі вмістом СН4 1—2%. Якщо потрібно одержати технологічний газ для синтезу NН3 зі змістом 0,2—0,3% СН4, процес проводять у дві ступіні. У першій ступіні -трубчатої печі — при температурі 800—820°С на виході із шару каталізатора СН4 реагує з водяною парою приблизно на 70%. Потім газ зі змістом 8—10% залишкового СН4 направляється на другу ступінь — реактор шахтного типу, куди подається повітря в кількості, необхідній для одержання азото-водневої суміші стехіометричного складу. За рахунок спалювання частини газу з повітрям температура піднімається приблизно до 1000°С и залишковий СН4 реагує практично цілком.
По другому методу конверсія вуглеводнів з одержанням газу, що містить 0,2—0,3% СН4, відбувається в одну ступінь у реакторі шахтного типу. При цьому до вихідного парогазовой суміші додають технічний О2 або повітря, збагачене О2 (40—45% 02). Тепло, що виділяється в початковому шарі каталізатора при протіканні екзотермічних реакцій вуглеводнів із О2, компенсує витрати тепла на ендотермічні реакції з водяною парою. Це дозволяє проводити процес конверсії автотермічно, тобто без підведення тепла ззовні.
3.
Технологічна схема двоступінчастого методу конверсії природного газу
Схема процесу представлена на рис. 1. Природний газ, що надходить з магістрального газопроводу під тиском 9,80665 *105 Па, стискується до 41,188-105 Па і нагрівається до 380—400°С в теплообміннику 6 за допомогою димових газів, що відходять із трубчастої печі 2. Далі газ направляється в реактор сіркоочистки , заповнений поглиначем на основі ZnО, для очищення від органічних і неорганічних сполук сірки.
Якщо в природному газі поряд з меркаптанами є дисульфіди й інші стійкі сполуки сірки, то їх необхідно попередньо гідрувати. Для цього до природного газу додають азотоводневу суміш у такій кількості, щоб у суміші утримувалося 5—10% Н2. Цю суміш при температурі 380—400°С пропускають спочатку через поглинач на основі ZnО, потім через кобальтомолибденовый каталізатор для гідрування стійких органічних сполук сірки в Н2S, що далі адсорбуєтся поглиначем на основі ZnО.
4.
Високотемпературна некаталітична конверсія метану
Природний газ підігрівають до температури 450˚С за рахунок спалювання частини газу. Нагрітий газ направляють в пальник конвертору, куди подається також кисень. На виході з пальнику газо-киснева суміш спалюється – при температурі 1400-1450˚С відбувається часткове окислення метану. Конвертований газ з вмістом метану 0,3-0,5% та сажі 20 мг/м3. з зони реакції поступає в казан-утилізувач. За рахунок охолодження конвертованого газу до t=250˚C в казані-утілізувачі утворюється пара з тиском 35ат. Потім газ охолоджується до температури 170˚С в теплообміннику нагріваючи хімічноочищену воду.
Очистка газу від сажі проводиться зрошенням водою - водночас він насичується водяною парою і охолоджується до температури 125˚С. Далі газ піддається конверсії оксиду вуглецю.
Процес високотемпературної некаталітичної конверсії метану застосовують у виробництві ацетілену та захисних атмосфер для металургійної промисловості та виробництва листового скла.
5.
Одержання водню та азотоводневої суміші газіфікацією твердих палив
Газифікація - високотемпературний процес взаємодії вуглецю палива з окислювачами, що проводиться з метою отримання суміші горючих газів (H2, CO, CH4). Як окиснювачі або газифікуючі агенти застосовують кисень, водяну пару, двоокис вуглецю або суміш цих речовин. У залежності від складу, співвідношення початкових речовин, температури, тривалості взаємодії можна отримати газові суміші різного складу. Процес газифікації в промислових умовах проводять в спеціальних апаратах, що називають газогенераторами, а газову суміш, яку одержують в результаті процесу – генераторним газом.
Таблиця 1.
Середній склад генераторного газу
| Вид дуття |
Склад, % об'ємні |
| СО |
Н2 |
СО2 |
СН4 |
N2 |
| Пароповітряний |
27,8 |
12,4 |
3,6 |
0,2 |
56,0 |
| Парокисневий |
40,0 |
41,0 |
16,5 |
0,9 |
1,6 |
| Повітря |
22,8 |
8,0 |
5,1 |
- |
64,1 |
Загальні принципи роботи газогенераторів можна розглянути на прикладі найпростішого шарового газогенератора, який являє собою вертикальну шахту, у верхній частині якої є завантажувальний люк із затвором. У нижній частині газогенератора встановлено колосникові грати, через які в шахту подають газифікуючий агент. Зверху поступає тверде паливо.
При подачі в газогенератор кисню в зоні, розташованій безпосередньо біля колосникових грат (зона горіння або окиснювальна зона) відбувається горіння твердого палива:
2С + О2 = 2СО + 218,8, МДж/кмоль
С + О2 = СО2 + 394,4, МДж/кмоль .
Діокис вуглецю, що утворюється, відновлюється у відновній зоні новими порціями вуглецю:
СО2 + С = 2СО - 175,6, МДж/кмоль
Якщо разом з киснем в генератор подають водяну пару, то у відновній зоні протікають реакції:
С + Н2О = СО + Н2 - 132,6, МДж/кмоль
С + 2Н2О = СО2 + 2Н2 - 89,5, МДж/кмоль
У цьому випадку газ, що утворюється містить два горючих компоненти: оксид вуглецю і водень, які утворилися за рахунок гетерогенних реакцій.Крім того, в газовій фазі можуть протікати гомогенні реакції між газоподібними продуктами:
СО + Н2О = СО2 + Н2 + 43,1, МДж/кмоль,
СО + 3Н2 = СН4 + Н2О + 203,7, МДж/кмоль.
Метан в умовах процесу схильний до термічного розпаду:
СН4 = С + 2Н2 - 71,1, МДж/кмоль.
Поєднання цих і деяких інших реакцій визначає склад газів, що утворюються по висоті газогенератора. З відновної зони гази виходять з температурою 800-9000С. Проходячи через вугілля, що росташоване вище, вони нагрівають його, внаслідок чого протікає процес піролізу. Ця зона називається зоною піролізу або зоною напівкоксування. Гази, що виходять з неї, підігрівають і сушать вугілля у верхній зоні - зоні сушки. Дві нижні зони (окиснювальна і відновна) складають зону газифікації, а дві верхні - зону підготовки палива.
У цьому процесі змінюється і склад твердої фази, оскільки в зону газифікації поступає кокс або напівкокс, а з неї виводиться зола.
Процес газифікації інтенсифікують шляхом підвищення температури, збільшення тиску газифікації, що дозволяє значно збільшити парціальні тиску реагуючих речовин, а також досягти збільшення швидкості дуття, концентрації кисню в дуття і збільшення реакційної поверхні.
На перших промислових установках як сировину використовували кам'яновугільний кокс, а згодом замість коксу газіфкації стали піддавати антрацит, кам'яне і буре вугілля, торф та інші види твердого палива.
6.
Електрохімічні методи одержання водню
Електрохімічними називаються виробництва, у яких хімічні процеси протікають під дією постійного електричного струму.
Електрохімічні методи виробництва в ряді випадків мають переваги перед хімічними: спрощується технологічний процес, більш повно використовується сировину й енергія, одночасно може вироблятися кілька коштовних продуктів, продукти виходять високого ступеня чистоти, недосяжної при хімічних способах виробництва. Завдяки зазначеним достоїнствам електрохімічні методи охоплюють численні і різноманітні виробництва, найважливішими з яких є одержання водню, хлору, лугів, кисню, неорганічних окислювачів.
Серед електрохімічних процесів розкладання водних розчинів без виділення металів найбільше поширення одержав електроліз водних розчинів хлористого натрію. При електролізі водних розчинів хлористого натрію одержують водень, хлор і їдкий натр
З трьох продуктів електролізу розчинів повареної солі водень – найменш коштовний продукт. Однак його правильне і повне використання має істотне значення для економіки хлорного виробництва. У процесі електролізу одержують до 310 м3 водню на одну тонну хлору.
Електроліз розчинів хлористого натрію у ваннах зі сталевим катодом і графітовим анодом дає можливість одержувати їдкий натр, хлор і водень в одному апараті (електролізері). При проходженні постійного електричного струму через водний розчин хлористого натрію можна чекати виділення хлору:
2Cl- - 2ē =Cl2
а також кисню:
2OH- - 2ē = 0.5O2 + H2O
або:
H2O - 2ē = 0.5O2 + 2Н+
Процес розкладання хлориду натрію можна виразити, реакціями:
2Cl- - 2ē =Cl2
2 H2O + ē = 2Н+ + 2OH-
2Н+ = Н2
2Н2 + 2Cl- = Cl2 + H2 + 2OH-
або
2 H2O + 2NaCl = Cl2 + H2 + 2NaOH
Таким чином, на аноді йде утворення хлору, а на катоді – водню і їдкого натру.
7. Одержання водню електролізом води
Найбільш простий метод одержання практично чистих водню та кисню – електролітичне розщеплення води під впливом постійного електричного струменя – 1,9-2,5В. Через великі витрати електричної енергії цей метод не знайшов широкого застосування. Водень методом електролізу води одержують в електролітичних ваннах. Для збільшення електропровідності води до неї додають деяку кількість NaOH або KOH.
Процес описується рівнянням:
2H2O=2H++2OH-
На катоді 2H++2e=2Ho 2H=H2
На аноді 2OH—2e=0,5O2+2H2O
Для того, щоб не допустити утворення грімучої суміші катод відокремлюють від аноду перегородкою з азбестовоъ тканини, через яку легко проникають іони водню і гідроксил-іони але не можуть проникнути гази.
Водень та кисень, що утворюються відводять по окремим трубопроводам, очищують від розчину лугу і направляють споживачам.
В промислових умовах як електроліт використовують розчин їдкого калі. аноди виготовляють з нікелю, катоди з залізу. Для одержання 1000м3 водню витрачається 4500-6000квт*ч електроенергії, 2,5кг лугу, 1000л дистильованої води та 200л охолоджуючої води.
конверсія каталітичний вуглеводень газ
8. Технологія аміаку
Аміак – ключовий продукт різних азотвміщуючих речовин. Склад його був установлений Бертоллі в 1784 р.
В даний час в усім світі виробляється ~5 млн. тон аміаку. Близько 80% зробленого аміаку застосовується для одержання азотних добрив.
Таблиця 2. Застосування аміаку
| Галузь застосування |
Приклади продуктів |
| Добрива |
Сульфат амонію, карбамід, нітрат амонію |
| Синт. волокна й ін. полімери |
Нейлон, віскоза, поліуретан |
| Холодильна техніка |
Рідкий аміак |
| Сухі гальванич. елементи, флюси |
Хлорид амонію |
| Вибухові речовини |
Концентрована азотна кислота |
| Барвники |
Азосполуки |
Сучасний процес синтезу аміаку заснований на його синтезі з азоту і водню при температурі 380-450К і тисках > 10МПа з використанням залізного каталізатору. Винайдено цей процес був у 1908 р. Фрицем Габером. Відкриття Габера дозволило продовжити Німеччини виробництво вибухових речовин під час першої світової війни. У цей час блокада Антанти перешкоджала ввозові в Німеччину чилійської селітри – сировини для виробництва вибухівки.
9. Фізико-хімічні основи процесу
Синтез аміаку з елементів здійснюється по рівнянню реакції:
N2+3H2=2NH3+ Q
Реакція оборотна, екзотермічна
ΔH298=-91,96кДж/моль
ΔH725=-112,9кдж/моль
Щоб процес синтезу аміаку був максимально ефективним й економічним, необхідно ретельно підібрати умови його проведення. найважливішими показниками, що враховуються при цьому є:
- вихід,
- швидкість,
- енергоємність процесу.
т.е. необхідно вивчити вплив тиску температури, каталізаторів на ефективність цього процесу.
Вплив тиску
Константа рівноваги процесу визначається рівнянням:
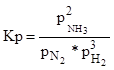
Виразивши парциальні тиски через мольні частки і повний тиск, одержимо:
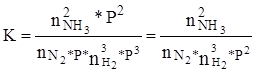
Оскільки, константа рівноваги при даній температурі величина постійна, то ріст тиску викликає зменшення величини nNH3. т.ч. дозволить збільшити ріст аміаку.
Вплив температури і каталізаторів
Практичний вихід аміаку завжди менше рівноважного і, як правило, не перевищує 70% рівноважного. Оскільки, процес екзотермічний, то ріст температури викликає зниження рівноважного виходу аміаку, однак при низьких температурах знижується швидкість реакції, а, отже, і продуктивність процесу. Т.ч. варто вибрати оптимальну температуру, що забезпечує максимальний практичний вихід аміаку
Швидкість реакції підвищують завдяки використанню каталізатору. Досить високу активність у процесах синтезу показали:
Fe, Os, U, Mo, W, Mn
Кращим для промислового застосування є залізний каталізатор, що зберігає свою активність 450-500˚С, коли можливий відносно високий вихід аміаку. Каталітичними отрутами для нього є сполуки сірки, фосфору, миш'яку. У виробництві використовують каталізатори, що містять 26-36% Fe, ~54%Fe2O3 і промотори –Al2O3, K2O, Ca, Si2, Mg. Активність таких каталізаторів при температурі 450˚З, тиску 30МПа й об'ємної швидкості 30000година-1 складає 18-20%.
10. Промислові способи синтезу аміаку
Звичайно схема аміачного заводу, що працює на природному газі, включать трохи 8 стадій:
1-я стадія – Видалення сірки з природного газу;
2-я стадія – парова конверсія метану;
3-я стадія – впуск повітря і паро-повітряна конверсія метану.
4-я стадія – окислювання монооксида вуглецю по реакції:
CO+H2O=CO2+H2
Цей процес проводиться в двох реакторах. У першому проводиться так звана середньотемпературна конверсія монооксиду вуглецю – температура 400°С, каталізатор – залізохромовий. В другому реакторі – низькотемпературна конверсія монооксиду вуглецю – застосовується каталізатор, що містить мідь, температура 220°С.
5-я стадія – Вимивання диоксида вуглецю з газової суміші за допомогою буферного лужного розчину карбонату калію або етаноламіну. Диоксид вуглецю звичайно скраплюють і використовують для виробництва карбаміду.
6-я стадія – Видалення залишків монооксиду вуглецю шляхом конверсії в метан на нікельвміщуючому каталізаторі.
7-я стадія – АВС піддають стискові, а потім охолодженню.
8-я стадія – Газ з компресору надходить у колону синтезу аміаку, що складається з колони синтезу і конденсатору.
Газова суміш, що виходить з колони синтезу містить близько 15% аміаку.
11Агрегати синтезу аміаку
Агрегати синтезу аміаку можна розділити на три категорії:
- низького тиску 10-16 МПа;
- високого тиску 80-100МПа;
- середнього тиску 20-50МПа.
Реактори синтезу аміаку є основними і найбільш складними апаратами установок синтезу. Вони визначають продуктивність системи, стабільність її роботи, тривалість експлуатації й економічну ефективність. У загальному виді реактор синтезу аміаку являє собою колонний апарат, усередині якого розміщена насадка, що складається з катализаторной коробки і теплообмінних елементів. Внутрішня частина колони синтезу призначена в основному для розміщення каталізатора. Від кількості каталізатора, його активності і режиму роботи залежить продуктивність реактора і всієї системи синтезу аміаку. Оптимальний температурний режим у реакційній зоні – 475-525°С.Для забезпечення цього режиму необхідно безупинно відводити з реакційної зони теплоту, еквівалентну кількості аміаку, що утворився. Спроби створити стабільний і оптимальний режим у колоні синтезу привели до розробки численних різновидів конструкцій реакторів синтезу аміаку
По конструктивних ознаках їх можна розділити на наступні групи:
- Трубчасті реактори з теплообмінниками.
- Полочні адіабатичні реактори – у цих реакторах процес синтезу і тепло відвід здійснюється східчасто на кожній полиці.
- Радіальні реактори – газовий потік рухається радіально чрез шар каталізатора.
- Горизонтальні камерні реактори – з поперечним рухом газового потоку через каталізатор.
- Комбіновані реактори.
Існує також двоступінчастий агрегат синтезу, де процес проводять у двох реакторах з виносними теплообмінниками, що відрізняються від колони синтезу меншими розмірами устаткування.
Більшість схем виробництва аміаку й азотної кислоти вважаються енерготехнологічними.
В установках синтезу аміаку під тиском 30,4МПа тепло реакції синтезу використовується для одержання пари. тиску 2,5-4,0 МПа в кількості 0,8т на 1т аміаку.
В установках синтезу аміаку під тиском 50,7 МПа тепло реакції синтезу використовується для одержання пари в кількості 0,8-0,9т/т аміаку.
Так, трубчаста піч первинного риформингу обладнана допоміжним казаном для одержання додаткової кількості пари високого тиску. У казанах-утилізаторах, установлених після конвертора метану другої ступіні одержують пара тиском 10,6 МПа.
12
Технологія азотної кислоти
Одержання азотної кислоти засновано на процеси Оствальда. Цей процес складається з 3-х стадій:
1. Каталітичне окислювання аміаку:
Аміак змішують з повітрям і пропускають над поверхнею Pt-Rh каталізатору, нагрітого до 900 ˚С
4NH3+5O2=4NO+6H2O ΔH=-905,6 кДж (1)
2. Одержання діоксиду азоту:
Гази, отримані на 1-й стадії, прохолоджують і змішують з повітрям
2NO+O2=2NO2 (2)
3. Одержання розведеної азотної кислоти:
3NO2+H2O=2HNO3+NO
При контактному окислюванні аміаку можливі наступні реакції:
4NH3+4O2=2N2O+6H2O
4NH3+6NO=5N2+6H2O
Ступінь перетворення аміаку в цих реакціях близька до 100% при температурі 750°С. Під час відсутності каталізатора найбільш швидкою є реакція, що протікає з утворенням азоту
В азотнокислому виробництві процес проводять на каталізаторах селективно прискорюють реакцію з утворенням NO. В основному застосовують платинові каталізатори.
На цих каталізаторах реакції окислювання протікають у дифузійній області.
Підвищення t прискорює процес, його проводять при температурі 800°С при атмосферному тиску і при температурі 900ºС при підвищеному тиску.
Підвищення тиску прискорює процес окислювання аміаку, тому що збільшуються концентрації реагентів, і зменшується обсяг газової суміші. Звичайно використовують надлишково тиск 1,8-2,0МПа.
Склад газової суміші. Для збільшення ступеня окислювання аміаку застосовують аміачно-повітряну суміш зі змістом аміаку 9,5-10,5%.
Промислові каталізатори. Каталізатори окислювання аміаку – сітки, виконані зі сплаву платіни з 4% палладія і 3% родію. На 1м2 активній поверхні окисляється до 600кг аміаку в добу. З метою економії платіни застосовують двох стадійне контактування, при якому аміак частково окислюється на платінових сітках, а потім доокислюється в шарі неплатинового зернистого каталізатора, що містить оксиди хрому.
Процес окислювання NO до NO2
Утворення діоксиду азоту відбувається при температурі до 700?З, а при температур <100°С рівновагу майже цілком зрушено вправо. Процес протікає в двох стадій:
2NO=N2O2
N2O2+O2=2NO2
Може протікати реакція:
2NO2=N2O4
Т.о. у нитрозных газах, що надходять на абсорбцію утримуватися:
NO2, O2, N2O4, N2O, NO, N2O2, N2, і т.д.
13.
Промислові установки для одержання азотної кислоти
Для одержання розведеної азотної кислоти з аміаку в промисловості використовуються три системи:
- під атмосферним тиском;
- під підвищеним тиском;
- комбіновані, у яких окислювання аміаку проходить під атм. тиском, а окислювання оксиду азоту й абсорбція водою під підвищеним тиском.
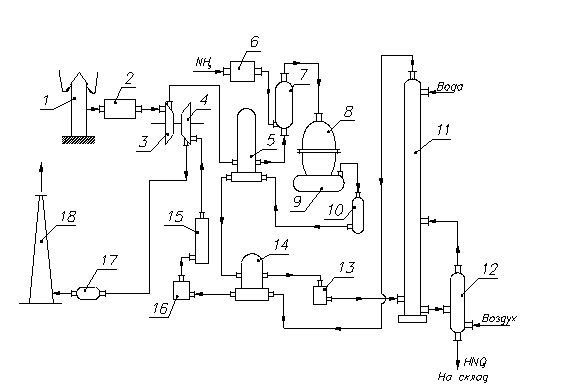
Рис. 2. Принципова технологічна схема одержання розведеної азотної кислоти під підвищеним тиском (0,73 МПа):
1 - повітрянозаборна труба; 2 – очищувач повітря; 3 - газовий компресор; 4 - газова турбіна; 5 - повітропідігрівник; 6 - випарник аміаку; 7 – змішувач з фільтрам; 8 - контактний апарат; 9, 17 - казан утилізатор; 10 - окислювач з фільтром; 11 - абсорбційна колона; 12 - отдувочна колона; 13 – холодильник- конденсатор; 14 - підігрівник хвостових газів; 15 - реактор каталітичного очищення; 16 - камера згоряння; 18 - вихлопна труба.
Сучасні установки, що працюють під підвищеним тиском ( від 0,2 до 1Мпа) і комбіновані розроблені за принципом енерготехнологічних схем, у яких енергія газів, що відходять, зв'язана з їхньою високою температурою і тиском, і теплота реакції окислювання аміаку використовується для стиску повітря і нітрозних газів, а також для одержання технологічної пари.
Технологічна схема одержання азотної кислоти включає наступні технологічні вузли:
1. Стиску повітря і підігріву його до 250°С за рахунок тепла нітрозних газів.
2. Окислювання аміаку при температурі 900°С
3. Утилізація тепла в казані-утилізаторі з утворенням пари
4. Окислювання NO до NO2
5. Абсорбція оксиду азоту водою
6. Каталітичне очищення хвостових газів
Ступінь перетворення аміаку 92-94%, концентрація кислоти 62-64%.
Висновок
У процесі виконання роботи були розглянуті питання з:
- Одержання водню конверсії метану;
- Фізико-хімічні основи процесу конверсії;
- Промислові види каталітичної конверсії;
- Технологічна схема двоступінчастого методу конверсії природного газу;
- Високотемпературна некаталітична конверсія метану;
- Одержання водню та азотоводневої суміші газіфікацією твердих палив;
- Електрохімічні методи одержання водню;
- Одержання водню електролізом води;
- Технологія аміаку;
- Промислові способи синтезу аміаку;
- Агрегати синтезу аміаку;
- Технологія азотної кислоти;
- Процес окислювання NO до NO2;
- Промислові установки для одержання азотної кислоти та ін..
Література
1. Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1991.-С.327, 334-349
2. Кутепов А.М. и др. Общая химическая технология. – М.: Высшая школа, 1990.-С.325-336
|