ГОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова
Кафедра фармацевтической химии с курсом токсикологической химии
Курсовая работа на тему:
"Рефрактометрический метод в экспресс-анализе лекарственных форм"
Подготовил:
Студент 5 курса 17 группы дневного отделения Жуков А.М.
Проверила:
Щепочкина О.Ю.
Москва, 2011 год
Рефрактометрия, выполняющаяся с помощью рефрактометров, является одним из распространённых методов идентификации химических соединений, количественного и структурного анализа, определения физико-химических параметров веществ.
Области применения этого метода: в пищевой промышленности для измерения содержания спирта в алкогольных продуктах, установления качества пищевых продуктов, в медицине и фармакологии для определения количества глюкозы в биологических жидкостях и лекарственных средств в растворах. Газовые интерференционные рефрактометры применяются для определения состава газов, в частности, для определения содержания горючих газов в воздухе шахт, поиска утечек в сетях газоснабжения.
Цель данной работы:
Выяснить актуальность данного метода анализа лекарственных веществ для среднестатистической аптеки.
Задачи:
Изучить рефрактометрический метод анализа лекарственных веществ;
Выяснить, какие на данный момент существуют рефрактометры;
Выяснить актуальность рефрактометрического метода анализа для аптеки.
Рефрактометрия
(от лат. refractus
- преломленный и греч. metreo
- измеряю) - метод анализа, основанный на явлении преломления света при прохождении из одной среды в другую. Преломление света, то есть изменение его первоначального направления, обусловлено различной скоростью распределения света в различных средах.
При этом отношение синуса угла падения луча (α) к синусу угла преломления (β) для двух соприкасающихся сред есть величина постоянная, называемая показателем преломления (n).
Показатель преломления также равен отношению скоростей распространения света в этих средах:

В лабораторных условиях обычно определяют так называемый относительный показатель преломления вещества по отношению к воздуху помещения, где ведется измерение. Показатель преломления измеряют на приборах рефрактометрах различных систем. Обычно измерение показателя преломления на рефрактометрах Аббе, в основу принципа, действия которого положено явление полного внутреннего отражения при прохождении светом границы раздела двух сред с различными показателями преломления.
Диапазон измеряемых показателей преломления при измерении в преходящем свете 1,3-1,7.
Точность измерения показателя преломления должна быть не ниже +2·10-4
.
Величина показателя преломления зависит от природы вещества, длины волны света, температуры, при которой проводится измерение и концентрации вещества в растворе. Измерение показателя преломления проводится при длине волны света 589,3 нм (линия в спектра натрия). Обязательным условием определения показателя преломления является соблюдение температурного режима. Обычно определение выполняется при 20±0,30С. При повышении температуры величина показателя преломления уменьшается, при понижении - увеличивается. Поправку рассчитывают по следующей формуле:
n1=n20
+ (20-t) ·0,0002
Показатель преломления, измеренный при 200
С и длине волны света 589,3 нм, обозначается индексом n20
.
Показатель преломления как константа может быть использован для идентификации тех лекарственных препаратов, которые по своей природе являются жидкостями. Согласно ФС определяют показатель преломления для идентификации галотана (фторотана), никетамида (диэтиламида кислоты никотиновой), токоферола ацетата, а также жирных и эфирных масел (персикового, касторового, эвкалиптового и др.). Рефрактометрия в фармацевтическом анализе широко используется для количественного определения веществ в растворе, особенно в практике внутриаптечного контроля. Примечание.
При концентрации вещества менее 3 - 4%
не рекомендуется использовать метод рефрактометрии.
Зависимость показателя преломления от концентрации вещества в процентах выражается формулой:

где n и n0 - показатели преломления раствора и растворителя; С - концентрация вещества в растворе; F - фактор показателя преломления. Показатель преломления раствора складывается из показателя преломления растворителя и показателей преломления растворенных веществ.
Для растворов, содержащих два или более веществ, формула будет иметь следующий вид:
n=n0+n1+n2+…
Фактор показателя преломления (F) - это величина прироста показател
я
преломления при увеличении концентрации на каждый процент. Значение факторов показателей преломления устанавливают экспериментально для каждого вещества и каждого процента концентрации. У некоторых веществ (калия йодид, магния сульфат, глюкоза безводная) величина фактора постоянная и не зависит от концентрации раствора. Факторы большинства веществ в растворах разных концентраций несколько отличаются друг от друга.
Значения показателей преломления и факторов для различных концентраций растворов лекарственных веществ приведены в рефрактометрических таблицах, которые имеются в руководстве по внутриаптечному контролю. Использование таблиц значительно упрощает расчеты.
Зависимость показателя преломления водных растворов некоторых веществ от концентрации:
рефрактометрия лекарственная форма аптека

Определение концентрации вещества в растворе.
В рефрактометрии используют два способа расчета концентрации вещества в растворе по измеренному показателю преломления.
1. Расчет концентрации по формуле:

Значение фактора показателя преломления берется из рефрактометрических таблиц.
Расчет концентрации по рефрактометрическим таблицам. Измерив показатель преломления, в таблице находят соответствующее ему значение концентрации. Если измеренный показатель преломления в таблице не приведен, проводится интерполирование.
Рефрактометрический метод используется для количественного определения концентрированных растворов.
Концентрированные растворы
- это рабочие растворы ЛВ определенной, более высокой концентрации, чем эти растворы прописываются в аптеках.
При приготовлении концентрированных растворов следует избегать концентраций близких к насыщенным, т.к. при понижении температуры раствора возможна кристаллизация растворенного вещества.
Отклонения, допускаемые в концентратах:
при содержании ЛВ до 20% - не более ± 2% от обозначенного процента;
при содержании ЛВ свыше 20% - не более ± 1% от обозначенного процента (Пр. МЗ РФ от 16.10.97).
Формулы расчета для исправления концентрации растворов,
изготовленных массообъемным способом.
1) Концентрация раствора оказалась выше требуемой.
Объем воды, необходимый для разбавления полученного раствора вычисляют по формуле:

где Х - количество воды, необходимое для разбавления изготовленного раствора (мл.);
А - объем изготовленного раствора (мл.);
В - требуемая концентрация раствора (%);
С - фактическая концентрация раствора (%).
2) Концентрация раствора оказалась ниже требуемой.
Массу ЛВ для укрепления полученного раствора вычисляют по формуле:

где Х - масса вещества, которую следует добавить к раствору (г);
А - объем изготовленного раствора (мл.);
В - требуемая концентрация раствора (%);
С - фактическая концентрация раствора (%);
r20 - плотность раствора при 200С (г/мл, г/см3)
Рефрактометры, наиболее подходящие для аптек.
Рефрактометр ИРФ-454 Б2М
Рефрактометр ИРФ-454Б2М предназначен для измерения показателя преломления и средней дисперсии неагрессивных жидкостей и твердых тел.
Рефрактометр ИРФ-454 Б2М обладает рядом достоинств:
быстротой измерения;
простотой обслуживания;
минимальным расходом исследуемого вещества, что особенно важно при работе с дорогостоящими материалами.
Рефрактометр ИРФ-454 Б2М применяется:
1. В МЕДИЦИНСКИХ УЧРЕЖДЕНИЯХ для определения белка в моче, сыворотке крови, плотности мочи, анализ мозговой и суставной жидкости, плотности субретинальной и других жидкостей глаза. Использование рефрактометра позволяет значительно сократить затраты времени при массовых обследованиях пациентов.
2. В ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ рефрактометр ИРФ-454б2м может применяться для исследования водных растворов различных лекарственных препаратов: кальция хлорида (0% и 20%); новокаина (0,5%, 1%, 2%, 10%, 20%, 40%); эфедрина (5%); глюкозы (5%, 25%, 40%); магния сульфата (25%); натрия хлорида (10%); кордиамина и т.д.
3. В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ:
на сахарных и хлебных заводах, кондитерских фабриках для анализа продуктов и сырья, полуфабрикатов, кулинарных и мучных изделий рефрактометр ИРФ-454 б2м определяет влажность меда (до 20 %)
для определения доли сухих веществ в различных суслах (ГОСТ 5900-73), "промочке", сахароаграровом сиропе, сиропе для мармелада, зефира, кремов и пряников, "тиражки" для пряников;
для определение массовой доли растворимых сухих веществ по сахарозе (BRIX) в продуктах переработки плодов и овощей, для определения процентного содержания жира в твердых продуктах питания (пряники, вафли или хлебобулочных изделий) концентрации солей.
4. ПРИ ОБСЛУЖИВАНИИ ТЕХНИКИ рефрактометр ИРФ-454 Б2М применяется для определения с большей точностью объемной концентрации противокристаллизационной жидкости "ИМ", которая добавляется в авиационное топливо в количестве от 0,1 до 0,3%. Дальнейшая обработка результатов ведется согласно "Методическим рекомендациям по анализу качества ГСМ в гражданской авиации" Ч. II стр.159. Опыт использования рефрактометров показал, что эти приборы значительно сокращаются время и повышают достоверность получения анализов по процентному содержанию жидкости "ИМ" в авиационном топливе.
Технические характеристики:
| Диапазон измерения показателей преломления |
от 1,2 до 1,7 |
| Диапазон измерений массовой доли сухих веществ (сахарозы) в растворе |
от 0 до 100% |
| Цена деления шкалы показателя преломления |
5х10-4
|
| Предел допускаемой основной погрешности по показателю преломления nD |
±1·10-4
|
| Габаритные размеры рефрактометра, мм, не более |
170×115×270 |
| Масса рефрактометра, кг, не более |
3,5 |
| Масса рефрактометра с принадлежностями и упаковкой, кг, не более |
4,5 |
| Источник питания |
(220±22) В, 50 или 60 Гц. |
| Диапазон рабочих температур |
+10. +40°С |
Рефрактометр АЛР-3
Автоматический лабораторный рефрактометр АЛР-3 с микропроцессорным управлением предназначен для исследования концентрации широкого диапазона жидких сред как низкой, так и высокой вязкости, независимо от прозрачности и цвета.
Прибор автоматически измеряет коэффициент преломления образца раствора, вычисляет его концентрацию и представляет результат на цифровом ЖК-индикаторе. Рефрактометр имеет стандартную калибровку по концентрации сахара в воде (шкала Брикс), но может быть откалиброван на концентрацию любых растворов по желанию заказчика с записью в память соответствующих шкал.
Рефрактометр АЛР-3 измеряет температуру исследуемого раствора и производит автоматическую компенсацию ее влияния на результат измерений.
| Диапазон измерения показателей преломления |
1,320 - 1,525 |
| Рабочий диапазон измерения концентрации растворов |
0 - 90 % |
| Погрешность измерения концентрации, не хуже |
± 0,1 % |
| Температурная компенсация |
автоматическая |
| Допустимые пределы изменения рабочей температуры |
0 - 50°С |
| Габаритные размеры рефрактометра, мм, не более |
170×115×270 |
| Погрешность измерения рабочей температуры, не хуже |
± 1°С |
| Время выхода на рабочий режим после включения, не более |
5 мин |
| Время установления выходного сигнала, не более |
1 мин |
| Масса, не более |
3.0 кг |
| Наибольшие габаритные размеры |
230х220х120 мм |
| Питание |
220 В, 50 Гц |
Рефрактометрические детектор
ы В отличие от фотометрических детекторов, реагирующих только на вещества, поглощающие свет в ультрафиолетовой, видимой и инфракрасной области спектра, рефрактометрические детекторы являются универсальными. Они особенно полезны, когда вещества не имеют интенсивного поглощения в УФ свете, не флуоресцируют и не обладают электрохимической активностью. Их принцип действия основан на дифференциальном измерении показателя преломления чистого растворителя и раствора анализируемого вещества в этом растворителе. Вклад растворенного вещества в изменение показателя преломления растворителя пропорционален объемной концентрации этого вещества, причем растворитель также является детектируемым веществом, так как имеет определенный показатель преломления.
Данные детекторы обладает средней чувствительностью, их показания в сильной степени зависят от колебаний параметров, влияющих на состав подвижной фазы, таких как давление, температура и концентрация анализируемого вещества. Поэтому рефрактометрический детектор мало пригоден для градиентной хроматографии. Требуется кропотливый подбор системы растворителей, имеющих близкие показатели преломления. Только при этом становится возможным осуществить градиентное элюирование в определенных пределах концентрации смеси растворителей. Чувствительность детектора к изменениям температуры составляет для разных растворителей от 5·10-4 до 5·10-5 единиц показателя преломления на 1°С. Что касается чувствительности к давлению, она составляет 1·10-4 - 5·10-4 единиц показателя преломления на 1 МПа.
Чувствительность детектора к температуре обусловливает специальные меры по стабилизации температуры самого детектора и подвижной фазы при входе в детектор. В этом случае применение более длинных соединительных трубок на входе в детектор, действующих как теплообменники, приводит к высокому экстраколоночному расширению пиков и снижает достигнутую в колонке эффективность разделения. В хроматографе, оснащенном рефрактометрическим детектором, с целью стабилизации потока элюента и параметров удерживания сорбатов в колонке желательно применять термостатирование колонки и детектора. Для реализации максимальной чувствительности детектора на уровне 10-8 единиц показателя преломления точность термостатирования должна быть не более ±0.01°С. При хорошем термостатировании детектор мало чувствителен к изменениям расхода подвижной фазы. Он прост конструктивно, удобен в работе, недеструктивен и дает высокую воспроизводимость показаний. Недостатком детектора является его нечувствительность к веществам, имеющим показатель преломления, одинаковый с растворителем.
Работа большинства современных рефрактометрических детекторов основана на трех различных принципах измерения сигнала: отклонении, отражении и интерференции. Ниже на рисунке представлена оптическая схема рефрактометра первого типа.

Свет от лампы (1), проходит через конденсорную линзу (2), растровую решётку (3) и линзу (4), служащую для образования параллельных пучков света, которые попадают в кварцевую кювету. Кювета представляет собой две смежные призмы a, b, разделённые светопроницаемой перегородкой, образующие плоскопараллельную пластину. Призма a заполняется подвижной фазой, тогда как через призму b протекает элюат с хроматографической колонки (стрелки указывают на направление потока). При наличии разности показателей преломления в призмах, свет, падающий на входную грань кюветы преломляется на границе раздела призм и отклоняется на некоторый угол. Отклонённый свет расщепляется призмой и падает на пару фотодиодов (8). Разность сигналов обоих фотодиодов пропорциональна отклонению луча света, а, следовательно, и разности коэффициентов преломления. Установка нуля детектора осуществляется вращением плоскопараллельной пластины (7), смещающей луч света.
Другой метод измерения основан на законе отражения света (закон Френеля), согласно которому интенсивность отраженного света, падающего на поверхность границы раздела жидкости и стекла, пропорциональна углу падения и разности показателей преломления двух сред. Преимуществом детекторов, работающих на этом принципе, является меньший объем ячеек (< 3 мкл), в связи с чем они могут работать при небольших расходах элюента и с высокоэффективными колонками. Однако чувствительность таких детекторов в 50-100 раз ниже чувствительности других типов рефрактометрических детекторов, что, кстати, делает их более пригодными для градиентного элюирования. Так как детектирование происходит на границе раздела жидкости и стекла, для получения стабильной работы детектора необходимо следить за чистотой стекла.
Детектор френелевского типа включает в себя источник света, конденсор, дифференциальную ячейку стеклянные стержни, линзу и фотоприемник. В его состав входят также теплообменники и диафрагма для регулирования силы светового потока. Источник света, снабженный инфракрасным блокирующим фильтром, предназначен для создания светового потока в видимой части спектра. Конденсор предназначен для формирования плоского пучка света, падающего на ячейку. Ячейка рефрактометра изготовлена из нержавеющей стали, герметизируется защитными стеклами, призмой и тефлоновыми прокладками. Стеклянные стержни и линза фокусируют прошедшие через ячейки световые потоки на светочувствительные элементы фотоприемника. Фокусировка позволяет устранить перекрывание световых потоков, которое может привести к дифференцированию хроматографических пиков.
Работа рефрактометрического детектора третьего типа основана на интерферометрическом принципе сдвига. Лучи света от источника видимой области спектра разделяются делителем на две части, фокусируются линзой и проходят через рабочую и сравнительную ячейки объемом 5 мкл. Лучи света затем объединяются с помощью другой линзы и делителя и попадают на чувствительный элемент. Различие показателей преломления рабочего и сравнительного потока элюента приводит к разнице в длине оптического пути, которая измеряется интерферометрическим детектором как изменение длин волн света. Показания этого типа детектора имеют достаточно широкий диапазон линейности, а чувствительность в 10 раз выше, чем для других рефрактометрических детекторов. При оптимальных рабочих условиях возможно детектирование около 3 мкг/мл растворенного вещества. Детектор фиксирует любой тип анализируемых веществ, не зависимо от структуры, молекулярной массы и других физико-химических свойств. Предел обнаружения для лучших рефрактометрических детекторов достигает 108 единиц показателя преломления. Однако уровень шума в этих детекторах на 2 порядка выше шума УФ детектора. Они оптимальны для применения, когда нет необходимости в высокой чувствительности, например в препаративной ЖХ.
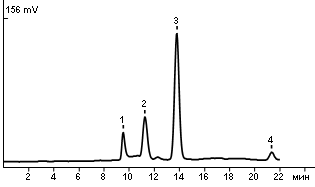
1. Сахароза 2. Глюкоза 3. Фруктоза 4. Сорбит Хроматограмма яблочного сока. Колонка: Rezex RCM-Monosaccharide 300х7.8 мм 8 мкм, защитная колонка: SecurityGuard Carbo-Ca2+ 4х3.0 мм, режим разделения: изократический, подвижная фаза: вода, расход: 0.6 мл/мин, температура колонки: 85°С, объем пробы: 20 мкл, детектор: рефрактометрический.
Рефрактометрическое определение концентрации спирта в лекарственных формах
Спирт этиловый (этанол, Spiritus aethylicus) - один из наиболее широко используемых органических растворителей в медицинской и фармацевтической практике. Этанол обладает бактериостатическими и бактерицидными свойствами. Широко используется для получения настоек, экстрактов, лекарственных форм для наружного применения. Качество спиртовых растворов зависит от концентрации спирта, в котором растворён препарат. В каждом случае необходима оптимальная концентрация, при которой лекарственное вещество не выделится в осадок. Поэтому готовятся водно-спиртовые растворы с различной концентрацией спирта. Количественное содержание этилового спирта можно определить как химическими так и физическими методами. Физические методы определения количественного содержания спирта этилового основаны на зависимости между концентрацией спирта и температурой кипения, плотностью, поверхностным натяжением, показателем преломления (рефракции). Рефрактометрический метод анализа заключается в установлении концентрации спирта в водно-спиртовых растворах с помощью показателя преломления (рефракции) nD. Показатель преломления зависит от температуры, длины волны света, природы вещества и растворителя, концентрации вещества. Экспериментально установлено, что показатель преломления спирто-водных растворов от 1% до 70% - увеличивается, от 70% до 80%> - прирост незначительный, от 80% до 90% - прирост не обнаруживается, а от 90% до 96% - приобретает отрицательную величину. Таким образом, рефрактометрическим методом можно определить крепость спирта в пределах от 1% до 70%.
Практическая часть
В практической части рассмотрим применение рефрактометрии при изготовлении и анализе раствора глицерина 10% для инъекций Раствор глицерина 10% - 1000 мл Состав. Глицерина 100,0 г (в пересчете на безводный)
1. Натрия хлорид 9,0 г Воды д/и до 1л Изготовление
. От производителей поступает глицерин (высший сорт, динамитный) с количественным содержанием 86 - 90% и 94 - 98% и более. Поэтому, чтобы рассчитать кол-во исходного глицерина, необходимо точно знать, какова в нем массовая доля безводного вещ-ва. С этой целью применяют рефрактометрию
. Показатель преломления исходного глицерина n= 1, 4569 соответствует массовая доля безводного вещества 89% (или 0,89). Исходное кол-во глицерина (mглиц, г), которое требуется для изготовления раствора по прописи 68:
2. m глиц = 100 г/ 0,89 = 112, 36 г Количественное определение глицерина в растворе. Вычисляем концентрацию глицерина:
С глиц = [n - (n0 + CNaCl* FNaCl)] / Fглиц, n - показатель преломления раствора;
n0 - показатель преломления воды очищенной, измеренный при той же температуре С NaCl - концентрация натрия хлорида в растворе, определенная методом аргентометрии FNaCl - фактор показателя преломления раствора натрия хлорида для найденной концентрации Fглиц - фактор преломления 10% раствора глицерина (0, 001156)
Примечание:
Если для одного из веществ, входящих в раствор, фактор показателя преломления неизвестен или не значительная его концентрация не позволяет получить точных данных, то готовят контрольный раствор, содержащий это вещество в той концентрации, которая была определена титрометрическим методом.
· Натрия бромида 2,0
Магния сульфата 5,0
Раствора глюкозы 20% - 200,0 мл В этом случае натрия бромид определяют методом аргентометрии (титрант - 0,1 н. раствор нитрата серебра, индикатор - бромфенольный синий), магний сульфат - методом комплексонометрии (титрант - 0,05 М раствор трилона Б, индикаторная смесь кислотного хром-черного специального). Глюкозу в присутствии натрия бромида целесообразно определить рефрактометрическим
методом. Расчет содержания глюкозы в процентах (С глк) выполняют по формуле:
· С глк = [n - (n0 + Cnabr* Fnabr+ Cmgso4)] / Fглк, где n - показатель преломления раствора n0 - показатель преломления воды очищенной, измеренный при той же температуре С nabr - концентрация натрия бромида в растворе, определенным методом Fnabr - фактор показателя преломления раствора натрия бромида для найденной концентрации Cmgso4 - концентрация магния сульфата (mgso4 * 7H20) в растворе, определенным методом комплексонометрии Fmgso4 - фактор показателя преломления раствора для найденной концентрации Fглк - фактор показателя преломления раствора глюкозы Раствор глюкозы 10 % - 100 мл.
Подлинность.
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты. После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают. Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.

Количественное определение.
Проводят методом рефрактометрии.
Показатель преломления глюкозы: 1,3473.
По рефрактометрической таблице находим, что фактор преломления F для растворов глюкозы равен 0,00142, показатель преломления воды равен 1,333.
С = (1,3473 - 1,3330) /0,00142 = 10, 07 %
Относительное отклонение:
10,07 - 10/10 *100% = 0,7 %
Допустимое отклонение + - 2%
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Раствор Магния сульфата 25% - 100 мл.
Подлинность.
Магний-ион:
К 2-3 каплям раствора прибавляют 1 мл воды, по 0,5 мл раствора аммония хлорида, натрия фосфата и аммиака; образуется белый кристаллический осадок, растворимый в разведенной уксусной кислоте и нерастворимый в избытке раствора аммиака.

Сульфат-ион:
К 2-3 каплям раствора прибавляют 3-5 капель воды и 2-3 капли раствора бария хлорида; образуется осадок, нерастворимый в разведенных минеральных кислотах.

Количественное определение.
Измеренный показатель преломления составил 1,3551.
Находим в рефрактометрической таблице ближайшие значения - 1,3550 и 1,3560.
Им соответствуют концентрации 24,7% и 25,92%.
Рассчитываем, насколько изменяется концентрация при изменении преломления на 0,0001:
(25,92% - 24,7%) / 10 = 0,122%
Отсюда, показателю преломления 1,3551 соответствует концентрация:
24,7% + 0,122% = 24,82%.
Допустимое отклонение в соответствии с приказом № 305 от 16.10.97 составляет +-2%
Относительное отклонение:
24,82-25/25 * 100% = 0,7 %
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Натрия бромида 2,0
Магния сульфата 5,0
Раствор глюкозы 20% - 200 мл
Подлинность.
Магний-ион:
К 2-3 каплям раствора прибавляют 1 мл воды, по 0,5 мл раствора аммония хлорида, натрия фосфата и аммиака; образуется белый кристаллический осадок, растворимый в разведенной уксусной кислоте и нерастворимый в избытке раствора аммиака.

Сульфат-ион:
К 2-3 каплям раствора прибавляют 3-5 капель воды и 2-3 капли раствора бария хлорида; образуется осадок, нерастворимый в разведенных минеральных кислотах.

Глюкоза:
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты.
После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают.
Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.
Схемы реакций см. стр.15.
Натрия бромид:
Натрий-ион:
Небольшое количество ЛФ внесенное в пламя горелки, окрашивает его в жёлтый цвет.
Бромид-ион:
0,5 мл ЛФ помещают в пробирку, добавляют 2-3 капли разведенной хлороводородной кислоты, 3-5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают.
Наблюдаем окрашивание хлороформного слоя в желтый цвет.

Количественное определение.
Количественное определение натрия бромида:
Аргентометрия.
Методика количественного определения:
0,5 мл испытуемого раствора поместили в пенициллиновый флакон, добавили 2 капли хромата калия, титруем 0,1М раствором нитрата серебра до окрашивания осадка в оранжево-бурый цвет.

Т=0,01029
а=0,5
VТ=0,49
x = (0,01029 x 0,49 х 100%) / 0,5 = 1,0%
Допустимое отклонение (пр. № 305) ± 5%
Количественное определение магния сульфата:
Комлексонометрия.
Методика количественного определения:
0,5 мл испытуемого раствора поместили в пенициллиновый флакон, добавили 1-2 капли индикатора кислотный хром черный. Титруем раствором Трилона Б до перехода окраски из фиолетового в голубой. Добавляем аммиачный буфер для поддержания pH среды.



Т=0,01232
а=0,5
VТ=0,4
x = (0,01232 x 1,0 х 100%) / 0,5 = 2,46%
Допустимое отклонение (пр. № 305) ± 5%
Относительное отклонение: 2,46 - 2,5/2,5 * 100% = 1,44%
Количественное определение глюкозы
целесообразно проводить рефрактометрически.

С = (1, 3651 - (1.333 + 1 * 0.00131 +2,46* 0,00095) /0,00142 = 19,8%
Допустимое отклонение: + - 5%
Относительное отклонение:
19,8 - 20/20 *100% = 1 %
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Кислоты аскорбиновой 0,1
Глюкозы 0,5
Подлинность:
Кислота аскорбиновая:
0,05 - 1 г смеси растворяют в 1-2 мл воды, добавляют 1-2 капли аммиачного раствора серебра нитрата. Выпадает темный осадок.
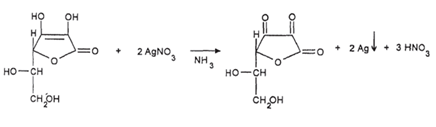
Глюкоза:
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты. После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают. Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.
Схемы реакций см. стр.15.
Количественное определение:
Кислота аскорбиновая
0,05 г порошка растворяют в 1-2 мл воды и титруют 0,1н раствором натрия гидроксида до розового окрашивания (индикатор - фенолфталеин).

Глюкоза
Растворяют 0,3 г порошка в 1-1.5 мл воды, объем доводят водой до 2 мл и определяют показатели преломления раствора и воды.
Если на титрование кислоты аскорбиновой в навеске массой 0,05 г (а1) (М=176,13 г/моль) израсходовано 4,25 мл 0,1 моль/л раствора натрия гидроксида (К=1,01), а показатель преломления раствора, полученного растворением в 2,0 мл воды навески массой 0,3 г (а2) - 1,3544
Фактор показателя преломления раствора кислоты аскорбиновой (F1) - 0,00160; безводной глюкозы (F2) - 0,00142. Показатель преломления воды - 1,333. По результатам титрования необходимо рассчитать содержание кислоты аскорбиновой (m1) в пересчете на массу порошка по прописи (Р).
Фактор эквивалентности кислоты аскорбиновой в методе нейтрализации равен 1.
Титр натрия гидроксида по кислоте аскорбиновой:

Затем рассчитывают концентрацию кислоты аскорбиновой (С1) в приготовленном для рефрактометрии растворе по формуле:

Содержание глюкозы (m2), в пересчете на массу порошка по прописи равно:
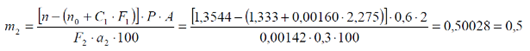
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
Вывод:
Вывод из всего написанного выше следует такой:
Рефрактометрический метод анализа, прост, быстр и удобен. Но наибольшее значение он имеет все же для пищевой промышленности и медицины (например, для определения белка).
Список литературы
1. Рефрактометрия в анализе лекарственных средств аптечного изготовления. Контроль качества лекарственных средств, изготовляемых в аптеках / ГОУ ВПО Нижегородская государственная медицинская академия Российского федерального агентства и социального развития. Кафедра фармацевтической химии и фармакогнозии - Нижний Новгород, 2008г.,19 с.
2. Компания ЕвроЛаб [Сайт компании]; http://www.eurolab.ru/refraktometriya (Дата обращения 20.12.2010)
3. Компания ЕвроЛаб [Сайт компании]; http://www.eurolab.ru/refraktometry (Дата обращения 20.12.2010)
4. Березина Е.С., Киселева А.А., Филиппова Ю.В. / Вестник Пермской государственной фармацевтической академии №2 - Пермь, 2007 г., с.123-125
5. Компания Аквилон хроматография [Сайт компании]; http://www.prochrom.ru/ru/? idp=127 (Дата обращения 20.12.2010)
|