ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ
Курсовая работа по биологической химии на тему:
БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ. ИНГИБИТОРЫ ФЕРМЕНТОВ СИНТЕЗА ДЕЗОКСИРИБОНУКЛЕОТИДОВ И ИСПОЛЬЗОВАНИЕ ИХ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Пенза 2004
СОДЕРЖАНИЕ:
Введение…………………………………………………………………………3
1. Биосинтез пуриновых нуклеотидов………………………………………...4
2. Образование AMP и GMP из IMP……………………………………………7
3. Ингибиторы биосинтеза пуринов…………………………………………….9
4. Синтез пуриновых дезоксирибонуклеотидов………………………………...9
5. Тканевая специфичность биосинтеза пуринов……………………………...11
6. Регуляция биосинтеза пуринов………………………………………………11
7. Биосинтез пиримидинов……………………………………………………...15
8. Регуляция биосинтеза пиримидинов………………………………………...18
9. Ингибиторы ферментов синтеза дезоксирибонуклеотидов и их использование для лечения злокачественных новообразований……………..20
10. Список литературы…………………………………………………………..24
ВВЕДЕНИЕ
Ни сами нуклеотиды, ни исходные пуриновые и пиримидиновые основания, поступающие в организм человека с пищей, не включаются ни в нуклеиновые кислоты тканей человека, ни в пуриновые или пиримидиновые коферменты, такие, как АТР или NAD. Даже если пища богата нуклеопротеинами, клетки человека все равно синтезируют предшественники нуклеиновых кислот из амфиболических промежуточных соединений (интермедиатов). Путь синтеза de novo позволяет синтетическим аналогам пуринов и пиримидинов с антиканцерогенными свойствами включаться в состав ДНК.
Скорость синтеза пуриновых и пиримидиновых рибо- и дезоксирибонуклеотидов является объектом тонкой регуляции. Сформировались механизмы, обеспечивающие такой уровень продукции этих соединений во времени, который удовлетворяет постоянно меняющиеся физиологические потребности организма. Наряду с синтезом de novo включаются так называемые пути «спасения», благодаря которым происходит реутилизация пуриновых и пиримидиновых оснований высвобождаемых из нуклеиновых кислот при деградации in vivo. К заболеваниям, которые связаны с нарушениями обмена пуринов и пиримидинов, относятся подагра, синдром Леша— Найхана, синдром Рейе, недостаточность аденозин-дезаминазы, недостаточность пуриннуклеозидфосфорилазы.
1. Биосинтез пуриновых нуклеотидов
У человека и других млекопитающих пуриновые нуклеотиды синтезируются для обеспечения потребностей организма в мономерных предшественниках нуклеиновых кислот, а также в соединениях, выполняющих другие функции. У некоторых позвоночных (птицы, земноводные, рептилии) синтез пуриновых нуклеотидов несет дополнительную функцию — является частью механизма, с помощью которого выводятся излишки азота в виде мочевой кислоты; такие организмы называют урикотелическими. Организмы, у которых конечным продуктом азотистого обмена является мочевина (как у человека), называют уреотелическими. Поскольку урикотелические организмы удаляют «излишки» азота в виде мочевой кислоты, синтез пуриновых нуклеотидов у них идет более интенсивно, чем у уреотелических. В то же время пути синтеза пуриновых нуклеотидов denovo — общие для обеих групп организмов.
Информация о происхождении каждого из атомов в молекуле пуринового основания получена в процессе радиоизотопных исследований, проведенных на птицах, крысах и человеке (рис. 1). На рис. 2 представлена схема пути биосинтеза пуриновых нуклеотидов. Первая стадия {реакция 1)
— образование 5-фосфорибозил-1-пирофосфата (ФРПФ). Эта реакция не уникальна для биосинтеза пуриновых нуклеотидов. ФРПФ служит также предшественником в синтезе пиримидиновых нуклеотидов (см. рис. 10), он необходим для синтеза NAD и NADP—двух коферментов, в состав которых входит никотиновая кислота. В реакции 2
(рис. 2), катализируемой фосфорибозил-пирофосфат-амидотрансферазой,
из ФРПФ и глутамина образуются глутамат и 5-фосфорибозиламин. Хотя возможны и другие механизмы синтеза 5-фосфорибозиламина, реакция, катализируемая амидотрансферазой, имеет наиболее важное физиологическое значение в тканях млекопитающих.
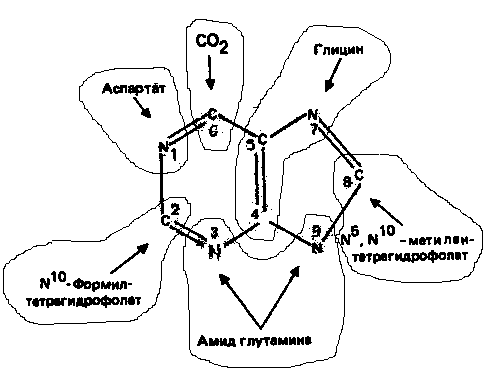
Рисунок 1.
Происхождение атомов азота и углерода пурино
вого кольца.
Далее 5-фосфорибозйламин вступает в реакцию с глицином (реакция 3);
при этом образуется глицинами д-рибозилфосфат (глицинамидориботид, Г АР). Амидная группа глутамина служит источником атома азота в положении 9 молекулы пурина (N-9), а глицин—источником атомов углерода в положениях 4 и 5 (С-4 и С-5) пуринового кольца. Эту реакцию катализирует глицинамид-киносинтетаза. Вре
акции 4
атом азота N7
молекулы глицинамид-рибозилфосфата формилируется N5
, N10
-Me-тенилтетрагидрофолатом. В результате этой реакции, катализируемой глицинамид-рибозил-фосфат-формилтрансферазой, поступающий одно-углеродный фрагмент займет положение С-8 в формирующемся пуриновом основании. В реак
ции 5
снова участвует глутамин — донор амидной группы. Амидирование происходит по атому С-4 формилглицинамид-рибозилфосфата и катализируется формилглицин-амидин-рибозилфосфатсинтетазой.Присоединенный атом азота займет в молекуле пурина положение 3.
В результате замыкания имидазольного кольца, катализируемого аминоимидазолрибозилфос-фатсинтетазой,образуется аминоимидазол-рибозилфосфат (реакция 6).
Далее синтез проходит через стадию образования аминоимидазолкар-боксилат-рибозилфосфата (реакция
7). В результате реакции формируется карбонильная группа, источником которой служит молекула СО2
, образующаяся в процессе дыхания.
Атом азота в положении 1 происходит из а-аминогруппы аспартата (реакция 8),
остальная часть которого образует сукцинильный фрагмент в молекуле аминоимидазолсукцинилкарбоксиламид-рибо-зилфосфата (АИСКАР).
В реакции 9
сукцинильная группа АИСКАР удаляется в виде фумарата. Оставшийся аминоимида-золкарбоксиламид-рибозилфосфат формилируется (реакция 10)
N 10
-формилтетрагидрофолатом (f10
-Н4
фолат) с образованием амидоимидазолкарбокси-ламид-рибозилфосфата; реакция катализируется соответствующей формилтрансферазой. Вновь присоединенный атом углерода, подобно атому С-8, поступает из пула одноуглеродных фрагментов при участии тетрагидрофолата и занимает в молекуле пурина положение 2.
Замыкание кольца (реакция 11)
происходит с помощью IMP-циклогидролазы, в результате образуется первый пуриновый нуклеотид—инозиновая кислота (инозинмонофосфат; IMP).
Значение метаболизма фолатов
В процессе биосинтеза пуриновых нуклеотидов (рис. 2) атомы углерода в положениях 8 и 2 поступают соответственно от N5
, М10
-метенилтет-рагидрофолата и N10
-формилтетрагидрофолата. Последний образуется из N5
, N10
-метенилтетрагидрофолата, который в свою очередь является продуктом NADP-зависимого дегидрогенирования N5
, N10
-метилентетрагидрофолата. Если N5
, N10
-метилентетрагидрофолат служит источником одноуглеродных фрагментов для многих акцепторов, то N5
,

Рисунок 2.
Путь биосинтеза
de
novo
пуринов из рибозо-5-фосфата и АТР
N10
-метенилтетрагидрофолат поставляет одноуглеродную группу (либо непосредственно, либо через стадию образования N10
-формилтетра-гидрофолата) только в пурины. Из приведенных сведений следует, что ингибирование процессов образования рассмотренных фолатов оказывает тормозящее влияние и на синтез пуринов denovo.
2. Образование AMP и GMP из IMP
Как показано на рис. 3 адениновые (реакции
12
и 13)
и гуаниновые нуклеотиды (реакции 14
и 15) образуются путем аминирования и соответственно окисления и аминирования общего предшественника—инозинмонофосфата (IMP). Аминирование IMPпротекает через стадию образования промежуточного соединения, в котором аспартат присоединяется к инозиновой кислоте, образуя аденилосукцинат. Эта реакция напоминает реакцию 8 биосинтеза пуринов (рис. 2), в которой а-азот аспарагиновой кислоты поставляет атом N-1 пуринового кольца. Образование аденилосукцината катализируется аденилосукцинатсинтазой и происходит при участии GTP. Удаление остающейся части аспарагиновой кислоты в виде фумарата приводит к образованию адениловой кислоты (аденозинмонофосфат; AMP). Отщепление фумарата от аденилосукцината катализируется ферментом аденилосукциназой. Этот же фермент катализирует отщепление фумарата от аминоимидазолсукцинилкарбоксамидрибозил-фосфата (реакция 9).
Так же, в две стадии, из IMP образуется гуанозинмонофосфат (GMP). В первой реакции на этом пути (реакция 14)
при участии NAD и Н2
О происходит окисление IMP с образованием ксантинмонофосфата (ХМР). Затем ХМР аминируется амидогруппой глутамина (реакция 15).
Для этого процесса необходим АТР, что в какой-то мере напоминает потребность в GTP при превращении IMP в AMP.

Рисунок 3.
Превращение
IMP
в
AMP
и
GMP
3. Ингибиторы биосинтеза пуринов
Несколько антиметаболитов — аналогов глутамина оказывают сильное ингибирующее воздействие на биосинтез пуринов. Азасерин (О-диазо-ацетил-L-серин) выступает как антагонист глутамина, особенно в реакции 5. Диазонорлейцин ([6-диазо-5-оксо]-L-норлейцин) блокирует реакцию 2, а 6-меркаптопурин наряду с другими эффектами ингибирует реакции 13 и 14 синтеза AMP и GMP соответственно. Микофеноловая кислота подавляет реакцию 14.
Превращение AMP и GMP в соответствующие ди- и трифосфаты осуществляется в две стадии (рис. 4). Реакции фосфорилирования — переноса фосфатных групп от АТР—осуществляются нуклео-зидмонофосфаткиназой и нуклеозиддифосфаткиназой.

Рисунок
4. Реакции фосфорилирования нуклеозидмонофосфата и нуклеозиддифосфата.
4. Синтез пуриновых дезоксирибонуклеотидов
Синтез пуриновых и пиримидиновых дезоксирибонуклеотидов происходит путем прямого восстановления 2'-углерода рибозного остатка соответствующего рибонуклеотида, а не путем синтеза denovo из 2'-дезоксианалога ФРПФ. Восстановление 2'-углеродного атома рибозы происходит только после превращения пуриновых и пиримидиновых нуклео-тидов в соответствующие нуклеозиддифосфаты. У некоторых бактерий в этом восстановительном процессе участвует кобаламин (витамин В12
). У животных процесс восстановления идет и в отсутствие витамина В12
. Восстановление рибонуклеозиддифосфатов в дезоксирибонуклеозид-дифосфаты катализируется рибонуклеотидредуктазойи требует участия тиоредоксина(белковый кофактор), тиоредоксинредуктазы (флавопротеиновый фермент) и NADPH (кофактор). Непосредственным донором электронов для нуклеотида является тиоредоксин, который предварительно восстанавливается NADPH. Обратимое окислительно-восстановительное превращение тиоредоксина катализируется тиоредоксинредуктазой. Восстановление рибонуклеозиддифосфата восстановленным тиоредоксином катализируется рибонуклеозидредуктазой (рис. 5). Эта сложная ферментная система функционирует в клетках только в период активного синтеза ДНК и деления.

Рисунок
5. Восстановление рибонуклеозиддифосфата до 2-дезокси-рибонуклеозиддифосфата.
5. Тканевая специфичность биосинтеза пуринов
Не во всех тканях человека происходит синтез пуриновых нуклеотидов denovo. Эритроциты и полиморфноядерные лейкоциты не способны синтезировать 5-фосфорибозиламин, и поэтому для образования пуриновых нуклеотидов им необходимы экзогенные пурины. Периферические лимфоциты способны синтезировать небольшие количества пуринов denovo. Установлено, что в клетках мозга млекопитающих содержатся очень малые количества ФРПФ-амидотрансферазы, на этом основании был сделан вывод о зависимости синтеза пуриновых нуклеотидов в мозге от поступления экзогенных пуринов. Оказалось, что основным местом синтеза пуриновых нуклеотидов в организме млекопитающих является печень. Из нее свободные основания или нуклеозиды попадают в другие ткани, не способные к синтезу пуринов denovo.
6. Регуляция биосинтеза пуринов
На синтез молекулы IMP затрачивается энергия гидролиза шести макроэргических фосфодиэфирных связей АТР, при этом в качестве предшественников выступают глицин, глутамин, метенилтетрагидрофолат и аспартат. Для экономии энергетических и питательных ресурсов важна эффективная регуляция процесса биосинтеза пуринов denovo. Важнейшую роль в этом процессе играет внутриклеточная концентрация ФРПФ. Она определяется соотношением скоростей его синтеза, утилизации и деградации. Скорость синтеза ФРПФ зависит от 1) наличия субстратов синтеза, особенно рибозо-5-фосфата, и 2) каталитической активности ФРПФ-синтазы, которая в свою очередь связана с внутриклеточной концентрацией фосфатов, а также с концентрацией пуриновых и пиримидиновых рибонуклеотидов, выступающих в роли аллостерических регуляторов (рис. 6). Скорость утилизации ФРПФ в значительной степени зависит от интенсивности цикла реутилизации пуриновых оснований, в ходе которого ксантин и гуанин фосфорибозилируются до соответствующих рибонуклеотидов. В меньшей степени скорость утилизации ФРПФ зависит от интенсивности синтеза пуринов denovo. Этот вывод основан на следующем наблюдении: в эритроцитах и культивируемых фибробластах мужчин с наследственным нарушением активности гипоксантин-гуанин—фосфо-рибозилтрансферазы уровень ФРПФ повышается в несколько раз.
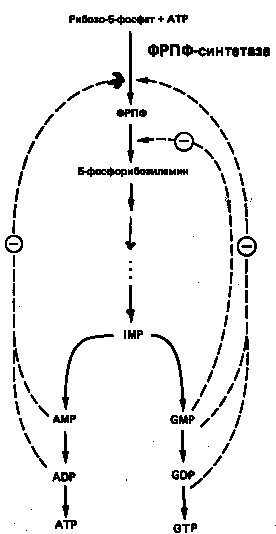
Рисунок
6. Регуляция скорости синтеза пуринов
de
novo. Сплошные линии указывают путь химических превращений. Пунктирные линии обозна-чают ингибирование конечными продуктами по принципу обратной связи.
Показано, что ФРПФ-амидотрансфераза – первый из ферментов, участ-вующих в процессе синтеза пуриновых нуклеотидов denovo, ингибируется invitro пуриновыми нуклеотидами (особенно аденозинмонофосфатом и гуанозинмонофосфатом) по принципу обратной связи. Эти ингибиторы конкурируют с субстратом — ФРПФ, последний, как выяснилось, занимает центральное место в регуляции синтеза пуринов denovo. Многие косвенные данные свидетельствуют о том, что роль амидотрансферазы в этом процессе менее существенна, чем ФРПФ-синтетазы.
Образование GMP или AMP из IMP регулируется двумя механизмами (рис. 7).
 Рисунок 7.
Регуляция превращений
IMP
в аденозиновые
и гуанозиновые нуклеотиды. Сплошные линии указывают
путь химических превращений. Пунктирные линии обозна
чают положительную и отрицательную регуляцию по
принципу обратной связи. Рисунок 7.
Регуляция превращений
IMP
в аденозиновые
и гуанозиновые нуклеотиды. Сплошные линии указывают
путь химических превращений. Пунктирные линии обозна
чают положительную и отрицательную регуляцию по
принципу обратной связи.
AMP регулирует активность аденилосукцинатсинтетазы, влияя по принципу обратной связи на собственный синтез. GMP регулирует собственный синтез, действуя по тому же принципу на 1МР-дегидрогеназу. Наряду с этим образование аденилосукцината из IMP на пути к AMP стимулируется GTP. Образование же GMP из ксантозинмонофосфата требует присутствия АТР. Таким образом, наблюдается существенная перекрестная регуляция дивергентных путей метаболизма IMP. Такая регуляция тормозит биосинтез одного из пуриновых нуклеотидов при недостатке другого. Гипоксантингуанин-фосфорибозилтрансфераза, катализирующая образо-вание из ксантина и гуанина IMP и GMP соответственно, весьма чувствительна к ингибирующему действию этих нуклеотидов.
Восстановление рибонуклеозиддифосфатов до дезоксирибонуклеозид-дифосфатов является объектом сложной регуляции. Этот процесс (рис. 8) обеспечивает сбалансированное образование дезоксирибонуклеотидов для синтеза ДНК.
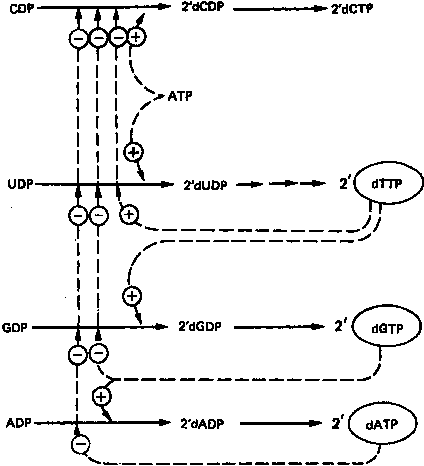
Рисунок
8.
Регуляция восстановления пуриновых и пири
мидиновых рибонуклеотидов до соответствующих 2'-
дезоксирибонуклеотидов. Сплошные линии указывают
путь химических превращений. Пунктирные линии обозна
чают положительную и отрицательную регуляцию по
принципу обратной связи.
7. Биосинтез пиримидинов
Структура ядра пиримидинов проще и путь их биосинтеза короче, чем у пуринов. В то же время оба пути имеют ряд общих предшественников. ФРПФ, глутамин, СО2
и аспартат необходимы для синтеза всех пиримидиновых и пуриновых нуклеотидов. Синтез тимидиновых нуклеотидов, а также всех пуриновых нуждается в присутствии производных тетрагидрофолата. Можно отметить одно существенное различие в путях биосинтеза пуриновых и пиримидиновых нуклеотидов. В первом случае синтез начинается с молекулы рибозофосфата как интегральной части будущей молекулы предшественника нуклеотида, во втором случае сначала синтезируется пиримидиновое основание и только на последних стадиях присоединяется остаток рибозофосфата.
Синтез пиримидинового кольца (рис. 9) начинается с образования карбамоилфосфата из глутамина, АТР и СО2
в реакции, катализируемой в цитозоле карбамоилфосфатсинтазой (реакция 1).
Отметим, что карбамоилфосфатсинтаза, ответственная за ранние стадии синтеза мочевины, локализована в митохондриях.
Первый уникальный для биосинтеза пиримидинов этап — образование карбамоиласпартата в реакции конденсации карбамоилфосфата и аспартата катализируется аспартаттранскарбамоилазой (реакция
2).
Затем в реакции, катализируемой дигидрооротазой, выщепляется Н2
О и образуется кольцевая структура (реакция 3).
На следующем этапе происходит дегидрогенирование под действием дигидрооротатдегидрогеназы с использованием NAD в качестве кофактора, при этом образуется оротовая кислота (реакция 4).
В реакции 5
к оротовой кислоте присоединяется остаток рибозофосфата с образованием оротидилата (оротидинмонофосфат, ОМР). Этот процесс осуществляется оротат-фосфорибозилгрансферазой — ферментом, аналогичным гипоксантин-гуанин—фосфорибозилтрансферазе и аденин-фосфорибозил-трансферазе, которые участвуют в фосфорибозилировании пуриновых колец.
Первый истинный пиримидиновый рибонуклеотид—уридилат (уридинмонофосфат, UMP) образуется при декарбоксилировании оротидилата (реакция 6).
Таким образом, только на предпоследней стадии образования UMP происходит фосфорибозилирование гетероцикла.
Дигидрооротатдегидрогеназа митохондриальный фермент. Все остальные ферменты, участвующие в синтезе пиримидинов denovo, локализуются в цитозоле.
Фосфорилирование пиримидиновых нуклеозидмонофосфатов до соответствующих ди- и трифосфатов происходит аналогично тому, как это описано для пуриновых нуклеозидмонофосфатов (реакции
7—12).
UTP аминируется до СТР; в реакции участвуют глутамин и АТР (реакция 9).
Механизм восстановления пиримидиннуклеозиддифосфатов до соответствующих 2/
-дезоксинуклеозиддифосфатов (реакция 10)
также аналогичен тому, который описан для пуриновых нуклеозиддифосфатов (рис. 5 и 8).
Образование тимидилата (тимидинмонофосфат; ТМР) (реакция 12)
— единственная реакция на пути биосинтеза пиримидиновых нуклеотидов, требующая участия производного тетрагидрофолата в качестве донора одноуглеродного фрагмента. 2'-Дезокси-UMP метилируется тимидилатсинтазой, использующей N5
, N10
-метилентетрагидрофолат как донор метильной группы.
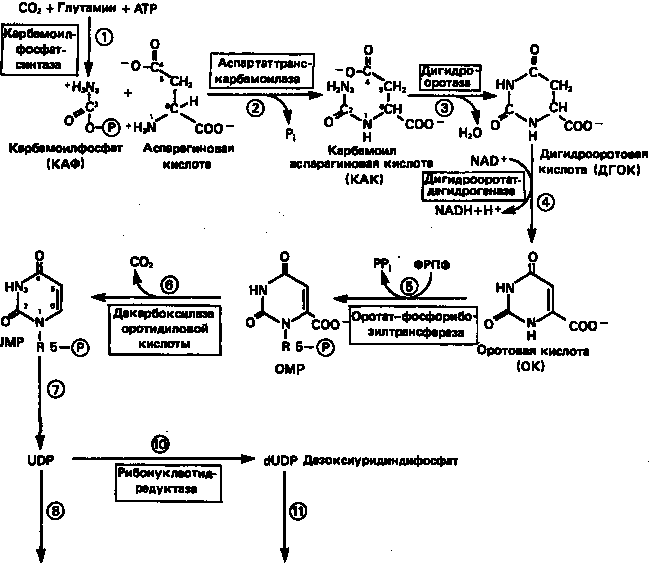 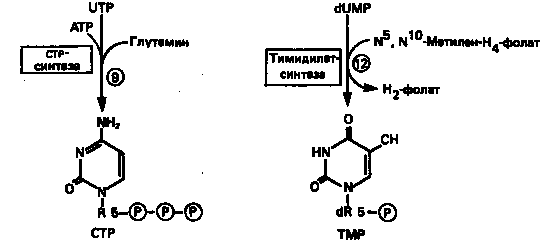
Рисунок 9.
Путь биосинтеза пиримидиновых нуклеотидов.
Метиленовая группа N5
, N10
-метилентетрагидрофолата в ходе реакции восстанавливается до метильной и присоединяется к атому С-5 dUMP. Процесс сопровождается окислением тетрагидрофолатного переносчика до дигидрофолата. Можно считать, что в результате метилирования dUMP с образованием ТМР происходит полное восстановление гидроксиметильной группы серина (переносимой на тетрагидрофолат при образовании N5
, N10
-метилентетрагидрофолата) до метильной с одновременным окислением тетрагидрофолата до дигидрофолата. Для того чтобы фолатный переносчик и далее мог функционировать, необходимо восстановить дигидрофолат до тетрагидрофолата. Эту реакцию катализирует дигидрофолатредуктаза. Именно поэтому делящиеся клетки, вынужденные синтезировать ТМР с образованием дигидрофолата, оказываются особенно чувствительны к ингибиторам дигидрофолатредуктазы. Один из таких ингибиторов — метотрексат (аметоптерин) широко используется как противоопухолевый препарат (см. ниже).
8. Регуляция биосинтеза пиримидинов
Путь биосинтеза пиримидиновых нуклеотидов регулируется двумя различными механизмами. Активность первых двух ферментов находится под контролем аллостерических эффекторов. Кроме того, три первых и два последних фермента являются объектами координированной репрессии—дерепрессии. Карбамоилфосфатсинтаза ингибируется UTP, пуриновыми нуклеотидами, но активируется ФРПФ (рис. 10). Аспартаттранскарбамоилаза особенно чувствительна к ингибирующему влиянию СТР. Аллостерические свойства аспартаткарбамоилазы микроорганизмов явились предметом интенсивных и ставших уже классическими исследований механизмов аллостерической регуляции активности ферментов.
Скорость биосинтеза пиримидинов коррелирует со скоростью биосинтеза пуринов, что указывает на координированный контроль синтеза нуклеотидов обоих типов. ФРПФ-синтетаза, фермент, катализирующий образование предшественника обоих путей биосинтеза, ингибируется по принципу обратной связи как пуриновыми, так и пиримидиновыми нуклеотидами. Карбамоилфосфатсинтаза также подвержена ингибированию по принципу обратной связи нуклеотидами обоих типов, а ФРПФ активирует этот фермент. Таким образом, на нескольких этапах биосинтеза пуриновых и пиримидиновых нуклеотидов осуществляется перекрестная регуляция.
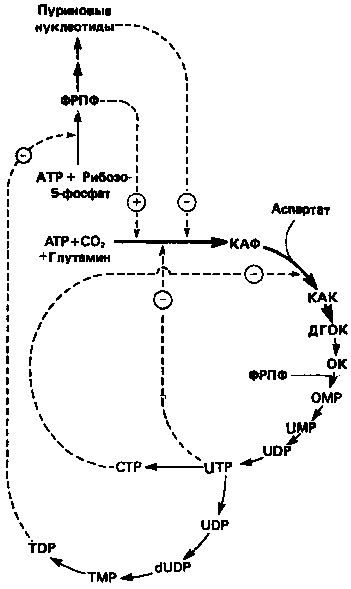
Рисунок 10.
Регуляция пути биосинтеза пиримидиновых
нуклеотидов. Сплошные линии указывают путь химиче
ских превращений. Пунктирные линии обозначают поло
жительную и отрицательную регуляцию по принципу
обратной связи. Сокращения расшифрованы на рис. 9.
9. ИНГИБИТОРЫ ФЕРМЕНТОВ СИНТЕЗА ДЕЗОКСИРИБОНУКЛЕОТИДОВ И ИСПОЛЬЗОВАНИЕ ИХ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Препараты этой группы являются антагонистами естественных метаболитов. При наличии опухолевых заболеваний используют в основном следующие вещества (см. структуры).
Антагонисты фолиевой кислоты:
Метотрексат (аметоптерин).
Антагонисты пурина:
Меркаптопурин (леупурин, пуринетол).
Антагонисты пиримидина:
Фторурацил (флуороурацил); Фторафур (тегафур); Цитарабин (цитозар).
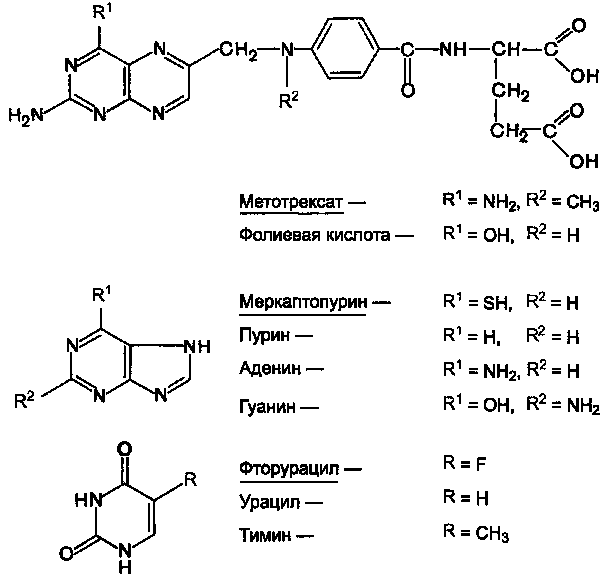 Рисунок 11.Химические структуры ряда метаболитов и их антиметаболитов. Рисунок 11.Химические структуры ряда метаболитов и их антиметаболитов.
Химически антиметаболиты лишь похожи на естественные метаболиты, но не идентичны им. В связи с этим они вызывают нарушение синтеза нуклеиновых кислот.
Это отрицательно сказывается на процессе деления опухолевых клеток и приводит их к гибели.
Действуют антиметаболиты на разных этапах синтеза нуклеиновых кислот, ингибируя ферменты их синтеза. Так, механизм антибластомного эффекта метотрексата, очевидно, заключается в том, что он угнетает дигидрофолатредуктазу, а также тимидил-синтетазу. Это нарушает образование пуринов и тимидина, в результате чего угнетается синтез ДНК. Меркаптопурин, по-видимому, препятствует включению пуринов в полинуклеотиды. Полагают, что фторурацил нарушает синтез нуклеотидов или тимидина и их включение в ДНК. Имеются данные о том, что в клетках опухоли фторурацил превращается в 5-фтор-2-дезокси-уридин-5-монофосфат, который является ингибитором фермента тимидил-синтетазы.
Антагонист фолиевой кислоты метотрексат и антагонист пурина меркаптопурин назначают главным образом при острых лейкозах. Метотрексат эффективен при указанной патологии в основном у детей, а меркаптопурин – также у взрослых. Кроме того, меркаптопурин и особенно метотрексат с успехом применяют при хорионэпителиоме матки. Метотрексат используют также в комбинированной химиотерапии ряда истинных (солидных) опухолей, например, рака молочной железы (см. рис. 32.1; табл. 32.2).
При лечении острых лейкозов улучшение общего состояния и гематологической картины происходит постепенно. Продолжительность ремиссии исчисляется несколькими месяцами.
Принимают препараты, как правило, внутрь. Метотрексат выпускают и для парентерального введения.
Метотрексат выделяется почками преимущественно в неизмененном виде. Часть препарата задерживается в организме очень длительное время (месяцы). Меркаптопурин подвергается в печени химическим превращениям и в моче обнаруживаются его метаболиты.

Таблица 1. Основные показания к применению ряда синтетических цитотоксических средств.
1
ОЛЛ — острая лимфобластическая лейкемия; ОМЛ — острая миелогенная лейкемия;
ХЛЛ — хроническая лимфоцитарная лейкемия; ХМЛ — хроническая миелогенная лейкемия.
Отрицательные стороны действия препаратов проявляются в угнетении ими кроветворения, тошноте, рвоте. У ряда больных наблюдается нарушение функции печени. Метотрексат поражает слизистую оболочку желудочно-кишечного тракта, вызывает конъюнктивиты.
Антагонист пиримидина — фторурацил существенно отличается по спектру антибластомного действия от метотрексата и меркаптопурина. Если последние эффективны главным образом при остром лейкозе, т.е. при гемобластозе, то фторурацил применяют при истинных опухолях. Его назначают при раке желудка, поджелудочной железы и толстого кишечника, раке молочной железы. У части пациентов фторурацил дает временную регрессию опухолей.
Вводят препарат внутривенно, так как из желудочно-кишечного тракта он всасывается плохо. В печени фторурацил подвергается химическим превращениям. Образующиеся метаболиты выделяются почками.
Токсичность препарата значительная. Из неблагоприятных эффектов наиболее серьезны угнетение кроветворения и язвенное поражение пищеварительного тракта (стоматит, энтерит). Кроме того, нарушается аппетит, возникают тошнота, рвота, понос. Отмечаются также облысение, поражение ногтей, дерматит.
Аналогичными свойствами обладает препарат фторафур, являющийся фтористым производным пиримидина. Он несколько менее токсичен, чем фторурацил. Применяют его при раке молочной железы, раке прямой и толстой кишки, раке желудка.
К антиметаболитам относятся также тиогуанин и цитарабин (ци-тозин-арабинозид), которые применяют при острых миелоидной и лимфоид-ной лейкемиях. Антагонист пиримидина флударабина фосфат (флуда-ра) в основном используют при хроническом лимфоцитарном В-клеточном лейкозе. Обычно его назначают при резистентности к стандартным курсам химиотерапии.
СПИСОК ЛИТЕРАТУРЫ:
1. Харкевич Д.А. Фармакология. М.: ГЭОТАР Медицина, 2000. – 664 с.
2. Ленинджер А. Основы биохимии. М.: Мир, 1985. – Т2. 736 с.
3. Марри Р., Греннер Д., Мейерс П., Родуэл В. Биохимия человека. – M., Мир, 1993. –Т 2, 416 с.
4. Албертс Б., Брей Д., Льюис Д., Рэфф М., Робертс К., Уотсон. Д. Молекулярная биология клетки. – М., Мир, 1987. Т 3, 296 с.
5. Prusoff W. H. et. al. Nucleoside analoges with antiviral activity. Biochem. Pharm., 1976, 25, 1223
6. Michelson A.M. The chemistry of Nucleosides and Nucleotides. Academic Press. 1963.
|