Реферат
на тему:
Основні поняття хімії
План
1. Поняття про хімічний елемент.
2. Речовина – один із основних об’єктів хімії.
3. Класифікація хімічних сполук.
4. Процеси, що відбуваються під час впливу зовнішніх умов на речовини:
а). фізичні
б). хімічні
в). фізико-хімічні
г). ядерні
Ви знаєте, що хімія вивчає хімічні елементи та їхні сполуки, хімічні перетворення різних сполук і ті закономірності, які цими перетвореннями керують. Отже, одним із найважливіших понять у хімії є поняття про хімічний елемент.
Хімічним елементом
називається тип атомів, які мають однаковий заряд ядра, що дорівнює протонному числу (порядковому номеру) елемента.
Нині відомо вже 112 хімічних елементів, їх класифікують по-різному, залежно від ознаки, яка береться в основу класифікації (схема 1).
Кожен із елементів має свій символ — знак хімічного елемента. Наявність хімічної азбуки дає змогу відображувати склад речовин за допомогою хімічних формул.
Зрозуміло, що, крім хімічного елемента, речовина також є одним із основних об'єктів хімії. І це справедливо, адже з речовин складаються всі тіла, що нас оточують. Наприклад, краплини дощу, іній на гілках, туман над річкою — усе це тіла, що складаються з однієї й тієї самої речовини — води.
Схема 1. Класифікацій хімічних елементів

Речовина досить повно визначається за трьома ознаками: а) займає частину простору; б) має масу спокою; в) побудована з часточок за рахунок сил притягання і відштовхування.
Хімія вивчає головним чином речовини, побудовані з атомів, молекул, йонів, радикалів.
Взаємне притягання і відштовхування частинок, з яких складається дана речовина, визначає її агрегатний стан.
У філософському розумінні речовина — це вид матерії, який має масу спокою.
У хімії ж поняття про речовину дещо обмежене, оскільки воно охоплює тільки хімічну форму матерії. Зважаючи на це, речовина — це певна сукупність частинок (атомних, молекулярних, йонних), що перебуває у будь-якому з трьох агрегатних станів.
У наш час відомо понад 12 мільйонів речовин, і цей список, мабуть, чи не щоденно поповнюється. Згідно з сучасними уявленнями про хімічний зв'язок усі речовини є хімічними сполуками, оскільки містять хімічно зв'язані між собою атоми елементів: якщо це атоми одного елемента — прості речовини, якщо кількох елементів — складні. Так, воду можна розкласти на водень Н2
і кисень О2
, а молекули Н2
і О2
, у свою чергу, на атоми Гідрогену Η та Оксигену О. Отже, речовини заведено розподіляти на прості та складні (схема 2).
Схема 2. Класифікація хімічних сполук

Прості речовини являють собою форми існування елементів у вільному стані. Деяким елементам відповідає кілька простих речовин (алотропних форм), які можуть різнитися як за складом, наприклад кисень О2
, озон О3
для елемента Оксигену, так і за будовою кристалічних ґраток, наприклад алмаз, графіт, карбін для елемента Карбону.
Кожній речовині притаманні специфічні властивості — об’єктивні характеристики, які визначають індивідуальність конкретної речовини і тим самим дають змогу відрізнити її від усіх інших речовин.
Властивості речовин визначаються їх складом і будовою, тобто характером зв'язків, що виникають між атомами, та їхнім просторовим розміщенням.
Властивості речовин суттєво змінюються залежно від наявних домішок. Ось чому для чистих речовин уведено поняття «хімічний індивід», що означає, який складається тільки з атомів (молекул, йонів) певного виду. Добування абсолютно чистих речовин, мабуть, практично неможливе, хоча нині використовують методи, які знижують вміст домішок до кількох атомів на 109
—1010
атомів основного елемента.
Складні речовини також класифікують за певними ознаками. Згадаємо, наприклад, на які класи поділяються неорганічні речовини (схема 3).
Під час впливу на речовини зовнішніх умов у них відбуваються різні процеси. Залежно від зміни речовини, аж д утворення нової речовини, ці процеси можна розподілити н кілька видів.
С
хема
3. Класифікація неорганічних речовий

Фізичні процеси
(нагрівання, випаровування, плавлення, охолодження, конденсація тощо), змінюючи фізичні властивості речовини, не змінюють будови атомів або молекул, з яких складається дана речовина, і не призводять до змінення хімічних властивостей, до утворення нової речовини.
Хімічні процеси
змінюють будову атомів і молекул, з яких складаються речовини, що реагують, і в результаті утворюються нові речовини з новими хімічними і фізичними властивостями. Хімічні процеси і є хімічними реакціями, їх можна зображувати за допомогою хімічних рівнянь.
Фізико-хімічні процеси
(наприклад, розчинення) єпроміжними між фізичними і хімічними процесами Вони, як правило, не викликають радикальних змін хімічних властивостей речовин, що беруть у них участь.
Ядерні процеси
зв'язані з перебудовою атомів, з яких Складається речовина, а це тягне за собою зміну фізичних і хімічних властивостей речовини.
При цьому змінюється протонне число (порядковий номер) цих атомів у періодичній системі.
Наприклад:
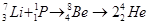
Використана література
1. Хімія 11 клас. Н.М.Туринська, Л.П. Величко.
|