| Одно- и многоатомные спирты
.
Алифатические спирты - это соединения, содержащие гидроксильную группу (-ОН), связанную с sp3
-гибридизованным атомом углерода. Спирты можно разделить на три большие группы: простые спирты, стерины и углеводы. Рассмотрим простые спирты, с общей формулой Cn
H2
n
+1
OH.
методы получения спиртов
1. Гидролиз галогеналканов в водных растворах щелочей

Реакция замещения галогена на ОН-группу протекает по механизму нуклеофильного замещения SN
. В зависимости от строения субстрата замещение протекает по SN
1
(мономолекулярное замещение):
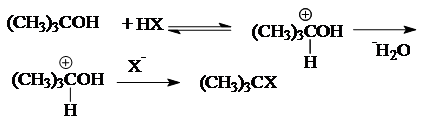
или SN
2
(бимолекулярное):
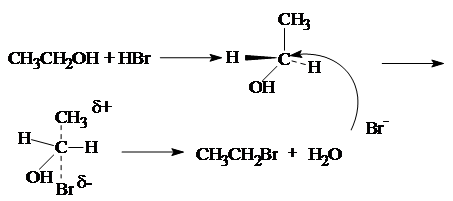
Атакующий агент – анионы (SH -
, OН -
, I -
, Br -
, С l -
, F -
, RO -
, CH3
COO -
, ONO2
-
) или молекула (ROH, HOH, NH3
, RNH2
). По увеличению реакционной способности анионы располагаются в следующий ряд:
HS -
, RS -
> I -
> Br -
> RO -
> Cl -
> CH3
COO -
> ONO2
-
Анионы более сильные нуклеофилы, чем сопряженные кислоты:
OH -
> HOH, RS -
> RSH, RO -
> ROH, Cl -
>HCl
Нуклеофил
– атом (или частица), который может отдать пару электронов любому элементу, кроме водорода. Механизм бимолекулярного нуклеофильного замещения (SN
2
) включает образование промежуточного комплекса.
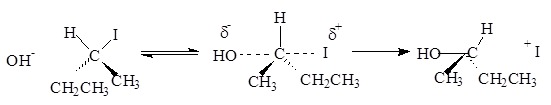
Представленная реакция является реакцией замещения, так как нуклеофил (ОН -
) вытесняет уходящую группу (I-
).
Механизм мономолекулярного нуклеофильного замещения (SN
1
) состоит из двух стадий:
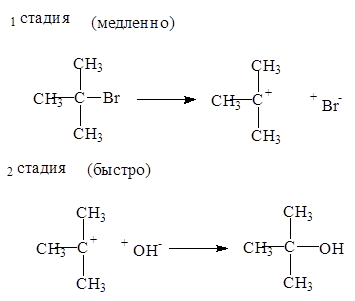
Реакции замещения по механизму SN
1
в тех случаях, когда образуется стабильный катион. Первичные галогеналканы реагируют по механизму SN
2
, а третичные - по механизму SN
1.
2. Гидратация алкенов.
Присоединение воды к алкену протекает в присутствии кислотных катализаторов (H2
SO4
, H3
PO4
, оксид алюминия и другие носители, обработанные кислотами).
Реакция протекает по карбоний-ионному механизму:
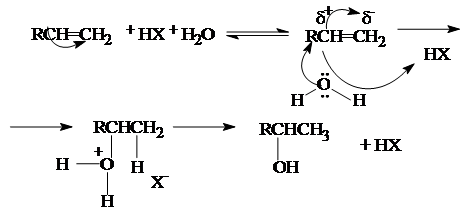
3. Восстановление карбонильных соединений (кетонов и альдегидов)
Альдегиды и кетоны легко восстанавливаются водородом в присутствии катализаторов (например, Ni, Pd, Pt) в соответствующие первичные и вторичные спирты:
CH3
-CH2
-COH + H2
® CH3
-CH2
-CH2
-OH
пропионовый альдегид пропанол-1
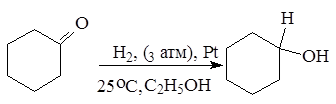
циклогексанон циклогексанол
Для восстановления карбонильной группы используются комплексные гидриды металлов - борогидрид натрия NaBH4
(растворитель - вода, этанол) или алюмогидрид лития LiAlH4
(растворитель - абсолютный эфир):
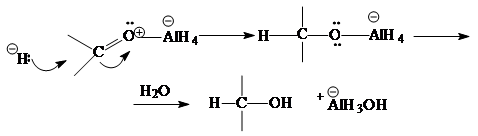
CH3
COCH3
+ LiAlH4
® (CH3
)2
-CHOH
CH3
-CHO + NaBH4
® CH3
-CH2
-OH
Сложные эфиры также восстанавливаются алюмогидридом лития, причем оба фрагмента эфира превращаются в спирты:
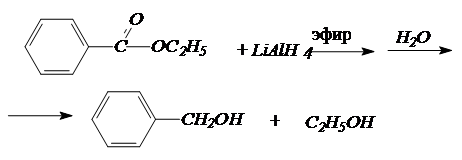
4. Синтезы спиртов с использованием реактивов Гриньяра.
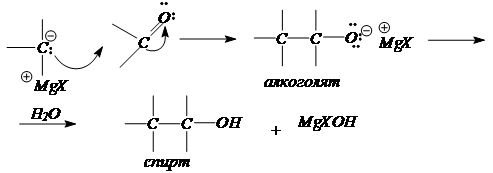
RMgHal + H2
C=O (формальдегид) ® RCH2
O -
Mg+
Hal + H2
O ® R-CH2
-OH
RMgHal + R’HC=O (альдегид) ® R( R’)CHO -
Mg+
Hal + H2
O ® R(R’)CH-OH
RMgHal + (R’)2
C=O (кетон) ® R( R’)2
CO -
Mg+
Hal + H2
O ® R(R’)2
C-OH
По механизму это реакция нуклеофильного присоединения к карбонильной группе.
Промышленные методы получения спиртов.
1. Окисление алканов
(синтез спиртов С10
-С20
).
3 RCH2
-OH + B(OH)3
« B(OHC2
R)3
+ 3 H2
O
2. Гидратация алкенов
.
R-CH=CH2
+ H2
O « R-CH (OH)-CH3
CH2
=CH2
+ H2
O ® CH3
CH2
OH
из пропилена и н-бутилена - изопропиловый и н-бутиловый спирты:
CH3
-CH=CH2
+ H2
O ® CH3
-CH (OH)-CH3
CH3
-CH2
-CH=CH2
+ H2
O ® CH3
-CH2
-CH (OH)-CH3
а из изобутилена - трет-бутиловый спирт:
(CH3
)2
C=CH2
+ H2
O ® (CH3
)3
C-OH
Электрофильный механизм гидратации определяет уже отмеченное выше направление присоединения (правило марковникова), а также изменение реакционной способности алкенов в ряду, определяемом сравнительной стабильностью образующихся карбокатионов:
(CH3
)2
CH=CH2
>> CH3
-CH2
-CH=CH2
> CH3
-CH=CH2
>> CH2
=CH2
3. Синтез спиртов по методу Фишера-Тропша
.
СО + 2Н2
« СН3
ОН
4. Процесс оксосинтеза
.
CH2
=CH2
+ CO + H2
® CH3
-CH2
-CHO
Химические свойства спиртов
Обусловлены способностью гидроксильной группы образовывать межмолекулярные водородные связи.
1. Кислотные и основные свойства спиртов.
CH3
-OH + HNO3
¨ CH3
-ONO2
+ H2
O
CH3
CH2
OH + H2
SO4
® CH3
CH2
OSO3
H + H2
O
CH3
CH2
OH + (CH3
CO)2
O ® CH3
COOC2
H5
+ CH3
COOH
Это – реакции замещения водорода на кислотный остаток.
2. Замещение гидроксильной группы на галоген.
CH3
CH2
OH + HBr « CH3
CH2
Br + H2
O
Реакция протекает по механизму нуклеофильного замещения.
CH3
CH2
-OH + SOCl2
® CH3
CH2
-Cl + SO2
+ HCl
3CH3
CH2
-OH + PCl3
® 3CH3
CH2
-Cl + H3
PO4
Ниже приводится механизм взаимодействия спирта с тионилхлоридом:
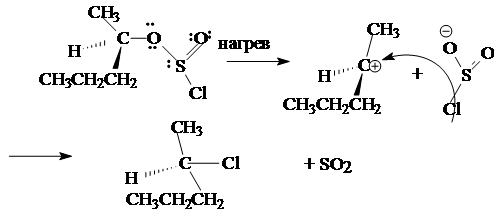
Этот механизм обозначается символом Sni
(замещение нуклеофильное внутримолекулярное).
Реакции отщепления
CH3
CH2
OH ® CH2
=CH2
В качестве катализаторов используют минеральные кислоты (серная, фосфорная), кислые соли (KHSO4
), ангидриды кислот (Р2
О5
), оксид алюминия и т.д.
R-OH + R’-OH ® ROR (ROR’, R’OR’) + H2
O
Порядок отщепления воды в большинстве случаев определяется
правилом зайцева
: при отщеплении воды наиболее легко отщепляет водород от соседнего наименее гидрированного атома углерода.
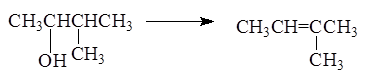
Реакция отщепления воды от спиртов протекает через стадию образования карбкатиона:
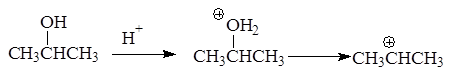
В зависимости от строения спирта образуются первичные, вторичные и третичные карбкатионы:
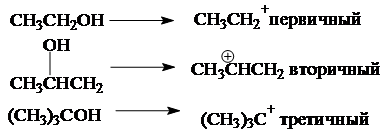
По увеличению стабильности катионы располагаются в следующий ряд: CH3
CH2
+
< CH3
CH+
CH3
< (CH3
)3
C+
Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Мы имеем дело в данном ряду с индукционной стабилизацией:
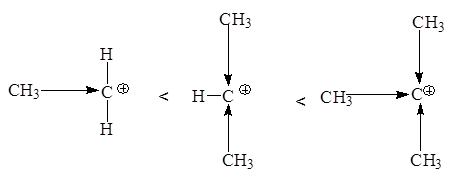
Образующиеся катионы в зависимости от их строения способны к перегруппировкам:
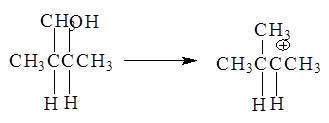
3-Метил-2-бутанол - в 2-метил-2-бутильный катион, склонный к перегруппировке в более стабильный:
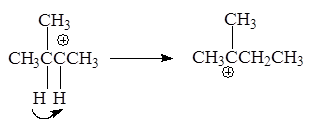
Образование последнего 2-метил-2-бутильного катиона связано с гидридным перемещением (Н-
) из положения 3 в положение 2.
В перегруппировке может участвовать и алкильная группа:
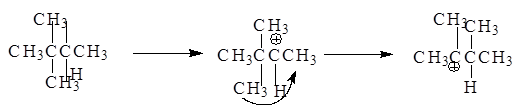
Основное различие между тремя типами реакционных интермедиатов (карбкатионы, карбанионы и свободные радикалы) состоит в том, что карбкатионы имеют тенденцию изомеризоваться в более устойчивые частицы.
Окисление
. Первичные и вторичные спирты могут быть окислены соответственно до альдегидов и кетонов. Третичные спирты устойчивы к окислению в мягких условиях.
Первичные спирты окисляются до альдегидов под действием окислителей, содержащих Cr(VI). Это обычно хромовая кислота H2
CrO4
:
R-CH2
-OH + H2
CrO4
® R-CHO + H2
CrO3
(неустойчива) + H2
0
Окисление первичного спирта начинается с образования эфира хромовой кислоты RCH2
-O-Cr(O)2
-OH. На следующей стадии эфир претерпевает реакцию отщепления, в результате которой образуется двойная связь С=О.
Альдегиды можно также получить окислением первичных спиртов реагентом Саретта (комплекс CrO3
с пиридином).
В относительно мягких условиях происходит окисление спирта разбавленным раствором оксида хрома (VI) в разбавленной серной кислоте (окисление по Джонсу).
Вторичные спирты легко окисляются до кетонов под действием K2
Cr2
O7
+H2
SO4
+H2
0 , CrO3
+CH3
COOH+H2
O и KMnO4
в кислой среде:
(R )2
CH-OH + [O] ® R-CO-R + H2
O
Механизм окисления вторичных спиртов подобен окислению первичных спиртов в альдегиды, поэтому для получения кетонов пригодны методы, описанные выше.
Дегидрирование спиртов
. Этим способом получают многие альдегиды и кетоны:
2R-CH2
-OH ® R-COH + H2
2(R)2
-CH-OH ® (R)2
-CO + H2
В качестве катализатора используются металлическая медь и серебро. В промышленности этот процесс реализован для получения формальдегида из метанола.
Многоатомные спирты
Обычно названия двухатомных спиртов производятся от названия двухатомного радикала с прибавлением слова гликоль, например этиленгликоль, пропиленгликоль. По Женевской номенклатуре пользуются окончанием -ол, но указывают число гидроксильных групп - диол, -триол, -тетрол и т.д.
В двухатомных спиртах гидроксилы могут быть соединены с первичными, вторичными и третичными атомами углерода, поэтому различают гликоли двупервичные, первично-вторичные и т.д.
Синтез гликолей осуществляется в основном теми же способами, что одноатомных спиртов, кроме того, окислением соответствующих алкенов перманганатом калия в щелочной среде (реакция Вагнера)
R-CH=CH2
+ [O]® R-CH(OH)CH2
-OH
Для окисления используют разбавленные водные растворы перманганата калия.
Практически наиболее важным промышленным методом получения гликолей является гидратация соответствующих a-оксидов:
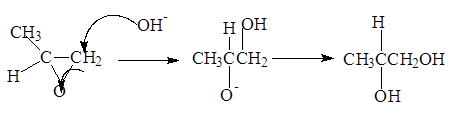
Из этиленоксида получают три важных класса соединений: целлозольвы, карбитолы
и карбоваксы
.
Целлозольвы
(соединения типа ROCH2
CH2
OH) образуются в результате реакции алкоголята и этиленоксида. Название “целлозольв” относится к 2-этоксиэтанолу. Бутилцеллозольв - хороший растворитель; он используется в гидравлических тормозных жидкостях и добавляется к авиационному топливу в качестве антифриза:
CH3
CH2
CH2
CH2
ONa + (CH2
)2
O + H2
O® CH3
CH2
CH2
CH2
-O-CH2
CH2
OH
Карбитолы
, являющиеся моноалкиловыми эфирами диэтиленгликоля, применяются в качестве растворителей, а также при изготовлении лаков. Их получают реакцией целлозольва с эквивалентным количеством этиленоксида.
Этиленгликоль
и пропиленгликоль
широко используют в производстве антифризов:
C3
H5
(OCOR)3
+ 3 NaOH ® HOCH2
-CHOH-CH2
OH + 3 RCOONa
Синтетический глицерин получают исходя из пропилена:
CH3
-CH=CH2
+ Cl2
® Cl-CH2
-CH=CH2
® OH- CH2
-CH=CH2
®
® OH- CH2
-CH(Cl)-CH2
OH ® OH- CH2
-CH(OH)-CH2
OH;
CH3
-CH=CH2
® CH2
=CH-COH + H2
O2
® OH-CH2
-CH(OH)-COH ®
® OH- CH2
-CH(OH)-CH2
OH.
|