В главах 11 и 12 были обсуждены проблемы возникновения первичной клетки из гипотетической протоклетки и последующего пути прогрессивной эволюции первичной клетки. Как было обнаружено в 70-х гг., на раннем этапе этого пути могло произойти выделение трех основных ветвей, каждая из которых самостоятельно и независимо эволюционировала, результатом чего явилось существование в рамках прокариотной клеточной организации двух крупных таксономических групп: эубактерий и архебактерий.
Подавляющее большинство известных прокариот относится к эубактериям. Именно у них достаточно хорошо изучены основные этапы прогрессивной эволюции, связанные с совершенствованием энергетических процессов. Архебактерии представляют собой к настоящему времени разрозненные группы со специфическими типами энергетического метаболизма. Имеющегося материала явно не достаточно для создания каких-либо эволюционных построений внутри группы архебактерий.
ГЛАВА 13. БРОЖЕНИЕ. ТИПЫ ЖИЗНИ, ОСНОВАННЫЕ НА СУБСТРАТНОМ ФОСФОРИЛИРОВАНИИ
Наиболее примитивным способом получения энергии, присущим определенным группам эубактерий, являются процессы брожения.
ОБЩАЯ ХАРАКТЕРИСТИКА ПРОЦЕСCOВ БРОЖЕНИЯ
"Брожение" — это сугубо микробиологический термин. Он характеризует энергетическую сторону способа существования нескольких групп эубактерий, при котором они осуществляют в анаэробных условиях окислительно-восстановительные превращения органических соединений, сопровождающиеся выходом энергии, которую эти организмы используют. Поскольку брожение протекает без участия молекулярного кислорода, все окислительно-восстановительные превращения субстрата происходят за счет его "внутренних" возможностей. Процесс брожения связан с такими перестройками органических молекул субстрата, в результате которых на окислительных этапах процесса высвобождается часть свободной энергии, заключенной в молекуле субстрата, и происходит ее запасание в молекулах АТФ. В процессе брожения, как правило, происходит расщепление углеродного скелета молекулы субстрата.
Круг органических соединений, которые могут сбраживаться, довольно широк. Это углеводы, спирты, органические кислоты, аминокислоты, пурины, пиримидины. Химическое вещество может быть подвергнуто сбраживанию, если оно содержит неполностью окисленные (или восстановленные) углеродные атомы. В этом случае есть возможность для окислительно-восстановительных преобразований между молекулами (или внутри одного вида молекул), возникающими из субстрата. В результате одна часть продуктов брожения будет более восстановленной, другая — более окисленной по сравнению с субстратом. Продуктами брожений являются различные органические кислоты (молочная, масляная, уксусная, муравьиная), спирты (этиловый, бутиловый, пропиловый), ацетон, а также CO2
и H2
. Обычно в процессе брожения образуется несколько продуктов. В зависимости от того, какой основной продукт накапливается в среде, различают молочнокислое, спиртовое, маслянокислое, пропионовокислое и другие виды брожений.
Следовательно, в каждом виде брожения можно выделить две стороны: окислительную и восстановительную. Процессы окисления сводятся к отрыву электронов от определенных метаболитов с помощью специфических ферментов (дегидрогеназ) и акцептированию их другими молекулами, образующимися из сбраживаемого субстрата, т. е. в процессе брожения происходит окисление анаэробного типа.
Энергетическая сторона
Собственно энергетической стороной процессов брожения является их окислительная часть, поскольку реакции, ведущие к выделению энергии, — это реакции окисления. Существует несколько исключений из этого правила: некоторые анаэробы часть энергии при сбраживании субстрата получают также в результате его расщепления. Примитивность процессов брожения заключается в том, что из субстрата в результате его анаэробного преобразования извлекается лишь незначительная доля той химической энергии, которая в нем содержится. Продукты, образующиеся в процессе брожения, все еще содержат в себе значительное количество энергии, заключавшейся в исходном субстрате. Чтобы четче представить разницу в энергетическом выходе процессов брожения и дыхания, приведем данные по изменению уровней стандартной свободной энергии для процессов гомоферментативного молочнокислого брожения и дыхания при одинаковом исходном энергетическом субстрате (глюкоза):
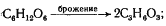 |
 |
| DG
0
' = –196,65 кДж/моль; |
DG
0
' = –2870,22 кДж/моль. |
В процессе гомоферментативного молочнокислого брожения синтезируются 2 молекулы АТФ на 1 молекулу сброженной глюкозы; в процессе дыхания при полном окислении молекулы глюкозы образуется 38 молекул АТФ. В обоих случаях эффективность запасания выделяющейся энергии в макроэргических связях АТФ приблизительно одинакова.
При брожении некоторые реакции на пути анаэробного преобразования субстрата связаны с наиболее примитивным типом фосфорилирования — субстратным фосфорилированием. К синтезу АТФ по механизму субстратного фосфорилирования ведут катаболические реакции, которые в зависимости от своей химической природы могут быть разделены на два типа. Большинство относится к окислительно-восстановительным реакциям. Богатые энергией соединения возникают в процессе брожения на этапах анаэробного окисления. Например, окисление фосфоглицеринового альдегида (ФГА), катализируемое ФГА-дегидрогеназой, приводит к образованию богатого энергией метаболита — 1,3-дифосфоглицериновой кислоты (1, 3-ФГК). Анаэробное окисление пировиноградной или a-кетоглутаровой кислот приводит к образованию высокоэнергети-ческих метаболитов — ацетил-КоА40
или сукцинил-КоА соответственно.
40
Символ "КоА" обозначает кофермент А, связанный с ацильной группой (R-CO~S-KoA), "КоА-SH", находящийся в свободном состоянии.
Второй тип реакций связан с расщеплением субстратов или промежуточных продуктов, образующихся из них. Катализируются эти реакции ферментами, относящимися к классу лиаз. Например, у гетероферментативных молочнокислых бактерий высокоэнергетический ацетилфосфат образуется из ксилулозо-5-фосфата в реакции, катализируемой фосфокетолазой:
ксилулозо-5-фосфат + ФН
® ФГА+ ацетилфосфат + H2
O.
К реакциям подобного типа относится также расщепление цитруллина, приводящее к синтезу карбамоилфосфата — соединения с макроэргической фосфатной связью:
цитруллин + ФН
® карбамоилфосфат + орнитин.
Богатые энергией соединения, образующиеся в реакциях рассмотренных выше типов, представляют в большинстве случаев ангидриды фосфорной кислоты или тиоэфиры органических кислот. Последние используются для синтеза АТФ через ферментативную стадию образования соответствующих ацилфосфатов:
ацил-КоА + ФН
® ацилфосфат + КоА-SH.
Из других высокоэнергетических соединений важное место в энергетике процессов брожения принадлежит фосфоенолпировиноградной кислоте (ФЕП). Эти соединения характеризуются тем, что свободная энергия, освобождающаяся при их гидролизе, находится в области значений от -35 до -88 кДж/моль и с помощью соответствующих ферментов может быть перенесена на молекулы АДФ.
Несмотря на большое число углеродных субстратов, доступных для сбраживания, количество реакций, приводящих непосредственно к синтезу АТФ при брожениях, сравнительно невелико. Наиболее распространены следующие из них:
1) ацетилфосфат + АДФ ® ацетат + АТФ;
2) 1,3-фосфоглицериновая кислота + АДФ ® 3-фосфоглицеринновая кислота + АТФ;
3) фосфоенолпировиноградная кислота + АДФ ® пировиноградная кислота + АТФ.
Другие реакции субстратного фосфорилирования ограничены какими-либо специфическими видами брожения. Например, сбраживание некоторых пиримидинов и аргинина, осуществляемое отдельными видами бактерий из рода Streptococcus,
приводит к образованию карбамоилфосфата, фосфатная группа которого переносится на АДФ в реакции, катализируемой карбаматкиназой:
карбамоилфосфат + АДФ ® карбамат + АТФ.
Один вид клостридиев (C. cylindrosporum
), сбраживающий пурины, способен образовывать формиат и тетрагидрофолат (ТГФК) из формилтетрагидрофолиевой кислоты в реакции, сопровождающейся фосфорилированием АДФ:
формил-ТГФК + АДФ + ФН
® формиат + ТГФК + АТФ.
Для этого вида указанная реакция служит основным путем получения АТФ.
Все реакции субстратного фосфорилирования локализованы в цитозоле клетки. Это указывает на простоту химических механизмов, лежащих в основе субстратного фосфорилирования.
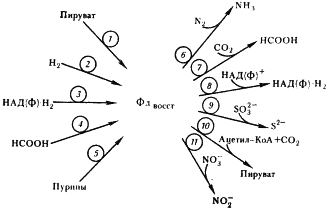
Проблема акцептора электронов
Основная проблема всех процессов брожения — проблема акцептора электронов. В конечном итоге степень окисления и сопряженное с этим количество свободной энергии, а также характер образующихся продуктов определяются природой конечных акцепторов электронов. При брожениях конечными акцепторами электронов служат в основном органические соединения: метаболиты, образующиеся из исходных субстратов (пировиноградная кислота, ацетальдегид), или вещества, имеющиеся в среде культивирования (некоторые аминокислоты и другие органические соединения, способные восстанавливаться). В ряде брожений акцепторами электронов служат молекулы CO2
, а также ионы водорода (H2
). Кроме того, в отдельных случаях дополнительными акцепторами электронов могут быть некоторые достаточно окисленные неорганические соединения, такие как нитрат, молекулярная сера. Если конечным акцептором электронов является ацетальдегид, образуется этанол, если пируват — молочная кислота. Акцептирование электронов молекулами CO2
приводит у разных видов к возникновению формиата или ацетата, если же эту функцию выполняют ионы водорода, образуется молекулярный водород (H2
).
Восстановленные соединения, акцептировавшие электроны, выделяются из клеток эубактерий в окружающую среду и накапливаются в ней в значительных количествах. Из-за низкого энергетического выхода процессов брожения для обеспечения энергией всех функций и биосинтетических процессов клетке приходится перерабатывать огромные количества субстратов.
Итак, брожение — это способ получения энергии, при котором АТФ образуется в процессе анаэробного окисления органических субстратов в реакциях субстратного фосфорилирования.
ГОМОФЕРМЕНТАТИВНОЕ МОЛОЧНОКИСЛОЕ БРОЖЕНИЕ
Последовательность биохимических реакций, лежащих в основе гомоферментативного молочнокислого брожения, получила название гликолитического пути (гликолиза)41
, фруктозодифосфатного пути, или пути Эмбдена — Мейергофа — Парнаса (Н. Embden, О. Meyerhof, Я. О. Парнас), по именам исследователей, внесших больший вклад в изучение этого процесса. Общая схема гомоферментативного молочнокислого брожения представлена на рис. 53.
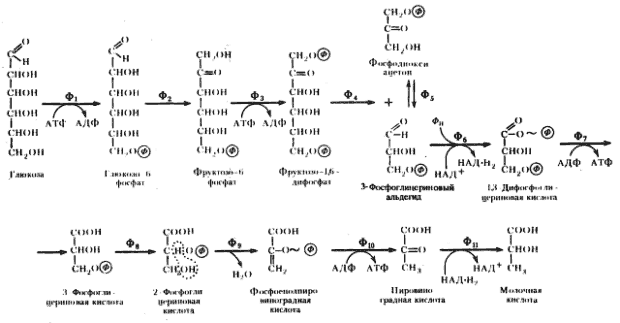 |
| Рис. 53. Гомоферментативное молочнокислое брожение: Ф1
— гексокиназа; Ф2
— глюкозофосфатизомераза; Ф3
— фофсофруктокиназа; Ф4
— фруктозо-1,6-дифосфатальдолаза; Ф5
— триозофосфатизомераза; Ф6
— 3-ФГА-дегидрогеназа; Ф7
— фофсоглицерокиназа; Ф8
— фосфоглицеромутаза; Ф9
— енолаза; Ф10
— пируваткиназа; Ф11
— лактатдегиброгеназа (по Dagley, Nicholson, 1973) |
Основными энергетическими ресурсами для эубактерий, осуществляющих гомоферментативное молочнокислое брожение, служат моносахара (в первую очередь, глюкоза) и дисахара (мальтоза, лактоза). В процессе подготовки к энергетическим преобразованиям дисахара ферментативным путем расщепляются до моносахаров. Различные моносахара, прежде чем подвергнуться преобразованиям, должны превратиться в глюкозо-6-фосфат. Момент унификации, т. е. превращения различных субстратов в один, исходный для дальнейшего его метаболизирования по данному пути, очень важен. От того, что служит исходным энергетическим ресурсом, зависит общий энергетический баланс процесса.
41
Собственно гликолиз — это определенная последовательность ферментативных реакций от углевода до пировиноградной кислоты, поэтому, строго говоря, "гликолиз" не является синонимом "гомоферментативного молочнокислого брожения", но 10 из 11 реакций у этих процессов идентичны.
Если исходным энергетическим субстратом служит глюкоза, первое превращение, которому она подвергается, — фосфорилирование. В результате образуется глюкозо-6-фосфат — метаболически активная форма глюкозы. Если исходный энергетический субстрат — лактоза, первым шагом на пути метаболизирования является ферментативное расщепление лактозы с помощью (3-галактозидазы на D
-галактозу и D
-глюкозу. D
-галактоза затем подвергается фосфорилированию, приводящему к образованию D
-галактозо-1-фосфата. Последний подвергается серии ферментативных превращений с участием УТФ в качестве кофермента, в результате которых превращается в глюкозо-1-фосфат.
У некоторых бактерий из рода Lactobacillus
имеется фермент мальтозофосфорилаза, катализирующий реакцию:
мальтоза + H3
PO4
® глюкозо-1-фосфат + глюкоза.
В результате этой реакции осуществляется расщепление дисахарида мальтозы на две молекулы глюкозы, одна из которых образуется в фосфорилированной форме. Здесь важно подчеркнуть, что в этой реакции молекула фосфорилированной глюкозы синтезируется без затраты АТФ.
Если исходным энергетическим субстратом, вовлекаемым в процесс гликолиза, служит полисахарид типа гликогена или крахмала, его использование начинается с фосфоролитического отщепления глюкозного остатка, протекающего по схеме:
(глюкоза)n
+ HPO4
2 –
® (глюкоза)n – 1
+ глюкозо-1-фосфат.
Глюкозо-1-фосфат, образующийся в результате подготовительных превращений углеводов, иных, чем глюкоза, превращается затем в глюкозо-6-фосфат. Перемещение фосфатной группы из положения 1 в положение 6 катализируется ферментом фосфоглюкомутазой. Дальнейшее превращение глюкозо-6-фосфата одинаково независимо от исходного энергетического субстрата (рис. 53).
Молекула глюкозо-6-фосфата изомеризуется в молекулу фруктозо-6-фосфата. Последний фосфорилируется в положении 1. Донором фосфата служит АТФ. Вторичное фосфорилирование молекулы фруктозы приводит к ее дальнейшему активированию.
Образовавшийся фруктозо-1,6-дифосфат разрывается на две триозы: фосфодиоксиацетон и 3-ФГА. Разрыв катализируется фруктозо-1,6-дифосфатальдолазой (альдолазой), являющейся ключевым ферментом этого пути. Достаточно обнаружить альдолазу, чтобы получить свидетельство существования гликолитического пути у организма. В последующие реакции может включаться только 3-ФГА. Фосфодиоксиацетон превращается в 3-ФГА в реакции изомеризации, катализируемой триозофосфатизомеразой.
На этом этапе заканчивается подготовительная стадия гликолитического пути: молекула глюкозы после активирования и расщепления на 2 фосфотриозы подготовлена для последующих превращений. Для активирования 1 молекулы глюкозы тратятся 2 молекулы АТФ42
. Таким образом, до сих пор процесс протекает с затратой энергии. Однако его смысл и назначение заключаются в обеспечении клетки энергией. Эта задача решается на следующей стадии.
Окисление 3-ФГА до 1,3-дифосфоглицериновой кислоты — один из наиболее важных этапов гликолитического пути, поскольку именно на этом этапе энергия, освобождающаяся при окислении альдегидной группы 3-ФГА, запасается в молекуле 1,3-ФГК. Реакция катализируется ферментом 3-ФГА-дегидрогеназой:
3-ФГА + НАД+
+ ФН
® 1,3-ФГК + НАД-H2
.
3-ФГА служит донором электронов, которые переходят на НАД+
функционирующий в качестве переносчика электронов от 3-ФГА к пировиноградной кислоте. Образование последней происходит на более поздних этапах гликолитического пути. Итак, альдегидная группа 3-ФГА окисляется до карбоксильной группы. Однако вместо свободной карбоновой кислоты образуется смешанный ангидрид фосфорной кислоты и карбоксильной группы 3-ФГК — 1,3-ФГК. Реакция окисления 3-ФГА до 1,3-ФГК с помощью НАД-зависимой 3-ФГА-дегидрогеназы состоит из нескольких этапов, в результате чего энергия, освобождающаяся при окислении 3-ФГА, запасается в макроэргической фосфатной связи у первого углеродного атома 1,3-ФГК. 1,3-ФГК реагирует далее с АДФ, отдавая высокоэнергетическую фосфатную группу, что приводит к синтезу молекулы АТФ. Таким образом, энергия, высвободившаяся при окислении альдегидной группы, оказывается запасенной в молекуле АТФ.
42
Если исходным субстратом служит полисахарид, например гликоген или крахмал, для активирования глюкозного остатка на подготовительной стадии гликолитического пути затрачивается только 1 молекула АТФ.
Итак, произошло образование 3-ФГК. Теперь можно подвести некоторые итоги. Клетка на этом этапе "вернула" свои энергетические затраты: 2 молекулы АТФ были затрачены и 2 молекулы АТФ синтезировались на 1 молекулу глюкозы. На этом же этапе в реакции окисления 3-ФГА до 1,3-ФГК и образования АТФ имеет место первое субстратное фосфорилирование. Энергия освобождается и запасается в макроэргических фосфатных связях АТФ в процессе перестройки сбраживаемого субстрата при участии ферментов. Реакция, ведущая к субстратному фосфорилированию, может быть проведена в пробирке. Все необходимые для этого компоненты известны и получены в чистом виде. Возможность осуществления реакции в пробирке указывает на то, что фермент, катализирующий ее, не связан с клеточными структурами. Первое субстратное фосфорилирование носит еще название фосфорилирования на уровне 3-ФГА.
После образования 3-ФГК фосфатная группа из третьего положения переносится во второе. Далее происходит отщепление молекулы воды от второго и третьего атомов углерода 2-ФГК, катализируемое ферментом енолазой, и образуется фосфоенолпировиноградная кислота. В результате происшедшей дегидратации молекулы 2-ФГК степень окисления ее второго углеродного атома увеличивается, а третьего — уменьшается. Таким образом, данная реакция по существу представляет собой внутримолекулярный окислительно-восстановительный процесс. Дегидратация молекулы 2-ФГК, приводящая к образованию ФЕП, сопровождается перераспределением энергии внутри молекулы, в результате чего фосфатная связь у второго углеродного атома из низкоэнергетической в молекуле 2-ФГК превращается в высокоэнергетическую в молекуле ФЕП.
Молекула ФЕП становится донором богатой энергией фосфатной группы, которая переносится на АДФ с помощью фермента пируваткиназы. Таким образом, в процессе превращения 2-ФГК в пировиноградную кислоту имеет место высвобождение энергии и запасание ее в молекуле АТФ. Это второе субстратное фосфорилирование. По ряду черт оно отличается от первого субстратного фосфорилирования: 1) если в первом случае образование макроэргической фосфатной связи протекало одновременно с присоединением к субстрату фосфатной группы, то во втором — фосфатная группа была присоединена к молекуле субстрата задолго до этого события; 2) первое субстратное фосфорилирование связано с реакцией окисления, приводящей к тому, что от молекулы 3-ФГА отрываются два электрона и переходят на НАД+
, т. е. молекула 3-ФГА служит донором электронов, но вопрос о конечном акцепторе их на этом этапе не решен. Напротив, при втором субстратном фосфорилировании, связанном с реакцией дегидратации молекулы 2-ФГК, решается проблема и донора и акцептора. Здесь в результате внутримолекулярного окислительно-восстановительного процесса одна молекула и донирует и акцептирует электроны.
В процессе второго субстратного фосфорилирования образуется еще молекула АТФ; в итоге общий энергетический выигрыш процесса составляет 2 молекулы АТФ на 1 молекулу глюкозы. Такова энергетическая сторона процесса гомоферментативного молочнокислого брожения.
Однако осталась еще проблема восстановленного переносчика — НАД-H2
, образованного в реакции окисления 3-ФГА. Чтобы процесс продолжался, в метаболический поток необходимо вернуть этот метаболит в окисленном виде (НАД+
), т. е. решить проблему конечного акцептора. Как же она решается в данном случае? Результатом рассмотренного выше процесса, помимо его энергетического итога, является образование 2 молекул пировиноградной кислоты и 2 молекул НАД-H2
на 1 молекулу сброженной гексозы. Молекула пировиноградной кислоты по своему химическому строению — достаточно окисленное соединение и может служить акцептором электронов. В этом случае донор-акцепторная проблема решена самым простым способом: 2 электрона переносятся с НАД-H2
на молекулу пировиноградной кислоты, что приводит к образованию молочной кислоты. Суммарно процесс можно выразить в виде следующего уравнения:
глюкоза + 2ФН
+ 2АДФ ® 2 молочная кислота + 2АТФ + 2H2
O.
Гомоферментативное молочнокислое брожение представляет собой энергетическую сторону образа жизни группы гомоферментативных молочнокислых бактерий. Черты древности этой группы видны не только в процессе добывания ее представителями энергии, но и в других сторонах их метаболизма, о чем будет сказано в разделе, посвященном краткой характеристике этих бактерий. Сейчас же остается подвести некоторые итоги рассмотренного процесса и оценить его "судьбу". В процессе гомоферментативного молочнокислого брожения имеют место 3 типа химических превращений:
- перестройка углеродного скелета исходного субстрата;
- окислительно-восстановительные превращения;
- образование АТФ.
Энергетический выход процесса таков: образование 2 молекул АТФ на молекулу глюкозы43
. Энергетическая эффективность процесса, т. е. эффективность запасания выделяемой свободной энергии в молекулах АТФ, составляет примерно 40%. Энергия запасается только в реакциях субстратного фосфорилирования. Как можно видеть из суммирования энергетических характеристик процесса, низкий энергетический выход сочетается в нем с высокой энергетической эффективностью, а в основе всего лежат простые механизмы получения энергии. Окислительно-восстановительные превращения имеют место на двух этапах процесса, именно они приводят к получению клеткой энергии. Если оценить общин окислительно-восстановительный .баланс процесса (C6
H12
O6
® 2C3
H6
O3
), можно видеть, что суммарного изменения степени окисленности при этом не происходит (если сравнить степень окисленности отдельных углеродных атомов глюкозы и молочной кислоты, получается другая картина). Это результат того, что процесс "замкнут на себя", т. е. субстрат является и источником веществ — доноров электронов и источником веществ — их акцепторов. "Замкнутость" процесса приводит к ограничению его окислительных и, следовательно, энергетических возможностей (но в данном конкретном случае еще не исчерпывает их). Все это, вместе взятое, определило "судьбу" гомоферментативного молочнокислого брожения.
43
Если исходный субстрат — полисахарид, образуются 3 молекулы АТФ на 1 молекулу сброженной глюкозы.
Возникнув как первый, далекий от совершенства энергетический процесс, гомоферментативное молочнокислое брожение не было потом отброшено в процессе эволюции. Наоборот, оно закрепилось и существует сейчас в виде гликолиза у подавляющего большинства прокариот, дрожжей, грибов, а также у высших животных и растений, но только как первый этап более совершенного энергетического процесса, сформировавшегося в результате последующего развития способов получения энергии живыми организмами. Чем объясняется такая судьба гомоферментативного молочнокислого брожения? Вероятно, оказалось выгодным использовать его в качестве первого подготовительного этапа по следующим причинам: 1) высокая энергетическая эффективность (не путать с энергетическим выходом процесса!); 2) простота механизмов получения энергии; 3) перестройка исходного субстрата в форму, метаболически удобную для последующих превращений.
ГОМОФЕРМЕНТАТИВНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ
Гомоферментативное молочнокислое брожение, в основе которого лежит гликолитический путь разложения глюкозы, является единственным способом получения энергии для группы эубактерий, которые при сбраживании углеводов превращают в молочную кислоту от 85 до 90% сахара среды. Бактерии, входящие в данную группу, морфологически различны. Это кокки, относящиеся к родам Streptococcus
и Pediococcus
, а также длинные или короткие палочки из рода Lactobacillus
. Последний подразделяется на три подрода. Бактерии, включенные в два из них (Thermobacterium, Streptobacterium
), также осуществляют гомоферментативное молочнокислое брожение. Все бактерии этой группы положительно окрашиваются по Граму, не образуют спор, неподвижны. Группа весьма гетерогенна в отношении нуклеотидного состава ДНК: молярное содержание ГЦ-пар оснований колеблется от 32 до 51%. Значительные колебания по этому признаку характерны и для бактерий, объединенных в роды и даже подроды.
Лактатдегидрогеназа, катализирующая превращение пирувата в лактат, стереоспецифична. У разных видов она содержится в виде определенных оптических изомеров; в зависимости от этого бактерии продуцируют D
- или L
-форму молочной кислоты. Те из них, которые образуют смесь D
- и L
-форм. содержат или две формы фермента, различающиеся стереоспецифичностью, или лактатрацемазу. Некоторые признаки, характерные для эубактерий, осуществляющих гомоферментативное молочнокислое брожение, представлены в табл. 15.
Таблица 15. Характеристика таксономических групп гомоферментативных молочнокислых бактерий
| Род и подрод бактерий |
Морфология и особенности деления клеток |
Молярное содержание ГЦ в ДНК, % |
Конфигурация молочной кислоты |
Наиболее распространенные виды |
| Род Streptococcus
|
сферические или овальные клетки; делятся в одной плоскости, в результате образуются пары или цепочки клеток |
33—44 |
D
|
S. faecalis
S. lactis
|
| Род Pediococcus
|
кокки; делятся в двух плоскостях, в результате образуются тетрады клеток |
33—44 |
DL
|
P. cerevisiae
|
Род Lactobacillus
Подрод Thermobacterium
Подрод Streptobacterium*
|
палочки; делятся в одной плоскости, образуют пары или цепочки клеток |
35—51
32—46 |
L
D
D
DL
DL
L
|
L. delbruckii
L. bulgaricus
L. lactis
L. jensenii
L. plantarum
L. casei
|
* Виды, относящиеся к этому подроду, расщепляют пентозы по окислительному пентозофосфатному пути, осуществляя гетероферментативное молочнокислое брожение. Поэтому они не являются облигатно гомоферментативными молочнокислыми бактериями.
У этой группы эубактерий молекулярный кислород не включается в энергетический метаболизм, но они способны расти в присутствии O2
, т. е. являются аэротолерантными анаэробами44
. В их клетках в значительном количестве содержатся флавиновыe ферменты, с помощью которых происходит восстановление молекулярного кислорода до H2
O2
. Из-за неспособности молочнокислых бактерий синтезировать гемовую группу у них отсутствует каталаза — фермент, катализирующий разложение перекиси водорода, поэтому последняя может накапливаться в клетке. Существующие механизмы защиты от молекулярного кислорода и его производных у этой группы эубактерий изложены в гл. 15.
44
Некоторые авторы представителей рода Lactobacillus
относят к микроаэрофилам (см. сноску на с. 127).
Особенностями конструктивного метаболизма гомоферментативных молочнокислых бактерий являются слабо развитые биосинтетические способности, что выражается в большой зависимости их роста от наличия в питательной среде готовых органических веществ (аминокислоты, витамины группы В, пурины, пиримидины). В качестве источника углерода молочнокислые бактерии используют лактозу (молочный сахар) или мальтозу (растительный сахар, образующийся при гидролизе крахмала). Могут они также использовать некоторые пентозы, сахароспирты и органические кислоты. Из всех известных непатогенных прокариот молочнокислые бактерии отличаются наибольшей требовательностью к субстрату. Зависимость этих бактерий от наличия готовых органических веществ среды указывает на примитивность в целом их конструктивного метаболизма.
Молочнокислые бактерии распространены там, где они могут обеспечить свои высокие потребности в питательных веществах и где имеются большие количества углеводов, переработка которых дает им необходимую для роста энергию. Их много в молоке и молочных продуктах, на поверхности растений и в местах разложения растительных остатков; обнаружены они в пищеварительном тракте и на слизистых оболочках животных и человека.
Молочнокислым бактериям принадлежит главная роль в осуществлении ряда процессов, используемых с давних времен для получения различных кисломолочных продуктов, в процессах соления и квашения овощей, силосования кормов. Кефир — продукт совместной деятельности молочнокислых бактерий и дрожжей. Известно много национальных кисломолочных продуктов (кумыс, йогурт и др.), для приготовления которых используют кобылье, верблюжье, овечье, козье молоко, а в качестве закваски — естественно возникшие и сохраняемые комплексы молочнокислых бактерий и дрожжей. Молочнокислые бактерии играют также большую роль в процессе приготовления сыров и сливочного масла. Первый этап производства сыров (створаживание белков молока) осуществляется молочнокислыми бактериями.
Скисание сливок, необходимое для получения сливочного масла, также вызывают бактерии рода Streptococcus
. Помимо молочной кислоты некоторые из них образуют ацетоин и диацетил, придающие сливочному маслу характерный запах и вкус Субстратом служит лимонная кислота, содержание которой в молоке может достигать 1 г/л. Реакции, ведущие к образованию этих веществ, начинаются с расщепления лимонной кислоты:
лимонная кислота ® уксусная кислота + щавелевоуксусная кислота
Уксусная кислота выделяется в среду, а щавелевоуксусная кислота (ЩУК) декарбоксилируется, что приводит к образованию пирувата:
ЩУК ® пировиноградная кислота + CO2
(1).
Дальнейшее метаболизирование пирувата осуществляется по трем различным путям: часть молекул восстанавливается до молочной кислоты; другая часть подвергается декарбоксилированию, приводящему к возникновению разных C2
-интермедиатов (ацетил-КоА и "активный" ацетальдегид) и взаимодействию между ними, заканчивающемуся синтезом молекулы диацетила. Восстановление последнего приводит к образованию ацетоина:
| CH3
-CO-CO-CH3
|
+ |
НАД-H2
|
® |
CH3
-CHOH-CO-CH3
|
+ |
НАД+
|
(2). |
| диацетил |
ацетоин |
Эта последовательность реакций не связана с получением клеткой энергии. Смысл ее, возможно, в дополнительном своеобразном решении "акцепторной проблемы", так как, во-первых, образование пирувата в реакции 1 не сопровождается синтезом НАД-H2
, и, во-вторых, синтез ацетоина из диацетила (реакция 2) требует дополнительных молекул НАД-H2
.
Использующие мальтозу молочнокислые бактерии участвуют в квашении овощей. В мелко нарезанные овощи добавляют 2 — 3% соли и создают условия, исключающие свободный доступ воздуха. Начинается спонтанное молочнокислое брожение. Аналогичный процесс протекает при силосовании кормов. Предназначенная для силосования растительная масса плотно загружается в силосные башни или ямы. Чтобы повысить питательные свойства среды, добавляют мелассу, а с целью создания более благоприятных условий для молочнокислых бактерий растительную массу подкисляют. В этих условиях также протекает спонтанное молочнокислое брожение.
СПИРТОВОЕ БРОЖЕНИЕ
Выше мы разобрали наиболее простой способ решения донор-акцепторной проблемы, который реализуется в виде молочнокислого брожения у группы гомоферментативных молочнокислых бактерий. Дальнейшие поиски на путях эволюции привели к формированию других метаболических возможностей для решения этой проблемы. Одна из них заключается в том, что из пировиноградной кислоты в результате ее окислительного декарбоксилирования образуется, ацетальдегид, который становится конечным акцептором водорода. В итоге из 1 молекулы гексозы образуются 2 молекулы этилового спирта и 2 молекулы углекислоты. Процесс получил название спиртового брожения. Спиртовое брожение распространено среди прокариотных (различные облигатно и факультативно анаэробные эубактерии) и эукариотных (дрожжи) форм. В анаэробных условиях у высших растений также отмечено накопление этилового спирта.
Процесс спиртового брожения, осуществляемый дрожжами, до последней реакции идет по тому же пути, что и описанный выше процесс молочнокислого брожения, но последняя реакция заменена двумя другими ферментативными реакциями. Сначала пируват с помощью пируватдекарбоксилазы, ключевого фермента спиртового брожения, декарбоксилируется до ацетальдегида и CO2
:
CH3
-CO-COOH ® CH3
-COH + CO2
.
Особенность реакции заключается в ее полной необратимости. Образовавшийся ацетальдегид восстанавливается до этанола с участием НАД+
-зависимой алкогольдегидрогеназы:
CH3
-COH + НАД-H2
® CH3
-CH2
OH + НАД+
Донором водорода служат 3-ФГА (как и в случае молочнокислого брожения).
Процесс спиртового брожения суммарно можно выразить следующим уравнением:
C6
H12
O6
+ 2ФН
+ 2АДФ ® 2CH3
-CH2
OH + 2CO2
+ 2АТФ +2H2
O.
Как видно из уравнения, с точки зрения энергетического выхода оба процесса (гомоферментативное молочнокислое и спиртовое брожение) одинаковы. В обоих случаях сбраживание 1 молекулы глюкозы приводит к образованию 2 молекул АТФ. Процессы различаются природой конечных акцепторов электронов. Кроме того, если при гомоферментативном молочнокислом брожении образовавшаяся молочная кислота в целом по степени окисленности-восстановленности не отличается от молекулы гексозы (имеет место лишь внутримолекулярное перераспределение окисленности и восстановленности отдельных углеродных атомов, входящих в ее молекулу), то в случае спиртового брожения происходит межмолекулярное размежевание на восстановленные (этиловый спирт) и окисленные (CO2
) молекулы.
Спиртовое брожение, осуществляемое дрожжами, интересно тем, что на нем впервые были сделаны открытия, имеющие принципиальное значение. Именно при изучении спиртового брожения Л. Пастер доказал, что оно является процессом, связанным с жизнедеятельностью определенных микроорганизмов — дрожжей. Л. Пастер открыл, что в условиях свободного доступа кислорода воздуха процесс спиртового брожения ингибируется и активируется дыхание. Это явление получило название "эффекта Пастера". "Эффект Пастера" есть результат определенного взаимодействия между различными энергетическими путями, существующими у дрожжей. Одним из проявлений такого взаимодействия является конкуренция за АДФ и неорганический фосфат между процессами субстратного фосфорилирования гликолитического пути и окислительного фосфорилирования в дыхательной цепи.
В 1897 г. братья Г. и Э. Бухнеры (Н. Buchner, E. Buchner) опубликовали первое сообщение о возможности осуществления спиртового брожения вне клетки. Оказалось, что бесклеточные экстракты дрожжей превращают углеводы в этанол. Это послужило отправным пунктом для детального изучения химизма процесса. Впервые было показано включение неорганического фосфора в этот процесс и роль фосфорилированных соединений (Л. А. Иванов, 1905; A. Harden, W. Young, 1905). Установлена природа отдельных реакций, катализирующих их ферментов, промежуточных продуктов метаболизма, коферментов, энергетических взаимопревращений. В 1933г. Г. Эмбден и О.Мейергоф предложили полную схему спиртового брожения. Наконец, работы К. Нойберга (К. Neuberg) по изучению механизма спиртового брожения привели к установлению еще одной важной особенности метаболизма низших форм жизни — его чрезвычайной гибкости.
К. Нойберг обнаружил, что в зависимости от условий процесс спиртового брожения может идти с образованием продуктов, которые в норме не образуются. Если к дрожжам, сбраживающим глюкозу, добавить бисульфит, то основным продуктом брожения будет глицерин. Оказалось, что бисульфит образует комплекс с ацетальдегидом, и последний не может больше функционировать как акцептор электронов:
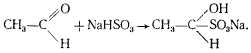
Следствием этого является передача электронов от НАД-H2
на фосфодиоксиацетон, восстановление его до 3-фосфоглицерина и дефосфорилирование последнего, приводящее к образованию глицерина. Кроме глицерина в среде происходит накопление ацетальдегида (в комплексе с бисульфитом), этанола и CO2
, но образование последних двух продуктов заметно подавлено. Когда брожение идет в присутствии бисульфита, энергетический выход процесса в два раза меньше по сравнению с нормальным спиртовым брожением, поскольку одна триоза не подвергается окислению, а восстанавливается до молекулы глицерина.
Спиртовое брожение протекает обычно при pH 3–6. Если его проводить в щелочной среде, например в присутствии NaHCO3
, также происходит накопление в сбраживаемом растворе глицерина. Оказалось, что в щелочных условиях ацетальдегид не может акцептировать электроны, поскольку в этих условиях он участвует в реакции дисмутации с образованием уксусной кислоты и этилового спирта. Акцептором электронов, как и в предыдущем случае, служит фосфодиоксиацетон. Процесс брожения в щелочной среде можно представить в виде следующего уравнения:
| 2C6
H12
O6
|
® |
2C3
H8
O3
|
+ |
CH3
-COOH |
+ |
CH3
-CH2
OH |
+ |
2CO2
. |
| глюкоза |
глицерин |
уксусная кислота |
этиловый спирт |
МИКРООРГАНИЗМЫ, ОСУЩЕСТВЛЯЮЩИЕ СПИРТОВОЕ БРОЖЕНИЕ
Накопление этилового спирта в среде в анаэробных условиях наблюдается у разных групп эубактерий и группы эукариотных микроорганизмов — дрожжей.
Эубактерии
Способность осуществлять в анаэробных условиях спиртовое брожение по пути, описанному в предыдущем разделе, присуща некоторым эубактериям, принадлежащим к разным таксономическим группам, например Sarcina ventriculi, Erwinia amylovora
.
S. ventriculi
относится к группе грамположительных анаэробных кокков. Клетки неподвижные; делятся в трех плоскостях, поэтому в культуре часто образуют пакеты, состоящие из 64 и более клеток. Веществом, связывающим клетки в пакетах, служит целлюлоза. Описана способность образовывать эндоспоры. Аэротолерантный анаэроб. Единственный способ получения энергии — сбраживание Сахаров. Потребность в питательных веществах довольно высока (многочисленные аминокислоты и ряд витаминов).
E. amylovora
относится к группе энтеробактерий. Это грамотрицательные подвижные палочки. Особенностью вида является его патогенность для растений. Факультативный анаэроб. В аэробных условиях получает энергию в процессе дыхания.
Помимо этилового спирта и CO2
в качестве продуктов брожения S. ventriculi
в среде накапливается уксусная кислота и выделяется молекулярный водород, у E. amylovora
накапливается молочная кислота. Разнообразие конечных продуктов у этих бактерий связано с тем, что пируват, образующийся при сбраживании глюкозы по гликолитическому пути, далее может метаболизироваться различно: восстанавливаться до молочной кислоты; подвергаться декарбоксилированию и последующему восстановлению, как описано в предыдущем разделе; подвергаться ферментативному расщеплению, приводящему к образованию ацетата и др.
У многих клостридиев и энтеробактерий среди продуктов брожения обнаруживают этиловый спирт, но путь его образования отличен от описанного в предыдущем разделе. Сбраживание сахаров до пировиноградной кислоты происходит по гликолитическому пути, дальнейшее же превращение пирувата идет не через пируватдекарбоксилазу. У названных групп бактерий пируват подвергается расщеплению, приводящему к образованию ацетил-КоА. Реакция катализируется пируватдегидрогеназой. Ацетил-КоА затем восстанавливается до ацетальдегида:
CH3
-CO~S-КоА + НАД-H2
® CH3
-COH + НАД+
+ КоА-SH,
а последний — до этанола.
Гетероферментативные молочнокислые бактерии накапливают в среде спирт, метаболизируя глюкозу по окислительному пентозофосфатному пути. В результате ряда ферментативных превращений образуется ацетилфосфат, восстановление которого в два этапа приводит к появлению молекулы этилового спирта.
Наконец, у бактерий Zymomonas mobilis
с неясным систематическим положением, используемых в Мексике для получения национального спиртного напитка "пульке", разложение глюкозы до пировиноградной кислоты идет по пути Энтнера — Дудорова. Дальнейшее превращение пирувата происходит с участием пируватдекарбоксилазы и алкогольдегидрогеназы. Выход продуктов брожения такой же, как при спиртовом брожении по гликолитическому пути: по 2 молекулы спирта и CO2
на 1 молекулу сброженной глюкозы, но энергетический выход в два раза ниже, чем при гликолизе: всего 1 молекула АТФ на 1 молекулу сброженной глюкозы.
Z. mobilis
— грамотрицательные подвижные бактерии, имеющие форму коротких палочек. Характеризуются высокими биосинтетическими способностями. Анаэробы, единственный способ получения энергии для которых — спиртовое брожение. Однако эти бактерии способны расти в присутствии молекулярного кислорода. Последний в этом случае используется для окисления части этанола до уксусной кислоты в соответствии с уравнением:
1 глюкоза + 1O2
® 1 этиловый спирт + 1 уксусная кислота + 1,7CO2
+ 0,2 молочная кислота
Таким образом, молекулярный кислород существенно не меняет характера энергетического метаболизма Z. mobilis.
В клетках бактерии обнаружены фрагменты ЦТК, цитохромы b
, c
, a2
, каталаза. Наиболее вероятным представляется, что предки Z. mobilis —
аэробы. Способ получения энергии за счет спиртового брожения — более позднее приспособление к условиям обитания.
Эукариоты
Основными продуцентами этилового спирта, имеющими широкое практическое применение, являются дрожжи — одноклеточные эукариотные микроорганизмы, принадлежащие к разным классам высших грибов. Наиболее распространенный способ размножения дрожжей — почкование. Дрожжи — аэробы со сформированным аппаратом дыхания, но в анаэробных условиях осуществляют спиртовое брожение по пути, рассмотренному в предыдущем разделе, т. е. получают энергию за счет субстратного фосфорилирования. Конструктивный метаболизм дрожжей основан на их хорошо развитых биосинтетических способностях. Есть виды дрожжей, развивающиеся на простых синтетических средах; эти дрожжи способны синтезировать все необходимые им сложные органические соединения. Существуют виды,. нуждающиеся в определенных витаминах группы В.
Добавление к питательной среде веществ, содержащих комплекс витаминов, аминокислот, сахаров приводит, как правило, к заметному стимулированию роста дрожжей.
Ряд отраслей промышленности основан на жизнедеятельности дрожжей (виноделие, производство спирта, пивоварение, хлебопекарное производство). Сырьем для производства спирта с использованием дрожжей служат углеводы растительного происхождения (картофель, злаки), отходы пищевой (мелассы) и целлюлозно-бумажной (щелока) промышленности, различные сельскохозяйственные отходы, а также гидролизаты древесины. Сбраживание дрожжами виноградного сока лежит в основе виноделия; сбраживание пивного сусла, приготовленного из проросших зерен ячменя, специальными пивными дрожжами — в основе пивоварения.
О путях образования этилового спирта
Изложенные данные позволяют составить определенное представление о том, насколько широко распространено образование этилового спирта среди разных групп эубактерий и насколько различны метаболические пути, ведущие к его синтезу. Из этого следует, что накопление в культуральной среде этилового спирта само по себе не может служить указанием на место процесса, приводящего к его образованию, в эволюции. Этиловый спирт у эубактерий может быть одним из конечных продуктов как эволюционно более ранних (гликолиз), так и более поздних (окислительный пентозофосфатный цикл, путь Энтнера — Дудорова) катаболических процессов. До сих пор среди эубактерий не обнаружены организмы, сохранившие черты примитивности энергетического и конструктивного метаболизма, у которых спиртовое брожение служило бы единственным способом получения энергии. Тот факт, что в самом "классическом" виде спиртовое брожение проявляется у дрожжей, форм эукариотных, не может, как нам кажется, ставить под сомнение его место в эволюции анаэробных энергетических процессов.
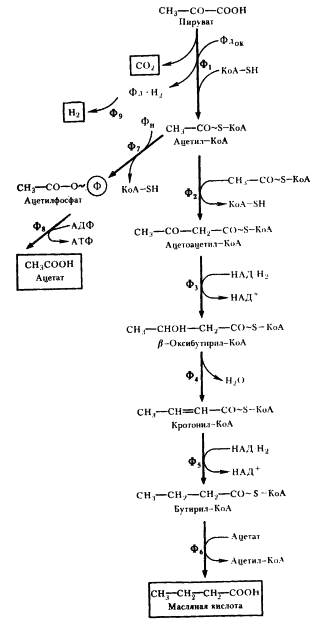
ПРОПИОНОВОКИСЛОЕ БРОЖЕНИЕ
Из рассмотренных двух типов брожения видно, что ключевым соединением в обоих процессах является пируват, поскольку в конечном итоге специфика брожения определяется дальнейшей судьбой пирувата. Основная задача последующих реакций — регенерирование молекулы НАД+
и возвращение ее в клеточный метаболизм. Прямое восстановление пирувата с помощью НАД-H2
до молочной кислоты реализуется в молочнокислом брожении. Другая возможность регенерирования НАД+
— "сбрасывание" водорода с НАД-H2
на фрагменты, образуемые при метаболизме пирувата, — имеет место в спиртовом брожении, осуществляемом дрожжами и некоторыми видами бактерий. Третья возможность связана с синтетическим процессом — усложнением молекулы пирувата, в результате которого создается более окисленная молекула акцептора, способная принять больше электронов с восстановленных переносчиков. Это происходит при присоединении к молекуле пирувата CO2
, приводящем к формированию четырехуглеродного скелета. Процесс получил название гетеротрофной ассимиляции углекислоты.
 |
| Рис. 54. Превращение пировиноградной кислоты в пропионовую при пропионовокислом брожении: Ф1
— метилмалонил-КоА-карбоксилтрансфераза; Ф2
— малатдегидрогеназа; Ф3
— фумараза: Ф4
— фумаратредуктаза; Ф5
— КоА-трансфераза; Ф6
— метилмалонил-КоА-мутаза (по Daglev, Nicholson. 1973; Rose. 1971) |
Впервые гетеротрофная ассимиляция углекислоты была обнаружена в 1936 г. X. Вудом и К. Веркманом (Н. Wood, C. Werkman) при изучении сбраживания глицерина пропионовыми бактериями. Карбоксилирование пирувата, приводящее к образованию щавелевоуксусной кислоты, получило название реакции Вуда — Веркмана. У эубактерий обнаружены различные реакции карбоксилирования пирувата или его фосфорилированного производного. Показано, что реакции карбоксилирования имеют место у всех гетеротрофных прокариот, а также в клетках всех эукариотных организмов, включая высшие растения и животных. Кроме того, в больших масштабах в природе реакции связывания CO2
осуществляются автотрофными. организмами в процессе хемо- и фотосинтеза.
В пропионовокислом брожении мы имеем дело с реализацией третьей возможности превращения пирувата — его карбоксилированием, приводящим к возникновению нового акцептора водорода — ЩУК. Восстановление пировиноградной кислоты в пропионовую у пропионовокислых бактерий протекает следующим образом (рис. 54). Пировиноградная кислота карбоксилируется в реакции, катализируемой биотинзависимым ферментом, у которого биотин выполняет функцию переносчика CO2
. Донором CO2
-группы служит метилмалонил-КоА. В результате реакции транскарбоксилирования образуются ЩУК и пропионил-КоА:
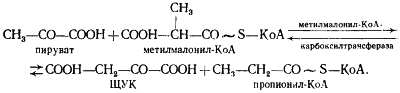
Рассмотрим теперь дальнейшую судьбу каждого из двух продуктов реакции, а также вопрос о происхождении одного из субстратов реакции — метилмалонил-КоА. (Основным источником пировиноградной кислоты служит процесс гликолитического расщепления гексоз или окислительные превращения, если в качестве субстрата брожения используют, например, диоксиацетон или глицерин.)
ЩУК в результате трех ферментативных этапов (аналогичных реакциям 6, 7, 8 цикла трикарбоновых кислот, см. рис. 92) превращается в янтарную кислоту:

Следующая реакция заключается в переносе КоА-группы с пропионил-КоА на янтарную кислоту (сукцинат), в результате чего образуется сукцинил-КоА и пропионовая кислота:
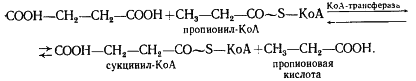
Образовавшаяся пропионовая кислота выводится из процесса и накапливается вне клетки. Сукцинил-КоА превращается в метилмалонил-КоА:
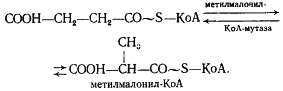
В состав кофермента метилмалонил-КоА-мутазы входит витамин B12
. Перегруппировки типа, указанного в приведенном выше уравнении, характерны для реакций, катализируемых ферментами, содержащими витамин B12
. В описанной выше реакции происходящие перемещения атомов в молекуле сводятся к двум типам: изменению углерод-углеродных связей и перераспределению водорода между углеродными атомами (рис. 55). Реакция, катализируемая мутазой, — ключевая в пропионовокислом брожении, так как в ней подготавливается субстрат, являющийся предшественником пропионовой кислоты.
Из схемы, представленной на рис. 54, можно видеть, что образование пропионовой кислоты из пировиноградной — результат взаимосвязанного функционирования двух циклов: цикла переноса одноуглеродного фрагмента и цикла переноса кофермента А.
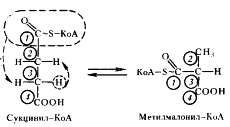 |
| Рис. 55. Механизм реакции, катализируемой метилмалонил-КоА-мутазой. Цифрами в кружочках пронумерованы атомы углерода |
Кофермент А, принимающий активное участие в пропионовокислом брожении, относится к группе мононуклеотидов. Он содержит аденин, Д
-рибозу, пирофосфатную группу и пептидоподобное соединение, в состав которого входит пантотеновая кислота — еще один витамин группы В. Функция кофермента А заключается в переносе ацильных групп (RCO~). Ацильная форма КоА представляет собой тиоэфир. Тиоэфирная связь, образующаяся между карбоксильной группой кислоты и тиоловой группой КоА, является высокоэнергетической.
Итак, разобранный выше поток реакций приводит к синтезу пропионовой кислоты. Однако пропионовокислое брожение — более сложный процесс, поскольку наряду с пропионовой кислотой в качестве продуктов брожения образуются уксусная, янтарная кислоты и CO2
. В схеме, изображенной на рис. 54, янтарная кислота образуется как промежуточное соединение на пути, ведущем к синтезу пропионата; но она может накапливаться в среде и как конечный продукт. К образованию сукцината, количество которого зависит от содержания CO2
в среде, ведет последовательность реакций, начинающаяся с карбоксилирования ФЕП (рис. 56), в которой остаток фосфорной кислоты ФЕП переносится на неорганический фосфат, что приводит к образованию пирофосфата:
ФЕП + CO2
+ ФН
® ЩУК + пирофосфат.
Дальнейшие превращения ЩУК до янтарной кислоты аналогичны реакциям 2 — 4, изображенным на рис. 54.
Многие пропионовые бактерии сбраживают глюкозу так, что на каждую молекулу пирувата, окисленную до уксусной кислоты и CO2
, приходятся 2 молекулы пирувата, восстановленные до пропионовой кислоты. Путь превращения пирувата, приводящий к образованию уксусной кислоты и CO2
, представлен на рис. 56. На этом пути имеют место окислительно-восстановительные реакции, идущие с вовлечением новых молекул НАД+
. Пируват подвергается окислительному декарбоксилированию с участием кофермента А:
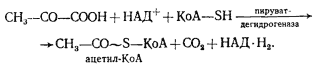
Процесс катализируется пируватдегидрогеназным комплексом и практически необратим. В результате образуется ацетил-КоА, содержащий высокоэнергетическую тиоэфирную связь, ацетильная группа с которого переносится на неорганический фосфат, что приводит к образованию ацетилфосфата и регенерированию кофермента А:
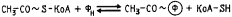
 |
| Рис. 56. Пути образования янтарной, уксусной кислот и CO2
пропионовыми бактериями: Ф1
— ФЕП-карбокситрансфосфорилаза; Ф2
— пируватдегидрогеназа; Ф3
— фосфотрансацетилаза; Ф4
— ацетаткиназа |
В этой реакции энергия, заключенная в тиоэфирной связи, реализуется в виде высокоэнергетической фосфатной связи ацетилфосфата.
И наконец, ацетилфосфат донирует фосфатную группу на АДФ с образованием АТФ и уксусной кислоты:

Итак, на участке от пирувата до ацетата образуется 1 молекула НАД-H2
и 1 молекула АТФ. Энергетическое значение для пропионовых бактерий этого участка метаболического пути очевидно и не требует обсуждения.
Кроме основных продуктов в разных количествах в культуральной жидкости пропионовых бактерий обнаружены молочная, муравьиная, изовалериановая кислоты, этиловый и пропиловый спирты, уксусный и пропионовый альдегиды, ацетоин, диацетил. Состав конечных продуктов брожения зависит от культуры бактерий, состава среды и условий культивирования. Это касается как видов накапливаемых продуктов, так и количественных соотношений между ними.
Теоретически пропионовое брожение должно приводить к образованию 4 молекул АТФ при сбраживании 1,5 молекулы глюкозы. Однако было обнаружено, что выход энергии несколько выше. Источником дополнительных молекул АТФ, возможно, является этап восстановления фумаровой кислоты до янтарной, катализируемый фумаратредуктазой (см. рис. 54). Получены экспериментальные данные в пользу того, что восстановление фумарата до сукцината — процесс, в результате которого некоторые первично анаэробные эубактерии могут синтезировать АТФ по механизму фосфорилирования, сопряженного с переносом электронов. Показано, что фумаратредуктаза связана с мембраной и образует комплекс с переносчиком электронов хиноном. В составе комплекса обнаружен цитохром b.
Фумаратредуктазная система найдена у пропионовых бактерий. Этой системе придается большое значение в эволюции как, возможно, первому шагу на пути создания многокомпонентных электронтранспортных цепей у эубактерий (см. гл. 15).
Энергетическая эффективность пропионовокислого брожения связана также с выработкой пропионовыми бактериями новых метаболических способностей: реакций транскарбоксилирования и перегруппировки, участия в процессе КоА-производных. Образование дикарбоновой кислоты из пировиноградной с использованием механизма транскарбоксилирования вместо прямого карбоксилирования пирувата позволяет избежать дополнительных энергетических затрат на этом этапе брожения. Все это вместе взятое позволяет рассматривать пропионовокислое брожение как более совершенный из рассмотренных до сих пор способов получения энергии в анаэробных условиях.
ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
В эту группу, объединяемую в род Propionibacterium
, входят грамположительные, неподвижные, не образующие спор палочковидные бактерии, размножающиеся бинарным делением. В зависимости от условий культивирования и цикла развития форма клетки может меняться до кокковидной, изогнутой или булавовидной. Типовой вид — P. freudenreichii
.
Большинство пропионовокислых бактерий — аэротолерантные анаэробы, получающие энергию в процессе брожения, основным продуктом которого является пропионовая кислота. Аэротолерантность их обусловлена наличием полностью сформированной ферментной системы защиты от токсических форм кислорода (супероксидный анион, перекись водорода). У пропионовокислых бактерий обнаружены супероксиддисмутазная, каталазная и пероксидазная активности. Внутри группы отношение к O2
различно. Некоторые виды могут расти в аэробных условиях.
Брожение не исчерпывает всех возможностей получения энергии этой группой эубактерий. Хотя гликолитическое расщепление глюкозы с образованием в качестве обязательного промежуточного соединения пировиноградной кислоты является основным путем разложения глюкозы, кроме этого пути в группе пропионовых бактерий обнаружен окислительный пентозофосфатный путь, реакции ЦТК, активное "флавиновое дыхание" и окислительное фосфорилирование, сопряженное с электрон-транспортной системой. Вклад каждого из этих путей в общий энергетический метаболизм зависит как от вида бактерий, так и от конкретных внешних условий. Эволюция пропионовых бактерий определенно шла по пути приспособления к аэробным условиям. У некоторых видов обнаружен "эффект Пастера": в присутствии кислорода воздуха происходит переключение с брожения на дыхание. Пропионовые бактерии могут синтезировать гемсодержащие белки. В их клетках обнаружены цитохромы.
Важную роль в аэробном метаболизме пропионовых бактерий играет "флавиновое дыхание", которому приписывают основную связь этих бактерий с молекулярным кислородом. В процессе "флавинового дыхания" происходит перенос двух электронов с флавопротеинов на O2
, сопровождающийся образованием перекиси водорода, которая разлагается бактериальной каталазой и пероксидазой. Однако "флавиновое дыхание" не связано с получением клеткой энергии. Транспорт электронов в дыхательной цепи некоторых пропионовых бактерий сопровождается образованием АТФ, что может указывать на подключение к этому процессу цитохромов, однако эффективность окислительного фосфорилирования низка. Последнее, вероятно, объясняется несовершенством механизмов сопряжения. В то время как в аэробных условиях конечным акцептором электронов с НАД-H2
является O2
, в анаэробных условиях им может быть нитрат, фумарат.
Таким образом, в группе пропионовых бактерий мы впервые при рассмотрении эубактериальных форм сталкиваемся с большим разнообразием энергетических возможностей. В целом у пропионовых бактерий достаточно четко просматриваются две тенденции: с одной стороны, усовершенствование основного анаэробного способа получения энергии, с другой — попытки приспособления и, более того, рационального использования молекулярного кислорода.
Конструктивный метаболизм пропионовых бактерий претерпел дальнейшую эволюцию в сторону большей независимости от органических соединений внешней среды. Пропионовые бактерии характеризуются хорошо развитыми биосинтетическими способностями и могут расти на простой синтетической среде с аммонийным азотом в качестве единственного источника азота при добавлении к среде пантотеновой кислоты и биотина, а для некоторых видов и тиамина. У ряда пропионовых бактерий обнаружена способность к азотфиксации.
Местообитание пропионовых бактерий — кишечный тракт жвачных животных, молоко, твердые сыры, в приготовлении которых они принимают участие. После молочнокислого брожения, когда лактоза превращена в молочную кислоту, начинают размножаться Пропионовые бактерии, сбраживающие молочную кислоту с образованием уксусной и пропионовой кислот. Эти кислоты придают сырам специфический острый вкус. Пропионовые бактерии используют в микробиологической промышленности в качестве продуцентов витамина B12
.
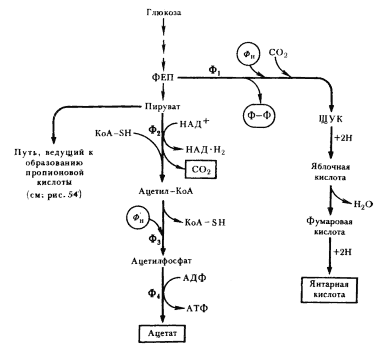
МАСЛЯНОКИСЛОЕ БРОЖЕНИЕ
 |
| Рис. 57. Пути превращения пирувата в маслянокислом брожении, осуществляемом Clostridium butyricum
: Ф1
— пируват:ферредоксиноксидоредуктаза; Ф2
— ацетил-КоА-трансфераза (тиолаза); Ф3
— (3-оксибутирил-КоА-дегидрогеназа; Ф4
— кротоназа; Ф5
— бутирил-КоА-дегидрогеназа; Ф6
— КоА-трансфераза; Ф7
— фосфотрансацетилаза; Ф8
— ацетаткиназа; Ф9
— гидрогеназа; Фдок
— окисленный; Фд-H2
— восстановленный ферредоксин; ФН
— неорганический фосфат |
Следующий вариант решения донор-акцепторной проблемы на базе гликолитически образованного пирувата представляет собой маслянокислое брожение. Новое в маслянокислом брожении — возникновение реакций конденсации типа С2
+ С2
® С4
, в результате чего образуется С4
-акцепторная кислота. Судьба этой кислоты различна и определяется необходимостью акцептирования водорода с НАД-H2
, освобождающегося в процессе брожения, а это в свою очередь тесно связано с оттоком водорода на конструктивные процессы. В качестве конечных C4
-продуктов в процессе брожения возникают соединения различной степени восстановленности. Характерным C4
-продуктом брожения является масляная кислота. Осуществляют такой тип брожения многие бактерии, относящиеся к роду Clostridium
.
Типичными представителями клостридиев, осуществляющих маслянокислое брожение, являются C. butyricum
и C. pasteurianum
. Они сбраживают сахара с образованием масляной и уксусной кислот, CO2
и H2
(рис. 57). Превращение глюкозы до пирувата осуществляется по гликолитическому пути. Следующая реакция — разложение пирувата до ацетил-КоА и CO2
, сопровождающееся образованием восстановленного ферредоксина (Фд). Реакция катализируется ферментом пируват: ферредоксиноксидоредуктазой и является ключевой в маслянокислом брожении. Особенности реакции — участие в ней белков, содержащих негемовое железо и кислотолабильную серу (FeS-белки)45
.
45
Кислотолабильной она названа потому, что при кислотной обработке белка происходит ее выделение в виде H2
S.
К FeS-белкам относится группа белков, участвующих в процессах электронного транспорта (ферредоксины), и ряд ферментов, катализирующих окислительно-восстановительные реакции. Установлено, что FeS-белки являются ключевыми в таких важных клеточных процессах, как фотосинтез, дыхание, азотфиксация, фиксация CO2
.
Отличительная особенность FeS-белков — строение их активного центра, содержащего негемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров (FeS-центры) широко распространены в клетках. Простейший из них содержит один атом железа, нековалентно связанного в молекуле белка, получившего название рубредоксина, с четырьмя остатками цистеина (рис. 58, А
)
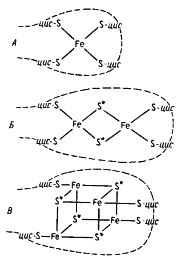 |
| Рис. 58. Железосероцентры FeS-белков. Железосероцентр рубредоксина (А
); предполагаемые модели железосероцентров Fe2
S2
-типа (Б
) и Fe4
S4
-типа (В
). Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис — цистеин |
Обнаруженный у C. pasteurianum
рубредоксин имеет окислительно-восстановительный потенциал около — 57 мВ и участвует в реакциях одноэлектронного переноса, в основе которого лежит переход железа:
Fe2+
« Fe3+
.
Остальные FeS-белки имеют более сложно организованные FeS-центры, в состав которых входит также неорганическая кислотолабильная сера. Известны Fe2
S2
-центры (содержат по два атома железа и неорганической серы), Fe3
S3
- и Fe4
S4
-центры (рис. 58, Б, В
). FeS-белки могут содержать один или более центров в молекуле. У большинства FeS-содержащих ферментов помимо FeS-центров в молекуле имеются и иные кофакторы: металлы (молибден, селен), хромофорные группы (флавин, гемы, птеридины), витамины (табл. 16).
Клостридии содержат ферредоксины с 1 — 2 центрами Fe4
S4
-типа и молекулярной массой 6000 — 7000 Да.
В зависимости от особенностей строения FeS-центров ферредоксины могут осуществлять одновременный перенос одного или двух электронов. Окислительно-восстановительный потенциал ферредоксинов находится в диапазоне от — 490 до — 310 мВ, однако описаны FeS-белки, окислительно-восстановительный потенциал которых высоко положителен (около + 350 мВ).
Ферредоксины играют центральную роль в метаболизме клостридиев, сопрягая катаболические процессы с биосинтетическими реакциями (рис. 59).
Таблица 16. Железосеросодержащие ферменты эубактерий
| Простетическая группа |
Ферменты |
| FeS-центры |
гидрогеназа и др. |
| FeS-центры + тиаминпирофосфат |
пируват:ферредоксин-оксидоредуктаза |
| FeS-центры + флавин |
сукцинатдегидрогеназа, НАД(Ф)-H2
-дегидрогеназа, глутаматсинтетаза и др. |
| FeS-центры + гем |
диссимиляционная сульфитредуктаза |
| FeS-центры + молибден |
нитрогеназа, диссимиляционная нитратредуктаза, формиатдегидрогеназа и др. |
| FeS-центры + два и более дополнительных кофактора |
ассимиляционная сульфитредуктаза, ксантиндегидрогеназа и др. |
 |
| Рис. 59. Роль ферредоксина в метаболизме клостридиев: 1 —
пируват:ферредоксин-оксидоредуктаза; 2 —
гидрогеназа; 3 —
ферредоксин: НАД (Ф)-оксидоредуктаза; 4 —
формиатдегидрогеназа; 5 —
ксантиндегидрогеназа; 6 —
нитрогеназа; 7 —
ферредоксин:CO2
-оксидоредуктаза (возможно, это формиатдегидрогеназа, катализирующая реакцию 4 в обратном направлении); 8 —
реакция 3, протекающая в обратном направлении; 9 —
сульфатредуктаза; 10 —
реакция 1, протекающая в обратном направлении; 11 —
нитратредуктаза |
Объясняется это тем, что у клостридиев (как и других облигатных анаэробов) физиологические реакции в клетке всегда протекают при отрицательных окислительно-восстановительных потенциалах. В этих условиях FeS-белки, имеющие общий отрицательный окислительно-восстановительный потенциал, особенно пригодны для функционирования в составе ферментов и в качестве переносчиков электронов.
Образующийся в реакции восстановленный ферредоксин поставляет электроны для восстановления N2
, протонов (H+
), CO2
и НАДФ+
, а последующее превращение ацетил-КоА приводит к синтезу АТФ в реакции субстратного фосфорилирования.
Путь, ведущий к синтезу масляной кислоты, начинается с реакции конденсации двух молекул ацетил-КоА (см. рис. 57). Образовавшийся ацетоацетил-КоА восстанавливается в b-оксибутирил-КоА. Источником электронов в этой реакции и дальше на пути синтеза масляной кислоты служат молекулы НАДxH2
, образующиеся при окислении 3-ФГА в 1,3-ФГК (см. рис. 53).
Дальнейшее превращение заключается в отщеплении от молекулы (3-оксибутирил-КоА молекулы воды, что приводит к образованию соединения с двойной углеродной связью. Кротонил-КоА ферментативно восстанавливается в бутирил-КоА. Масляная кислота образуется в реакции переноса кофермента А с молекулы бутирил-КоА на ацетат. Эта реакция более "выгодна" для клетки, так как не приводит к потере энергии (в отличие от реакции простого гидролиза). Образующийся в реакции ацетил-КоА возвращается в метаболический поток и может быть использован для синтеза АТФ (реакция 7 на рис. 57) или же вновь участвовать в последовательности реакций, ведущих к синтезу масляной кислоты (реакции 2 — 6, там же).
Разобранный выше путь, завершающийся синтезом масляной кислоты, не связан с получением клеткой энергии, поскольку ни на одном из этапов не происходит образования АТФ. Единственное назначение метаболических превращений ацетил-КоА по этому пути — акцептирование электронов, переносимых на НАД+
в процессе гликолитического метаболизирования глюкозы: две молекулы НАД-H2
образуются на этапе гликолиза, и на двух этапах превращений ацетил-КоА до масляной кислоты происходит потребление водорода с НАД-H2
.
В связи с этим особо важное значение приобретает превращение ацетил-КоА, ведущее к синтезу ацетата, поскольку именно с этим путем связано дополнительное получение клостридиями энергии в процессе маслянокислого брожения. Процесс включает несколько ферментативных реакций (см. рис. 57). Сначала имеет место окислительное декарбоксилирование пировиноградной кислоты, катализируемое пируват:ферредоксиноксидоредуктазой. Далее с помощью гидрогеназы происходит выделение молекулярного водорода с восстановленного ферредоксина.
Гидрогеназы — одна из групп FeS-содержащих ферментов, катализирующих реакции поглощения и выделения молекулярного водорода, обнаружены у разных групп эубактерий: облигатных анаэробов и аэробов, факультативных форм, у хемо- и фототрофных организмов. Различаются строением молекулы, природой доноров и акцепторов электронов, с которыми взаимодействуют, локализацией в клетке, выполняемыми функциями. Но все гидрогеназы катализируют реакцию H2
® 2H+
+ 2e–
.
Гидрогеназа C. pasteurianum
, один из наиболее детально изученных ферментов, — белок с молекулярной массой примерно 60 000 Да, представленный одной субъединицей. В молекуле содержатся три центра типа Fe4
S4
. Донором (акцептором) электронов клостридиальной гидрогеназы служит ферредоксин.
При разрушении клеток C. pasteurianum
гидрогеназная активность проявляется только в растворимой фракции: в периплазматическом пространстве и цитоплазме. Гидрогеназа, локализованная в периплазматическом пространстве, катализирует необратимую реакцию поглощения H2
. Находящаяся в цитоплазме гидрогеназа способна катализировать реакции как поглощения, так и выделения H2
. У клостридиев она входит в состав ферментного комплекса, осуществляющего окислительное декарбоксилирование пирувата (см. рис. 57).
Основная функция гидрогеназ клостридиев (и других облигатных анаэробов) заключается в избавлении от избытка образующихся в катаболических реакциях восстановительных эквивалентов (электронов), которые переносятся на H+
и удаляются из клетки в виде молекулярного водорода.
Гидрогеназы других эубактерий могут иметь более сложное строение: состоять из нескольких неидентичных субъединиц, содержать помимо FeS-центров флавины в качестве простетических групп. Помимо ферредоксинов гидрогеназы разных организмов могут взаимодействовать с довольно широким набором переносчиков электронов: цитохромами c
, НАД (Ф), хинонами и др.
В то время как поглощение На происходит только с участием гидрогеназ, выделение молекулярного водорода у эубактерий, способных к фиксации N2
, наряду с гидрогеназой может катализироваться и нитрогеназой. Согласно одной из точек зрения, гидрогеназы возникли в результате усложнения структуры ферредоксинов.
Ацетил-КоА превращается в ацетилфосфат, а затем в ацетат, при этом синтезируется молекула АТФ. Две последние реакции аналогичны тем, которые происходят при образовании уксусной кислоты в пропионовокислом брожении (см. рис. 56).
Основным источником выделяемых при брожении газообразных продуктов (CO2
и H2
) служит реакция окислительного декарбоксилирования пирувата. У клостридиев описаны и другие пути образования молекулярного водорода. В частности, НАД-H2
, возникающий на гликолитическом пути, может восстанавливать ферредоксин в реакции, катализируемой НАД-H2
:ферредоксиноксидоредуктазой, а с восстановленного ферредоксина H2
выделяется при участии гидрогеназы. Как видно, природа нашла различные пути для избавления от избытка восстановительных эквивалентов и для регенерирования и последующего возвращения в клеточный метаболизм промежуточных переносчиков водорода.
Выведение уравнения маслянокислого брожения и определение его энергетического выхода затруднительно из-за лабильности процесса, состоящего из двух основных ответвлений: одного — окислительного, ведущего к образованию ацетата и АТФ, другого — восстановительного, функция которого — акцептирование водорода, образовавшегося в процессе гликолиза. Количественное соотношение между обоими ответвлениями зависит от многих внешних факторов (состав среды, стадия роста и др.).
Расчеты показали, что в целом на 1 моль сбраживаемой глюкозы в маслянокислом брожении образуется 3,3 моля АТФ. Это наиболее высокий энергетический выход брожения, т. е. получения энергии за счет субстратного фосфорилирования, из всех рассмотренных выше типов брожений.
Некоторые клостридии (C. acetobutylicum, C. bejerinckii, C. cellobioparum
и др.) при сбраживании сахаров наряду с кислотами накапливают в среде нейтральные продукты (бутиловый, изопропиловый, этиловый спирты, ацетон). Особенно много нейтральных продуктов образуется культурой C. acetobutylicum,
что дало основание в свое время выделить как вариант маслянокислого брожения ацетоно-бутиловое брожение. У клостридиев, осуществляющих ацетоно-бутиловое брожение, образование масляной кислоты происходит на первом этапе брожения. По мере подкисления среды (до pH ниже 5) и повышения в ней концентрации жирных кислот индуцируется синтез ферментов, приводящих к накоплению нейтральных продуктов, в первую очередь н
-бутанола и ацетона. н
-Бутанол образуется из бутирил-КоА, предшественника масляной кислоты, в результате двух последовательных ферментативных реакций (рис. 60). Первая из них заключается в отщеплении кофермента А и одновременном гидрировании, приводящем к образованию масляного альдегида. Последующее его восстановление с помощью НАД-H2
приводит к появлению н
-бутанола. Путь, ведущий к образованию ацетона, начинается с переноса от ацетоацетил-КоА кофермента А на ацетат. Декарбоксилирование ацетоуксусной кислоты приводит к образованию ацетона. Образование этанола происходит в результате двухступенчатого восстановления ацетил-КоА.
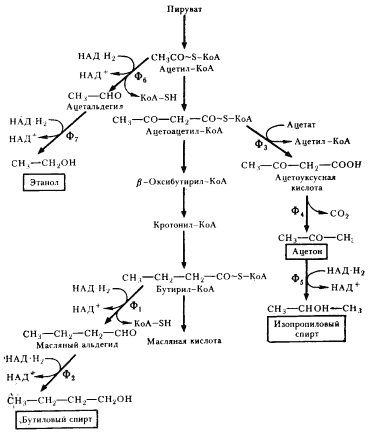 |
| Рис. 60. Образование нейтральных продуктов при маслянокислом брожении: Ф1
— бутирилальдегиддегидрогеназа; Ф2
— бутанолдегидрогеназа; Ф3
— КоА-трансфераза; Ф4
— ацетоацетатдекарбоксилаза; Ф5
— изопропанолдегидрогеназа; Ф6
— ацетальдегиддегидрогеназа; Ф7
— алкогольдегидрогеназа |
Физиологический смысл дополнительных ферментативных этапов у C. acetobutylicum
, ведущих к накоплению в среде н
-бутанола, этанола и ацетона, заключается в образовании конечных продуктов нейтрального характера. Первоначально нейтральный pH среды вследствие накопления масляной и уксусной кислот быстро падает. Некоторые клостридии выработали механизм борьбы с нарастающей кислотностью, который начинает функционировать при низком pH среды и приводит к появлению перечисленных выше нейтральных продуктов. Одновременно происходит понижение общей кислотности среды, что также свидетельствует об активном противодействии этих бактерий неблагоприятным условиям.
Изучение физиологии группы клостридиев, осуществляющих ацетоно-бутиловое брожение, привело к открытию В. Н. Шапошниковым (1884 — 1968) явления двухфазности этого процесса, которое позднее было обнаружено в большинстве типов брожений, характеризующихся сложным набором конечных продуктов. В основе явления двухфазности лежит тесная связь между конструктивными и энергетическими процессами. Вначале, когда имеет место активный рост культуры, сопровождающийся интенсивными биосинтетическими процессами, происходит значительный отток образующегося при брожении восстановителя для конструктивных целей. Это сопровождается преобладающим синтезом более окисленных конечных продуктов брожения (I фаза). При затухании роста и переходе культуры в стационарное состояние уменьшается потребность в восстановителе для конструктивных целей. Последнее приводит к большему его использованию в энергетических процессах и, следовательно, к образованию более восстановленных конечных продуктов брожения (II фаза). Таким образом, масштабы конструктивного метаболизма определяют характер и направление энергетических процессов.
Как можно оценить возникшую у маслянокислых бактерий последовательность ферментативных реакций, ведущих к синтезу масляной кислоты, а также дополнительные ферментативные этапы, ведущие к синтезу н
-бутанола и ацетона? На пути от ацетил-КоА до масляной кислоты в двух точках имеет место акцептирование водорода с НАД-H2
. Синтез н
-бутанола из бутирил-КоА связан еще с двумя восстановительными этапами. Итак, образование н
-бутанола вызвано не только противодействием нарастающей кислотности. Этот дополнительно развившийся участок пути весьма эффективен в качестве ферментативных преобразований, связанных с утилизацией возникающих в процессе брожения молекул НАД-H2
.
Рассмотрим под этим же углом зрения путь, ведущий к синтезу ацетона. Метаболизирование части ацетоацетил-КоА через ацетоуксусную кислоту в ацетон приводит к определенной потере потенциальных акцепторов водорода, которые могли бы на пути к образованию масляной кислоты или н
-бутанола присоединить соответствующее количество водорода с НАД-H2
. Однако этот путь является более коротким путем образования нейтральных продуктов, что, вероятно, для бактерий в определенных условиях выгодно. Кроме того, попыткой как-то компенсировать этот недостаток можно объяснить возникновение у некоторых видов клостридиев способности ферментативно восстанавливать ацетон в изопропанол с использованием водорода с НАД-H2
.
С точки зрения решения обеих проблем (нейтрализация среды и акцептирование восстановительных эквивалентов, образующихся при гликолизе), наиболее эффективен путь, ведущий к синтезу этанола, на двух этапах которого происходит акцептирование водорода с НАД-H2
. Некоторые клостридии в качестве одного из нейтральных продуктов образуют значительные количества этанола.
БАКТЕРИИ РОДА Clostridium
К клостридиям относят большое количество видов бактерий, число которых постоянно возрастает. Это один из самых крупных родов среди эубактерий. Принадлежность к роду определяется на основании только трех признаков: 1) способности образовывать эндоспоры; 2) облигатно анаэробного характера энергетического метаболизма; 3) неспособности осуществлять диссимиляционное восстановление сульфата. Отсюда понятно, что эта таксономическая группа эубактерий чрезвычайно гетерогенна, о чем, в частности, свидетельствует интервал значений ГЦ-оснований ДНК, молярное содержание которых с учетом описанных новых видов занимает область от 21 до 57%.
Из этого можно также сделать вывод, что организмы, объединяемые в род Clostridium
, нельзя рассматривать как эволюционно однотипные. Последующая характеристика их метаболических особенностей дает достаточно четкое представление об этом. Изучение эубактерий, относимых к клостридиям, наоборот, указывает на раннее расхождение видов рода в процессе эволюции.
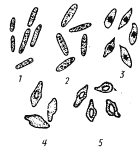 |
| Рис. 61. Процесс спорообразования у клостридиев: 1 —
молодые вегетативные клетки; 2 —
клетки, находящиеся в стационарной фазе; 3, 4 —
стадии спорообразования; 5 —
клетки с созревшими спорами (по Иерусалимскому, 1963) |
За исключением C. coccoides
, вегетативные клетки бактерий из рода Clostridium
имеют форму прямых или слегка изогнутых палочек с закругленными концами (рис. 61). Большинство видов грамположительные, подвижные. Движение осуществляется с помощью перитрихиально расположенных жгутиков. По мере старения в процессе цикла развития клетки теряют подвижность, накапливают гранулезу (запасное вещество типа крахмала) и переходят к спорообразованию. Образующиеся споры овальной или сферической формы. Диаметр их, как правило, превышает диаметр вегетативной клетки, поэтому, если формирующаяся спора расположена в центре клетки, последние меняют форму, становясь веретеновидными (рис. 61); если же споры образуются у одного из клеточных концов, клетки приобретают форму барабанных палочек.
Клостридии — облигатные анаэробы. Однако спектр их чувствительности к молекулярному кислороду достаточно широк, что связано с обнаружением в клетках большинства клостридиев супероксиддисмутазы и с другими приспособлениями на уровне клеточных популяций, помогающими нейтрализовать токсические эффекты O2
и его производных. Именно при работе с клостридиями Л. Пастер в 1861 г. открыл форму жизни без кислорода.
Энергетический метаболизм
В зависимости от вида сбраживаемого субстрата выделяют несколько физиологических групп клостридиев: сахаролитические клостридии, использующие в качестве субстратов брожения вещества углеводной природы (моносахара, крахмал, клетчатка); протеолитические клостридии, субстратами брожения которых являются белки, пептиды, аминокислоты; пуринолитические клостридии, специфически приспособленные к сбраживанию гетероциклических соединений (пурины и пиримидины). Среди них есть виды, обладающие довольно широкими возможностями (субстратами брожения служат как углеводы, так и белки), и узкоспециализированные виды, способные использовать в качестве источника энергии и углерода какое-либо одно или очень небольшое число соединений.
Субстратами брожения сахаролитических клостридиев служат такие моносахара, как глюкоза, фруктоза, лактоза, ксилоза и др. Некоторые виды могут использовать крахмал, целлюлозу, пектин, хитин, предварительно гидролизуемые соответствующими экзоферментами. Типичными представителями сахаролитических клостридиев, осуществляющих разобранное в предыдущем разделе классическое маслянокислое брожение, являются C. butyricum
и C. pasteurianum
. Известны среди клостридиев виды, сбраживающие сахара по гликолитическому пути, но без образования масляной кислоты (табл. 17). Пути, ведущие к биосинтезу большинства перечисленных в таблице продуктов брожений, осуществляемых клостридиями, уже обсуждались нами при разборе маслянокислого и других видов брожений.
Для некоторых клостридиев (C. aceticum, C. thermaceticum, C. formicaceticum
и др.) характерно сбраживание сахаров, приводящее практически к образованию только одного конечного продукта — уксусной кислоты (гомоацетатное брожение); из 1 молекулы сброженной гексозы синтезируется 3 молекулы ацетата. Изучение последовательности биохимических реакций, приводящих к этому, показало, что сбраживание 1 молекулы гексозы по гликолитическому пути приводит к образованию только 2 молекул ацетата. Одновременно образуются и 2 молекулы CO2
. Третья молекула ацетата синтезируется из 2 молекул CO2
принципиально иным путем. Фиксация углекислоты у гомоацетатных клостридиев46
происходит по нециклическому механизму, получившему название ацетил-КоА-пути, поскольку его ключевым метаболитом является ацетил-КоА (рис. 62). Одна из молекул CO2
, служащая источником метильной группы ацетата, на первом этапе восстанавливается с образованием формиата, а затем при участии тетрагидрофолиевой кислоты в качестве кофермента в несколько этапов восстанавливается до метил-ТГФК. С последнего метильная группа переносится на фермент, содержащий витамин B12
в качестве кофермента (корриноидный фермент), приводя к регенерированию ТГФК. С корриноидного фермента CH3
-группа поступает на CO-дегидрогеназу.
46
Виды, осуществляющие гомоацетатное брожение, называют также ацетогенными.
Таблица 17. Основные продукты брожения некоторых сахаролитических клостридиев, не образующих масляной кислоты
| Организм |
Основные продукты брожения |
| C. sphenoides, C. glycolicum
|
этанол, уксусная кислота, CO2
, H2
|
| C. cellobioparum
|
этанол; уксусная, муравьиная, молочная кислоты; CO2
, H2
|
| C. clostridioforme
|
уксусная, молочная кислоты; CO2
, H2
|
| C. oroticum
|
этанол; уксусная, молочная, муравьиная кислоты; CO2
|
| C. coccoides
|
янтарная, уксусная кислоты |
| C. durum
|
этанол, пропанол; муравьиная, уксусная, молочная кислоты |
| C. nexile
|
этанол; муравьиная, уксусная, молочная, янтарная кислоты; H2
|
| C. quercicolum
|
уксусная, пропионовая кислоты, H2
|
| C. ramosum
|
муравьиная, уксусная, молочная, янтарная кислоты |
| C. aceticum, C. thermaceticum, C. formicaceticum, C. spiroforme
|
уксусная кислота |
Вторая молекула CO2
, углерод которой служит источником карбоксильной группы ацетата, при участии CO-дегидрогеназы восстанавливается до CO, оставаясь связанной с этим ферментом. CO-дегидрогеназа, ключевой фермент этого пути синтеза ацетата, имеет 3 центра, связывающие CH3
-, CO-группы и кофермент А. Затем на ферменте осуществляется карбоксилирование метильной группы и взаимодействие образовавшейся ацетильной группы с коферментом А, приводящее к образованию ацетил-КоА. По характеру превращений, катализируемых CO-дегидрогеназой, фермент правильнее называть ацетил-КоА-синтазой. Дальнейшие превращения ацетил-КоА до ацетата, сопровождающиеся образованием АТФ, описаны ранее.
К протеолитическим относятся клостридии, имеющие активные протеолитические ферменты и поэтому способные использовать в качестве субстратов белки и пептиды, гидролизуя их до аминокислот и подвергая затем последние сбраживанию. В эту группу входят C. putrifiicum, C. histolyticum, C. sporogenes
и другие сапрофитные виды. Близки к этим видам и некоторые патогенные формы: C. botulinum
— продуцент ботулина — экзотоксина, являющегося одним из самых сильных биологических ядов; C. tetani
— столбнячная палочка, образующая в организме человека столбнячный токсин. К протеолитическим клостридиям примыкают виды, использующие в качестве источника углерода и энергии ограниченное число свободных аминокислот. Например, C. cochlearium
растет только на среде с глутаминовой кислотой, глутамином и гистидином; C. sticklandii
может сбраживать лизин, аргинин, фенилаланин, серин, а C. propionicum —
треонин, аланин, серин, цистеин.
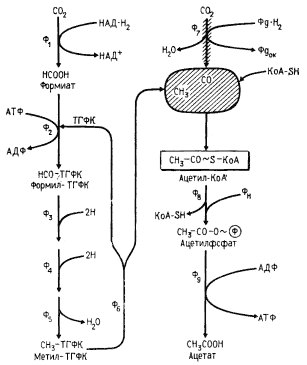 |
| Рис. 62. Ацетил-КоА-путь фиксации CO2
у гомоацетатных клостридиев: Ф1
— формиатдегидрогеназа; Ф2
— формил-ТГФК-синтаза; Ф3
— Ф5
-ферменты, катализирующие превращение формил-ТГФК до метил-ТГФК; Ф6
— корриноидный фермент; Ф7
— CO-дегидрогеназа (фермент изображен в виде заштрихованных стрелки и эллипса); Ф8
— фосфотрансацетилаза; Ф9
— ацетаткиназа |
Известны два типа сбраживания аминокислот клостридиями. Для многих клостридиев одна аминокислота может служить источником энергии и углерода, например, глутаминовая кислота — для C. tetanomorphum
, лизин — для C. sticklandii
. В этом случае ее диссимиляция приводит к возникновению метаболитов, характерных для гликолитического пути, и в первую очередь пирувата, дальнейшие превращения которого идут по одному из путей, описанных выше. У C. sticklandii
сбраживание лизина приводит к образованию масляной и уксусной кислот и NH3
, а у C. tetanomorphum
при сбраживании глутаминовой кислоты в дополнение к перечисленным выше продуктам образуется некоторое количество CO2
.
Ряд аминокислот может подвергаться сбраживанию клостридиями только парами. Механизм процесса был расшифрован Л. Стиклендом (L. Stickland) в 1934 г., показавшим, что при этом происходит сопряженное окисление-восстановление пары аминокислот, одна из которых окисляется, другая — восстанавливается. Такой тип сбраживания аминокислот получил название реакции Стикленда. Окисляемыми аминокислотами, т. е. донорами электронов, служат аспарагин, аланин, валин, серин, гистидин и др. Восстанавливаемые аминокислоты — глицин, пролин, орнитин, аргинин и др.
Наиболее обстоятельно изучен процесс сопряженного сбраживания аланина и глицина, которые, как правило, поодиночке большинством клостридиев не используются. Первым этапом превращений аланина является его окислительное дезаминирование, приводящее к образованию соответствующей a-кетокислоты, в данном случае пирувата:
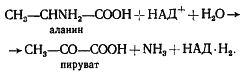
Пировиноградная кислота затем подвергается окислительному декарбоксилированию в реакции, катализируемой пируват:ферредоксин-оксидоредуктазой, приводящей в конечном итоге к синтезу молекулы АТФ и ацетата. На двух этапах окислительного преобразования аланина возникают восстановленные переносчики, которые используются для восстановления второй аминокислоты — глицина. Восстановительное дезаминирование глицина до ацетата — довольно сложная реакция. Катализирующая ее ферментная система связана с мембраной и состоит из нескольких белков, включая белок, содержащий селен:
| CH2
NH2
-COOH |
+ |
НАД-H2
|
® |
CH3
-COOH |
+ |
NH3
|
+ |
НАД+
. |
| глицин |
ацетат |
В целом сопряженные окислительно-восстановительные превращения аланина и глицина могут быть выражены следующим образом:
аланин + 2H2
O ® ацетат + NH3
+ CO2
+ 4Н;
2 глицин + 4Н ® 2 ацетат + 2NH3
.
Получение энергии при сбраживании этой пары аминокислот связано с окислением аланина и соответствует 1 молекуле АТФ на молекулу окисленного аланина.
Обнаружены клостридии, специфически приспособленные к сбраживанию гетероциклических азотсодержащих соединений" в том числе пуринов и пиримидинов, — пуринолитические клостридии. Относящиеся к этой группе виды часто узкоспециализированы в отношении пищевых субстратов. Так, C. acidurici
и C. cylindrosporum
могут расти, сбраживая только некоторые пурины (гуанин, ксантин, гипоксантин, мочевая кислота) до уксусной и муравьиной кислот, глицина, NH3
и CO2
. C. uracilium
и C. oroticum
могут сбраживать пиримидины. C. oroticum
использует оротовую кислоту, выделяя в среду уксусную и дикарбоновую кислоты, CO2
и NH3
. C. uracilium
использует урацил, который распадается до b-аланина, CO2
и NH3
. Сбраживание пуринов и пиримидинов — сложный процесс, состоящий из многих последовательных реакций, в некоторых из них путем субстратного фосфорилирования синтезируется АТФ.
Совершенно особый тип брожения осуществляет C. kluyveri
, сбраживающий смесь этанола и уксусной кислоты до масляной, капроновой кислот и H2
. Превращение этанола и уксусной кислоты в масляную и капроновую кислоты можно описать. следующими уравнениями:
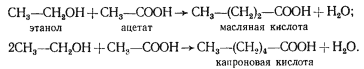
Однако ни одна из этих реакций не приводит к синтезу АТФ. Энергетическая сторона процесса долгое время оставалась неясной. Оказалось, что получение энергии связано с образованием молекулярного водорода в процессе окисления этанола, дегидрирование которого на двух этапах приводит к синтезу ацетил-КоА:
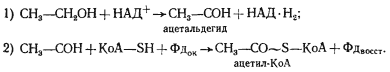
Электроны с ферредоксина могут переноситься далее на НАД+
или на Н+
, что приводит в последнем случае к выделению H2
. Следствием переноса части электронов на H+
будет нарушение соотношения между количеством ацетил-КоА и НАД-H2
, необходимым для синтеза масляной кислоты (см. рис. 57), в сторону относительного недостатка молекул восстановленного кофермента. Возникшие "избыточные" молекулы ацетил-КоА используются для синтеза АТФ в реакциях, описанных ранее. По проведенным подсчетам, энергетический выход этого вида брожения составляет около 1 моля АТФ на 6 молей этанола.
Таким образом, типы брожений, осуществляемых клостридиями, необычайно разнообразны как в отношении используемых субстратов, так и синтезируемых конечных продуктов, и виды, осуществляющие сбраживание углеводов по гликолитическому пути с накоплением масляной кислоты в качестве одного из основных продуктов, являются только одной из групп организмов, относимых к роду Clostridium.
Особенности конструктивного метаболизма
Потребности клостридиев в питательных веществах отличаются большим разнообразием. Как правило, клостридии могут расти только на сложных, богатых органическими соединениями средах. Многие клостридии выделяют экзоферменты, расщепляющие макромолекулы (углеводы, белки) на составляющие их мономеры. До сих пор только небольшое число видов удалось культивировать в лаборатории на синтетической среде. Для них выявлена потребность в витаминах (главным образом группы В) и наборе аминокислот.
Интересная особенность эубактерий из рода Clostridium
— дальнейшее развитие способности вовлекать углекислоту в клеточный метаболизм. У C. kluyveri
, растущего на смеси C3
-соединений (этанол + ацетат), до 30% углерода клетки возникает из углерода CO2
. Для C. aceticum
и других видов, осуществляющих гомоацетатное брожение, показана способность к хемолитоавтотрофному росту на минеральной среде за счет превращения CO2
и H2
в ацетат:
4H2
+ 2CO2
® CH3
-COOH + 2H2
O.
В группу гомоацетатных бактерий, помимо некоторых представителей рода Clostridium
, входят организмы, принадлежащие к родам Acetobacterium, Acetogenium, Eubacterium, Butyribacterium
и др. При росте на минеральной среде энергию ацетогены получают в процессе анаэробного дыхания с использованием H2
в качестве донора электронов, а CO2
— конечного их акцептора (см. гл. 16). Исходными метаболитами для биосинтетических путей служат ацетил-КоА (ключевой метаболит пути фиксации CO2
ацетогенами) и пируват, образующийся из последнего в реакции восстановительного карбоксилирования.
Пути включения CO2
в клеточный метаболизм клостридиев различны. Углекислота может использоваться ими в качестве конечного акцептора электронов, что приводит к прямому восстановлению CO2
до формиата. Донорами электронов в этой реакции служат восстановленный ферредоксин или НАД-H2
. Реакция может служить способом удаления избытка восстановительных эквивалентов, образующихся при брожении, т. е. быть необходимой для сбалансирования окислительных и восстановительных этапов в энергетическом метаболизме. Образовавшийся в результате восстановления CO2
формиат может подвергаться дальнейшему восстановлению и служить источником метильных групп, используемых для клеточных биосинтезов.
Для разных видов клостридиев показана активная фиксация CO2
на C2
- и C3
-соединениях, таких как ацетил-КоА, пропионил-КоА, пируват, в реакциях восстановительного карбоксилирования, например:
ацетил-КоА+ CO2
+ Фдвосст
® пируват + KoA-SH + Фдок
.
Механизм, по которому происходит автотрофная фиксация CO2
у клостридиев, осуществляющих гомоацетатное брожение, изображен на рис. 62.
Дальнейший шаг вперед по пути независимости от среды связан с распространением у этой группы эубактерий способности фиксировать атмосферный азот (небольшая способность к фиксации N2
обнаружена у пропионовых бактерий). Первый анаэробный азотфиксатор был выделен из почвы C. Н. Виноградским и назван им в честь Л. Пастера Clostridium pasteurianum
.
Молекула N2
чрезвычайно прочна. Чтобы разорвать три связи между двумя атомами в молекуле N2
, необходимо затратить 941 кДж/моль, поэтому восстановление N2
до NH3
химическим путем — очень энергоемкий процесс. Фиксация молекулярного азота, до сих пор обнаруженная только у прокариот, осуществляется с помощью ферментной системы — нитрогеназы, состоящей из двух компонентов: малого, содержащего железо и серу (Fe-белок), и большого, в состав которого дополнительно входит молибден (MoFe-белок)47
. Соотношение между ними у разных азотфиксирующих прокариот колеблется от 1:1 до 2:1, хотя в целом нитрогеназы из разных источников обнаруживают значительное сходство.
Для функционирования нитрогеназы необходим источник энергии в виде АТФ, ионы магния и восстановитель с низким окислительно-восстановительным потенциалом. У C. pasteurianum
непосредственным донором электронов для восстановления N2
служит восстановленный ферредоксин, электроны с которого поступают сначала на Fe-белок нитрогеназы (рис. 63).
47
У некоторых азотфиксаторов вместо или наряду с молибденом в составе большой субъединицы обнаружен ванадий, у других найдена нитрогеназа, содержащая только железо.
Восстановленный Fe-белок образует комплекс с молекулами Mg и АТФ, что приводит к сдвигу окислительно-восстановительного потенциала FeS-центра белка от — 290 до — 400 мВ.
Это делает возможным последующий перенос активированных электронов на MoFe-белок, в активном центре которого происходит восстановление N2
. Перенос 1 электрона на MoFe-белок сопровождается гидролизом как минимум 2 молекул АТФ. Так как за один раз FeS-центрами ферредоксина, Fe- и MoFe-белков может быть перенесено не более 2 электронов, а для восстановления N2
до аммиака необходимо 6 электронов, следовательно, процесс должен состоять не меньше чем из трех последовательных стадий восстановления:
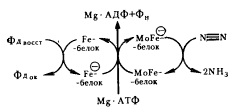 |
| Рис. 63. Функционирование нитрогеназы: кружком обозначена восстановленная форма белка. Объяснение см. в тексте |
В течение длительного времени не удавалось обнаружить какие-либо частично восстановленные промежуточные соединения. Единственным идентифицированным продуктом восстановления был аммиак. Недавно быстрая остановка нитрогеназной реакции в кислой или щелочной среде позволила обнаружить гидразин. Вероятно, промежуточные соединения в процессе восстановления молекулы N2
остаются прочно связанными с нитрогеназой. По проведенным измерениям, для восстановления 1 молекулы N2
требуется не менее 12 молекул АТФ. Таким образом, процесс азотфиксации связан с затратой большого количества клеточной энергии. Для ассимиляции 1 мг N2
C. pasteurianum
в процессе брожения перерабатывается примерно 500 мг сахара.
Помимо N2
нитрогеназа может восстанавливать ряд других субстратов, таких как N2
O, C2
H2
и его аналоги, N3
–
, CN–
. В отсутствие N2
нитрогеназа катализирует выделение молекулярного водорода в реакции, протекающей с затратой АТФ. Это дает основание предполагать, что нитрогеназа является результатом дальнейшего усложнения молекулы гидрогеназы, приобретшей способность катализировать не только восстановление протонов, ведущее к выделению H2
, но и ряд других субстратов, в том числе и N2
.
Роль в природе и практическое значение
С жизнедеятельностью клостридиев связаны различные процессы, протекающие в природе: разложение (гниение) азотсодержащих соединений (белков, нуклеиновых кислот) в анаэробных условиях; анаэробное разложение растительных материалов, таких как клетчатка, хитин. Некоторые сахаролитические клостридии могут использовать в качестве субстрата брожения пектиновые вещества, составляющие покровы растительных клеток. Пектин — полимер метил-D
-галактуроновой кислоты. Последняя имеет сложное строение и при воздействии на нее пектиновыми ферментами гидролизуется на ряд сахаров, кислот и метиловый спирт. Клостридии, принадлежащие к виду C. felsineum
, содержат активную пектиназу и могут поэтому получать энергию, осуществляя маслянокислое брожение пектиновых веществ. Этот вид играет важную роль в процессе мацерации волокон при мочке льна.
Еще в конце прошлого века было обнаружено, что некоторые клостридии патогенны, т. е. вызывают заболевания человека и животных. В основе патогенности клостридиев лежит их способность синтезировать и выделять из клетки высокоэффективные токсины.
Бактерии группы Clostridium
находят и практическое применение. Их используют в производстве масляной кислоты, необходимой для парфюмерной промышленности. Ацетоно-бутиловое брожение, осуществляемое некоторыми видами клостридиев, используют для получения в промышленном масштабе ацетона и бутанола. В свое время в нашей стране возникла острая потребность в этих веществах. Получать их химическим путем в то время было гораздо сложнее, чем микробиологически. В 30-х гг. академик В. Н. Шапошников организовал одно из первых в СССР промышленных микробиологических производств, на котором было освоено получение н
-бутанола и ацетона с помощью клостридиев.
АЛЬТЕРНАТИВНЫЕ ПУТИ СБРАЖИВАНИЯ УГЛЕВОДОВ
В течение длительного времени считали, что единственным путем сбраживания углеводов является гликолитический путь с различными вариантами метаболизирования пирувата. Однако постепенно накапливались данные, которые определенно указывали на существование иных, чем гликолиз, путей расщепления углеводов. Гликолитическая схема в одних случаях не, могла объяснить использования эубактериями пентоз в качестве энергетического субстрата, а также того, каким путем они синтезируют необходимую для нуклеиновых кислот рибозу, в других — распределения 14
C в конечных продуктах брожения.
Работами нескольких лабораторий были расшифрованы еще два пути расщепления углеводов, отличные от гликолитического, получившие название окислительного пентозофосфатного пути (другие названия: гексозомонофосфатный, или фосфоглю-конатный, или путь Варбурга — Диккенса — Хореккера) и 2-кето-3-дезокси-б-фосфоглюконатного (КДФГ), или пути Энтнера — Дудорова 48
.
48
Пути названы по имени ученых О. Варбурга (О. Warburg), Ф. Диккенса (F. Dickens), Г. Хореккера (G. Horecker), И. Энтнера (N. Entner) и М. Дудорова (М. Doudoroff), внесших большой вклад в их расшифровку.
ОКИСЛИТЕЛЬНЫЙ ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
Схема начальных этапов окислительного пентозофосфатного пути представлена на рис. 64. Первая реакция заключается в фосфорилировании глюкозы с помощью АТФ и превращении ее в метаболически активную форму глюкозо-6-фосфата, аналогично тому, что имеет место на первом этапе гликолиза. Следующий этап заключается в дегидрировании глюкозо-6-фосфата, катализируемом глюкозо-6-фосфатдегидрогеназой. Особенность реакции в том, что в ней участвует НАДФ+
в качестве акцептора водорода. Образовавшийся продукт реакции очень нестоек и спонтанно или с помощью фермента лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты, которая подвергается окислительному декарбоксилированию, катализируемому фосфоглюконатдегидрогеназой. Эта реакция приводит к образованию соответствующего пентозофосфата, НАДФ-H2
и выделению CO2
. Рибулозо-5-фосфат обратимо превращается в ксилулозо-5-фосфат и рибозо-5-фосфат с участием ферментов фосфопентозоэпимеразы и фосфопентозоизомеразы соответственно.
Суммарно весь процесс можно представить в виде следующего уравнения:
глюкозо-6-фосфат + 2НАДФ+
® рибозо-5-фосфат + CO2
+ 2НАДФ-Н2
.
Как видно, на этом этапе образуются 2 молекулы НАДФ-H2
, которые могут потребляться в восстановительных биосинтетических процессах, и молекула рибозо-5-фосфата, используемого в синтезе нуклеиновых кислот и пентозосодержащих коферментов49
. Примечательно, что ни на одном из окислительных этапов не синтезируется АТФ.
49
Некоторые авторы считают, что особенность окислительного пентозофосфатного пути — перенос электронов на окислительных этапах на НАДФ+
, а не на НАД+
— в последующем оказалась очень "выгодной" для аэробов, так как позволила иметь два отдельных пула восстановленных пиридиновых переносчиков, с одного из которых (НАД-H2
) электроны поступали в дыхательную цепь, а с другого (НАДФ-H2
) использовались в биосинтетических восстановительных реакциях.
Первоначально окислительный пентозофосфатный путь возник, вероятно, для обеспечения эубактерий пентозами. В этом случае возникновение только трех новых ферментов (глюкозо-6-фосфатдегидрогеназы, лактоназы и фосфоглюконатдегидрогеназы) уже приводило к синтезу пентоз. Поскольку к этому времени функционировали изомеразные ферменты гликолитического пути (см. рис. 53), формирование фосфопентозоизомеразы произошло довольно легко. Действительно, при определенных условиях окислительный пентозофосфатный путь на этом завершается.
Дальнейшее его развитие, вероятно, связано с энергетическими потребностями клетки. Меньшей части образующегося рибозо-5-фосфата оказалось достаточно для удовлетворения всех потребностей клетки в пентозах. Остальная часть синтезируемого пентозофосфата была субстратом, хранившим в себе большие запасы энергии. Способность использовать в энергетических целях этот субстрат связана с возникновением двух ферментов: фосфопентозоэпимеразы, катализирующей превращение рибулозо-5-фосфата в ксилулозо-5-фосфат (рис. 64), и пентозофосфокетолазы, катализирующей расщепление ксилулозо-5-фосфата на 3-ФГА и ацетилфосфат (рис. 65).
Использование в качестве источника энергии в анаэробных условиях пентозных субстратов, образуемых в окислительном пентозофосфатном пути, свойственно группе гетероферментативных молочнокислых бактерий, для которых характерно образование в качестве конечных продуктов брожения ряда органических соединений: молочной и уксусной кислот, этилового спирта, глицерина, CO2
и др. Этим гетероферментативные молочнокислые бактерии отличаются от гомоферментативных, почти полностью сбраживающих гексозы по гликолитическому пути в молочную кислоту.
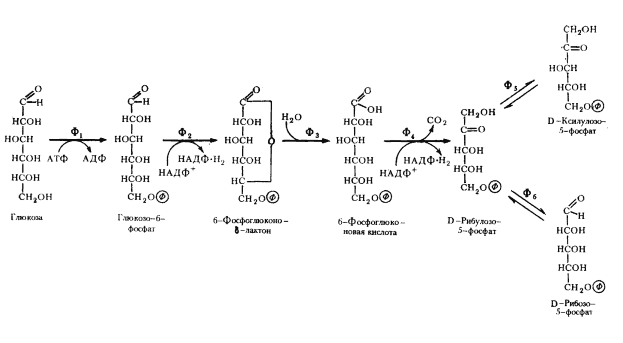 |
| Рис. 64. Окислительный пентозофосфатный путь (начальные этапы): Ф1
— гексокиназа; Ф2
— глюкозо-6-фосфатдегидрогеназа; Ф3
— лактоназа; Ф4
— фосфоглюконатдегидрогеназа (декарбоксилирующая); Ф5
— фосфопентозоэпимераза; Ф6
— фосфопентозоизомераза (по Dagley, Nicholson, 1973) |
Изучение механизмов образования конечных продуктов брожения гетероферментативными молочнокислыми бактериями обнаружило, что они связаны с дальнейшими различными путями метаболизирования C2
- и C3
-фрагментов фосфокетолазной реакции. 3-ФГА претерпевает ряд ферментативных превращений, идентичных таковым гликолитического пути, и через пируват превращается в молочную кислоту. Судьба двухуглеродного фрагмента различна: двухступенчатое восстановление ацетилфосфата приводит к накоплению в среде этанола; окислительный путь превращения ацетилфосфата завершается образованием уксусной кислоты (рис. 65).
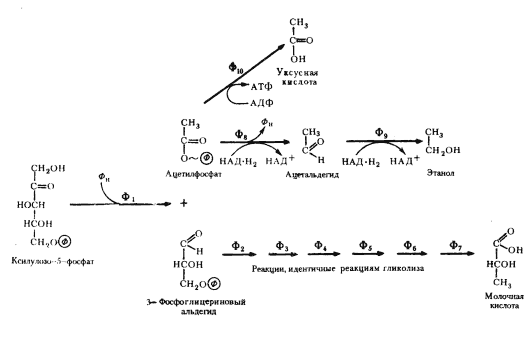 |
| Рис. 65. Гетероферментативное молочнокислое брожение: Ф1
— пентозофосфокетолаза; Ф2
— 3-ФГА-дегидрогеназа; Ф3
— фосфоглицераткиназа; Ф4
— фосфоглицеромутаза; Ф5
— енолаза; Ф6
— пируваткиназа; Ф7
— лактатдегидрогеназа; Ф8
— ацетальдегиддегидрогеназа; Ф9
— алкогольдегидрогеназа; Ф10
— ацетаткиназа (по Schlegel, 1972) |
Преобладание в ферментационной среде того или иного продукта зависит от вида культуры, условий культивирования и фазы развития. Гетероферментативные молочнокислые бактерии Leuconostoc mesenteroides
сбраживают глюкозу в молочную кислоту, этанол и CO2
по следующему уравнению:
C6
H12
O6
® CH3
-CHOH-COOH + CH3
-CH3
-CH2
OH + CO2
У других гетероферментативных молочнокислых бактерий больший удельный вес занимают процессы, ведущие к накоплению уксусной кислоты. Образование уксусной кислоты из ацетилфосфата сопряжено с синтезом АТФ. Если брожение идет с образованием этанола, то выход энергии равен 1 молекуле АТФ на молекулу сброженной глюкозы; если образуется уксусная кислота, то общий энергетический баланс процесса составляет 2 молекулы АТФ на молекулу глюкозы, т. е. такой же, как при гликолизе.
Окислительный пентозофосфатный путь функционирует в качестве единственного пути сбраживания углеводов у облигатных гетероферментативных молочнокислых бактерий. Эти бактерии лишены ключевых ферментов гликолитического пути, например альдолазы и триозофосфатизомеразы. Большинство молочнокислых бактерий имеют два пути сбраживания углеводов: гликолитический и окислительный пентозофосфатный. Сбраживание гексоз, как правило, протекает по гликолитическому пути, а пентоз — по окислительному пентозофосфатному. Это имеет место, например у Lactobacillus plantarum
. Ферменты окислительного пентозофосфатного пути обнаружены у клостридиев.
Таким образом, возникнув сначала как механизм синтеза клеткой C5
-соединений, т. е. для выполнения узкой специфической задачи, этот путь получил дальнейшее развитие и стал выполнять дополнительную функцию снабжения эубактерий энергией в анаэробных условиях. Субстратная база для окислительного пентозофосфатного пути позднее была расширена, так как он стал использоваться и для сбраживания пентоз биогенного происхождения, накапливавшихся в окружающей среде.
Но на этом пути эволюционное развитие окислительного пентозофосфатного пути расщепления углеводов не остановилось. Была сформирована последовательность реакций, "замыкающая" этот путь в цикл, в результате чего стала возможной полная деградация молекулы сахара. Исходными субстратами на этом пути служат пентозы, образующиеся из рибулозо-5-фосфата, ксилулозо-5-фосфата и рибозо-5-фосфата (см. рис. 64). При участии двух дополнительных ферментов — транскетолазы и трансальдолазы — осуществляется перенос C2
- и C3
-фрагментов между изомерными пентозо-5-фосфатами и продуктами их взаимопревращений (рис. 66). Сначала транскетолаза переносит C3
-фрагмент от молекулы ксилулозо-5-фосфата на молекулу рибозо-5-фосфата, в результате чего образуется C7
-сахар и C3
-сахар — 3-ФГА. 3-ФГА, образующийся в транскетолазной реакции и, как известно, представляющий собой промежуточный продукт гликолитического пути, является первой точкой, в которой пересекаются эти пути.
Далее трансальдолаза действует на продукты транскетолазной реакции, перенося C3
-фрагмент от молекулы C7
-сахара на C3
-молекулу — 3-ФГА. В результате образуются молекулы C6
-и C4
-сахара. Один из продуктов реакции — фруктозо-6-фосфат является промежуточным соединением гликолитического пути, поэтому данная реакция есть вторая точка пересечения обоих путей углеводного метаболизма. Наконец, транскетолаза осуществляет перенос C2
-фрагмента от молекулы D
-ксилулозо-5-фосфата на молекулу C4
-сахара по той же схеме, что и в первой транскетолазной реакции.
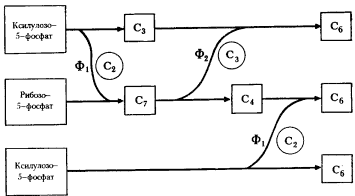 |
| Рис. 66. Окислительный пентозофосфатный путь (конечные этапы): Ф1
— транскетолаза; Ф2
— трансальдолаза; кружками обведены C2
— гликольальдегидная и C3
— диоксиацетоновая группы; в квадраты заключены C3
— 3-фосфоглицериновый альдегид (3-ФГА), C4
— D
-эритрозо-4-фосфат, C6
— D
-фруктозо-6-фосфат, C7
— D
-седогептулозо-7-фосфат (по Schlegel, 1972) |
Итог этих взаимопревращений таков: из 3 молекул пентозофосфата синтезируются 2 молекулы фруктозо-6-фосфата и 1 молекула 3-ФГА. Фруктозо-6-фосфат ферментативно превращается в глюкозу, и 2 молекулы глюкозы снова возвращаются в цикл. 2 молекулы 3-ФГА также могут конденсироваться с образованием 1 молекулы глюкозы. В результате функционировавания полного окислительного пентозофосфатного пути из 6 поступающих в него молекул глюкозы 5 молекул ревосстанавливаются, а одна полностью окисляется до CO2
, что приводит к восстановлению 12 молекул НАДФ+
до НАДФ-H2
. Это можно представить в виде следующего уравнения:
6 глюкозо-6-фосфат + 12НАДФ+
® 5 глюкозо-6-фосфат + 6CO2
+ 12НАДФ-H2
+ ФН
.
Таким образом, окислительный пентозофосфатный путь может служить циклическим механизмом полной деградации углеводов, при этом водород, отщепленный от глюкозы, поступает в электронтранспортную цепь и переносится на O2
.
Остановимся теперь на функциях последнего этапа пути. Как механизм, обеспечивающий полную деградацию углеводов, этот путь не получил универсального распространения, хотя есть эубактерии, осуществляющие разложение углеводов в аэробных условиях только по окислительному пентозофосфатному пути. У многих организмов, использующих пентозы в качестве субстратов брожения, окислительный пентозофосфатный путь служит для превращения пентоз в гексозы, которые затек сбраживаются в гликолитическом пути. Кроме того, выше мы упоминали о двух точках пересечения этого пути с гликолизом на этапах образования 3-ФГА и фруктозо-6-фосфата. Все это говорит о тесном контакте окислительного пентозофосфатного пути с гликолизом и о возможном переключении с одного пути на другой. Наконец, помимо пентоз, образующихся на начальных этапах пути, возникновение C4
- и C7
-сахаров в транскетолазной и трансальдолазной реакциях также представляет определенный интерес для клетки, так как эти сахара являются исходными субстратами для синтеза ряда важных клеточных метаболитов.
ГЕТЕРОФЕРМЕНТАТИВНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ
К гетероферментативным молочнокислым бактериям, сбраживающим сахара с образованием молочной кислоты, CO2
, этанола и/или уксусной кислоты, относятся представители рода Leuconostoc
и бактерии, объединенные в подрод Betabacterium
рода Lactobacillus
(L. fermentum, L. brevis
). У них отсутствует ключевой фермент гликолитического пути — фруктозодифосфатальдолаза, и поэтому сбраживание субстратов они могут осуществлять только по окислительному пентозофосфатному пути, т. е. являются облигатно гетероферментативными формами. Кроме того, представители подрода Streptobacterium
(L. casei, L. plantarum, L. xylosis
) этого же рода сбраживают гексозы по гликолитическому пути, а пентозы по окислительному пентозофосфатному пути, осуществляя в первом случае гомоферментативное, а во втором — гетероферментативное молочнокислое брожение.
Таблица 18. Характеристика таксономических групп гетероферментативных молочнокислых бактерий*
| Род и подрод бактерий |
Морфология и особенности клеточного деления |
Молекулярное содержание ГЦ в ДНК, % |
Конфигурация молочной кислоты |
Наиболее распространенные виды |
| Род Leuconostoc
|
сферические или чечевицеобразные клетки; делятся в одной плоскости, в результате образуются цепочки |
38—44 |
D |
L. mesenteroides
L. lactis
|
Род Lactobacillus
Подрод Betabacterium
|
палочки; делятся в одной плоскости |
37—53 |
DL
|
L. fermentum
L. brevis
L. buchneri
|
* Характеристика представителей подрода Streptobacterium
приведена в табл. 15.
Гетероферментативные молочнокислые бактерии по морфологическим, культуральным признакам, особенностям конструктивного метаболизма близки к гомоферментативным формам. Некоторые признаки гетероферментативных молочнокислых бактерий представлены в табл. 18.
ПУТЬ ЭНТНЕРА — ДУДОРОВА
Общая схема третьего пути расщепления углеводов эубактериями представлена на рис. 67.
Первые два его этапа — фосфорилирование молекулы глюкозы и ее дегидрирование до 6-фосфоглюконовой кислоты — идентичны первым двум этапам окислительного пентозофосфатного пути. Специфичны для пути Энтнера — Дудорова две следующие реакции: 1) дегидратирование 6-фосфоглюконовой кислоты, приводящее к образованию КДФГ-кислоты; 2) расщепление продукта первой реакции на два C3
-фрагмента. Конечными продуктами второй реакции являются пировиноградная кислота и 3-ФГА. Последний окисляется в пировиноградную кислоту так же, как в гликолитическом пути. Следовательно, при разложении молекулы глюкозы до пирувата по пути Энтнера — Дудорова образуется 1 молекула АТФ (2 молекулы АТФ синтезируются на отрезке пути 3-ФГА ® пировиноградная кислота минус 1 молекула АТФ, затраченная на фосфорилирование глюкозы), 1 молекула НАД-H2
и 1 молекула НАДФ-H2
.
Путь Энтнера — Дудорова имеет важное значение, когда сбраживаемыми субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные. Он функционирует у довольно широкого круга эубактерии, главным образом, грамотрицательных, получающих энергию в процессе дыхания (энтеробактерии50
, виды Azotobacter, Pseudomonas, Alcaligenes, Rhizobium, Spirillum, Xanthomonas, Thiobacillus
и др.). У анаэробов он встречается довольно редко. В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis
. Однако ее изучение позволяет предполагать, что Z. mobilis
— вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен у некоторых клостридиев, что еще раз подчеркивает неоднородность эубактерий, объединенных в эту таксономическую группу.
50
У энтеробактерий гликолитический и окислительный пентозофосфатный пути функционируют как центральные конститутивные пути метаболизирования углеводов, путь Энтнера — Дудорова — как индуцибельный.
Согласно существующим представлениям путь Энтнера — Дудорова сформировался позднее гликолитического и окислительного пентозофосфатного путей и возник как ответвление последнего, поскольку начала окислительного пентозофосфатного пути и пути Энтнера — Дудорова идентичны и для последнего необходимо было сформировать только два новых фермента (6-фосфоглюконатдегидратазу и КДФГ-альдолазу). Появление пути Энтнера — Дудорова, вероятно, было вызвано высокой потребностью клеток в пирувате, поэтому возникла необходимость сформировать механизм, при помощи которого пируват образовывался бы из исходного субстрата как можно более коротким и прямым путем. Действительно, к получению пирувата по пути Энтнера — Дудорова ведут всего 4 реакции, в то время как в гликолитическом пути для этого требуется 9 ферментативных преобразований.
Как можно видеть из схемы процесса (рис. 67), путь Энтнера — Дудорова имеет несколько точек пересечения с гликолитическим и окислительным пентозофосфатным путями: 6-фосфоглюконовая кислота представляет собой промежуточное соединение пути Энтнера — Дудорова и окислительного пентозофосфатного; пируват и 3-ФГА — промежуточные соединения пути Энтнера — Дудорова и гликолиза.
В природе есть много мест с полным или почти полным отсутствием молекулярного кислорода. Это глубокие слои воды, почвы, илы морей и континентальных водоемов. Особую экологическую нишу для развития анаэробов представляют рубец и кишечник животных и человека. Облигатно анаэробный способ существования широко распространен среди эубактерий. Систематическое изучение анаэробных эубактерий, предпринятое в последние десятилетия, обнаружило неоднородность входящих в эту группу организмов, способных получать энергию в процессах брожения, фотосинтеза и анаэробного дыхания.
Только небольшая часть облигатно анаэробных эубактерий может быть отнесена к первичным анаэробам, т. е. возникшим в докислородную эпоху и сохранившим до настоящего времени основные черты метаболизма того периода в результате обитания в анаэробных экологических нишах: получение энергии в процессе брожения, отсутствие электронтранспортных цепей, слабо развитые биосинтетические способности.
Большинство существующих облигатных анаэробов среди эубактерий имеют вторичное происхождение как следствие повторной адаптации к анаэробным условиям, сопровождающейся, как правило, изменениями деградационного характера: потерей способности взаимодействовать с O2
, утратой некоторых компонентов переноса электронов, большей зависимостью от готовых органических соединений среды обитания и т. д. Примером могут служить строго анаэробные эубактерии, составляющие основную микрофлору рубца и пищеварительного тракта животных и человека. Это в большинстве грамотрицательные кокки или палочки, способные сбраживать сахара и/или аминокислоты. У многих из них обнаружены цитохромы b
и a
и показана способность синтезировать АТФ по механизму мембранзависимого фосфорилирования.
В представленном в этой главе материале проанализированы энергетические процессы, сформированные на первом этапе эволюции жизни на Земле. То, что брожение — наиболее примитивный способ получения энергии организмами, в настоящее время никем не ставится под сомнение. Гораздо сложнее оценить, какой путь в процессе эволюции пройден теми или иными организмами. Очевидно, что при имеющихся возможностях обмена генетической информацией в мире прокариот сохранение их в первоначальном виде маловероятно. Описание представленных в этой главе нескольких групп анаэробных эубактерий, в первую очередь, пропионовокислых бактерий и клостридиев, служит иллюстрацией этого.
ЛИТЕРАТУРА
- Влавианос-Арванитис А., Олескин А.В.
Биополитика. Био-окружение. Био-силлабус. Афины: Биополитическая Интернациональная Организация. 1993.
- Горелов А.А.
Социальная экология. М. Изд-во Ин-та философии РАН. 1998.
- Гусев М.В.
К обсуждению вопроса об антропоцентризме и биоцентризме// Вест. Моск. ун-та. Сер. 16 (Биология). 1991. N 1. С.3--6.
- Данилова Н.Н., Крылова А.Л.
Физиология высшей нервной деятельности. М.: Учебная литература. 1997.
- Дерягина М.А.
Эволюционная антропология. М.: Изд-во УРАО. 1999.
- Дерягина М.А, Бутовская М.Л.
Этология приматов. М.: МГУ. 1992.
- Дольник В.Р.
Непослушное дитя биосферы. Беседы о человеке в компании птиц и зверей. М.: Педагогика. 1994.
- Дольник В.Р.
Вышли мы все из природы. Беседы о поведении человека в компании птиц, зверей и детей. М.: Linka Press. 1996.
- Дьюсбери Д.
Поведение животных. Сравнительные аспекты. М.: Мир. 1981.
- Захаров А.А.
Организация сообществ у муравьев. М.: Наука. 1991.
- Зорина З.А., И.И. Полетаева, Ж.И. Резникова.
Основы этологии и генетики поведения. М.: Изд-во МГУ. 1999.
- Карпинская Р.С., Лисеев И.К., Огурцов А.П.
. Философия природы: коэволюционная стратегия. М.: Интерпракс. 1995. С. 13--78.
- Ламсден Ч., Гуршурст А.
Генно-культурная коэволюция: человеческий род в становлении // Человек. 1991. № 3. С.11--22.
- Лоренц К.З.
Агрессия (так называемое зло). М.: Прогресс. 1994.
- Майерс Д.
Социальная психология. Спб., М., Харьков, Минск: Питер. 2000.
Мак-Фарленд Д.
Поведение животных. Этология и психобиология. М.: Мир. 1988.
|