МИНИСТРЕСТВО НАУКИ И ОБРАЗОВАНИЯ РЕСПУБЛИКИ КАЗАХСТАН
ЕВРАЗИЙСКИЙ НАЦИЛНАЛЬНЫЙ УНИВЕРСИТЕТ ИМ.Л.Н.ГУМИЛЕВА
КАФЕДРА «ХИМИЯ»
РЕФЕРАТ
НА ТЕМУ:
Особенность химического состава природных вод. Внутренняя структура молекул воды. Физические свойства воды.
ВЫПОЛНИЛА: ЕРГЕШБАЕВА С.Б. ПРОВЕРИЛА: ЖУМАБАЕВА Ж.Е.
АСТАНА-2011г.
Содержание:
Химический состав воды
Структура молекулы воды
Физические свойства воды
Список использованной литературы
Химический состав воды
Введение
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы - это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) - 300 г, почти треть от массы раствора.
Основные (преобладающие) компоненты
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3
-
, хлорид Cl-
и сульфат SO4
2-
) и четыре катиона (кальций Ca2+
, магний Mg2+
, натрий Na+
и калий K+
) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-
, B3+
, Sr3+
и др. Отнесение ионов K+
к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K+
могут играть главную роль.
Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO4
2-
или HCO3
-
, а среди катионов в зависимости от степени удаленности от побережья Ca2+
или Na+
. Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl-
падает, а SO4
2-
, Ca2+
и Mg2+
, наоборот, повышается. Причиной повышения содержания SO4
2-
и Ca2+
является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO4
2-
. Если увеличение содержания Ca2+
и Na+
связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO4
2-
обусловлено, с одной стороны, окислением SO2
и H2
S, с другой - поднятием сернокислых солей с засоленных поверхностей.
Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO3
-
> SO4
2-
> Cl-
и Ca2+
> Mg2+
> Na+
или Ca2+
> Na+
> Mg2+
, то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl-
> SO4
2-
> HCO3
-
и Na+
> Mg2+
> Ca2+
. Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ.
Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
Органические вещества
Органическим веществом природных вод называют комплекс истинно растворенных и коллоидных веществ органических соединений. По происхождению органические вещества природных вод могут быть разделены на поступающие извне (с водосборной площади) и образующиеся в самом водном объекте. К первой группе относятся главным образом гумусовые вещества, вымываемые водой из почв, торфяников, лесного перегноя и других видов природных образований, включающих остатки растений, и органические вещества, поступающие с промышленными и хозяйственно-бытовыми сточными водами. Из гумусовых веществ для гидрохимии наибольший интерес представляют гуминовые и фульвокислоты. Обе эти кислоты характерны для гумуса (гумусовые кислоты), они не содержатся в живых растительных и животных тканях. Соотношение между ними в разных торфах и почвах неодинаково. В черноземных почвах преобладают гуминовые, а в подзолистых - фульвокислогы.
Газы в природной воде
Если налить в стакан холодную воду из-под крана и поставить в тёплое место, на стенках появятся пузырьки газа. Газы были растворены в холодной воде и выделились при нагревании (поскольку растворимость газов при нагревании уменьшается). Это кислород, азот и углекислый газ. Растворимость газа в воде обычно падает с повышением температуры, что связано с повышением кинетической энергии молекул газа, способствующей преодолению сил притяжения молекул воды. Все природные воды представляют газовые растворы. Наиболее широко распространены в поверхностных водах кислород O2
и двуокись углерода CO2
, а в подземных - сероводород H2
S и метан CH4
. Иногда CO2
в значительных количествах может насыщать также воды глубоких горизонтов. Кроме того, во всех природных водах постоянно присутствует азот N2
.
Кислород (O2
) находится в природной воде в виде растворенных молекул. Кислород, являясь мощным окислителем, играет особую роль в формировании химического состава природных вод. Кислород поступает в воду в результате происходящих в природе процессов фотосинтфотосинтеза и из атмосферы. Расходуется кислород на окисление органических веществ, а также в процессе дыхания организмов. Концентрация растворенного кислорода в природных водах колеблется в ограниченных пределах (от 0 до 14 мг/л, при интенсивном фотосинтезе, в полдень, возможна и более высокая концентрация). Вследствие зависимости концентрации кислорода в поверхностных водах от целого ряда факторов его концентрация значительно меняется в течение суток, сезона и года. Так как потребление кислорода сравнительно мало зависит от суточных изменений солнечной радиации, а фотосинтез всецело определяется ею, то в течение дня происходит накопление кислорода, а в темное время суток расходование его. Кислород необходим для существования большинства организмов, населяющих водоемы. Как сильный окислитель кислород играет важную санитарно-гигиеническую роль, способствуя быстрой минерализации органических остатков.
Диоксид углерода (CO2
) находится в воде главным образом в виде растворенных молекул газа CO2
. Однако часть их (около 1 %) вступает во взаимодействие с водой, образуя угольную кислоту:
CO2
+ H2
O ↔ H2
CO3
Обычно же не разделяют CO2
и H2
CO3
и под диоксидом углерода подразумевают их сумму (CO2
+ H2
CO3
). В природных водах источником диоксида углерода являются прежде всего процессы окисления органических веществ, происходящие с выделением CO2
как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. К ним относятся дыхание водных организмов и различные виды биохимического распада и окисления органических остатков. В некоторых подземных водах важным источником диоксида углерода являются вулканические газы, выделяющие из недр земли, происхождение которых связано с дегазацией мантии и со сложными процессами метаморфизации осадочных пород, протекающими в глубинах под влиянием высокой температуры. Поэтому часто в подземных водах и источниках глубинного происхождения наблюдается высокое содержание диоксида углерода. Поглощение водой диоксида углерода из атмосферы имеет более важное значение для воды морей и океана и менее значимо для вод суши. Уменьшение содержания диоксида углерода прежде всего происходит при фотосинтезе. При очень интенсивном фотосинтезе, когда отмечается полное потребление газообразного CO2
, последний может быть выделен из ионов HCO3
-
:
HCO3
-
↔ CO3
2-
+ CO2
Диоксид углерода расходуется также на растворение карбонатов:
CaCO3
+ CO2
+ H2
O ↔ Ca(HCO3
)2
Также расходуется на химическое выветривание алюмосиликатов. Уменьшение содержания CO2
в воде, особенно в поверхностных водах суши, происходит также при выделении его в атмосферу. Вообще CO2
атмосферы имеет большое значение для CO2
содержащегося в поверхностных водах, регулируя его содержание там. Между CO2
атмосферы и CO2
поверхностных вод существует непрерывный обмен, направленный на установление между ними равновесия, согласно закону Генри-Дальтона. Поскольку парциальное давление диоксида углерода в атмосфере очень невелико (33 Па), то, несмотря на большую растворимость его (при давлении 1013 гПа и температуре 12 °С до 2166 мг/л), равновесие между водой и атмосферой достигается при очень малом содержании CO2
в воде. При парциальном давлении CO2
в атмосфере 33 Па растворимость его в воде будет 2166•0,00033=0,715 мг/л (при 12 °С). Обычно же поверхностные воды суши, в которых протекают различные процессы разложения органического вещества и которые связаны с почвами, имеют большее содержание CO2
и поэтому выделяют его в атмосферу. Лишь при очень сильном фотосинтезе, когда CO2
практически исчезает, может происходить поглощение CO2
из атмосферы. Содержание диоксида углерода в природных водах чрезвычайно разнообразно - от нескольких десятых долей до 3000-4000 мг/л. Наименьшая концентрация CO2
наблюдается в поверхностных водах, особенно минерализованных (моря, соленые озера), наибольшая - в подземных и загрязненных сточных водах. В реках и озерах концентрация CO2
редко превышает 20-30 мг/л.
Растворенный молекулярный азот (N2
) - наиболее постоянный газ в природных водах. В высшей степени химически устойчивый и биологически трудно усвояемый, азот, будучи занесен в глубинные слои океана или подземные воды, меняется главным образом лишь под влиянием физических условий (температура и давление). Растворенный в поверхностных водах азот имеет преимущественно воздушное происхождение. Наряду с этим в природе широко распространен азот биогенного происхождения, возникающий в результате денитрификации.
Газ метан (CH4) относится к числу наиболее распространенных газов и подземных водах. В газовой фазе подземных вод почти всегда количественно преобладает азот, двуокись углерода или метан. Основным источником образования метана служат дисперсные органические вещества в породах. Метан и тяжелые углеводороды, нередко встречаются в значительных концентрациях в глубинных подземных водах закрытых структур, связанных с нефтеносными месторождениями. В небольшой концентрации метан наблюдается в природных слоях озер, где он выделяется из ила при разложении растительных остатков, а также в океанических донных отложениях в районах высокой биологической продуктивности.
Газ сероводород (H2
S) является одним из продуктов распада белкового вещества, содержащего в своем составе серу, и поэтому скопление его часто наблюдается в придонных слоях водоемов вследствие гниения различных органических остатков. В нижних частях глубоких озер и морей, где отсутствует водообмен, часто образуется сероводородная зона. При парциальном давлении сероводорода в атмосфере, равном нулю, длительное присутствие его в поверхностных водах невозможно. Кроме того, он окисляется кислородом, растворенным в воде. В реках сероводород наблюдается лишь в придонных слоях, главным образом в зимний период, когда затруднена аэрация водной толщи. Присутствие сероводорода в природных незагрязненных поверхностных водах - сравнительно редкое явление. Гораздо чаще сероводород присутствует в подземных водах, изолированных от поверхности и в сильно загрязненных поверхностных водах, в которых он служит показателем сильного загрязнения и анаэробных условии.
Мезоэлементы
Кроме главных ионов, содержание которых в воде достаточно велико, ряд элементов: азот, фосфор, кремний, алюминий, железо, фтор - присутствуют в ней в концентрациях от 0,1 до 10 мг/л. Они называются мезоэлементами (от греч. "мезос" - "средний", "промежуточный").
Азот в форме нитратов NO3
-
попадает в водоёмы с дождевой водой, а в форме аминокислот, мочевины (NH2
)2
CO и солей аммония NH4
+
- при разложении органических остатков.
Фосфор существует в воде в форме гидрофосфатов HPO3
2-
и дигидрофосфатов H2
PO3
-
, образующихся в результате разложения органических остатков.
Кремний является постоянным компонентом химического состава природных вод. Этому способствует в отличие от других компонентов повсеместная распространенность соединений кремния в горных породах, и только малая растворимость последних объясняет малое содержание кремния в воде. Концентрация кремния в природных водах обычно составляет несколько миллиграммов в 1 л. В подземных водах она повышается и часто достигает десятков миллиграммов в 1 л, а в горячих термальных водах - даже сотен. На растворимость кремния, кроме температуры сильно влияет повышение pH раствора. Сравнительно малое содержание кремния в поверхностных водах, уступающее растворимости диоксида кремния (125 мг/л при 26 °С, 170 мг/л при 38 °С), указывает на наличие в воде процессов уменьшающих ее концентрацию. К ним надо отнести потребление кремния водными организмами, многие из которых, например диатомовые водоросли, строят свой скелет из кремния. Кроме того, кремниевая кислота как более слабая вытесняется из раствора угольной кислотой:
Na4
SiO4
+ 4CO2
+ 4H2
O = H4
SiO4
+ 4NaHCO3
Способствует неустойчивости кремния в растворе и склонность кремниевой кислоты при определенных условиях переходить в гель. В очень мало минерализованных водах кремний составляет существенную, а иногда и преобладающую часть химического состава воды, несмотря на его малое абсолютное содержание. Присутствие кремния в воде является серьезной помехой в технике, так как при продолжительном кипячении воды кремний образует в котлах очень твердую силикатную накипь.
Алюминий поступает в водоёмы в результате действия кислот на глины (каолин):
Al2
[Si2
O5
](OH)4
+ 6H+
= 2SiO2
+ 5H2
O + 2Al3+
Основной источник железа - железосодержащие глины. Органические остатки (ниже обозначаются как "С"), находящиеся в контакте с ними, восстанавливают железо до двухвалентного, которое медленно вымывается в форме гидрокарбоната или солей гуминовых кислот:
2Fe2
O3
+ "C" + 4H2
O + 7CO2
= 4Fe(HCO3
)2
Когда вода с растворёнными в ней ионами Fe2+
вступает в контакт с воздухом, железо быстро окисляется, образуя коричневый осадок гидроксида Fe(OH)3
. Со временем он превращается в болотную руду - бурый железняк (лимонит) FeO(OH). Карельская болотная руда использовалась в XVIII-XIX столетиях для получения железа.
Синеватая плёнка на поверхности воды - это Fe(OH)3
, образующийся, когда подземные воды, содержавшие ионы Fe2+
, вступают в контакт с воздухом. Ее часто путают с масляной пленкой, однако различить их очень легко: у пленки гидроксида железа рваные края. Если поверхность воды слегка взволновать, гидроксидная пленка, в отличие от масляной, не будет переливаться.
Микроэлементы
К этой группе относятся элементы, соединения которых встречаются в природных водах в очень малых концентрациях, поэтому их и называют микроэлементами. Их концентрация измеряется микрограммами в 1 л (мкг/л), а часто имеет и более малые значения. Микроэлементы представляют собой самую большую группу элементов химического состава природных вод, в нее входят все элементы периодической системы, не включенные в предыдущие группы рассмотренных компонентов. Условно их можно разделить на пять подгрупп: 1) типичные катионы (Li+
, Rb+
, Cs+
, Be2+
, Sr2+
, Ba2+
и др.); 2) ионы тяжелых металлов (Cu2+
, Ag+
, Au+
, Pb2+
, Fe2+
, Ni2+
, Co2+
и др); 3) амфотерные комплексообразователи (Cr, Mo, V, Mn); 4) типичные анионы (Br-
, I-
, F-
); 5) радиоактивные элементы. Микроэлементы необходимы для нормальной жизнедеятельности растений, животных и человека. Однако при повышенной концентрации многие микроэлементы вредны и даже ядовиты для живых организмов. Поэтому часто они становятся загрязняющими веществами и концентрация их контролируется. Успешное изучение микроэлементов затруднено не только их малым содержанием в природных водах, но и в сильнейшей мере неясностью формы их присутствия в растворе. Последнее не только осложняет выяснение закономерностей их миграции и режима но и создает трудности при химическом анализе. Например, многие тяжелые металлы мигрируют в больших концентрациях именно во взвешенном, а не в растворенном состоянии. Растворенные органические комплексы образуют большинство металлов, прежде всего двух- и трехвалентные металлы с гуминовыми и фульвокислотами. Концентрация закомплексованных металлов определяется прежде всего концентрацией органических кислот. В виде коллоидных соединений присутствуют многие гидроксиды металлов. Возможно, происходит адсорбция органических веществ на поверхности коллоидов, что придает им большую стабильность в растворе.
Структура жидкости
Применение термина "структура" для описания льда понятно, лед кристалл и, разумеется, обладает внутренней структурой. Но что такое структура жидкости? "Разве отсутствие структуры - текучесть - не является определяющим качеством жидкости?" - писал Бернал. Оказывается, жидкость обладает структурой, и не одной, а несколькими. Все дело во временном масштабе.
Если с какой-либо фиксированной молекулой воды связать систему координат, то для наблюдателя, находящегося в этой системе, структура воды будет зависеть от характерного масштаба времени, с которым он будет наблюдать молекулярную жизнь воды. У воды существуют два характерных временных параметра. Как и у всякого вещества, будь то жидкость или твердое тело, существует период колебаний отдельной молекулы τυ
. Для воды эта величина составляет значение 10-13
с. В жидкости, кроме периода колебаний молекул около своего положения равновесия τυ
, имеется еще одно характерное время - время "оседлой жизни" τD
, т.е. среднее время существования данного локального окружения одной молекулы. Для воды τD
~ 10-11
с, т.е. прежде чем перескочить на новое место, молекула воды совершает 100 колебаний на одном месте.
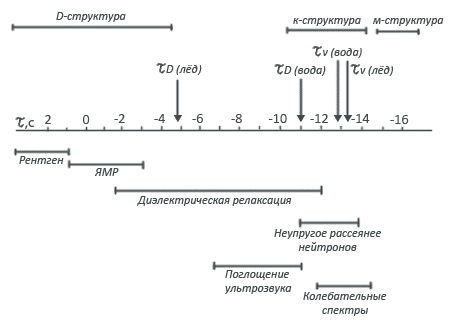
Два эти параметра разбивают временную шкалу на три области, каждой из которых соответствует своя структура жидкости. Если наблюдатель будет пользоваться достаточно малым временным масштабом, т.е. будет смотреть в течение времени, много меньшего τυ
, то он увидит хаотически разбросанные молекулы, среди которых трудно усмотреть какой-либо порядок. Тем не менее это беспорядочное расположение молекул называют мгновенной, или М-структурой.
Чтобы понять, почему все-таки этот беспорядок называют структурой, наблюдателю необходимо перейти к более длительному временному масштабу. Но не слишком, точнее, больше чем τυ
, но меньше чем τD
. На этом временном интервале реальные молекулы уже не будут видны, наблюдатель сможет увидеть лишь точки, вокруг которых они совершают свои колебания. Оказывается, что эти точки в воде расположены довольно регулярно и образуют четкую структуру, называемую К-структурой, что означает "колебательно усредненная".
М- и К-структуры воды подобны таким же структурам льда. Чтобы увидеть различия этих структур у воды и льда, нужно понаблюдать за ними несколько дольше, т.е. с характерным временем, много большим чем τD
. Наблюдаемую в этом случае картину называют Д-структурой - диффузионно усредненной. В отличие от льда Д-структура воды полностью размыта из-за частых перескоков молекул воды на большие расстояния (эти перескоки составляют процесс самодиффузии молекул воды). Д-структура образуется диффузионным усреднением К-структур и не может быть описана каким-либо особым расположением точек в пространстве. Сторонний наблюдатель видит, что, по сути дела, никакой Д-структуры жидкости и не существует (заметим, что именно Д-структура как полное статистическое усреднение ансамбля молекул определяет термодинамические свойства воды.).
И тем не менее Д-структура существует, и ее можно увидеть. Наблюдатель, находящийся на некоторой молекуле воды, увидит, что его собственная молекула, перемещается хаотически по всему объему воды, каждый раз оказывается в более или менее упорядоченном окружении. Он увидит, что чаще всего "его" молекулу будут окружать четыре других молекулы H2
O, иногда соседей окажется пять, иногда шесть, в среднем как мы знаем, их будет 4,4. Таким образом, Д-структурой воды можно считать картину, видимую наблюдателем.
Такой подход к описанию структуры воды чаще всего используется при интерпретации спектроскопических данных, потому что различные спектроскопические методы - рентгеновский, ЯМР, диэлектрическая релаксация, комбинационное рассеяние нейтронов - способны "считывать" молекулярные данные с различным характерным временем разрешения.
Перемещение молекул доказывается обычно броуновским движением. Каплю воды, в которой плавают очень легкие частицы твердого нерастворимого вещества, рассматривают под микроскопом и наблюдают, что частицы беспорядочно перемещаются в массе воды. Каждая такая частица состоит из множества молекул и не облачает самопроизвольным движением. Частицы испытывают удары со стороны движущихся молекул воды, которые заставляют их всё время менять направление движения, а это означает, что сами молекулы воды движутся беспорядочно.
Физические свойства
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1]), по сравнению с соединениями водорода с похожим молекулярным весом.
Высокая теплоёмкость жидкой воды.
Низкая вязкость.
Высокое поверхностное натяжение.
Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °C этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.[2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
|