МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Самарский государственный университет»
КАФЕДРА БИОХИМИИ
ВЛИЯНИЕ ДОЛГОСРОЧНОЙ ИЗОЛЯЦИИ НА УРОВЕНЬ ГЛЮКОКОРТИКОИДОВ И АДРЕНАЛИНА У КРЫС
Курсовая работа
Специальность: 020201.65 – Биология
Специализация: «Биохимия»
Выполнила студентка 3 курса
Сорокина Людмила Юрьевна
Подпись__________________
Научный руководитель:
доктор биологических наук, профессор
Подковкин Владимир Георгиевич
Подпись__________________
Курсовая работа защищена
«___»________________2010 г.
Оценка_____________________
Заведующий кафедрой биологической химии
кандидат биологических наук, профессор Ю.П. Фролов
Подпись ____________________
Самара
2010
СОДЕРЖАНИЕ
ВВЕДЕНИЕ ……………………………………………………………. 4
1. Обзор литературы……………………………………………………. 6
1.1 Долгосрочная изоляция………………………………………….. 6
1.2 Глюкокортикоиды и их функции……...…….…………………… 9
1.3 Функция гипофизарно – адренокортикальной системы
в процессах адаптации…………………………………………... 15
1.4 Действие адреналина при стрессе……..………………………. 21
2. Экспериментальная часть…………………………………………… 23
2.1 Материалы и методы исследования…………………………… 23
2.2.Результаты исследований и их обсуждение ………………….. 24
Выводы ………………………………………………………..…............27
Список использованных источников ………………………...………..28
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
11-ОКС – 11-оксикортикостероиды
ГК – глюкокортикоиды
ЦНС – центральная нервная система
САС – симпатоадреналовая система
ГГНС – гипоталамо-гипофизарно-надпочечниковая система
ВВЕДЕНИЕ
В настоящее время каждый человек сталкивался с проблемой страха, агрессии, тревоги, эмоционального стресса. Данные психологические состояния человека обусловлены влиянием окружающей среды, ее стимулирующим или угнетающим воздействием. В данных условиях возрастает напряжение систем, которые обеспечивают адаптацию организма [6, 5].
Существует широкое разнообразие форм поведения животных и человека, которые проявляются в ответ на раздражители, вызывающие боль или страх, например, нападение, «оцепенение», припадание к земле, беганье и бегство, причем некоторые из них являются видоспецифичными [9].
Все данные состояния можно обозначить одним словом – стресс. Стресс как особое психическое состояние связан с зарождением и проявлением эмоций, но он не сводится только к эмоциональным феноменам, а детерминируется и отражается в мотивационных, когнитивных, волевых, характерологических и других компонентах личности [5].
Многочисленными исследованиями показано, что изоляция человека и животных приводит тоже к возникновению стрессорного состояния. Возникает синдром социальной изоляции, который приводит к устойчивым нарушениям как в сфере внутривидовых взаимодействий, так и в условно-рефлекторной деятельности [29].
В совокупности перечисленных признаков синдром социальной изоляции может во многом объяснить повышенную вероятность возникновения ряда психопатологических состояний, таких как злоупотребление алкоголем и наркотиками, социальная агрессия и склонность к насилию, другие девиации в поведении. В связи с этим данная проблема является не абстрактной, а актуальной в наше время, затрагивающей людей в полной мере [27].
Целью нашей работы было исследование влияния долгосрочной изоляции на уровень 11-оксикортикостероидов в плазме, печени, в левом надпочечнике, а так же на уровень адреналина в правом надпочечнике у крыс.
Задачи нашего исследования:
1) Определить уровень 11-оксикортикоидов у крыс, подвергавшихся воздействию долгосрочной социальной изоляции.
2) Проанализировать изменение относительной массы надпочечников и тимуса у контрольных и опытных крыс после долгосрочной изоляции.
2) Проанализировать содержание адреналина у контрольных и опытных животных.
1.ОБЗОР ЛИТЕРАТУРЫ
1.1. Долгосрочная изоляция
Долгосрочная социальная изоляция – ограничение социального опыта, вследствие чего наблюдается нарушение социального статуса животного и человека [27].
Крысы, выращенные в условиях социальной изоляции с раннего возраста, обладают свойствами, позволяющими их рассматривать как модель депрессивного синдрома [24]. При этом наиболее выраженным проявлением депрессии у животных является показатель повышения тревожности и агрессии. Все животные пребывали в состоянии стресса [16,17]. Стресс является реакцией не столько на физические свойства ситуации, сколько на особенности взаимодействия между личностью и окружающим миром [9]. Это в большей степени продукт наших когнитивных процессов, образа мыслей и оценки ситуации, знания собственных возможностей (ресурсов), степени обученности способам управления и стратегии поведения, их адекватному выбору. И в этом заложено понимание того, почему условия возникновения и характер проявления стресса (дистресса) у одного человека не являются обязательно теми же для другого [18].
Проблема психологического стресса в трудовой деятельности и социальной жизни человека особенно активно стала изучаться у нас в стране и за рубежом в последние три-четыре десятилетия. Этому способствовал ряд обстоятельств [11].
Термин «стресс» (от англ. stress – давление, напряжение) заимствован из техники, где это слово используется для обозначения внешней силы, приложенной к физическому объекту и вызывающей его напряженность, то есть временное или постоянное изменение структуры объекта [13]. В физиологии, психологии, медицине этот термин применяется для обозначения обширного круга состояний человека, возникающих в ответ на разнообразные экстремальные воздействия. Первоначально понятие стресса возникло в физиологии для обозначения неспецифической реакции организма («общего адаптационного синдрома») в ответ на любое неблагоприятное воздействие (Г. Селье). Позднее стало использоваться для описания состояний индивида в экстремальных условиях на физиологическом, биохимическом, психологическом, поведенческом уровнях [12].
В современной научной литературе термин «стресс» используется по крайней мере в трех значениях[26]. Во-первых, понятие стресс может определяться как любые внешние стимулы или события, которые вызывают у человека напряжение или возбуждение [4]. В настоящие время в этом значении чаще употребляются термины «стрессор», «стресс-фактор». Во-вторых, стресс может относиться к субъективной реакции и в этом значении онотражает внутреннее психическое состояние напряжения и возбуждения; это состояние интерпретируется как эмоции, оборонительные реакции и процессы преодоления (copingprocesses), происходящие в самом человеке [7]. Такие процессы могут содействовать развитию и совершенствованию функциональных систем, а также вызывать психическое напряжение. Наконец, в-третьих, стресс может быть физической реакцией организма на предъявляемое требование или вредное воздействие. Именно в этом смысле и В. Кеннон и Г. Селье употребляли этот термин. Функцией этих физических (физиологических) реакций, вероятно, является поддержка поведенческих действий и психических процессов по преодолению этого состояния [26].
Социальная изоляция приводит к устойчивым нарушениям как в сфере внутривидовых взаимодействий, так и в условно-рефлекторной деятельности [29]. Внутривидовая изоляция в раннем онтогенезе (с 15-18 дня жизни) влияет на зоосоциальное поведение как самцов, так и самок [24]. Сравнение особенностей зооциального поведения самцов и самок крыс, имеющих одинаковый индивидуальный опыт, позволило установить, что уровень агрессии определяется не только полом, но и индивидуальным опытом (среди животных с обычным зоосоциальным опытом агрессивнее являются самки, а среди изолянтов – самцы) [30]. Внутривидовая изоляция в раннем онтогенезе затрудняет формирование инструментального навыка только у самцов, но не у самок. Отличительной чертой самок крыс, не зависящей от индивидуального опыта, является затруднение адаптации в новой незнакомой ситуации по сравнению с самцами [16].
Вследствие социальной изоляции крыс в раннем возрасте от сородичей наблюдаются депрессивноподобные состояния, проявляющиеся в поведенческих признаках синдрома социальной изоляции. К ним относятся: 1) двигательная и исследовательская гиперактивность;
2) повышение тревожности и депрессивности;
3) повышение уровня агрессии и защиты;
4) повышенная реактивность подкрепляющих систем [27, 23].
В целом социальная изоляция животных от сородичей в раннем онтогенезе приводит к реактивности их нервной системы.
Социальная изоляция в раннем возраста оказывает влияние на многие факторы, приводит к изменению биологических показателей. На настоящий момент проведено уже достаточно большое количество исследований о влиянии долгосрочной изоляции по различным критериям. [12, 18].
Изменения в поведении крыс обусловлены действием гипоталамо-гипофизарно-адренокортикальной, симпатоадреналовой систем. Влияние этих систем на процесс адаптации в экстремальных для организма условиях мы и рассмотрим в нашей работе.
1.2. Глюкокортикоиды и их функции
По строению все глюкокортикоиды являются стероидами. Основным и наиболее активным естественным глюкокортикоидом человека является кортизол, но это верно не для всех видов животных. Например, у крысы основным глюкокортикоидом является кортикостерон, а кортизола производится мало, и он малоактивен для тканей организма крысы. У человека наоборот: кортикостерон производится в очень малых количествах, и он малоактивен для тканей человеческого организма. Синтез данных гормонов происходит в коре надпочечников [7].
Глюкокортикоиды обладают разносторонним действием на организм: влияют на обмен веществ, оказывают противовоспалительное, иммунорегулирующее, противоаллергическое действие, антистрессовое и противошоковое действие. Нас интересует антистрессовое действие ГК на организм. Их уровень в крови резко повышается при стрессе, травмах, кровопотерях, шоковых состояниях. Повышение их уровня при этих состояниях является одним из механизмов адаптации организма к стрессу, кровопотере, борьбы с шоком и последствиями травмы [30]. Глюкокортикоиды повышают системное артериальное давление, повышают чувствительность миокарда и стенок сосудов катехоламинам, предотвращают десенситизацию рецепторов к катехоламинам при их высоком уровне [15]. Кроме того, глюкокортикоиды также стимулируют эритропоэз в костном мозгу, что способствует более быстрому восполнению кровопотери [14].
Активацию коры надпочечников в состоянии стресса первоначально связывали с механизмом обратной связи (гипотеза Сайерсов) и влиянии адреналина на адреногипофиз (гипотеза Лонга).
В соответствии с гипотезой Сайерсов усиление утилизации кортикостероидов во время стресса приводит к снижению содержания их в крови, что оказывает стимулирующее влияние адренокортикотропную функцию адреногипофиза. Эта гипотеза объясняет хорошо постоянный уровень кортикостероидов в покое, но не раскрывает активации кортикотропной функции в начале стресса [2].
По гипотезе Лонга стимулятором кортикотропной функции адреногипофиза является адреналин. В начале стресса симпатическими нейронами вызывается усиленная секреция адреналина, который достигает гуморальным путем гипофиза и оказывает свое стимулирующее влияние на клетки, продуцирующие кортикотропин. Если влияние адреналина ослабить действием дибенамина, то освобождение кортикотропина при стрессе уменьшится [30].
Гипоталамус оказывает стимулирующее воздействие на секрецию ГК. В нем нет строго локализованного, дискретного нервного центра, регулирующего гипофизарно-адренокортикальную систему [10]. Вместо этого выявляются диффузно расположенные нервные образования, участвующие в осуществлении данной функции. Эта диффузная система простирается от мамиллярных тел до зрительного перекрестка по вентромедиальной части гипоталамуса с наибольшим скоплением нейронных элементов в районе серого бугра. Нарушение любого центра этой зоны вызывает изменение в активности системы. Следовательно, гипоталамус оказывает влияние на гипофизарно-адренокортикальную систему как единое целое и является частью общего гомеостатического механизма ЦНС [7].
Механизм действия ГК
Гормоны коры надпочечников необходимы для обеспечения ответа ткани на стрессор, но сами эти гормоны не единственная причина усиления белкового катаболизма при стрессе. Данные гормоны необходимы для общего поддержания процессов жизнедеятельности в организме, а не для активации отдельных функций. Эти гормоны играют пассивную роль, обеспечивая различным регуляторным механизмам возможность выдерживать достаточное напряжение в гомеостатической регуляции [2].
Принцип пермиссивной роли гормонов сформулирован Инглом, позже подтвержден клиническими материалами. Этот принцип гласит: хотя определенные процессы и не индуцируются гормонами, но могут быть осуществлены только при наличии соответствующего гормона в достаточном количестве. Одним из веских аргументов, лежащих в основе этого принципа, было участие гормонов коры надпочечников в обеспечении появления белкового катаболизма при стрессе [28].
По теории пермиссивной роли ГК, деятельность коры надпочечников усиливается в состояние стресса не с целью создания гиперкортикализма, а для поддержания гомеостаза, способствуя приспособлению всех тканей. Чем больше суммарная активность клеток организма, т.е. чем больше гомеостатическая активность тканей в соответствии с силой действующего стрессора, тем больше и запрос тканей на кортикостероиды; следовательно, тем больше должна усиливаться деятельность коры надпочечников.
Известно более пятидесяти ферментов, активность которых зависит от адренокортикального статуса. Все это свидетельствует об обширном воздействии ГК на разные ферментативные реакции. Однако несомненно, что далеко не все эти результаты отражают непосредственное влияние ГК на соответствующие ферменты. Существуют ферменты, на активность которых ГК воздействуют прямо и в физиологических концентрациях [7].
При исследовании клеток тимуса выявлены две формы связывания ГК в них: специфическое, коррелирующее с выражением глюкокортикоидной активности, и неспецифическое. Для специфического связывания характерны насыщение при высоких физиологических дозах гормона и относительно медленная ассоциация и диссоциация; оно происходит первоначально в цитоплазме. Для неспецифического связывания характерны быстрая ассоциация и большой объем; оно наблюдается во всех фракциях клетки, включая ядро; в него могут поступать любые стероиды и метаболиты. Роль белков в связывании доказана тем, что комплекс стероид – рецептор разрушается под влиянием проназ, а не под воздействием дезоксирибонуклеазы и рибонуклеазы. Известно, что связывание с рецептором необходимо для перемещения гормона из цитоплазмы в ядро.
На основании изучения кинетики насыщения тимоцитов адреналэктомированных крыс Шаумбург и Боесен пришли к заключению о наличии специфического рецептора ГК; они вычислили, что на одну клетку приходится 2400 мест связывания, а из них 25-30% насыщенно ГК при концентрациях, соответствующих нормальному содержанию в крови. Полное насыщение рецепторов достигается при концентрации ГК, наблюдаемой в крови в состоянии стресса. Скорость образования комплекса стероид – рецептор при температуре 37̊ С оказалась достаточной, чтобы предшествовать сроку наиболее ранних проявлений метаболических изменений, обусловленных ГК [28].
Почти в это же время обнаружен рецептор ГК и в цитоплазме клеток печени. Установлено наличие цитоплазматических рецепторов для ГК, подробно изучены их характеристики в клетках культуры гепатомы. Впоследствии глюкокортикоидные рецепторы обнаружены в фибробластах, мозгу, молочной железе, почке, лейкоцитах. Сердце, легких, семенниках и желудке, костной и жировой ткани. Наличие этих рецепторов рассматривают как общее свойство большинства млекопитающих; наивысшую концентрацию их нашли у крыс в печени, у кролика в тимусе. В аденогипофизе больше связывающих мест для глюкокортикоидных рецепторов, чем в гипоталамусе и заднем гиппокампе. Поэтому основным местом приложения обратного влияния ГК на аппарат, стимулирующий их продукцию, считается гипофиз [2].
Связывание ГК с рецептором зависит от температуры: по мере повышения температуры от 0̊ до 37̊ процесс связывания ускоряется, вместе с тем увеличивается скорость диссоциации, т.е. комплекс переходит в боле стабильное состояние. В то же время связывание с ГК увеличивает стабильность соответствующего рецепторного белка [8].
Соединение стероида с рецептором – обязательное условие перемещения этого комплекса в ядро клетки, где происходит индукция процессов белкового синтеза. При температуре тела перемещение комплекса ГК – рецептор в ядро достигает оптимальной скорости. Для перемещения в ядро в рецепторе необходимо конформационное изменение, зависящее от температуры. В ядре этот комплекс связывается на генетическом аппарате. Цитоплазматический рецептор связывается с хроматином только тогда, когда находится в комплексе со стероидом.
На основании данных, полученных в опытах с микроорганизмами, Карлсон заключил, что основным звеном действия стероидов является активация генетического аппарата. Положение этой концепции для понимания механизма действия ГК у млекопитающих возможно при решении двух задач: как ГК доходят до генетического аппарата клетки и усиливается ли продукция мРНК, содержащей матрицы энзимных белков, индуцируемых ГК [7].
Первая задача решается благодаря открытию цитоплазматических рецепторов, переноса комплекса стероид – рецептор в ядро клетки и связыванию этого комплекса на хроматине. Для решения второй задачи недостаточно только установить усиление синтеза РНК и повышение ее концентрации, необходимо выяснить влияние ГК на разные виды РНК. Полученные данные противоречивы. Одни авторы не обнаружили выборочной индукции синтеза различных видов РНК под влиянием ГК в печени в течение 1 – 2,5 ч после введения гормона. В то же время исследования других авторов, выполненные на препаратах печени крысы, свидетельствуют об усилении включения меченых предшественников в ядерную ДНК [10].
Учитывая, что ГК оказывают влияние на разные точки генетического аппарата, можно рассмотреть цепь событий в клетке под влиянием ГК следующим образом.
1. ГК проходит через клеточную мембрану и попадает в клетку. Считают, что этот процесс по существу диффузионный и зависит от концентрации гормона во внеклеточной жидкости, которая находится в равновесии с содержанием свободного гормона. Есть данные о наличии в клеточной мембране транспортной системы для ГК, обеспечивающей более быстрое накопление гормона в цитоплазме.
2. В клетке ГК соединяется со специфическим белком – рецептором. При температуре 37̊ связывание ГК с рецептором достигает максимума через 5 – 10 минут.
3. После соединения со стероидом в рецепторном белке происходят конформационные изменения, зависящие от температуры.
4. Комплекс стероид – рецептор перемещается в ядро клетки. Этот процесс начинается не позднее чем через 15 мин после вхождения ГК в систему.
5. Комплекс стероид – связывается на хроматине, что достигает своего максимума через 30 мин после введения ГК.
6.Стимулируется активность структурного гена, в результате чего усиливается транскрипция мРНК.
7. ГК блокирует действие репрессора на мРНК. Благодаря чему увеличивается накопление мРНК.
8. Часть новой мРНК содержит информацию для синтеза специфических белков, стимулирующих образование других видов РНК.
9. Непосредственное действие ГК на аппарат трансляции состоит из двух этапов: освобождение рибосом из ЭПС и усиление агрегации рибосом.
10. Трансляция информации, содержащейся в образованной мРНК, приводит к синтезу энзимных белков.
После выполнения своей роли в ядре клетки ГК отщепляется от комплекса с рецептором и высвобождается в неизменном виде. Полураспад комплекса ГК – рецептор длится 13 мин [7].
1.3 Функция гипофизарно-адренокортикальной системы в процессах адаптации
Анализируя литературу об обмене гормона, мы сталкиваемся с понятиями «утилизация», «элиминация», «биотрансформация». Эти термины нельзя понимать как синонимы. Наиболее старый термин «утилизация» первоначально применяли для обозначения совокупности изменений в молекулах гормона начиная с его выхода из крови. Об элиминации гормона следует говорить, только имея в виду определенную среду, например элиминацию гормона из крови, или из тканевой жидкости, или из клеток и т.д. После элиминации гормона из крови он может вступать в связь с цитоплазматическими рецепторами в тканях без изменений молекулы гормона или же подвергается обратимым метаболическим превращениям. Следовательно, нельзя ставить знак равенства между элиминацией гормона из крови и метаболическим превращения его [10, 21].
Элиминация кортикостероидов из крови в состоянии стресса
На основании экспериментальных данных, полученных из опытов на адреналэктомированных животных при инфекции, термическом воздействии или мышечной работе, сделали вывод об увеличении «утилизации» кортикостероидов в состоянии стресса. Но дальнейшие изучения скорости элиминации кортикостероидов из крови в состоянии стресса не дали столь однородных результатов [26].
В опытах на адреналэктомированных животных установлено, что пониженная элиминация кортикостероидов не является результатом стресса вообще, а обусловлена угнетением некоторых функций печени.
Таким образом при различных формах стрессорного действия, связанных с развитием патологических процессов или чрезмерного воздействия внешних факторов на организм, в большинстве случаев отмечено угнетение скорости элиминации кортикостероидов из крови, а при физической работе скорее наблюдается противоположное. Итак, можно говорить о разнонаправленных изменениях обмена кортикостероидов в состоянии стресса [7].
Тем не менее, нельзя исключить возможность, что в состоянии стресса обмен кортикостероидов происходит по-разному и зависит от влияния различных «обусловливающих» факторов: при чрезмерном действии стрессора и при развитии патологических процессов результат воздействия «обусловливающих» факторов по-видимому, другой, чем в случаях, когда влияние стрессора не выходит за физиологические пределы [1].
Самым решающим фактором, определяющим скорость элиминации стероидов из крови, является интенсивность кровотока через печень. Естественно, что объемная скорость кровотока через печень изменяется неодинаково при действии различных стрессоров и в разных состояниях организма. Однако имеют значение и другие факторы. Например, из опытов на животных было установлено, что оказывает влияние изменение температуры тела, насыщенность организма аскорбиновой кислотой [28].
Таким образом, имеющиеся данные не позволяют заключить, что в состоянии стресса элиминация кортикостероидов из крови изменяется строго в одном направлении. Очевидно, изменение скорости элиминации кортикостероидов в состоянии стресса зависит от разных обусловливающих факторов, результатом которых может быть в одних случаях повышение, в других – понижение ее [11]. Кроме того на элиминацию кортикостероидов из крови действуют также усиленное связывание их с цитоплазматическими рецепторами в начале стресса, выход из клетки гормона после освобождения его из комплекса стероид – рецептор и попадание новых порций гормона в клетку [8].
Динамика адренокортикальной активности в стрессовой ситуации.
Выделяя три стадии общего адаптационного синдрома, можно представить такую картину динамики адренокортикальной активности: усиление ее в стадии тревоги, нормализацию в стадии резистентности вместе с приобретением повышенных функциональных запасов и истощение коры надпочечников при чрезвычайно продолжительном действии стрессора [18, 15].
В фазе шока, стадии тревоги резистентность организма к стрессору понижена. Адренокортикальная активность характеризуется сначала относительной, а затем абсолютной ее недостаточностью. В фазе контрашока адренокортикальная активность увеличивается, и вместе с тем растет резистентность организма к стрессору [22]. Это характеризуется постоянной повышенной сопротивляемостью к стрессору без необходимости активизировать адренокортикальную активность. Наступление стадии истощения, характеризующейся резким спадом резистентности к стрессору, связано с первоначальным усилением адренокортикальной активности, переходящей в абсолютную недостаточность ее [7].
Наиболее важная особенность динамики гипофизарно-адрено-кортикальной системы при стрессе заключается в том, что усиление ее в виде реакции контрашока (или просто в виде стрессовой реакции) имеет полифазный характер. Замена повышенной адренокортикальной активности на пониженную происходит при продолжительном действии стрессоров [10].
Полифазный характер стрессовой реакции гипофизарно-адренокорти-
кальной системы нашел свое подтверждение во многих исследованиях. Первоначальное усиление, сменяющееся затем угнетением, установлено в ряду показателей активности системы после введения адреналина, токсинов, алкоголя или формалина [25, 8].
Важнейшей особенностью деятельности гипофизарно-адренокортика-
льной системы является кратковременность регулирующих воздействий, вызывающие более длительные, чем регуляторные воздействия, изменения гормонопродукции клетками коры надпочечников. Кратковременность и тем самым гибкость регулирующего влияния кортикотропина связаны с малой длительностью его полураспада (от 1 до 18 мин). Скорость элиминации кортикотропина из крови пропорциональна уровню его в крови [7, 22].
Итак, следует считать установленным, что реакция гипофизарно – адренокортикальной системы на стрессор характеризуется не постоянным, а волнообразным увеличением ее активности. При этом выявляются три принципиально важные фазы-реакции системы на стресс [10].
Кора надпочечников не выделяет кортикостероиды непрерывно, а работает вспышками, которые чередуются периодами покоя. Интервалы между вспышками варьируют от 1 – 2 ч до 3 ч. Эпизодический характер секреции вообще и полифазность стрессовой реакции в частности могут быть связаны с циклом действия стероидов на клеточном уровне, для которого характерны следующие этапы: насыщение цитоплазматических рецепторов в тканях мишени, транслокация комплекса стероид – рецептор в ядро, взаимодействие этого комплекса с геномом, приводящее к индукции синтеза энзимных белков, освобождение стероида из указанного комплексов, выхода стероида из клетки и метаболическая инактивация стероида. Связь этого цикла с эпизодическим характером секреции можно представить таким образом: кортикостероиды, выделенные в результате одной вспышки секреции, через некоторое время достигают цитоплазматических рецепторов в тканях-мишенях и связываются с ними, вследствие чего уровень кортикостероидов в крови снижается; он вновь увеличивается после выхода кортикостероидов из клетки или в след за новой вспышкой секреции. Часть кортикостероидов постоянно подвергается метаболическим превращениям, и поэтому все время существует необходимость в новых порциях гормона [28,15].
Для обеспечения максимального адаптационного эффекта поддержания продукции ГК на высоком уровне по крайней мере в течение 1- 2 часов (до полной реализации цикла действия ГК) [20]. Одна кратко- временная вспышка секреции не может удовлетворить эту потребность. Поэтому маловероятно, что в состоянии стресса поддерживается такой же режим секреторных вспышек, как в условиях покоя. Основным в действии ГК является индукция ими синтеза энзимных белков и усилении этого процесса требует повышенной в объеме или скорости взаимодействия ГК с рецепторами. Для этого и нужен приток к тканям значительных количеств ГК. Поэтому весьма логично в начале стресса ожидать не только повышения продукции ГК, но и ускоренной их элиминации из крови [7, 3].
Полифазность стрессовой реакции рассматривается в связи с наличием нервных образований, раздражение которых приводит к быстрой или медленной активации гипофизарно-адренокортикальной системы. Разрушение гипоталамических центров исключает фазу быстрой активации системы, но при этом остается фаза медленной активации.
Состояние гипофизарно-адренокортикальной системы при длительном периоде стрессора
Новый уровень интенсивности гормонов гипофизарно-адренокортикальной системы обеспечивает большую длительность вторичной активации системы. Эта фаза заканчивается или достижение достаточной резистентности к стрессору на клеточном уровне, делающей усиленную адренокортикальную активность ненужной, или новым угнетение активности [10].
Адаптация организма к повторяющимся стрессорам характеризуется постепенным уменьшением стрессовой активации глюкокортикоидной функции вплоть до полного исчезновения реакции. Адаптация к конкретному уровню стрессорного воздействия достигается через фазу околопредельного исчерпывания возможностей клеток коры надпочечников. Для адаптации необходимо усовершенствование аппарата биосинтеза кортикостероидов [26, 7].
Функционирование гипофизарно-адренокортикальной системы определяется устойчивостью разных звеньев этой системы, а так же нейронов, секретирующих разные кортикостероиды, участвующие в регуляции системы. Различия в функциональной устойчивости могут выявляться отдельными секреторными клетками. Они рассматриваются как снижение секреции кортикостероидов при длительных патологических состояниях как результат распределения клеток коры надпочечников по порогу выключения их активности [4].
Значение ГК в процессах адаптации
Основная функция ГК в процессах адаптации заключается в индукции энзимных белков. Через синтезируемые ферменты ГК принимают участие в широком спектре метаболических процессов. Важную роль выполняют ГК и в биосинтезе адреналина. Введением их можно увеличивать содержание адреналина в надпочечниках [7, 4].
1.4 Действие адреналина при стрессе
Адреналин (эпинефрин) (L-1(3,4-Диоксифенил)-2-метиламин-
этанол) — основной гормон мозгового вещества надпочечников, а также нейромедиатор. 
По химическому строению является катехоламином. Адреналин содержится в разных органах и тканях, в значительных количествах образуется в хромаффинной ткани, особенно в мозговом веществе надпочечников [2].
Действие адреналина связано с влиянием на α- и β-адренорецепторы и во многом совпадает с эффектами возбуждения симпатических нервных волокон. Адреналин участвует в реализации реакций типа «бей или беги», его секреция резко повышается при стрессовых состояниях, пограничных ситуациях, ощущении опасности, при тревоге, страхе, при травмах, ожогах и шоковых состояниях. Он оказывает стимулирующее воздействие на ЦНС, хотя и слабо проникает через гематоэнцефалический барьер. Он повышает уровень бодрствования, психическую энергию и активность, вызывает психическую мобилизацию, реакцию ориентировки и ощущение тревоги, беспокойства или напряжения, генерируется при пограничных ситуациях [14].
При возникновении опасности адреналин выбрасывается в кровь и мобилизует запасы углеводов для быстрого высвобождения энергии, увеличивает мышечную силу, вызывает расширение зрачков и сужение периферических кровеносных сосудов [8]. Таким образом, направляются резервные силы для «бегства или борьбы», а кроме того снижаются кровопотери благодаря сужению сосудов и быстрому свертыванию крови. Адреналин стимулирует также секрецию АКТГ (т.е. гипоталамо-гипофизарную ось). АКТГ, в свою очередь, стимулирует выброс корой надпочечников кортизола, в результате чего увеличивается превращение белков в глюкозу, необходимую для восполнения в печени и мышцах запасов гликогена, использованных при реакции тревоги [19].
Находясь в спокойном состоянии, клетки мозгового слоя надпочечников все время вырабатывают незначительное количество адреналина [20]. В случае воздействия на организм человека какого-либо внешнего либо внутреннего фактора, происходит скачок выработки адреналина. Такими факторами могут быть – физическое напряжение, умственное напряжение, инфекция и т.д. В такие стрессовые ситуации, данные гормоны исполняют достаточно серьезную регуляторную роль [2, 11].
Первым органом, реагирующим на стресс, является гипоталамус. Именно он направляет сигнал в гипофиз, который в свою очередь вырабатывает гормоны, которые так необходимы практически всем тканям и органом. Надпочечники первыми улавливают данные гормоны. Подхватив распространяющиеся гормоны, органы начинают вырабатывать адреналин, который именуется гормоном тревоги. Итогом такой реакции становятся – резкое сужение сосудов, повышение артериального давления, учащение пульса, дыхания, увеличение количества сахара в крови [14].
В случае если у человека или животного вырабатывается большое количество адреналина, тогда он достаточно быстро справляется со стрессом. Однако есть и одно но. Такие люди практически всегда находятся в напряженном состоянии. Если у человека имеется нехватка адреналина, тогда он постоянно мучается в моменты, когда что-то не идет по плану. Есть и такие люди, у которых достаточно много как гормонов тревоги, так и гормонов стабильности. Их настроение постоянно меняется. Чаще всего нельзя предсказать их ход мыслей или действий [19, 25].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Материалы и методы исследования
Эксперимент проводился на 10 беспородных крысах обоих полов массой 150-250 грамм. Все манипуляции с животными проводились согласно международным правилам использования животных в эксперименте.
По плану эксперимента животные были разделены на две группы.
В первую группу входили животные, которых содержали в обычных условиях. В клетках находилось по несколько крыс.
Вторую группу составляли животные, подвергавшиеся долгосрочной социальной изоляции на протяжении 35 суток. Они содержались в условиях свободного доступа к пище и воде.
Животных выводили из эксперимента путем декапитации. У экспериментальных животных извлекали надпочечники и печень, отделяли их от соединительной ткани и взвешивали. Относительную массу надпочечников выражали в процентах от массы тела.
Приготовляли гомогенат левого надпочечника в 2,5 мл 30-% раствора спирта и гомогенат печени в отношении 1:5 в 30-% растворе спирта.
Плазму на анализ брали с 5-% раствором этилендиаминтетраацетата натрия (ЭДТА). Затем центрифугировали 10 минут при 1500 об/мин.
Уровень 11-ОКС в левом надпочечнике, плазме и печени определяли по методу Ю.А. Панкова и И.Я.Усватовой, в модификации В.Г.Подковкина.
Определяли уровень адреналина в правом надпочечнике.
Нормальное распределение значений оценивалосьс помощью критерия Стьюдента. Различие средних значений в группах сравнивали с помощью стандартного t-критерия Стьюдента. Отличия считали статистически значимыми при p<0,05 [23].
2.2. Результаты исследования и их обсуждение
Проведенные исследования обнаружили понижение функциональной активности коры надпочечников под действием фактора долгосрочной социальной изоляции (рис 2.1). Происходило уменьшение массы желез – надпочечников и тимуса [27]. Действие изоляции полностью снимало напряжение гипоталамо-гипофизарно-надпочечниковой системы, судя по представленным показателям [24]. Выделяющиеся 11-ОКС оказывают угнетающее действие на тимус, что приводит к уменьшению его относительной массы.

Рис. 2.1 Изменение относительной массы желез под действием изоляции
Относительно содержания 11-ОКС в надпочечниках, печени и плазме крови видно уменьшение их концентрации. Это происходит в результате действия долгосрочной социальной изоляции у крыс [27]. Этот фактор оказывает угнетающее воздействие на гипоталамо-гипофизарно-надпочечниковую систему, так как животные, находясь в долгосрочной изоляции, пребывают несвойственных им условиях (рис. 2.2).

Рис. 2.2 Изменение количества 11-ОКС в печени, плазме, надпочечниках в процентах
Необходимо отметить, что наряду с уменьшением содержания 11-ОКС происходило так же и уменьшение концентрации адреналина в надпочечниках у крыс, пребывавших в долгосрочной социальной изоляции (рис. 2.3). Это связано с угнетением функции симпатоадреналовой системы. Происходит истощение и нарушение данных функций [24].
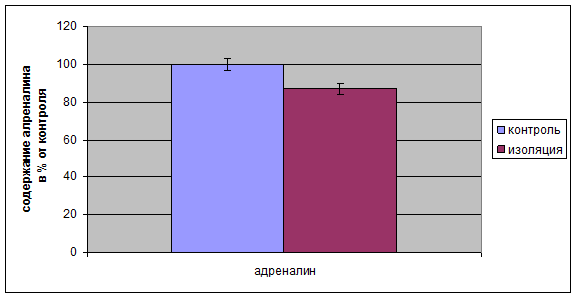
Рис. 2.3 Изменение уровня адреналина в крови крыс, подвергавшихся долгосрочной социальной изоляции.
У контрольных крыс, не подвергавшихся долгосрочной изоляции, данные показатели находятся в пределах нормы по причине отсутствия действий факторов, оказывающих стимулирующее или угнетающее действие на функции симпотоадреналовой системы [27].
ВЫВОДЫ
1. В результате действия долгосрочной социальной изоляции происходит уменьшение массы желез – надпочечников и тимуса.
2. Происходит угнетение функции коры надпочечников, из-за чего уровень 11-оксикортикостероидов у опытных крыс, после воздействия на них социальной изоляции, уменьшился по сравнению с контролем.
3. 35 суток долгосрочной изоляции вызывает угнетение функций симпатоадреналовой системы, вследствие чего происходит уменьшение уровня адреналина в надпочечниках у крыс.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Акоф Р. Л.,Системы, организации и междисциплинарные исследования. В кн.: Исследования по общей теории систем - М.: 1969. 143-144с.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. Москва, медицина 1998 - 200с.
3. Брагина Н.Н., Т. А. Доброхотова. Функциональные ассиметрии человека – М.: Медицина, 1988 – 240с
.
4. Березин Ф.Б., Барлас Т.В. Социально – психологическая адаптация при невротических и психосоматических расстройствах // Журнал невропат. и психиатрии им С.С. Корсакова, 1994. Том. 94. №6. С. 38- 43с.
5. Борневассер М.А. Стресс в условиях труда // Психические состояния. Хрестоматия. – СПб.: Питер, 2000.С. 195 – 214с.
6. Вартанян Г.А., Петров Е.С. Эмоции и поведение. Л: Наука, 1989 - 137с.
7. Виру А.А. Гормональные механизмы адаптации и тренировки – Л.: Наука 1981 – 155с.
8. Водоевич В.П., Витаминокоррекция стресса в клинике внутренних болезней, Учебное пособие, Гродно 2003 – 139с.
9. Власов В.В. Реакция организма на внешние воздействия: общие закономерности развития и методические проблемы исследования. – Иркутск: 1994 – 344 с.
10. Гращеко Н.И. Гипоталамус и его роль в физиологии и паталогии. Издательство «Наука», М.: 1964 – 187с.
11. Григорьян Г.А., Г.Х. Меранова. Индивидуальное поведение при ошибках прогноза подкрепления и неопределенности стреды, Институт высшей нервной деятельности и нейрофизиологии РАН. 2008-150с.
12. Козловский В.Л., Прахье И.В., Санкт-Петербургский научно-исследовательский психоневрологический институт, им. В.М. Вехтерева. Изменение поведения у мышей после субхронического введения фенамина и галопередина. 2005 – 136с.
13. Котенкова Е.В., В.В. Вознесенская. Механизмы изоляции у грызунов: от поведения к рецепторам. Институт проблем экологии и эволюции им. А.Н. Северцева РАН, М.: 2003 – 150с.
14. Калуев А.А. Нейронауки, Медународный научно-практический журнал. 1(3)-2006 – 134с.
15. Кириллов О.И. Стрессовая гипертрофия надпочечников / О.И. Кириллов. – М.: Наука, 1994. – 176с.
16. Лебедев А.А., Русановский В.В., Т.М. Макарова, П.Д. Шабанов, 2005. Институт экспериментальной медецины РАМН. Сравнение внутривидового и индивидуального поведения самок и самцов крыс, выращенных в условиях соц. Изоляции.
17. Подковкин Д.Г., Иванов Д.Г. Влияние краткорсрочной изоляции на поведение крыс в тесте «открытое поле». Самарский государственный университет, Самара. Институт экспериментальной медицины и биотехнологии Самарского государственного медицинского университета, Самара.
18. Роик Р.О., Русановский В.В., Стрельцов В.Ф, Шабанов П.Д., 2004 Российская Военно-медецинская академия, Санкт-Петербург. Оценка эффектов антидепрессантов с разными механизмами действия на модели депересссивноподобного состояния, вызванного социальной изоляцией.
19. Спирин А.С. Молекулярная биология. Москва, «Высшая школа» 1986.
20. Саградян А.Л. – Советская медицина. 1974, №5
21. Судаков К.В. Гипоталамические пейсмейкеры биологических мотиваций как основа формирования алкогольного влечения.
22. Украинцев Ю.В., Чесенокова Т. Т. Индивидуальная склонность к активной либо к пассивной реакции на эмоциональный стресс у лиц с разным уровнем кортизола в крови // Журнал высшей нервной деятельности. 2008. Том. 58. №4. С. 423 – 431.
23. Фролов Ю.П. Математические методы в биологии: ЭВМ и программирование. Самара: Изд- во СамГУ, 1997.
24. Хоничева Н.М., P.Чабак-Горбач, H.A.Крупина. Гетерогенность тревожных состояний (влияние ранней изоляции) у крыс. Институт высшей нервной деятельности и нейрофизиологии РАН, Москва; Медицинская Академия – Университет, Люблин, Польша; Институт общей патологии и патофизиологии РАМН, Москва.
25. Хомская Е.Д., Батова Н.Я. Мозг и эмоции (нейропсихологические исследования). М.: Изд-во МГУ, 1992. С. 6-67
26. Чернышев А.П., В.В Лапа, Бодров В.А. Информационный стресс: Учебное пособие для вузов – М.: ПЕР СЭ, 200-352с
27. Шабанов П.Д., Мещеров Ш.К., Лебедев А.А. Синдром социальной изоляции. СПб.: Элби – СПб, 2004. 208с
28. Шабанов П.Д., Лебедев А.А., Мещеров Ш.К. Нейробиологические механизмы подкрепления, активируемые психостимуляторами и глюкокортикоидами.
29. Baerends G.P. Ethologikal aspecs agonistic behavior//Agress. Behav. 1989. Vol.15. N1/ 38-39
30. Sanjay J. Mathew, M.D.; Jeremy D. Coplan, M.D.; Jack M. Gorman, M.D. American journal of psychiatry Нейробиологическиемеханизмысоциальноготревожногорасстройства. 2001; 158:10, pp. 1558-1567.
|