Реферат.
Дипломная работа на тему: «Биохимические показатели крови человека при сальмонеллезной интоксикации» содержит 46 страниц печатного текста, таблиц, 8 рисунков, 59 использованных источников литературы, из них 10 иностранных.
Перечень ключевых слов: сальмонеллез, перекисное окисление липидов, циркулирующие иммунные комплексы, каталаза, молекулы средней массы, сывороточный альбумин, эндогенная интоксикация.
Объект исследования: сыворотка крови практически здоровых людей и больных сальмонеллезом г. Пензы.
Практическое применение: в здравоохранении.
Список сокращений.
ПОЛ – перекисное окисление липидов;
ЦИК – циркулирующие иммунные комплексы;
ЧСА – человеческий сывороточный альбумин;
МДА – малоновый диальдегид;
ПЭГ – полиэтиленгликоль;
АОС – антиокислительная способность;
АТ – антитело;
АГ – антиген;
ИК – иммунный комплекс;
ЛПС – липополисахаридный комплекс;
МСМ – молекулы средней массы;
ТБК – тиобарбитуровая кислота;
ЭКА – эффективная концентрация альбумина;
ОКА – общая концентрация альбумина;
ТХУ – трихлоруксусная кислота;
ЦНС – центральная нервная система;
ц-АМФ – циклический аденозинмонофосфат;
АФК – активные формы кислорода;
LOOH, HOOH – гидроперекиси;
СОД – супероксиддисмутаза.
Содержание.
Введение………………………………………………………………..
1. Обзор литературы ………………………………………………...
1.1. Биохимическая характеристика интоксикации при сальмонеллезной инфекции…………………………..……..
1.2. Молекулярные механизмы развития эндогенной
интоксикации при сальмонеллезе……………………..…..
1.3. Показатели уровня эндогенной интоксикации
организма при сальмонеллезе……………………………….
2. Материалы и методы исследования………………………….
2.1. Материалы исследования…………………………………….
2.2. Методы исследования…………………………………………
3. Результаты и обсуждение………………………………….……
3.1. Определение показателей уровня интоксикации в
сыворотке крови практически здоровых людей……..
3.2. Определение показателей уровня интоксикации в
сыворотке крови больных сальмонеллезом………….…..
Список использованных источников……………………….…..
Выводы………………………………………………………………….
Приложения…………………………………………………………….
|
5-6
7-19
7-11
11-14
14-19
20-25
20
20-25
26-34
26-27
28-34
35-40
41
42-46
|
Введение
Успехи в борьбе с инфекционными заболеваниями в нашей стране общепризнанны. Вместе с тем в инфектологии еще остаются проблемы, имеющие серьезное социально-экономическое значение для всех стран мира. К их числу относятся острые кишечные инфекционные заболевания [1].
Сальмонеллез – группа острых кишечных инфекционных болезней, вызываемых бактериями рода Salmonella, характеризующихся значительным полиморфизмом клинического течения, частым наличием интоксикации, лихорадки, признаков поражения желудочно-кишечного тракта [2].
Крупные достижения отечественных и зарубежных исследователей, установивших патогенетическое значение нарушения биологической регуляции при острых кишечных инфекциях, дали новый импульс в изучении патогенеза сальмонеллеза [3].
Иммунная система представляет собой сложную многокомпонентную систему из быстроделящихся и покоящихся клеток. Она является высокочувствительной к воздействию токсинов бактерий. Это приводит к нарушению иммунорегуляторных процессов.
Наиболее информативными являются показатели состояний прооксидантно-антиоксидантного равновесия, которое при усилении действия на организм токсинов смещается в сторону активизации ПОЛ, уровня холестерина, ЦИК, Ит, МСМ.
ПОЛ – это фундаментальный универсальный молекулярный механизм, лежащий в основе устойчивости и адаптационных возможностей организма. В норме ПОЛ обеспечивает условие для жизненно важных функций клетки, в случае же интоксикации становится пусковым механизмом патобиохимических изменений в организме человека.
Целью моей дипломной работы является изучение биохимических показателей эндотоксикоза в динамике патологического процесса. В задачи исследования входило:
1. Определение содержания МДА, уровня холестерина, ЦИК, Ит, МСМ и активности каталазы в группе контроля, которую составили практически здоровые люди.
2. Определение содержания МДА, уровня холестерина, ЦИК, Ит, МСМ и активности каталазы у больных сальмонеллезом.
3. Исследование изменения изучаемых показателей у больных в зависимости от степени тяжести заболевания.
1. Обзор литературы
1.1. Биохимическая характеристика интоксикации при сальмонеллезной инфекции
Сальмонеллезы принадлежат к числу инфекционных заболеваний, весьма широко распространенных на всех континентах мира. Возбудителем сальмонеллезов являются микроорганизмы, принадлежащие к роду Salmonella, семейства кишечных Enterobacteriaceae.
Сальмонеллы – это мелкие бактерии вытянутой формы с закругленными концами длиной от 1 до 3 и диаметром 0,5-0,8 нм [4].
Сальмонеллез встречается чаще у жителей городов, чем сел, что связывается с лучшей регистрацией заболеваемости, наличием множественных детских учреждений, широким употреблением пищевых полуфабрикатов. Заболевание отмечается круглый год, но максимальное число регистрируется в теплое время года, что объясняется благоприятными условиями размножения сальмонелл в пищевых продуктах и реализации инфекции [5].
Таблица 1.1.1.
Статистические данные больных сальмонеллезом г. Пензы.
| Год |
Количество больных
г. Пензы
|
На 100 тыс. населения, % |
Кол-во больных Пензенской
области
|
На 100 тыс. населения, % |
| 1996 |
187 |
34,9 |
362 |
23,1 |
| 1997 |
140 |
26,1 |
316 |
20,3 |
| 1998 |
230 |
43,0 |
448 |
28,8 |
В возникновении сальмонеллеза ведущую роль играют живые бактерии, гибель которых в организме больного сопровождается развитием эндотоксинемии. Принято выделять два вида токсичных продуктов жизнедеятельности микробов-экзотоксии и эндотоксии. К экзотоксинам отнесены токсичные продукты жизнедеятельности бактерий, активно (при жизни) секретируемые в окружающую среду, а к эндотоксинам – те ядовитые для макроорганизма продукты жизнедеятельности, которые освобождаются только при лизисе микробной клетки [6].
Кроме токсина палочка имеет ряд антигенов клеточной стенки. О-антиген расположен на поверхности микробной клетки и представляет собой фосфолипидно-полисахаридный комплекс, включающий 60 % полисахарида, 20-30 % липида и 3-4,5 % гексозамина. Н-антиген определяется жгутиками. Поверхностные антигены клеточной стенки провоцируют типоспецифический антительный ответ, а глубинные – видоспецифический [6,7].
При сальмонеллезе развитие и тяжесть симптомов обусловлены интоксикацией и обезвоживанием. По мнению А.Ф. Билибина интоксикация – явление сложное, сводящееся к изменению нервнорефлекторной деятельности и гуморальной регуляции с обменными сдвигами. К.В. Бунин в основу синдрома интоксикации ставит воздействие токсина на :
1) падение артериального давления, снижение сократительной способности миокарда;
2) гормональную регуляцию водно-солевого обмена с изменениями биосинтеза гормонов в коре надпочечников с угнетением процесса их метаболизма;
3) функцию почек (снижение клубочковой фильтрации, повышение канальцевой реабсорбции воды, снижение концентрации очищения мочевины) [8].
Сальмонеллезная интоксикация возникает как результат патологии первичного ответа на инфекционный агент вследствие значительных потерь воды и электролитов с рвотой и жидким стулом. По мере увеличения дефицита воды и электролитов на первый план выступают симптомы обезвоживания и поражения ЦНС. Если процесс прогрессирует, обезвоживание нарастает, появляются признаки недостаточности кровообращения, которые при интоксикации имеют клинику шока. Частая рвота и понос – первые признаки интоксикации [9].
Обязательным условием развития заболевания являются наличие большого количества возбудителей и их токсинов, массовое проникновение антигенов в кровь. Наибольшей токсичностью отличается липид А, вызывающий следующие основные реакции: активацию лейкоцитов и макрофагов, стимуляцию выброса эндогенного пирогена, антогониста глюкокортикоидов, интерферона, интерлейкинов, подавление тканевого дыхания, активацию системы комплемента, тромбоцитов, факторов свертывания крови другие [10,11], [рис. 1.1.1].
Главной причиной развития шока при сальмонеллезе считается не повреждающее действие самих микробов или их токсинов, а своеобразный ответ организма на них. Под токсико-инфекционным шоком следует понимать экстремальное состояние организма, наступающее в результате действия токсичных субстанций возбудителей, патогенных иммунных комплексов на органы и ткани организма, сопровождающееся острым нарушением метаболизма в них [12].
Схематическое изображение липополисахаридов
стенок микробов.
Рис. 1.1.1.
С.А. Степанов с помощью аспирационной биопсии обнаружил в тонкой кишке больных сальмонеллезом изменение эпителия, острое воспаление слизистой оболочки, нарушение микроциркуляции и сосудистой проницаемости. К.Х. Ходжаев в эксперименте на крысах показал, что сальмонеллезная инфекция вызывает нарушение процесов тканевого дыхания и фосфорилирования. Состояние поджелудочной железы изучено Белянской Т.А. В острый период болезни отмечено снижение ферментативной активности панкреатического сока – уровень трипсина был снижен в 71 % случаев, липазы в 55 %, амилазы – в 66 %.
Таким образом эндотоксин вызывает активацию синтеза, преимущественно протеолитических ферментов, задержку экструзии секретируемых проэнзимов, что приводит к секреции и поступлению ферментов в лимфатическое и кровеносное русло [13,14].
При сальмонеллезе развивается обезвоживание, обусловленное потерей внеклеточной жидкости, а при тяжелом течении заболевания и части клеточной. Дегидратация в большинстве случаев имеет изотонический характер, сочетаясь с развитием сгущения крови, дефицитом электролитов, метаболическим ацидозом в капиллярной и венозной крови [15], [рис. 1.1.2].
1.2. Молекулярные механизмы развития эндогенной
интоксикации при сальмонеллезе
Явления интоксикации вызывают заболевания, сопровождающиеся повышенным распадом тканей, усиленными процессами катаболизма, недостаточностью функции печени и почек, снижением процессов микроциркуляции [16].
В ответ на действие первичного патогена, которым являются эндотоксины, сальмонелл, в организме развиваются типовые каскадные реакции, что лежит в основе современной концепции СЭИ.
На Международном симпозиуме в Санкт-Петербурге (1994 г) было дано определение этого синдрома как клинического синдрома с проявлением симптомов интоксикации при патологических состояниях неоднородных по этиологии и обуславливающих накопление в тканях и биологических жидкостях организма продуктов патологического обмена веществ, метаболитов, деструкции клеточных и тканевых структур, разрушения белковых молекул [17,18].
Шано В.П. с соавторами подчеркивает, что токсическое влияние липополисахаридной субстанции эндотоксина проявляется комплексом нарушений, обусловленных повреждением как циркулирующих клеток в кровотоке, так и эндотелиоцитов, эозинофилов, нейтрофилов, макрофагов, следствием чего является выброс в кровоток ряда биологически активных веществ – цитокинов, интерлейкинов. Главной точкой приложения эндотоксина являются эндотелиальные клетки, активация их приводит к высвобождению простациклина, выделению эластазы, токсических метаболитов кислорода, факторов активации тромбоцитов и комплемента с высвобождением терминального комплекса комплемента, брадикинина с последующим формированием синдрома повышенной проницаемости капилляров. Это приводит к тому, что в очаг воспаления начинают входить компоненты крови, прежде всего фибриноген и тромбоциты. Фибрин способствует агрегации тромбоцитов, полимеризации фибрина и – возникновению тромбов. Следствием тромбоза являются нарушения микроциркуляции с последующей гипоксией, что приводит к дальнейшим повреждениям клеток в очаге воспаления. Метаболическим результатом этого является изменение аэробного метаболизма клеток на анаэробный, повышенное продуцирование лактата и протонов, снижение показателей рН [19].
Среди тканевых (клеточных) медиаторов воспаления важное место занимают простагландины. Исходными продуктами для биосинтеза простагландинов являются ненасыщенные жирные кислоты: линолевая, арахидоновая, пентаноевая. Наибольшее значение имеет в организме арахидоновая кислота, которая содержится в фосфолипидах клеточных мембран.
Простагландины вызывают сильное диуретическое и натрийуретическое действие, оказывают разнообразное действие на желудочно-кишечный тракт. Они могут стимулировать и тормозить сокращение и секреторную активность тонкой кишки, тормозят секрецию соляной кислоты слизистой оболочки желудка. Простагландины вызывают секрецию воды и электролитов в просвет кишки, вызывая диарею, повышают концентрацию ц-АМФ в слизистой оболочке тонкой кишки, влияют на прочность и упругость эритроцитарной мембраны [20, 21, 22, 49].
1.3. Показатели уровня эндогенной интоксикации
организма при сальмонеллезе
Анализируя данные литературы за последние десятилетия, можно сказать, что основными показателями интоксикации при сальмонеллезе являются ПОЛ, уровня холестерина, ЦИК, ИТ, МСМ и активность каталазы. При развитии интоксикации на фоне сальмонеллеза происходит активный хемотаксис нейтрофиллов в очаг воспаления, где они поглощая и переваривая чужеродный агент, изменяют свою метаболическую активность, характеризующуюся усилением поглощения кислорода, повышенной утилизацией глюкозы и гиперпродукцией АФК (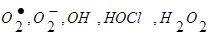 ) [23, 24]. ) [23, 24].
Перекисное окисление является универсальным механизмом взаимодействия кислорода со многими органическими субстратами, в том числе с липидами. Внедрение кислорода в молекулы окисленного субстрата приводит к образованию реакционно-способных промежуточных продуктов – свободных радикалов, гидроперекисей, которые в дальнейшем вызывают повреждение других классов соединений – белков, нуклеиновых кислот, углеводов (рис. 1.3.1).
Метаболизм супероксидного радикала в норме
и при патологии (Владимиров Ю.Я., 1998)
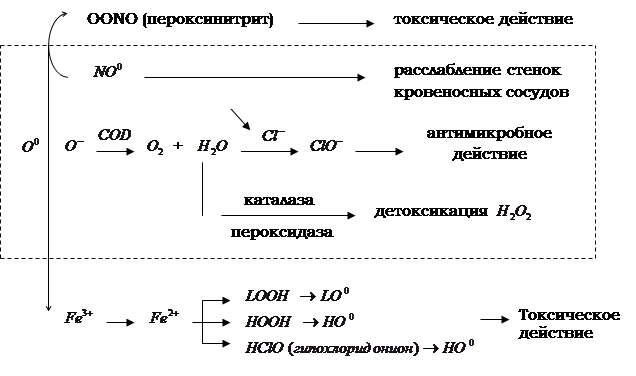
Рис. 1.3.1.
Накопленные к настоящему времени данные литературы позволяют сделать вывод о том, что свободнорадикальное окисление липидов при сальмонеллезной инфекции играет определенную патогенетическую роль [25, 50].
Установлено, что при развитии ПОЛ в биомембранах понижается содержание легкоокисляемых полиненасыщенных жирных кислот и изменяются физико-химические свойства: микровязкость, текучесть, мембранный потенциал, полярность внутренних областей мембран. Таким образом, изменяются транспортные свойства мембраны и активность ферментов [26].
Регуляция свободнорадикального окисления обеспечивается в клетке системой антиоксидантной защиты. Так, накапливающаяся в процессе ПОЛ перекись водорода обезвреживается с помощью каталазы, присутствующей во всех тканях организма. Каталаза (КФ 1.11.1.6.) представляет собой гемсодержащий фермент с молекулярной массой около 250000 Д, локализованный в пероксисомах клеток [27].
Митохондриальная каталаза участвует в оксидазном пути окисления, сопровождающемся запасанием энергии в виде АТФ. Блокирование транспорта электронов в дыхательной цепи приводит к стимуляции пероксисомального окисления. При потологиях, связанных с нарушением энергетических процессов, каталаза пероксисом может выходить из них и участвовать в окислении на мембранах эндоплазматического ретикулума [28, 53].
В работе Л.Б. Оконенко с соавторами о состоянии антиоксидантной системы судили по активности СОД, глутатионпероксидазы и каталазы, анализ данных выявил дефицит антиоксидантов [29, 30].
При инфекционном токсикозе в мембранах эритроцитов резко снижается содержание общих фосфолипидов, но увеличивается количество НЭЖК и лизофосфотидилхолина, что косвенно указывает на повышение активности фосфолилаз, которые избирательно разрушают липиды мембран. Холестерин подвергается как активному, так и пассивному обмену в мембранах эритроцитов [29]. Фермент лецитинхолестеролацил трансфераза превращает эфиры холестерина в свободный холестерин и тем самым регулирует уровень свободного холестерина в плазме, что способствует проникновению его в мембраны. Следовательно, инактивация этого фермента в результате гипоксии при эндотоксикозе ведет к повышению уровня эфиров холестерина в мембранах эритроцитов [31,32].
Наряду с уровнем МДА, активности каталазы и уровня холестерина для диагностики заболевания и его прогноза имеют значение и другие неспецифические показатели – ЦИК, Ит, МСМ.
Синтезирующиеся при формировании иммунитета специфические антитела обладают способностью взаимодействовать с антигенами возбудителей и тем самым вызывать нейтрализацию патогенных микробов и их токсинов. Эта реакция сопровождается образованием иммунных комплексов антиген – антитело [33, 34, 54, 55]. При патологических состояниях образование ИК выходит из под контроля, в результате чего развивается та или иная болезнь ИК [рис. 1.3.2.].
Патогенетические механизмы болезней иммунных
комплексов (Сура В.В., 1987)
Рис. 1.3.2.
В результате развития эндотоксемии при сальмонеллезе организм длительное время контактирует с избытком АГ как экзогенного (компоненты микробных клеток), так и эндогенного (компоненты разрушенных клеток самого организма) происхождения. Вместе с тем наблюдается угнетение системы комплемента, ответственного за лизис микробных клеток. В этих условиях значительного избытка АГ и недостаточности выработки АТ может привести к образованию ИК, которые способны откладываться в определенных тканях и вызывать острые воспалительные реакции. При значительных отложениях наблюдаются функциональные и морфологические повреждения органов и тканей [35].
Связываясь с клеточной мембраной ЦИК вызывают выделение в окружающую среду протеолитических ферментов и основных пептидов. Эти вещества повреждают протеогликановые компоненты тканей, действуют на базальную мембрану и вызывают некроз эндотелиальных клеток [36].
ЦИК наряду с продуктами ПОЛ вызывают нарушение проницаемости мембран, вплоть до их разрыва, что в конечном итоге может привести к гибели клетки. В результате появляются различные вещества пентидной природы. Из них наибольший интерес представляют молекулы средней массы.
Являясь олигопептидами с молекулярной массой 300-5000 Дальтон, они расцениваются как универсальный критерий эндогенной интоксикации и влияют на ее уровень и прогноз [37, 38].
МСМ образуются в организме под воздействием повреждающих эндогенных или экзогенных факторов различного генеза, являются промежуточными продуктами протеолиза. [39, 57].
Пристальное внимание исследователей к МСМ объясняется высокой биологической активностью их отдельных фракций, которые ингибируют гликолиз, глюконеогенез, пентозный цикл, синтез гемоглабина, нуклеиновых кислот, мембранный транспорт, дагоцитов, эритропоэз, микроциркуляцию, обладают иммунодепрессивным, цитотоксическим, нейро- и психотропным свойствами. Сейчас, квалификационная оценка степени тяжести состояния больных при сальмонеллезе немыслима без определения МСМ [40].
Установлено, что значительная часть циркулирующих в крови СМ не только растворена в плазме крови, но и связана с альбумином.
Человеческий сывороточный альбулин (ЧСА) – важнейший транспортный белок, осуществляющий перенос эндогенных метаболитов и ксенобиотиков в плазме крови, межклеточной жидкости, в лимфе.
Универсальность транспортной функции ЧСА обеспечивается его уникальной способностью связывать лиганды различной химической природы. Интенсивная лигандная нагрузка молекул альбулина приводит к изменению их структуры и связывающей способности. Такие модификационные формы ЧСА обнаруживаются при патологии [41].
О величине токсического действия вредных веществ можно судить по ЭКА, которая снижается после того, как токсические вещества займут центры связывания в молекуле альбулина, что приводит к снижению детоксикационных свойств организма. Изучение свойств альбулина является важным с точки зрения как диагностики, так и лечения [42].
2. Материалы и методы исследований
2.1. Материал исследований
Уровень интоксикации оценивался по изменениям в крови больных эффективной и общей концентраций сывороточного альбулина, малонового диальдегида, как одного из продуктов ПОЛ, уровня холестерина, ЦИК, МСМ и активности каталазы.
Для всех исследований бралась сыворотка крови. Исследовано 30 больных сальмонеллезом в возрасте от 17 до 46 лет. Для контроля набиралась группа 51 человека разного пола в возрасте от 20 до 46 лет.
Кровь бралась из локтевой вены, преимущественно натощак в количестве не менее 5 мл. Центрифугируем 1500 об/мин 10 минут. Для выполнения анализов сыворотки необходимо использовать сразу или заморозить и хранить при t=-20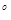 С. С.
2.2. Методы исследований
2.2.1. Определение МДА с тиобарбитуровой кислотой
(Конюхова В.С., 1989)
Об изменении интенсивности ПОЛ судим по изменению уровня вторичного продукта ПОЛ – малонового диальдегида.
Метод основан на том, что при высокой температуре в кислой среде МДА реагирует с 2-ТБК, образуя окрашенный розовый триметиновый комплекс с максимумом поглощения при 535 им.
Ход работы: К 0,2 мл сыворотки крови добавить 0,2 мл дистиллированной воды, 1 мл 0,6 % ТБК в ледяной уксусной кислоте. Кипятить 30 минут, охладить и добавить 1 мл 5№ КОН и 2 мл изопропанола. Центрифугируют при 6000 об/мин 20 минут. Колориметрируют при 535 нм и 580 нм против контроля, содержащего вместо плазмы воду.
Расчет: 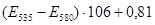 (мкМоль/л), где Е – оптическое поглащение изопропилового экстракта; 106 – коэффициент пересчета оптической плотности. (мкМоль/л), где Е – оптическое поглащение изопропилового экстракта; 106 – коэффициент пересчета оптической плотности.
Пример расчета: больной Максимов С., 19 лет
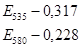
концентрация МДА = 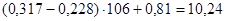 (мкМоль/л). (мкМоль/л).
2.2.2. Определение активности каталазы
(Королюк М.А., 1988)
Метод основан на способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс.
Ход определения: Реакция запускается добавлением 0,1 мл сыворотки крови к 2 мл 0,03 % раствора перекиси водорода. В холостую пробу вместо сыворотки вносят 0,1 мл дистиллированной воды. Реакцию останавливают через 10 минут добавлением 1 мл 4% молибдата аммония. Интенсивность окраски измеряют на спектрофотометре при длине волны 410 нм против контрольной пробы, в которой вместо перекиси водорода вносят 2 мл воды.
Расчет: 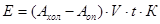 (мкат/л), где (мкат/л), где
Е – активность каталазы в мкат/л;
А – оптическая плотность холостой и опытной проб;
V – объем вносимой пробы, 0,1 мл;
t – время инкубации, 600 сек;
К – коэффициент миллимолярной экстинкции перекиси водорода, равный 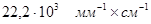 . .
За единицу активности каталазы принимают то количество фермента, которое участвует в превращении 1 мкат перекиси водорода за 1 секунду при заданных условиях. Расчет активности каталазы ведут на 1 л сыворотки крови.
Пример расчета: больной Крайнов Т.В., 31 год.
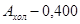
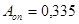
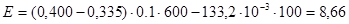 (мкат/л) (мкат/л)
2.2.3. Определение общего холестерина в сыворотке крови ферментативным методом «Фотокол»
(Творогова М.Г., 1995)
Определение основано на сопряженных реакциях, которые катализирует холестеринэстераза, холесериноксидаза и пероксидаза:
Эфиры холестерина 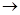 холестерин + Ж.К.; холестерин + Ж.К.;
Холестерин + О2
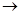 холестинон + Н2
О2
; холестинон + Н2
О2
;
Н2
О2
+ хромогены 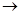 Н2
О + окрашенный продукт. Н2
О + окрашенный продукт.
Концентрация образующегося в ходе реакции окрашенного продукта пропорциональна концентрации холестерина в пробе.
Ход определения: Рабочий реагент обязательно вносить в пробирки после проб, содержащих холестерин. Пробирки встряхнуть и инкубировать при t = 37o
С. Через 10 минут после начала инкубации пробирки повторно встряхнуть и инкубировать 20 минут при t = 37o
С. Окрашенные пробы фотометрировать при 500 нм в кювете с длиной оптического пути 5 мм или 10 мм относительно холостой пробы. Окраска стабильна в течении двух часов при комнатной температуре.
Концентрацию холестерина в исследуемых пробах рассчитать по формуле:
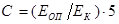 ммоль/л, где ммоль/л, где
ЕОП
и ЕК
– оптические плотности исследуемой пробы и пробы с калибратором.
Норма: 3,62 – 5,2 ммоль/л.
2.2.4. Определение циркулирующих иммунных комплексов
в крови методом ПЭГ-теста (Гриневич Ю.А., 1988)
Метод основан на селективной преципитации комплексов АТ-АГ в 3,75 % ПЭГ (полиэтиленгликоля) с последующим определением плотности преципитата.
Реактивы:
1) 0,1 м боратный буфер (3,410 г борной кислоты, 4,275 г буры растворить в 1 л дистиллированной воды)
2) 10 г полиэтиленгликоль – 6000 ед. растворить в 240 мл буфера.
Ход определения: К 0,3 мл сыворотки крови добавить 0,6 мл реактива №1, перемешать и перенести по 0,3 мл в 2 пробирки. В I добавить 2,7 мл раствора №1 (контроль). Во II добавить 2,7 мл раствора №2 (опыт). Перемешать, инкубировать в течение 60 минут при комнатной температуре. На спектрофотометре (КФК-3) определяют оптическую плотность в кюветах 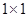 при 450 нм. при 450 нм.
Расчет: Высчитывают разность показателей оптической плотности, результат умножают на 1000 и получают количество ИК в 100 мл сыворотки. Ответ выражают в единицах оптической плотности. 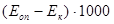 - количество ЦИК в 100 мл сыворотки. - количество ЦИК в 100 мл сыворотки.
Норма: 54,24 + 2,03 усл. ед.
Пример расчета: больной Максимов С.И., 19 лет.
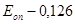
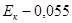
Количество ЦИК в 100 мл сыворотки:
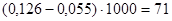 усл. ед. усл. ед.
2.2.5. Определение уровня МСМ в крови (Габриэлен Н.И., 1984)
Метод основан на осаждении белков из исследуемой жидкости 10 % раствором ТХУ с последующем центрифугированием и определением абсорбции света супернатантом в 10 раз разведенным дистиллированной водой.
Ход работы: Сыворотку крови обрабатывают 10 % раствором ТХУ. В качестве контроля лучше использовать сам раствор ТХУ в 30 раз разведенный дистиллированной водой. Оптическая плотность его против воды составляет 0,123±0,012 усл. ед. на волне 254 нм при 23-25 С. Центрифигируем 3000 об/мин в течение 30 минут. К 0,5 мл надосадочной жидкости +4,5 мл дистиллированной воды. Измерение проводим на спектрофотометре в УФ свете при 280 нм для определения ароматических аминокислот и при длине волны 254 нм для определения нуклеотидов. Уровень МСМ выражают в единицах, количественно равных показателям экстинции. С. Центрифигируем 3000 об/мин в течение 30 минут. К 0,5 мл надосадочной жидкости +4,5 мл дистиллированной воды. Измерение проводим на спектрофотометре в УФ свете при 280 нм для определения ароматических аминокислот и при длине волны 254 нм для определения нуклеотидов. Уровень МСМ выражают в единицах, количественно равных показателям экстинции.
2.2.6. Определение показателей «эффективная концентрация
альбумина» и «общая концентрация альбумина» в сыворотке крови человека флуоресцентным методом
(Миллер Ю.И., 1994).
Принцип метода:
Метод основан на специфическом взаимодействии флуоресцентных органических соединений с альбумином в сыворотке крови. В зависимости от условий этого взаимодействия интенсивность флуоресценции красителя из альбумина отражает различные свойства белка. Индекс ЭКА/ОКА не зависит от числа молекул альбумина в пробе и характеризует физико-химические свойства молекулы альбумина.
Состав набора:
Реактив I (4 ампулы по 5 мл). Предназначен для приготовления раствора используемого при разбавлении сыворотки крови. Он содержит антикоагулянт ЭДТА.
Реактив II (4 ампулы по 0,7 мл). Основным компонентом является специальное флуоресцирующее соединение, интенсивность флуоресценции которого в сыворотке крови пропорциональна концентрации сывороточного альбумина.
Реактив III (4 ампулы по 0,7 мл). Взаимодействие реактивов №2 и №3 с сывороткой позволяет определить ОКА.
Определение показателя ЭКА:
К 2,0 мл надосадочной жидкости добавить 0,025 мл реактива 2. Перемешать. Измерить интенсивность флуоресценции при длине волны возбуждения 420 нм и длине волны испускания 515 нм.
Определение показателя ОКА:
В ту же пробу добавить 0,025 мл реактива 3. Перемешать. Измерить интенсивность флуоресценции. Нормальные величины показателя ЭКА лежат в интервале нормальных значений ОКА от 40 г/л – 55 г/л.
Подготовка образцов крови к измерениям:
Буферный раствор: Содержимое ампулы с реактивом 1 перенести в 100 мл дистиллированной воды. Перемешать. 0,025 мл сыворотки крови добавить в пробирку, содержащую 5 мл раствора для разбавления крови. Для анализа берут жидкость 2,0 мл полученного образца.
Используют специализированный анализатор АКЛ-0,1.
3. Результаты исследования и их обсуждение
3.1. Определение показателей уровня интоксикации
в сыворотке крови практически здоровых людей
Нами было произведено исследование биохимических показателей – МДА, активность каталазы, уровень холестерина, ЦИК, МСМ, Ит в сыворотке крови 51 донора в возрасте от 20 до 46 лет. Сыворотка крови доноров была получена на ОСПК (областная станция переливания крови) г. Пензы.
Полученные результаты биохимических анализов были подвергнуты статистической обработке, согласно методам и приемам статистического анализа.
По данным комитета экспертов Международной федерации клинической химии по референтным величинам рекомендуется верхняя и нижняя границы нормы на уровне М±1,96σ, состояние предболезни М±2σ, состояние острой формы М±3σ.
Об уровне процессов ПОЛ судили по концентрации вторичного продукта МДА. Содержание количества МДА составляет 3,61±0,07 мкМоль/л. Это значение близко к данным, найденным в литературе (табл. 3.1.1). У 48 человек значение содержания МДА входит в границы М±1,96σ. У 3 человек (5 %) содержание МДА соответствует значению М±2σ, что соответствует состоянию предболезни.
Активность каталазы у практически здоровых людей составила 16,7±0,15 мкат/л (табл. 3.1.1). При исследовании активности каталазы в группе доноров отклонений за пределы М±1,96σ мы не наблюдали.
Уровень холестерина, определяемый нами у практически здоровых людей составил 4,45±0,68 ммоль/л (табл. 3.3.1.), показатели уложились в границу референтной величины М±1,96σ.
Содержание ЦИК, определяемое нами в сыворотке крови практически здоровых людей составило 52,62±3,52 усл. ед. (табл. 3.1.1). 94 % людей по показателям ЦИК входит в границы нормы, а 6% находятся в состоянии предболезни.
Уровень МСМ у обследованных доноров в среднем составил 0,280±0,01 усл. ед. Это значение близко к данным, найденным в литературе (табл. 3.1.1). При исследовании МСМ отклонений за пределы М±1,96σ мы не наблюдаем.
У практически здоровых людей определена детоксикационная нагрузка сывороточного альбумина, т.е. определение общей и эффективной концентрации альбумина. Токсичность по альбумину составляет 0,13±0,01 усл. ед. (табл. 3.1.1). Все значения токсичности по альбумину вошли в границы М±1,96σ.
Полученные нами данные не имели существенных отличий от значений этих показателей, имеющихся в литературе в сравнении с приложением 2.
Таблица 3.1.1.
Содержание биохимических показателей в сыворотке крови практически здоровых людей
Группа
обследованных
|
n |
МДА
мкМоль/л
|
Активность
каталазы
мкат/л
|
ЦИК
усл. ед.
|
МСМ
усл. ед.
|
Ит
усл. ед.
|
Холестерин
ммоль/л
|
Практически
здоровые
|
51 |
3,61±0,07 |
16,7±0,15 |
52,62±3,52 |
0,28±0,01 |
0,13±0,01 |
4,45±0,68 |
3.2. Определение показателей уровня интоксикации
в сыворотке крови больных сальмонеллезом
Сыворотка крови больных исследовалась на базе центра госсанэпиднадзора г. Пензы. Исследования биохимических показателей велись в острую фазу заболевания и в период ранней реконвалесценции. Обследовано нами 30 больных сальмонеллезом в возрасте от 17 до 46 лет, с целью установления показателей, характеризующих эндотоксикоз: перекисное окисление липидов, уровень холестерина, Ит по сывороточному альбумину, циркулирующих иммунных комплексов, молекул средней массы и активности каталазы. Причем биохимические показатели крови в разгар заболевания отличались от показателей в период ранней реконвалесценции.
Таблица 3.2.1.
Биохимические показатели сыворотки крови
у больных сальмонеллезом
Группа
обследованных
|
МДА
мкМоль/л
|
Активность
каталазы
мКат/л
|
Ит
усл. ед.
|
ЦИК
усл. ед.
|
МСМ
усл. ед.
|
Холестерин ммоль/л |
Контроль, n=51 (практически
здоровые)
|
3,61±0,07 |
16,7±0,15 |
0,13±0,01 |
52,62±3,52 |
0.280±0,01 |
4,45±0,68 |
| Больные (острый период) n=30 |
7,19±0,2 |
13,09±0.16 |
0,29±0,01 |
100,63±4,04 |
0,550±0,02 |
6,54±0,07 |
Больные (ранняя
реконвалесценция) n=30
|
3,87±0,15 |
15,84±0,19 |
0,15±0,01 |
68,9±2,8 |
0,310±0,02 |
4,65±0,7 |
| р≤0,001 |
р≤0,01 |
р≤0,001 |
р≤0,001 |
р≤0,05 |
р≤0,01 |
Так, в ходе исследования выявлено достоверное увеличение количества МДА в сыворотке крови больных сальмонеллезом на 99 % по отношению к контролю, т.е. возрастает в 2 раза. Данные наших исследований подтверждаются сведениями Л.Б. Оконенко, Л.Д. Мартыненко и другими. По данным этих авторов концентрация МДА при сальмонеллезе возрастает в 2-2,5 раза.
Как видно из таблицы (табл. 3.2.1), у больных наблюдается интенсификация ПОЛ.
Под воздействием сальмонеллезного токсина происходит нарушение липидных бислоев клеточных и субклеточных мембран. Накопление в крови первичных и вторичных продуктов ПОЛ идет не в силу количественных изменений в содержании фосфолипидов плазмы крови, а вследствие интенсификации их свободнорадикального окисления. Результатом инициации ПОЛ становится образование критических концентраций продуктов ПОЛ, которые токсичны для организма. Известно, что повышение ПОЛ может приводить к нарушению проницаемости мембран с последующей инактивацией мембранно-ассоциированных ферментных систем, выходом лизосомальных гидролаз в цитозоль, что вызывает повреждение ДНК т другие существенные изменения в структуре и функциональном состоянии клетки [29, 43, 51, 52].
Установлено, что при ряде инфекционных заболеваний развивается антиоксидантная недостаточность. Одновременно снижается актиность ферментов антиоксидантной защиты, в частности каталазы [44].
По нашим наблюдениям, активность каталазы снизилась на 22 % в острый период заболевания по отношению к контролю. В период ранней реконвалесценции показатель активности каталазы приближается к контролю (табл. 3.2.1).
Л.Б. Оконенко, Л.И. Волкова в своих работах отмечает угнетение каталазной активности. В острый период заболевания происходит резкое сокращение антиоксидантной обеспеченности организма [26, 29].
А.С. Волков указывает на то, что в процессе эндотоксикации метаболические расстройства приводят к гиперлипидемии. Это подтверждается данными наших наблюдений. Так, уровень холестерина в сыворотке крови больных сальмонеллезом в среднем составил 6,54±0,07 ммоль/л, что на 46,9% больше контроля (табл. 3.2.1).
Таким образом, гиперхолестеринемия характеризует патологию обмена липидов и липопротеидов [32,45].
В период ранней реконвалесуценции уровень холестерина приближается к контролю [рис. 3.2.1].
Процентное соотношение показателей липидного обмена при эндотоксикозе, вызванном сальмонеллезной инфекцией
Рис. 3.2.1.
Анализируя результаты проведенных исследований, мы установили, что содержание ЦИК в плазме крови больных сальмонеллезом на 91 % больше, чем в контроле [рис. 3.2.2]. Полученные данные согласуются с выводами исследования И.А. Ильинского, Т.В. Лукинской и других. Повышенное содержание ЦИК говорит о снижении антителообразования в присутствии избытка антигенов. В подобной ситуации ЦИК индуцирует острое иммунное воспаление, сопровождающееся повреждением эндотелия сосудов и почечных клубочков, активацией кининовой системы, что ведет к более серьезным метаболическим нарушениям [46, 47, 48].
Как правило, повышение уровня ЦИК обнаруживается уже в начальный период болезни, на этом же уровне содержание их остается и в острую фазу. Только в стадии реконвалесценции наблюдается понижение показателей [табл. 3.2.1].
Процентное соотношение показателей эндотоксикоза (ЦИК, МСМ) в сыворотке больных относительно контроля
Рис. 3.2.2.
При воспалении воздействие протеиназ на протеогликановые комплексы тканей приводит к образованию пула токсических веществ со среднемолекулярной массой (МСМ).
У обследованных нами больных сальмонеллезом уровень МСМ на 96 % выше по сравнению с контролем (рис. 3.2.2). По нашим данным содержание МСМ при сальмонеллезе повысилось в 1,9 раза, что согласуется с данными исследований Б.С. Нагаева и М.И. Габриловича. В наших исследованиях уровень МСМ повышается в разгар заболевания [табл. 3.2.1].
Как указывают многие авторы повышение уровня МСМ является неблагоприятным признаком. Объясняется это тем, что отдельные фракции МСМ обладают различной биологической активностью: ингибируют эритропоэз, угнетают синтез гемоглобина, ДНК, глюконеогенез, изменяют проницаемость мембран, нарушают тканевое дыхание и микроциркуляцию. Поэтому, среди широкого круга метаболитов, оказывающих токсическое действие, интегральным показателем эндотоксикоза считают уровень МСМ [39, 40, 48, 56].
Важное звено в системе детоксикации организама представляет альбулин, поскольку он переносит к гепатоцитам эндогенные метаболиты.
Эффективная концентрация альбулина при сальмонеллезе снижается, т.к. токсические вещества занимают центры связания в молекуле альбулина. Следовательно, связывающая способность альбулина может служить критерием общей интоксикации организма. Загруженность альбулина метаболитами дает информацию об эффективности функционирования печени и почек – основных детоксирующих органов человека [41, 42].
В результате наших исследований ЭКА в острый период заболевания составила 42,3±2,87 (г/л), в период ранней реконвалесценции 43±2,16 (г/л). Содержание ОКА в острую фазу заболевания составляет 54,5±3,52 (г/л), в период ранней реконвалесценции 50±3,8 (г/л) [прилож. 6,7].
Снижение ЭКА ведет к повышению коэффициента токсичности. Было установлено, что индекс токсичности у больных сальмонеллезом возрастает на 123 % по сравнению с контролем [рис. 3.2.3]. По нашим данным уровень Ит в острую фазу заболевания повысился в 2,3 раза [табл. 3.2.1].
На основании проведенных исследований можно сделать следующее заключение: у больных сальмонеллезом происходят интенсификация ПОЛ и угнетение иммунитета, снижение антиоксидантной защиты и детоксикационной способности организма.
Определение индекса токсичности по сывороточному
альбулину в сыворотке крови больных
сальмонеллезом
Рис. 3.2.3.
Таким образом, в наших исследованиях мы установили, что при сальмонеллезе уровень показателей ПОЛ, уровень холестерина, Ит, ЦИК, МСМ повышается, что согласуется с данными, имеющимися в литературе [рис. 3.2.4]. В исследуемой нами группе больных наиболее информативными показателями являются МДА, Ит, МСМ.
Выводы
Список литературы
1. Покровский В.И., Килессо А.В., Ющук Н.Д. Сальмонеллезы, результаты и перспективы их научных исследований // Советская медицина. – 1994. - №5. – С. 3-8.
2. Будагян Ф.Е. Пищевые токсикозы, токсиноинфекции, их профилактика. – М.: Медицина, 1989. – 207 с.
3. Покровский В.И. Острые кишечные инфекции // Советская медицина, 1989. - №5. – С. 6-13.
4. Тимаков В.Д., Петровская В.Г. Биологические и генетические характеристики рода salmonella. – М.: Медицина, 1990. – 293с.
5. Бунин К.В. Пищевые токсикоинфекции. – М.: Медицина, 1989. – 302 с.
6. Бойченко М.Н. Сальмонеллез: Распространение возбудителя в организме // Журнал микробиологии и эпидемиологии, 1991. - №5. – С. 9-13.
7. Мельников В.И., Гимранов М.Г. Ферменты патогенности и токсины бактерий. – М.: Медицина, 1995. – 252с.
8. Бунин К.В., Бродов Л.Е. О возможности возникновения инфекционно-токсического шока при сальмонеллезе // Терапевтический архив, 1995. - №8. – С. 27-32.
9. Пак С.Г., Гурьянов М.Х., Пальцев М.А. Сальмонеллез. – М.: Медицина, 1990. – 304с.
10. Кац Л.Н., Зигангирова Н.А. Жирнокислотный состав ЛПС бактерий рода salmonella // Журнал микробиологии и эпидемиологии. – 1990. - №7. – С. 35-38.
11. Вертиев Ю.В. Бактериальные токсины: Биологическая сущность и происхождение // Журнал микробиологии и эпидемиологии. – 1996. - №3. – С. 43-46.
12. Mannel D.N., More R.N. Endotoxinin – duced tumor cytotoxic factor //Jn. Microbiology. – 1990. – Р. 141.
13. Ющук Н.Д., Тендетник Ю.М. Патогенез сальмонеллезов// Советская медицина. - 1991. - №8. - С. 77-82.
14. Бунин К.В. Основы патогенетической иммунологии инфекционных болезней// Клиническая медицина. - 1990. - №3. - С.9-13.
15. Малов В.А., Пак С.Г. Медико-биологические аспекты проблемы интоксикации в инфекционной патологии // Терапевтический архив. - №1. - 1992. - С. 7-12.
16. Аркамов В.А., Межирова И.М., Ткачук З. А. Патофизиологические аспекты эндогенной интоксикации при кишечной инфекции // Анестезиология и реаниматология. - 1990. - №5. - С. 28-32.
17. Кузнецов Н.Н., Девайкин Е.В., Егоров В.М. Синдром эндогенной интоксикации при критических состояниях организма, новые диагностические и прогностические возможности //Анестезиология и реаниматология. - 1996. - №6. - С. 21-27.
18. Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник Российской академии медицинских наук. - 1998. - №7. - С. 43-57.
19. Шано В.П., Гюльмамедов Ф.И., Нестеренко А.Н. Варианты лечения критических состояний с учетом патогенеза SIRS-синдрома системного воспалительного ответа //Анестезиология и реаниматология. - 1997. - №6. - С. 48-52.
20. Юркив В.А. Эндогенные простагландины и их роль в механизме развития диареи //Простагландины в эксперименте и клинике. – 1990. - №5. - С. 176-177.
21. Марков Х.М. Современное учение о простагландинах //Патофизиология. - 1990. - №5 - С. 13-15.
22. Шубич М.Г., Авдеева М.Г. Медиаторные аспекты воспалительного процесса //Архив патологии. - 1997. - №2 - С. 3-8.
23. Ерин А.И. Механизмы ПОЛ. Запуск и регуляция //Бюллетень экспериментальной биологии и медицины. - 1994. - Т.118. -№10. - С. 343-348.
24. Мамонтова Н.С. Инициирование ПОЛ в сыворотке крови //Клиническая медицина. - 1992. - №6. – С. 37-40.
25. Бурлакова Е.Б., Храпова И.Г. Перекисное окисление липидов мембран и природные антиоксиданты // Успехи химии. – 1990. - №9. – С. 1540-1557.
26. Волкова Л.И., Бондаренко М.И. Перекисное окисление липидов и механизм антиоксидантного действия // Врачебное дело. – 1991. - №12. – С. 35-38.
27. Бенина Н.Ф., Чеганова М.И. Активность окислительно-восстановительных ферментов у больных с хроническими воспалительными заболеваниями // Клиническая медицина. – 1989. - №1. – С.17-22.
28. Ахмедов Д.Р. Клинико-патогенетическое значение антиоксидантной системы при инфекционных заболеваниях // Иммунология. – 1994. - №2. – С. 25-27.
29. Оконенко Л.Б. Перекисное окисление липидов при сальмонеллезе // Журнал микробиологии и эпидемиологии. – 1994. - №6. – С. 55-58.
30. Махмудов О.С., Исматуллаев О.Ш. Клиническая эффективность применения витамина Е в лечении сальмонеллеза // Клиническая диагностика. – 1990. - №6. – С.93-95.
31. Титов В.Н., Творогова М.Г., Никитин С.В. Холестерин сыворотки крови: методические аспекты и диагностическое значение // Клиническая диагностика. – 1992. - №3. – С.45-51.
32. Курашвили Л.В., Волков А.С. Прогностическая значимость определения холестерина во фракции липопротеидов высокой плотности // Клиническая диагностика. – 1993. - №3. – С.5-8.
33. Лященко Ю.И., Трихлеб В.И. Циркулирующие иммунные комплексы при инфекционных заболеваниях // Советская медицина. – 1991. - №1. – С. 27-29.
34. Вельбри А.Л. Одновременная оценка уровня иммунных комплексов и иммуноглобулинов для характеристики патологического процесса // Лабораторное дело. – 1990. - №5. – С. 7-18.
35. Виноградова Т.В., Капелько М.А. Взаимосвязь между уровнем ЦИК и функциональным состоянием фагоцитирующей системы // Иммунология. – 1991. - №5. - С. 63-66.
36. Сура В.В., Масонов Е.Л., Борисов Н.А. Клинико-патогенетические закономерности развития болезней иммунных комплексов // Терапевтический архив. – 1987. - №12. – С. 3-10.
37. Владыка А.С., Левицкий Э.Р., Поддубная Л.П. Средние молекулы и проблема эндогенной интоксикации при критических состояниях различной этиологии // Анестезиология и реаниматология. – 1990. - №1. – С. 37-41.
38. Николайчик В.В., Кирковский В.В., Лобачева Г.А. «Средние молекулы» - образование и способы определения // Лабораторное дело. – 1989. - №8. – С. 31-33.
39. Киреев С.С., Багмут Т.А., Курочкин М.Ю. Определение тяжести эндотоскикоза при критических состояниях организма // Педиатрия. – 1990. - №6. – С.107-109.
40. Владыка А.С., Беляков И.А. Диагностическое значение уровня МСМ в крови при оценке тяжести эндотоксинемии // Вестник хирургии. – 1989. – №8. – С. 126-129.
41. Иванов А.И., Сарнацкая В.В., Короленко Е.А. Модификация лигандной нагрузки и структуры сывороточного альбулина человека при различных методах выделения // Биохимия. – 1996. – т. 61. – вып.№5. – С. 903-912.
42. Миллер Ю.И., Добрецов Г.Е. Молекулярные основы флюоресцентного метода определения связывающей емкости альбулина сыворотки крови // Биохимия. – 1994. - №5. – С.20-28.
43. Мартыненко Л.Д., Шепелев А.П. Перекисное окисление липидов при экспериментальной сальмонеллезной инфекции // Журнал Микробиологии и эпидемиологии. – 1990. - №4.– С.7-10.
44. Чудинова В.В., Алексеев С.М. Перекисное окисление липидов и механизм антиоксидантного действия // Биоорганическая химия. – 1994. - №10. – т. 20. – С. 1029-1047.
45. Творогова М.Г. Степень достоверности однократного определения холестерина (обзор литературы) // Клиническая диагностика. – 1997. - №1. – С. 4-5.
46. Ильинский И.А., Лукинская Т.В. Циркулирующие иммунные комплексы при сальмонеллезе // Иммунология. -–1994. - №4. – С. 105-108.
47. Фролов В.М., Ющук И.Д. Иммунный статус больных сальмонеллезом // Иммунология. – 1992. - №10. – С. 108-112.
48. Нагаев Б.С., Габрилович М.И., Кимова И.А. Содержание среднемолекулярных пептидов в плазме крови больных сальмонеллезом // Инфекционные болезни. – 1996. - №6. – С. 12-17.
49. Field M., Musch M.W. Role of prostaglandins in regulation of instestional elektrolyte transport // Prostaglandins. – 1991. – vol.21. – P. 73-80.
50. Jaya P.S., Agstine J., Menon V.P. Roll of lipid peroxides, glutathione and antiperoxidative erzymes in alcohd and drus toxicity // Exp. Biol. Jndian J. – 1993. - №5. – P. 453-459.
51. Praper H.H., Sgvires E.J., Agarwal S., Hadley M. A comporative evalution of thiobarbituric acid methods for the determination of malondialdehyde in biological materials // Free. Radic. Biol. Med. – 1993. - №4. – P. 353-363.
52. Anderson D., Phillips B.T. Schemere P. The effect of variovus antioxidants and other modifying agents on oxygen radical generated DNA famage in human lymphucytes in the comet assay // Environ. and Mol. Mutagenes. – 1994. – 23. Suppl n.23. – P. 2-8.
53. Desharer David, Wood Gwendolyn E., Friedman Richard L. Mollecular characterirution of catalase from Bortetella pertussis: Jdentification of the Kat A promot er in an upstream insertion seguence // Mol. Microbiol. – 1994. – №1. – P. 123-130.
54. Cheigton W.D., Zambent P.H., Mischer P.A. Circulationg immune complexes in infections diseases // Jmmunol. – 1993. – v.111. – P. 1219-1227.
55. Webster David M., Rees Anthohy R. Antibody – antigen interactions // Curr. Opinion struct. Biol. – 1994. - №1. – P. 123-129.
56. Schimuzu T., Kondo R. A method for the detection of Medium – sized molecules //Anch. Biochem. – 1991. – vol. 206. – P. 271-276.
57. Bannet E.V. Chia D., Restivo C. et al. – peptides of the “middle molecules” group // Analyt. Biochem. – 1994. – vol. 86. – P.271-278.
ПРИЛОЖЕНИЕ
Приложение 1.
Биохимические показатели крови
практически здоровых людей,
n
=51.
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
МДА (мкМоль/л) |
ЦИК
(усл. ед.)
|
Уровень холестерина
ммоль/л
|
Активность каталазы |
МСМ
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 1 |
К. В. И. |
35 |
Ж |
5.02.98. |
3,59 |
30 |
3,47 |
19,4 |
0,358 |
| 2 |
К. Б. А. |
39 |
М |
5.02.98. |
3,62 |
30 |
4,95 |
17,2 |
0,225 |
| 3 |
У. С. Б. |
29 |
М |
15.02.98. |
2,18 |
45 |
3,54 |
16,1 |
0,352 |
| 4 |
И. И. И. |
31 |
Ж |
17.02.98. |
3,6 |
60 |
5,188 |
16,8 |
0,214 |
| 5 |
К. В. Л. |
34 |
М |
17.02.98. |
3,48 |
100 |
4,90 |
17,1 |
0,287 |
| 6 |
М. В. В. |
40 |
М |
17.02.98. |
4,6 |
69 |
3,915 |
15,8 |
0,254 |
| 7 |
С. П. Б. |
40 |
М |
25.02.98. |
3,59 |
40 |
4,056 |
16,6 |
0,269 |
| 8 |
Л. Е. В. |
32 |
М |
25.02.98. |
3,47 |
30 |
5,047 |
15,7 |
0,362 |
| 9 |
Г. Т. Ю. |
28 |
Ж |
15.03.98. |
4,65 |
76 |
5,141 |
16,2 |
0,261 |
| 10 |
А. И. А. |
28 |
Ж |
16.03.98. |
3,53 |
34 |
5,188 |
16,9 |
0,253 |
| 11 |
Л. Л. Я. |
40 |
Ж |
16.03.98. |
4,00 |
99 |
3,77 |
17,4 |
0,357 |
| 12 |
С. Б. И. |
46 |
Ж |
19.03.98. |
3,45 |
70 |
3,33 |
18,2 |
0,167 |
| 13 |
С. И. В. |
28 |
Ж |
16.04.98. |
3,48 |
35 |
3,49 |
16,3 |
0,253 |
| 14 |
М. А. И. |
31 |
М |
16.04.98. |
3,54 |
61 |
3,40 |
14,5 |
0,256 |
| 15 |
Х. А. И. |
37 |
М |
22.04.98. |
4,47 |
30 |
4,24 |
16,1 |
0,268 |
| 16 |
К. И. П. |
30 |
М |
22.04.98. |
3,59 |
34 |
3,91 |
16,4 |
0,377 |
| 17 |
Р. И. И. |
33 |
М |
22.04.98. |
4,35 |
110 |
5,14 |
17,3 |
0,245 |
| 18 |
И. И. А. |
29 |
Ж |
27.04.98. |
3,48 |
31 |
5,33 |
17,8 |
0,280 |
| 19 |
И. В. А. |
40 |
М |
27.04.98. |
3,60 |
60 |
4,24 |
18,1 |
0,218 |
| 20 |
М. И. В. |
36 |
Ж |
10.05.98. |
3,54 |
54 |
5,09 |
17,6 |
0,382 |
| 21 |
С. В. Г. |
32 |
М |
10.05.98. |
4,0 |
33 |
4,86 |
16,7 |
0,355 |
| 22 |
З. О. А. |
32 |
М |
12.05.98. |
3,77 |
45 |
3,77 |
16,3 |
0,232 |
| 23 |
Я. В. В. |
30 |
М |
12.05.98 |
3,61 |
120 |
3,33 |
15,8 |
0,274 |
| 24 |
П. И. В. |
31 |
М |
17.05.98. |
3,44 |
100 |
3,96 |
14,9 |
0,286 |
| 25 |
А. С. Б. |
36 |
М |
17.05.98. |
2,93 |
69 |
5,14 |
16,8 |
0,253 |
| 26 |
С. А. И. |
20 |
Ж |
3.02.99. |
3,61 |
70 |
5,19 |
16,6 |
0,268 |
| 27 |
М. И. В. |
34 |
М |
9.02.99. |
3,53 |
43 |
5,05 |
17,3 |
0,351 |
| 28 |
Д. О. В. |
37 |
Ж |
9.02.99. |
3,61 |
27 |
4,9 |
17,8 |
0,194 |
| 29 |
Т. С. Д. |
22 |
М |
16.02.99. |
3,75 |
30 |
4,95 |
14,5 |
0,309 |
| 30 |
К. В. А. |
28 |
М |
9.04.99. |
3,48 |
60 |
3,77 |
16,2 |
0,214 |
| 31 |
Ш. А. Л. |
30 |
М |
17.02.99 |
3,59 |
58 |
4,48 |
17,2 |
0,232 |
| 32 |
Г. А. К. |
41 |
Ж |
17.02.99 |
4,21 |
41 |
3,91 |
16,8 |
0,305 |
| 33 |
Ч. И. В. |
24 |
М |
16.02.99 |
3,99 |
30 |
5,05 |
16,3 |
0,265 |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 34 |
С. О. Ю. |
30 |
М |
16.02.99. |
3,57 |
35 |
3,58 |
16,9 |
0,239 |
| 35 |
С. С. М. |
27 |
М |
16.02.99. |
3,02 |
46 |
3,39 |
15,7 |
0,248 |
| 36 |
М. С. В. |
29 |
Ж |
9.02.99. |
2,50 |
38 |
5,14 |
14,3 |
0,372 |
| 37 |
Р. Т. А. |
28 |
Ж |
9.02.99. |
3,88 |
33 |
3,77 |
16,2 |
0,245 |
| 38 |
С. С. В. |
28 |
Ж |
16.04.98. |
2,61 |
54 |
4,24 |
16,8 |
0,261 |
| 39 |
С. В. В. |
32 |
М |
16.04.98. |
3,14 |
37 |
5,38 |
17,1 |
0,379 |
| 40 |
Р. Т. В. |
23 |
М |
15.05.98. |
3,99 |
19 |
4,95 |
18,3 |
0,358 |
| 41 |
О. А. Е. |
25 |
М |
15.05.98. |
3,24 |
75 |
5,05 |
16,9 |
0,251 |
| 42 |
А. В. Е. |
33 |
М |
18.05.98. |
3,88 |
28 |
4,56 |
17,5 |
0,275 |
| 43 |
Б. В. С. |
44 |
М |
18.05.98. |
4,26 |
110 |
3,33 |
15,6 |
0,213 |
| 44 |
С. В. И. |
30 |
Ж |
19.02.99. |
4,09 |
46 |
4,81 |
14,8 |
0,307 |
| 45 |
К. Ю. И. |
46 |
М |
19.02.99. |
3,77 |
48 |
5,03 |
16,3 |
0,264 |
| 46 |
В. Ю. И. |
37 |
М |
27.03.98. |
3,81 |
43 |
4,95 |
16,7 |
0,280 |
| 47 |
К. Е. И. |
32 |
М |
27.03.98. |
3,54 |
44 |
5,33 |
16,9 |
0,232 |
| 48 |
Ж. Ю. С. |
30 |
М |
5.04.98. |
4,04 |
85 |
3,77 |
17,3 |
0,218 |
| 49 |
П. В. А. |
31 |
Ж |
5.04.98. |
3,15 |
23 |
4,24 |
18,8 |
0,381 |
| 50 |
Б. А. И. |
31 |
М |
13.04.98 |
3,45 |
37 |
5,05 |
16,8 |
0,239 |
| 51 |
Л. Т. Ю. |
42 |
М |
9.02.99. |
3,04 |
59 |
5,33 |
| Μ |
3,61 |
52,62 |
4,45 |
16,7 |
0,280 |
| m |
0,07 |
3,52 |
0,68 |
0,15 |
0,01 |
| σ |
0,48 |
25,17 |
0,09 |
1,04 |
0,06 |
Приложение 2
Содержание биохимических показателей в сыворотке крови практически здоровых людей по данным литературы
Группа
обследованных
|
n |
МДА
мкМоль/л
|
Активность
каталазы
мкат/л
|
ЦИК
усл. ед.
|
МСМ
усл. ед.
|
Холестерин
ммоль/л
|
| Мартыненко Л.Д., 1990 |
31 |
4,36±0,27
|
| Оконенко Л.Б., 1994 |
34 |
16,3±0,3 |
| Куликов И.Н., 1996 |
40 |
54,2±3,2 |
| Нагаев Б.С., 1996 |
70 |
0,31±0,02 |
| Творогова М.Г. 1995 |
40 |
4,62±0,31 |
Приложение 3
Биохимические показатели крови практически здоровых людей,
n=51
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
ЭКА (г/л) |
ОКА
(г/л)
|
ОКА
(%)
|
Ит
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| 1 |
К. В. И. |
35 |
Ж |
5.02.98. |
43 |
49 |
88 |
0,13 |
| 2 |
К. Б. А. |
39 |
М |
5.02.98. |
46 |
53 |
87 |
0,15 |
| 3 |
У. С. Б. |
29 |
М |
15.02.98. |
34 |
41 |
84 |
0,16 |
| 4 |
И. И. И. |
31 |
Ж |
17.02.98. |
38 |
44 |
86 |
0,15 |
| 5 |
К. В. Л. |
34 |
М |
17.02.98. |
48 |
56 |
86 |
0,16 |
| 6 |
М. В. В. |
40 |
М |
17.02.98. |
47 |
52 |
90 |
0,10 |
| 7 |
С. П. Б. |
40 |
М |
25.02.98. |
46 |
53 |
87 |
0,15 |
| 8 |
Л. Е. В. |
32 |
М |
25.02.98. |
48 |
57 |
84 |
0,18 |
| 9 |
Г. Т. Ю. |
28 |
Ж |
15.03.98. |
44 |
49 |
90 |
0,11 |
| 10 |
А. И. А. |
28 |
Ж |
16.03.98. |
42 |
49 |
86 |
0,17 |
| 11 |
Л. Л. Я. |
40 |
Ж |
16.03.98. |
46 |
51 |
90 |
0,11 |
| 12 |
С. Б. И. |
46 |
Ж |
19.03.98. |
36 |
50 |
89 |
0,11 |
| 13 |
С. И. В. |
28 |
Ж |
16.04.98. |
47 |
54 |
87 |
0,14 |
| 14 |
М. А. И. |
31 |
М |
16.04.98. |
47 |
52 |
90 |
0,10 |
| 15 |
Х. А. И. |
37 |
М |
22.04.98. |
45 |
50 |
90 |
0,11 |
| 16 |
К. И. П. |
30 |
М |
22.04.98. |
35 |
41 |
85 |
0,17 |
| 17 |
Р. И. И. |
33 |
М |
22.04.98. |
42 |
46 |
91 |
0,09 |
| 18 |
И. И. А. |
29 |
Ж |
27.04.98. |
38 |
44 |
86 |
0,15 |
| 19 |
И. В. А. |
40 |
М |
27.04.98. |
47 |
52 |
90 |
0,10 |
| 20 |
М. И. В. |
36 |
Ж |
10.05.98. |
47 |
54 |
87 |
0,14 |
| 21 |
С. В. Г. |
32 |
М |
10.05.98. |
34 |
41 |
84 |
0,16 |
| 22 |
З. О. А. |
32 |
М |
12.05.98. |
46 |
53 |
87 |
0,15 |
| 23 |
Я. В. В. |
30 |
М |
12.05.98 |
39 |
44 |
88 |
0,12 |
| 24 |
П. И. В. |
31 |
М |
17.05.98. |
51 |
55 |
93 |
0,07 |
| 25 |
А. С. Б. |
36 |
М |
17.05.98. |
43 |
48 |
89 |
0,11 |
| 26 |
С. А. И. |
20 |
Ж |
3.02.99. |
47 |
54 |
87 |
0,14 |
| 27 |
М. И. В. |
34 |
М |
9.02.99. |
38 |
44 |
86 |
0,15 |
| 28 |
Д. О. В. |
37 |
Ж |
9.02.99. |
49 |
55 |
89 |
0,12 |
| 29 |
Т. С. Д. |
22 |
М |
16.02.99. |
36 |
40 |
89 |
0,11 |
| 30 |
К. В. А. |
28 |
М |
9.04.99. |
38 |
44 |
86 |
0,15 |
| 31 |
Ш. А. Л. |
30 |
М |
17.02.99 |
40 |
43 |
93 |
0,08 |
| 32 |
Г. А. К. |
41 |
Ж |
17.02.99 |
42 |
46 |
91 |
0,09 |
| 33 |
Ч. И. В. |
24 |
М |
16.02.99 |
48 |
56 |
86 |
0,16 |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| 34 |
С. О. Ю. |
30 |
М |
16.02.99. |
49 |
55 |
89 |
0,12 |
| 35 |
С. С. М. |
27 |
М |
16.02.99. |
47 |
52 |
90 |
0,10 |
| 36 |
М. С. В. |
29 |
Ж |
9.02.99. |
45 |
50 |
90 |
0,11 |
| 37 |
Р. Т. А. |
28 |
Ж |
9.02.99. |
39 |
44 |
88 |
0,13 |
| 38 |
С. С. В. |
28 |
Ж |
16.04.98. |
43 |
48 |
89 |
0,11 |
| 39 |
С. В. В. |
32 |
М |
16.04.98. |
36 |
40 |
90 |
0,11 |
| 40 |
Р. Т. В. |
23 |
М |
15.05.98. |
38 |
44 |
86 |
0,15 |
| 41 |
О. А. Е. |
25 |
М |
15.05.98. |
35 |
41 |
85 |
0,17 |
| 42 |
А. В. Е. |
33 |
М |
18.05.98. |
48 |
53 |
91 |
0,10 |
| 43 |
Б. В. С. |
44 |
М |
18.05.98. |
37 |
44 |
84 |
0,18 |
| 44 |
С. В. И. |
30 |
Ж |
19.02.99. |
45 |
50 |
90 |
0,11 |
| 45 |
К. Ю. И. |
46 |
М |
19.02.99. |
47 |
54 |
87 |
0,14 |
| 46 |
В. Ю. И. |
37 |
М |
27.03.98. |
44 |
51 |
86 |
0,16 |
| 47 |
К. Е. И. |
32 |
М |
27.03.98. |
42 |
46 |
91 |
0,09 |
| 48 |
Ж. Ю. С. |
30 |
М |
5.04.98. |
48 |
56 |
86 |
0,16 |
| 49 |
П. В. А. |
31 |
Ж |
5.04.98. |
47 |
53 |
89 |
0,13 |
| 50 |
Б. А. И. |
31 |
М |
13.04.98 |
36 |
40 |
89 |
0,11 |
| 51 |
Л. Т. Ю. |
42 |
М |
9.02.99. |
43 |
48 |
89 |
0,11 |
| Μ |
43 |
48,8 |
88 |
0,13 |
| m |
0,01 |
| σ |
0,03 |
Приложение 4
Биохимические показатели крови
больных сальмонеллезом в острый период,
n
=30.
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
№ истории болезни |
МДА (мкМоль/л) |
ЦИК
(усл. ед.)
|
Уровень
холестерина
ммоль/л
|
Активность каталазы |
МСМ
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
| 1 |
М. А. М. |
32 |
М |
14.02.98. |
160А02.8 |
5,84 |
74 |
5,37 |
13,6 |
0,611 |
| 2 |
Л. В. И. |
37 |
М |
14.02.98. |
230А02.08 |
6,02 |
133 |
8,91 |
12,7 |
0,537 |
| 3 |
С. О. Е. |
29 |
М |
9.02.99. |
410А02.1 |
7,18 |
96 |
5,74 |
13,8 |
0,683 |
| 4 |
Б. В. И. |
46 |
Ж |
9.02.99. |
182А02.1 |
5,93 |
111 |
5,68 |
13,1 |
0,700 |
| 5 |
Х. В. В. |
28 |
Ж |
11.07.99. |
523А02.0 |
8,13 |
120 |
4,75 |
14,4 |
0,570 |
| 6 |
С. Н. Е. |
19 |
Ж |
12.10.98. |
728А02.8 |
9,34 |
82 |
7,03 |
11,8 |
0,700 |
| 7 |
М. О. И. |
24 |
Ж |
11.10.98. |
615А02.8 |
6,59 |
140 |
9,85 |
10,9 |
0,782 |
| 8 |
К. Г. А. |
32 |
М |
3.03.98. |
363А02.8 |
7,77 |
68 |
7,3 |
13,5 |
0,604 |
| 9 |
Д. И. Е. |
39 |
М |
3.03.98. |
290А02.8 |
5,96 |
97 |
5,72 |
13,0 |
0,543 |
| 10 |
Е. Т. А. |
17 |
Ж |
10.02.98. |
490А02.1 |
8,93 |
88 |
4,12 |
12,7 |
0,529 |
| 11 |
Р. О. А. |
37 |
Ж |
10.02.98. |
517А02.1 |
7,13 |
105 |
8,91 |
13,5 |
0,690 |
| 12 |
К. С. И. |
39 |
М |
27.02.98. |
560А02.8 |
6,60 |
92 |
5,7 |
13,1 |
0,581 |
| 13 |
Ш. Г. В. |
25 |
Ж |
13.03.98. |
393А02.8 |
7,25 |
148 |
4,82 |
13,6 |
0,742 |
| 14 |
Б. И. Р. |
41 |
М |
13.03.98. |
102А02.8 |
8,18 |
105 |
6,84 |
12,8 |
0,458 |
| 15 |
П. О. К. |
33 |
Ж |
4.07.98. |
280А02.8 |
9,05 |
76 |
4,72 |
12,4 |
0,617 |
| 16 |
К. И. И. |
29 |
Ж |
4.07.98. |
432А02.1 |
5,94 |
115 |
9,67 |
13,7 |
0,610 |
| 17 |
Т. С. И. |
31 |
Ж |
4.07.98. |
630А02.0 |
6,64 |
73 |
5,9 |
13,2 |
0,623 |
| 18 |
С. И. В. |
47 |
М |
28.09.98. |
216А02.0 |
7,81 |
108 |
5,06 |
13,6 |
0,542 |
| 19 |
К. И. Б. |
42 |
Ж |
28.09.98. |
390А02.8 |
8,20 |
139 |
4,84 |
11,7 |
0,413 |
| 20 |
П. О. А. |
53 |
М |
15.02.99. |
575А02.8 |
6,95 |
132 |
6,45 |
10,9 |
0,562 |
| 21 |
С. И. П. |
25 |
М |
15.02.99. |
721А02.8 |
7,17 |
99 |
5,6 |
12,8 |
0,717 |
| 22 |
Е. Т. С. |
24 |
Ж |
17.02.99. |
470А02.8 |
5,27 |
114 |
8,48 |
13,6 |
0,657 |
| 23 |
З. О. Ю. |
36 |
М |
17.02.99. |
370А02.0 |
7,53 |
83 |
5,52 |
14,2 |
0,614 |
| 24 |
М. Л. А. |
41 |
М |
6.10.98. |
182А02.0 |
8,41 |
92 |
7,73 |
13,3 |
0,534 |
| 25 |
Д. С. К. |
22 |
Ж |
6.10.98. |
652А02.8 |
6,12 |
100 |
7,73 |
13,8 |
0,586 |
| 26 |
К. С. Д. |
18 |
Ж |
11.10.98. |
713А02.8 |
7,03 |
86 |
10,15 |
12,9 |
0,570 |
| 27 |
Е. А. В. |
43 |
М |
28.08.98. |
760А02.8 |
5,90 |
77 |
6,8 |
13,7 |
0,681 |
| 28 |
М. О. Р. |
33 |
М |
28.08.98. |
535А02.8 |
7,77 |
69 |
6,24 |
13,6 |
0,649 |
| 29 |
П. З. Л. |
30 |
Ж |
7.12.98. |
862А02.0 |
6,78 |
102 |
5,72 |
13,7 |
0,740 |
| 30 |
Е. В. В. |
31 |
Ж |
7.12.98. |
718А02.8 |
8,27 |
95 |
3,89 |
12,9 |
0,531 |
| Μ |
7,19 |
100,63 |
6,54 |
13,09 |
0,550 |
| m |
0,196 |
4,04 |
0,07 |
0,16 |
0,02 |
| σ |
1,07 |
22,138 |
0,01 |
0,85 |
0,11 |
Приложение 5
Биохимические показатели крови
больных сальмонеллезом в стадии ремиссии,
n
=30.
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
№ истории болезни |
МДА (мкМоль/л) |
ЦИК
(усл. ед.)
|
Уровень
холестерина
ммоль/л
|
Активность каталазы |
МСМ
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
| 1 |
М. А. М. |
32 |
М |
14.02.98. |
160А02.8 |
3,84 |
54 |
3,77 |
15,8 |
0,225 |
| 2 |
Л. В. И. |
37 |
М |
14.02.98. |
230А02.8 |
4,02 |
48 |
4,95 |
15,6 |
0,287 |
| 3 |
С. О. Е. |
29 |
М |
9.02.99 |
410А02.1 |
5,18 |
35 |
5,14 |
14,5 |
0,354 |
| 4 |
Б. В. И. |
46 |
Ж |
9.02.99. |
182А02.1 |
3,03 |
96 |
4,24 |
16,1 |
0,268 |
| 5 |
Х. В. В. |
28 |
Ж |
11.07.98. |
523А02.0 |
4,15 |
77 |
5,19 |
16,4 |
0,256 |
| 6 |
С. И. Е. |
19 |
Ж |
12.10.98. |
728А02.8 |
5,96 |
68 |
3,96 |
15,7 |
0,358 |
| 7 |
М. О. И. |
24 |
Ж |
11.10.98. |
615А02.8 |
3,19 |
58 |
3,39 |
14,9 |
0,280 |
| 8 |
К. Г. А. |
32 |
М |
3.03.98. |
363А02.8 |
4,17 |
60 |
5,05 |
14,5 |
0,332 |
| 9 |
Д. И. Е. |
39 |
М |
3.03.98. |
290А02.8 |
2,98 |
56 |
5,14 |
16,2 |
0,253 |
| 10 |
Е. Т. А. |
17 |
Ж |
3.03.98. |
490А02.1 |
5,63 |
73 |
4,95 |
17,3 |
0,209 |
| 11 |
Р. О. А. |
37 |
Ж |
10.02.98 |
517А02.1 |
3,65 |
100 |
5,24 |
15,8 |
0,209 |
| 12 |
К. С. И. |
39 |
М |
10.02.98. |
560А02.8 |
3,53 |
83 |
5,09 |
14,3 |
0,214 |
| 13 |
Ш. Г. В. |
25 |
Ж |
27.02.98. |
393А02.8 |
4,12 |
69 |
3,77 |
17,6 |
0,272 |
| 14 |
Б. И. Р. |
41 |
М |
13.03.98. |
102А02.8 |
3,68 |
75 |
4,24 |
17,1 |
0,353 |
| 15 |
П. О. К. |
33 |
Ж |
13.03.98. |
280А02.8 |
4,16 |
81 |
3,77 |
15,3 |
0,386 |
| 16 |
К. И. И. |
29 |
Ж |
4.07.98. |
432А02.1 |
2,93 |
63 |
5,05 |
17,7 |
0,232 |
| 17 |
Г. С. И. |
31 |
Ж |
4.07.98. |
630А02.0 |
3,57 |
77 |
3,75 |
16,8 |
0,305 |
| 18 |
С. И. В. |
47 |
М |
4.07.98. |
216А02.8 |
3,69 |
68 |
4,24 |
16,4 |
0,265 |
| 19 |
К. И. Б. |
42 |
Ж |
28.09.98. |
390А02.8 |
4,12 |
100 |
3,92 |
15,9 |
0,413 |
| 20 |
П. О. А. |
53 |
М |
28.90.98. |
575А02.8 |
3,95 |
64 |
4,16 |
16,8 |
0,294 |
| 21 |
С. И. П. |
25 |
М |
15.02.99. |
721А02.8 |
3,17 |
73 |
5,33 |
14,3 |
0,562 |
| 22 |
Е. Т. С. |
24 |
Ж |
15.02.99. |
470А02.8 |
2,50 |
72 |
4,81 |
14,9 |
0,531 |
| 23 |
З. О. Ю. |
36 |
М |
17.02.99 |
370А02.0 |
4,53 |
59 |
4,24 |
15,6 |
0,309 |
| 24 |
М. Л. А. |
41 |
М |
17.02.99. |
182А02.0 |
4,41 |
43 |
5,02 |
16,3 |
0,265 |
| 25 |
Д. С. К. |
22 |
Ж |
6.10.98. |
652А02.8 |
3,12 |
48 |
3,33 |
16,9 |
0,272 |
| 26 |
К. С. Д. |
18 |
Ж |
6.10.98. |
713А02.8 |
3,03 |
66 |
5,91 |
15,7 |
0,239 |
| 27 |
Е. А. В. |
43 |
М |
11.10.98. |
760А02.8 |
2,90 |
72 |
3,89 |
15,9 |
0,245 |
| 28 |
М. О. Р. |
33 |
М |
28.08.98. |
535А02.8 |
4,77 |
73 |
4,74 |
16,2 |
0,179 |
| 29 |
П. З. Л. |
30 |
Ж |
7.12.98. |
862А02.0 |
3,78 |
80 |
5,58 |
14,7 |
0,524 |
| 30 |
Е. В. В. |
31 |
Ж |
7.12.98. |
718А02.8 |
4,27 |
77 |
3,68 |
13,9 |
0,355 |
| Μ |
3,87 |
68,9 |
4,65 |
15,84 |
0,31 |
| m |
0,15 |
2,8 |
0,7 |
0,19 |
0,02 |
| σ |
0,81 |
15,41 |
0,09 |
1,02 |
0,1 |
Приложение 6
Биохимические показатели крови больных сальмонеллезом в острый период,
n=30
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
ЭКА (г/л) |
ОКА
(г/л)
|
ОКА
(%)
|
Ит
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| 1 |
К. В. И. |
35 |
Ж |
5.02.98. |
42 |
54 |
78 |
0,28 |
| 2 |
К. Б. А. |
39 |
М |
5.02.98. |
42 |
56 |
75 |
0,33 |
| 3 |
У. С. Б. |
29 |
М |
15.02.98. |
44 |
59 |
74 |
0,35 |
| 4 |
И. И. И. |
31 |
Ж |
17.02.98. |
38 |
49 |
77 |
0,29 |
| 5 |
К. В. Л. |
34 |
М |
17.02.98. |
47 |
59 |
79 |
0,25 |
| 6 |
М. В. В. |
40 |
М |
17.02.98. |
42 |
57 |
74 |
0,37 |
| 7 |
С. П. Б. |
40 |
М |
25.02.98. |
42 |
55 |
76 |
0,31 |
| 8 |
Л. Е. В. |
32 |
М |
25.02.98. |
43 |
54 |
80 |
0,26 |
| 9 |
Г. Т. Ю. |
28 |
Ж |
15.03.98. |
44 |
59 |
75 |
0,35 |
| 10 |
А. И. А. |
28 |
Ж |
16.03.98. |
45 |
55 |
82 |
0,22 |
| 11 |
Л. Л. Я. |
40 |
Ж |
16.03.98. |
44 |
59 |
75 |
0,34 |
| 12 |
С. Б. И. |
46 |
Ж |
19.03.98. |
40 |
51 |
78 |
0,27 |
| 13 |
С. И. В. |
28 |
Ж |
16.04.98. |
42 |
58 |
72 |
0,38 |
| 14 |
М. А. И. |
31 |
М |
16.04.98. |
42 |
56 |
75 |
0,34 |
| 15 |
Х. А. И. |
37 |
М |
22.04.98. |
45 |
54 |
83 |
0,21 |
| 16 |
К. И. П. |
30 |
М |
22.04.98. |
38 |
55 |
69 |
0,43 |
| 17 |
Р. И. И. |
33 |
М |
22.04.98. |
38 |
49 |
78 |
0,29 |
| 18 |
И. И. А. |
29 |
Ж |
27.04.98. |
44 |
55 |
80 |
0,25 |
| 19 |
И. В. А. |
40 |
М |
27.04.98. |
42 |
57 |
74 |
0,36 |
| 20 |
М. И. В. |
36 |
Ж |
10.05.98. |
43 |
57 |
75 |
0,32 |
| 21 |
С. В. Г. |
32 |
М |
10.05.98. |
35 |
41 |
85 |
0,17 |
| 22 |
З. О. А. |
32 |
М |
12.05.98. |
47 |
58 |
81 |
0,24 |
| 23 |
Я. В. В. |
30 |
М |
12.05.98 |
40 |
51 |
78 |
0,27 |
| 24 |
П. И. В. |
31 |
М |
17.05.98. |
43 |
50 |
86 |
0,16 |
| 25 |
А. С. Б. |
36 |
М |
17.05.98. |
42 |
56 |
75 |
0,33 |
| 26 |
С. А. И. |
20 |
Ж |
3.02.99. |
43 |
54 |
80 |
0,26 |
| 27 |
М. И. В. |
34 |
М |
9.02.99. |
42 |
58 |
72 |
0,38 |
| 28 |
Д. О. В. |
37 |
Ж |
9.02.99. |
48 |
57 |
84 |
0,19 |
| 29 |
Т. С. Д. |
22 |
М |
16.02.99. |
45 |
54 |
83 |
0,21 |
| 30 |
К. В. А. |
28 |
М |
9.04.99. |
38 |
49 |
78 |
0,29 |
| Μ |
42,3 |
54,5 |
77,7 |
0,29 |
| m |
2,87 |
3,52 |
0,01 |
| σ |
17,6 |
24,12 |
0,07 |
Приложение 7
Биохимические показатели крови больных сальмонеллезом в стадии ремиссии,
n=30
| № п/п |
Ф. И. О. |
Возраст |
Пол |
Дата анализа |
ЭКА (г/л) |
ОКА
(г/л)
|
ОКА
(%)
|
Ит
(усл. ед.)
|
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| 1 |
К. В. И. |
35 |
Ж |
5.02.98. |
46 |
53 |
86 |
0,15 |
| 2 |
К. Б. А. |
39 |
М |
5.02.98. |
34 |
41 |
84 |
0,16 |
| 3 |
У. С. Б. |
29 |
М |
15.02.98. |
38 |
44 |
86 |
0,15 |
| 4 |
И. И. И. |
31 |
Ж |
17.02.98. |
47 |
51 |
84 |
0,18 |
| 5 |
К. В. Л. |
34 |
М |
17.02.98. |
42 |
51 |
86 |
0,16 |
| 6 |
М. В. В. |
40 |
М |
17.02.98. |
36 |
40 |
89 |
0,11 |
| 7 |
С. П. Б. |
40 |
М |
25.02.98. |
47 |
51 |
84 |
0,18 |
| 8 |
Л. Е. В. |
32 |
М |
25.02.98. |
35 |
41 |
85 |
0,17 |
| 9 |
Г. Т. Ю. |
28 |
Ж |
15.03.98. |
36 |
40 |
85 |
0,11 |
| 10 |
А. И. А. |
28 |
Ж |
16.03.98. |
46 |
53 |
86 |
0,15 |
| 11 |
Л. Л. Я. |
40 |
Ж |
16.03.98. |
39 |
44 |
88 |
0,12 |
| 12 |
С. Б. И. |
46 |
Ж |
19.03.98. |
54 |
63 |
86 |
0,16 |
| 13 |
С. И. В. |
28 |
Ж |
16.04.98. |
36 |
50 |
89 |
0,11 |
| 14 |
М. А. И. |
31 |
М |
16.04.98. |
36 |
42 |
86 |
0,17 |
| 15 |
Х. А. И. |
37 |
М |
22.04.98. |
44 |
52 |
85 |
0,18 |
| 16 |
К. И. П. |
30 |
М |
22.04.98. |
48 |
56 |
86 |
0,16 |
| 17 |
Р. И. И. |
33 |
М |
22.04.98. |
43 |
48 |
90 |
0,12 |
| 18 |
И. И. А. |
29 |
Ж |
27.04.98. |
42 |
47 |
89 |
0,12 |
| 19 |
И. В. А. |
40 |
М |
27.04.98. |
49 |
56 |
88 |
0,14 |
| 20 |
М. И. В. |
36 |
Ж |
10.05.98. |
35 |
41 |
85 |
0,17 |
| 21 |
С. В. Г. |
32 |
М |
10.05.98. |
47 |
52 |
90 |
0,10 |
| 22 |
З. О. А. |
32 |
М |
12.05.98. |
43 |
49 |
88 |
0,13 |
| 23 |
Я. В. В. |
30 |
М |
12.05.98 |
44 |
49 |
90 |
0,11 |
| 24 |
П. И. В. |
31 |
М |
17.05.98. |
46 |
51 |
90 |
0,11 |
| 25 |
А. С. Б. |
36 |
М |
17.05.98. |
51 |
55 |
92 |
0,07 |
| 26 |
С. А. И. |
20 |
Ж |
3.02.99. |
44 |
51 |
86 |
0,15 |
| 27 |
М. И. В. |
34 |
М |
9.02.99. |
48 |
54 |
89 |
0,13 |
| 28 |
Д. О. В. |
37 |
Ж |
9.02.99. |
42 |
49 |
86 |
0,17 |
| 29 |
Т. С. Д. |
22 |
М |
16.02.99. |
48 |
57 |
84 |
0,18 |
| 30 |
К. В. А. |
28 |
М |
9.04.99. |
45 |
54 |
83 |
0,20 |
| Μ |
43 |
50 |
84,3 |
0,15 |
| m |
2,16 |
3,8 |
0,01 |
| σ |
14,9 |
15,41 |
0,03 |
|