МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО
ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
Кафедра биохимии и физиологии человека и животных
С.А. Костогорова
студентка 4 курса
СОДЕРЖАНИЕ АСКОРБИНОВОЙ, ДЕГИДРОАСКОРБИНОВОЙ И ДИКЕТОГУЛОНОВОЙ КИСЛОТ В ЭРИТРОЦИТАХ ЗДОРОВЫХ ДЕТЕЙ И СТРАДАЮЩИХ ИНСУЛИНЗАВИСИМЫМ САХАРНЫМ ДИАБЕТОМ
(курсовая работа)
Научный руководитель:
к.б.н., доц. Титова Н.М.
Красноярск, 1999
оглавление
Введение..................................................................................................... 2
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ................................................................. 3
1.1.биохимические процессы при созревании и старении эритроцитов.... 3
1.1.1. Характеристика эритроцитов.......................................................... 3
1.1.2. Энергетический обмен в эритроцитах............................................ 5
1.1.3. Антиоксидантная система эритроцитов.......................................... 6
1.2. Аскорбат как компонент АОС эритроцитов........................................ 8
1.2.1. Строение и физико-химические свойства аскорбата..................... 8
1.3. Сахарный диабет как один из распространёенных патологических процессов 9
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ....................................................... 11
2.1. Подготовка эритроцитов..................................................................... 11
2.2. Метод раздельного определения аскорбиновой, дегидроаскорбиновой и дикетогулоновой кислот в эритроцитах.................................................... 11
2.3. СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ......................... 13
Глава 3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ....................................... 14
ВЫВОДЫ...................................................................................................... 15
литература.............................................................................................. 16
SUMMARY.................................................................................................... 19
Приложение................................................................................................... 20
Зрелые эритроциты млекопитающих – это высокоспециализированные безъядерные клетки. Основной функцией эритроцитов является транспорт кислорода от клетки к тканям и углекислоты в обратном направлении. Высокие концентрации кислорода и процессы оксигенации – деоксигенации гемоглобина обуславливают образование высокореакционных интермедиатов кислорода, вызывающих нарушение нормального функционирования клетки. Существует антиоксидантная система защиты клетки от свободнорадикального окисления. В её состав входит ряд ферментов и небелковых веществ. Важную роль в антиоксидантной системе играет вещество небелковой природы – аскорбат. Он обладает широким спектром антиоксидантных свойств, в частности, только аскорбат достаточно реакционноспособен для эффективного ингибирования инициации перекисного окисления липидов. Аскорбат блокирует поглощение кислорода и образование перекиси водорода; присутствие аскорбата в клетках оказывает защитное действие на гемоглобин, препятствуя его окислению. Аскорбат в ходе выполнения своих биохимических функций обратимо переходит в окисленную форму – ДАК и ДКГК. Основную роль в биохимических процессах играет редокс-пара – АК/ДАК. По данным литературы, это соотношение может меняться при различных патологических процессах, одним из наиболее распространённых из них является инсулинзависимый сахарный диабет. Исследования, направленные на изучение изменения содержания АК, ДАК и ДКГК в клетках могут быть одним из критериев, свидетельствующих о наличии в организме вышеуказанных процессов.
Целью данной работы явилось определение содержания АК, ДАК, ДКГК в общей эритроцитарной массе у детей, страдающих инсулинзависимым сахарным диабетом. Данная работа представляет собой часть исследований, проводимых на кафедре биохимии и физиологии человека и животных КГУ по изучению метаболизма эритроцитов.
1.1.биохимические процессы при созревании и старении эритроцитов
1.1.1. Характеристика эритроцитов
Зрелый эритроцит человека является упрощенной клеткой по биохимической и структурной организации. Это высокоспециализированная безъядерная клетка. Эритроциты человека образуются из ядросодержащих клеток преимущественно в костном мозге. В этих предшественниках эритроцитов содержатся субклеточные структуры и ферментные системы, необходимые для деления, созревания, дифференцировки, процессов биосинтеза ДНК, РНК, белков, в том числе глобина, синтеза гема, липидов, углеводов, других соединений. На этой стадии развития эритроцита осуществляются окислительные процессы, тканевое дыхание, анаэробное расщепление углеводов (гликолиз), прямое окисление глюкозы через пентозофосфатный путь (Черняк Н.Б., 1976).
До сих пор нет достаточно чётких представлений о том, как соотносятся отдельные стадии созревания ядерных клеток с изменениями химического состава и обмена веществ. Однако известно, что в процессе развития клетки на стадии нормобласта уменьшается количество РНК, увеличивается содержание гемоглобина и утрачивается способность к синтезу ДНК, в связи с чем нарушается способность к митотическому делению.
Ретикулоциты – безъядерные клетки, образующиеся на последнем этапе созревания, предшествующем образованию эритроцитов, характеризуются схожей морфологией, в частности, содержат митохондрии, рибосомы, ЭПР. В ретикулоцитах осуществляется биосинтез глобина, гема, пуринов, пиридиннуклеотидов, фосфатидов, липидов (Фёдоров Н.А., Черняк Н.Б., 1976). РНК практически не синтезируется. Происходит фосфорилирование, сопряжённое с окислением, и гликолиз (Гинодман Л.М., 1968). В обмене веществ ретикулоцитов участвуют эндогенные и экзогенные субстраты, в том числе аминокислоты, глюкоза.
Последний этап созревания – превращение ретикулоцита в эритроцит – протекает 1-3 дня. Происходят значительные изменения в обмене веществ и морфологии клеток (Фёдоров Н.А., 1976).
В зрелых безъядерных эритроцитах нарушены биологический аппарат дыхания, системы синтеза белка, пуринов, порфиринов. Сохраняется способность к гликолизу, утилизации небольшого количества глюкозы в пентозном цикле и синтезу некоторых соединений, например, глутатиона.
В норме длительность жизни эритроцитов поддерживается в течение 120 дней специализированными ферментными системами. Выведение эритроцитов из циркуляции связано с изменениями (структурных компонентов, химического состава, источников энергии), характеризующими старение клеток. Наиболее характерными изменениями при старении эритроцитов являются:
1) уменьшение активности различных ферментов гликолиза и пентозного цикла, что понижает интенсивность данных процессов (Мортенсен, Брайн, 1974);
2) уменьшение содержания липидов, что приводит к изменению структуры эритроцитов, увеличению чувствительности к осмотическому лизису и механическим воздействиям;
3) изменения в составе катионов в результате изменения проницаемости мембраны;
4) изменение содержания АТР, что в свою очередь связывается как с одной из причин нарушения проницаемости, так и с уменьшением приживаемости эритроцитов в кровяном русле.
Одной из ведущих гипотез старения является свободнорадикальная гипотеза, предложенная Д. Хартманом. Она связывает причины возрастных изменений с накоплением молекулярных повреждений в мембранах и генетическом аппарате клетки свободными радикалами и продуктами перекисного окисления липидов. Нарушение нормального функционирования клетки обусловлено высокими скоростями образования высокореакционных интермедиатов кислорода (супероксидрадикал, пероксид водорода, гидроксильный радикал), что, в свою очередь, связано с постоянно протекающими процессами оксигенации и деоксигенации гемоглобина и наличием высоких концентраций кислорода в ходе выполнения основной функции эритроцитов – транспорта кислорода от клетки к тканям и углекислого газа в обратном направлении.
1.1.2. Энергетический обмен в эритроцитах
Для поддержания функциональной активности клеток организма необходима затрата энергии. Зрелые эритроциты, циркулирующие в кровяном русле, являются метаболически активными клетками, несмотря на отсутствие способности к синтезу белков, аэробному расщеплению глюкозы в лимоннокислом цикле Кребса (Владимиров Г.Е. по Рапопорту, 1970). Основным процессом обмена энергии в них является гликолиз. Процесс, протекающий в эритроцитах, близок к процессам в других клетках и тканях, и подробно описан (Фёдоров Н.А. по Райкеру, 1976).
К особенностям гликолиза в эритроцитах можно отнести использование, помимо глюкозы, других моносахаридов: фруктозы, маннозы, галактозы, а также инозина, сорбита при наличии соответствующих ферментов (Йошикава, 1968). В процессе гликолиза происходит образование АТР и NADH. Энергия гликолиза используется для активного транспорта катионов через клеточную мембрану и поддержания соотношения между ионами калия и натрия в эритроцитах и плазме, для сохранения целостности мембраны и двояковогнутой формы клетки. Образующийся NADH используется для восстановления пировиноградной кислоты в молочную и для восстановления метгемоглобина при участии метгемоглобинредуктазы. В составе метгемоглобина содержится трёхвалентное железо, вследствие чего он не способен к транспорту кислорода. Характерной особенностью гликолиза в эритроцитах является превращение 1,3- дифосфоглицерата не только в 3-фосфоглицерат, но и в 2,3-дифосфоглицериновую кислоту под действием дифосфоглицеромутазы. 2,3-дифосфоглицерат имеет, наряду с АТР, важное значение в регуляции сродства гемоглобина к кислороду. По мере старения эритроцита происходит уменьшение способности к восстановлению метгемоглобина в гемоглобин, т.е. нарушение функциональной активности эритроцита. Это связанно именно с уменьшением интенсивности гликолиза, в результате которого образуется NADH, необходимый для действия метгемоглобинредуктазы. Уменьшение содержания 2,3-дифосфоглицерата приводит к сдвигу диссоциационной кривой влево, ухудшению отдачи кислорода тканям.
Итогом всех реакций гликолиза является превращение 1 молекулы глюкозы в 2 молекулы молочной кислоты с одновременным превращением 2 молекул ADP в 2 молекулы АТР.
Наряду с гликолизом – анаэробным расщеплением глюкозы до молочной кислоты – в эритроцитах существует дополнительный путь утилизации глюкозы – прямое окисление до углекислого газа и воды в ходе пентозофосфатного цикла. Этот путь неотличим от подобных процессов, протекающих в других клетках и тканях; суммарным результатом цикла является окисление одной из 6 молекул глюкозо-6-фосфата до 6 молекул СО2
и восстановление 12 молекул NADPH. Роль пентозного цикла в зрелых эритроцитах заключается, с одной стороны, в образовании пентозофосфатов. В реакции цикла образуется 3-глицероальдегидфосфат, подвергающийся превращениям в цепи гликолитических реакций и, таким образом, является дополнительным источником энергии. Основное значение пентозофосфатного цикла заключено в образовании молекул NADPH. Значение NADPH определяется его участием в ряде реакций, необходимых для поддержания функциональной активности и целостности эритроцитов. К ним относятся восстановление метгемоглобина в гемоглобин при участии NADPH и метгемоглобинредуктазы и восстановление окисленного глутатиона с помощь. NADPH- глутатионредуктазы. Восстановленный глутатион (GSH), форма со свободно реагирующей тиоловой группой составляет в эритроцитах до 96% общего количества. Сохранение глутатиона в восстановленном состоянии необходимо для предохранения ряда ферментов, содержащих SH- группы, от инактивации, ограждение мембраны клетки от действия перекисей и необратимого окислительного денатурирования гемоглобина.
1.1.3. Антиоксидантная система эритроцитов
Основная функция эритроцитов – транспорт кислорода от лёгких к тканям и СО2
в обратном направлении. Благодаря высоким концентрациям кислорода и постоянно протекающим процессам оксигенации – деоксигенации гемоглобина, в этих клетках с высокой скоростью идут процессы образования свободных радикалов: Н2
О2
, ОН-
. Кроме того, в эритроцитах в результате аутокаталитических реакций образуются перекиси и гидроперекиси липидов.
Основное количество О2
-
в эритроцитах образуется при аутоокислении гемоглобина в метгемоглобин. Это пример генерации супероксидного радикала, связанной с неферментативным окислением субстрата:
Hb + O2
Û Hb…
O2
Û MetHb + O2
-
Большую роль в защите клетки от свободных радикалов играют ферментативные антиоксиданты. Эритроциты содержат высокоактивную супероксиддисмутазу, которая осуществляет дисмутацию двух O2
-
с образованием перекиси водорода:
O2
-
+ O2
-
Û H2
O2
+ O2
Образовавшаяся перекись водорода, являющаяся сильнейшим окислителем, частично нейтрализуется неферментативным путём при непосредственном участии аскорбата или других антиоксидантов (a-токоферол, глутатион восстановленный). Основное количество Н2
О2
расщепляется в реакциях, катализируемых каталазой и глутатионпероксидазой:
Н2
О2
+ Н2
О2
Þ 2Н2
О + О2
Н2
О2
+ RH2
Þ 2Н2
О + R
Важную роль в антиоксидантной системе эритроцитов играют легкоокисляющиеся пептиды, содержащие аминокислоты с SH-группой: метионин, цистеин. Особое место занимает глутатион – трипептид, образованный цистеином, глутаматом, глицином. В организме он присутствует в окисленной и восстановленной форме (GSH). Основной антиоксидантный эффект глутатион оказывает, участвуя в работе ферментативных антиоксидантов. Глутатион является ингибитором активированных кислородных радикалов и стабилизатором мембран. Это связано с тем, что SH- содержащие соединения подвергаются окислению в первую очередь, что предохраняет от окисления другие функциональные группы.
Немаловажный вклад в защиту клетки от органических радикалов вносят неферментативные антиоксиданты. Эффективными перехватчиками органических радикалов являются фенольные антиоксиданты, имеющие в структуре ароматическое кольцо, связанное с одной или несколькими гидроксильными группами. Имеется несколько тысяч фенольных соединений, обладающих антиоксидантным эффектом: витамины группы Е и К, триптофан, фенилаланин, убихиноны, большинство животных и растительных (каротиноиды, флавоноиды) пигментов. Синтезируется ароматическое кольцо только у высших растений и микроорганизмов, поэтому многие из фенольных антиоксидантов входят в группу облигатных пищевых, которые эффективно ингибируют О2
-
, ОН-
и индуцируемые ими процессы перекисного окисления (Оксенгендлер, 1985).
Антиоксидантными свойствами обладают хелатные соединения, связывающие металлы переменной валентности (церулоплазмин, мочевая кислота, трансферрин). Тем самым они препятствуют вовлечению их в реакции разложения перекисей, поскольку в присутствии металлов переменной валентности образование высокореакционных радикалов усиливается (Эристер, 1987).
Таким образом, развитие и функционирование клеток в кислородсодержащей среде не представляется возможным без существования защитных систем – специализированных ферментативных и неферментативных антиоксидантов. В живых организмах постоянен процесс образования прооксидантов, уравновешиваемый дезактивацией их антиоксидантными системами. Для поддержания гомеостаза регенерация антиоксидантов должна быть непрерывной. Отсутствие или нарушение в её непрерывной работе приводит к развитию окислительных процессов, к накоплению окислительных повреждений, что сопровождает ряд патологических физиологических процессов, например, старение (Оксенгендлер, 1985).
1.2. Аскорбат как компонент АОС эритроцитов
1.2.1. Строение и физико-химические свойства
аскорбата
Витамин С (L-аскорбиновая кислота) входит в состав алифатического ряда витаминов. По своему строению он может быть отнесен к производным углеводов. Это γ-лактон 2,3-дегидро-L-гулоновой кислоты, производное ненасыщенных полиокси-γ-лактонов. Структура близка структуре a-глюкозы.
Благодаря наличию двух асимметричных атомов углерода в 4 и 5 положениях, аскорбиновая кислота (АК) образует 4 оптических изомера и 2 рацемата. D- и L- аскорбиновые кислоты в природе не встречаются и синтезированы искусственным путём.
Наличие в АК двух сопряжённых двойных связей (углерод-углеродной и углерод-кислородной) обуславливает ее способность к обратимому окислению, продуктом которого является дегидроаскорбиновая кислота (ДАК). ДАК устойчива, но ее лактонное кольцо, в отличие от стабилизированного двойной связью лактонного кольца L-АК в водном растворе легко гидролизуется с образованием 2,3-дикетогулоновой кислоты (2,3-ДКГК). Эта реакция необратима, ее скорость возрастает при повышении температуры и рН среды. Через ряд дальнейших превращений ДКГК переходит в щавелевую и L-треоновую кислоты. Такое же превраще
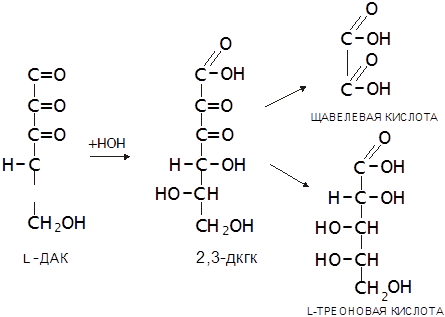 |
ние имеет место в организме (Халмурадов, Тоцкий, 1993):Способность к О-В превращениям, связанная с ендольной группировкой, которая стабилизирована находящейся в цикле соседней карбонильной группировкой, сопровождающаяся перенесением атомов водорода к акцепторам, является важнейшей каталитической функцией АК в живом организме. L-АК по своей биологической активности высокоспецифична. Витаминная активность проявляется только при наличии свободных гидроксильных групп. Различные функциональные производные по ним лишают молекулу витаминной активности почти полностью, как и гидрирование ненасыщенной связи лактонного кольца. Поэтому L-ДАК имеет витаминную активность, равноценную L-АК, тогда как 2,3-ДКГК полностью ее лишена. Вследствие легкой окисляемости L-АК – донор Н+
, она количественно легко восстанавливает многочисленные соединения, как-то: йод, перманганат калия и другие. L-АК – переносчик Н+
в некоторых ферментативных реакциях живой клетки, она легко окисляется пероксидазой, цитохромоксидазой, каталазой. L-АК восстанавливает окисленные формы ферментов, окисляясь в ДАК, обратимо легко регенерирующуюся в АК под действием глутатиона за счет его сульфгидрильной группы:
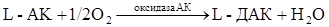
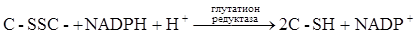
Окисление АК катализируется медью, в меньшей степени – катионами серебра и железа. Имеется предположение, что специфическим катализатором окисления АК в животных организмах является белок, синтезирующийся в печени, осуществляющий транспорт меди, обладающий оксигеназной активностью, - церулоплазмин. В меньшей степени окисление аскорбата катализируют другие катионы, в частности, серебра и железа. Комплексоны, флавоноиды тормозят окислительный распад АК. Некоторые белки ингибируют окисление АК, связываясь с ней или путём образования комплекса с медью – сывороточные глобулины (Борец, 1980). Окисление тормозится –SH содержащими соединениями: сернистая кислота блокирует фермент аскорбиназу; С-SH связывает ионы Cu+
, удаляя т. с. катализатор окисления АК из реакции (Киверин, 1971).
1.2.2. Биосинтез АК в живом организме
L-АК синтезируется в растениях и организме некоторых животных из D-глюкозы через лактон D-глюкуроновой кислоты и L-гулоно-γ-лактон или их производное. В процессе биосинтеза происходит превращение соединений D-ряда в соединения L-ряда (Березовский, 1993):Биосинтез АК в организме животных происходит в клетках печени, почек, надпочечников, гипофиза, стенки тонкого кишечника (Киварин, 1973).
1.2.3. Физиологические свойства аскорбата
Витамин С является постоянной составной частью тканей и органов человека. Его поступление в организм должно быть ежедневным, т. к. аскорбат, играя важную роль в обменных процессах организма, все время расходуется. Он восстанавливает окисленные формы ферментов, активирует некоторые протеазы, тормозит действие амилазы и протеазы поджелудочной железы, активирует эстеразу печени. L-АК участвует в обмене некоторых ароматических аминокислот, регулирует уровень холестерина в крови, усиливает антитоксические функции гепатоцитов (вкупе с глюкозой), норамализирует белковообразование. Витамин С необходим для нормального функционирования клеток, продуцирующих коллаген, активирует и регулирует зритропоэз (способствуя усвоению железа), нормализует нарушенное протромбинообразование, нормализует процессы свертывания (Андреев; 1996). Аскорбат играет положительную роль в развитии иммунных реакций организма, обладает некоторым детоксицирующим свойством, является существенным фактором профилактики и лечения инфекционных заболеваний.
Витамин С оказывает положительное воздействие на углеводный обмен. Волынский З. М. с сотрудниками показали, что повышает синтез гликогена в печени, и что нарастание содержания гликогена в печени, как правило, прямо пропорционально повышению в этом органе витамина С. К такому выводу позволяют прийти многочисленные клинические наблюдения последнего времени, подтверждающие ценное свойство АК обладать нормализующим действием на уровень сахара в крови. Подобный эффект связан с синергическим действием аскорбата и гормонов – инсулина и адреналина. Витамин С может усиливать действие инсулина или действовать аналогично ему, способствуя образование гликогена в печени. Синергизм возникает косвенным путем через воздействие инсулина и витамина С на общегормональный фон организма.
Таким образом, АК оказывает разностороннее влияние на процессы обмена веществ у здоровых людей, а при различных патологических состояниях благоприятствует нормальному течению обмена веществ и функционированию различных органов и систем организма (Бременер; 1997).
1.3. Сахарный диабет как один из
распространенных патологических процессов
Диабет сахарный (diabetes mellitus; сахарная болезнь, сахарное мочеизнурение) – эндокринное заболевание, обусловленное дефицитом гормона инсулина в организме или его низкой биологической активностью; характеризуется хроническим течением, нарушением всех видов обмена веществ, ангиопатией.
Сахарный диабет представляет собой самую распространённую эндокринную патологию. В его развитии существенную роль играют наследственная предрасположенность и неблагоприятное воздействие окружающей среды, однако, характер наследственной предрасположенности и так называемых факторов риска различны при разных типах сахарного диабета. Факторами риска развития сахарного диабета являются появление антител к b-клеткам островков поджелудочной железы, частые вирусные инфекции, гиподинамия, ожирение, нерациональное или недостаточное питание, стрессы, генетически отягощенный по сахарному диабету анамнез и другие.
Согласно классификации ВОЗ, различают два основных типа сахарного диабета. Это инсулинзависимый (I тип) и инсулиннезависимый (II тип) сахарный диабет. Инсулинзависимый сахарный диабет, как правило, развивается у лиц молодого возраста и детей, имеющих генетическую предрасположенность к сахарному диабету именно данного типа. Инсулиннезависимым сахарным диабетом чаще болеют лица, старше 50 лет (особенно женщины). Наследственная предрасположенность играет большую роль, чем при сахарном диабете I – типа.
Механизм развития сахарного диабета сложен и многогранен. Он зависит как от функции самой поджелудочной железы, так и от внепанкреатических факторов. Прежде всего, нарушен обмен углеводов. Из-за недостатка инсулина или других причин затрудняется переход глюкозы в мышечную и жировую ткань, снижается синтез гликогена в печени, усиливается образование глюкозы из белков и жиров (глюконеогенез). В развитии этих процессов увеличивается содержание глюкозы в крови. Если в норме оно довольно устойчиво и натощак у здоровых людей колеблется в пределах 3,33 – 35,55 ммоль/л (70 – 100 мг%), то при сахарном диабете в зависимости от формы и тяжести течения обычно превышает 6,00 ммоль/л, достигая 20 –30 ммоль/л и больше.
Диабет у детей и подростков характеризуется тяжелым течением и, как правило, острым началом заболевания. От времени появления первых признаков заболевания (жажда, похудание, выделение большого количества мочи, общая слабость, сухость кожи) до развития тяжёлого состояния и значительных нарушений обмена веществ, проходит обычно 2 недели. Дети, больные сахарным диабетом, требуют обязательного лечения и постоянного лечебного контроля.
Нами обследован 41 ребёнок, страдающий инсулинзависимым сахарным диабетом, и 10 человек контрольной группы. Объектом исследования служили эритроциты больных и здоровых детей. Для получения эритроцитов кровь брали из локтевой вены капельным способом, в качестве антикоагулянта использовали гепарин.
Исследования проводили в общей эритроцитарной массе детей, страдающих инсулинзависимым сахарным диабетом, и детей контрольной группы.
2.1. Подготовка эритроцитов
Свежую гепаринизированную кровь разливали в центрифужные пробирки по 5 мл. После пятнадцатиминутного центрифугирования при 3000 об/мин при 40
С отбирались и отбрасывались лейкоцитарный слой и плазма. Эритроциты суспендировали в десятикратном объёме 0.9% раствора NaCl и центрифугировали в течение пятнадцати минут при 3000 об/мин. Супернатант отсасывали, процедуру повторяли 3 раза. Это делалось для более плотной упаковки эритроцитов.
2.2. Метод раздельного определения аскорбиновой, дегидроаскорбиновой и дикетогулоновой кислот в эритроцитах
Для количественных определений АК, ДАК и ДКГК использовали метод J.H. Roe, C.A. Kuether (1943) в модификации В.В. Соколовского, Л.В. Лебедевой, Т.Б. Лиэлуп (1967). Метод основан на взаимодействии 2,4- динитрофенилгидразина с ДАК с образованием в серной кислоте соответствующего озазона. ДАК и ДКГК дают красное окрашивание, используемое для фотометрического определения. Для вычисления суммы всех кислот их окисляют 2,6- дихлорфенолиндофенолятом натрия. Содержание АК определяют по разности. Для дифференцированного определения ДАК и ДКГК смесь подвергают действию восстановителей, при этом в АК восстанавливается только ДАК. В качестве восстановителя использовали димеркаптопропансульфонат натрия (унитиол)
Реактивы:
1. 2.
10 М унитиол (0.84 мл 5% раствора ампулированного препарат в 100 мл 0.2 М фосфатного буфера рН 7.0. хранить не более суток).
2. 5% трихлоруксусная кислота (ТХУ). Хранить в холодильнике не более двух недель.
3. 85% раствор серной кислоты (100 мл воды + 900 мл концентрированной серной кислоты).
4. 2% раствор 2,4-динитрофенилгидразина в 9Н серной кислоте, содержащей 0.25% тиомочевины (хранить в холодильнике не более 1 месяца).
5. 0.001 Н раствор 2,6- дихлорфенолиндофенолята натрия (краскаТильманса). Хранить в темноте не более 1 недели.
6. 0.9% раствор хлорида натрия (физиологический раствор).
Ход определения.
В три пробирки помещали по 0.5 мл упакованных и отмытых от плазмы эритроцитов с известным гематокритом. В первую прибавляли 0.25 мл физиологического раствора и 0.25 мл унитиола. После пятнадцатиминутной инкубации при периодическом помешивании суспензии отбирали 0.5 мл экстракта, к которому прибавляли 1.5 мл ТХУ.
В две другие пробирки также прибавляли по 1.5 мл ТХУ.
В две пробирки вносили по 0.75 мл супернатанта, полученного при центрифугировании смеси упакованных эритроцитов с ТХУ. В одну из пробирок добавляли по каплям 0.001 Н раствор 2,6- дихлорфенолиндофенолята натрия до появления слаборозового окрашивания, устойчивого в течение 30 секунд. В третью пробирку помещали 0.75 мл супернатанта, полученного после центрифугирования смеси упакованных эритроцитов с физиологическим раствором, унитиолом и ТХУ. Во все пробирки добавляли по 0.25 мл 2,4- динитрофенилгидразина и доводили объём до 1.25 мл дистиллированной водой, инкубировали при 100 0
С в течение 10 минут и охлаждали в ледяной бане. В каждую пробирку добавляли небольшими порциями 1.25 мл 85% раствора серной кислоты, охлаждая в ледяной бане после каждой порции. Окрашенные растворы фотометрировали через час при длине волны 540 нм.
Концентрацию кислот определяли по формуле:
С = (3*А)/0.085; где
С – концентрация кислот, мг%
3 – концентрация стандартного раствора, мг%
А – оптическая плотность пробы
0.085 – оптическая плотность стандартного раствора
Результаты исследований обрабатывались статистически (Лакин И.А., 1976).
Целью исследования являлось определение содержания аскорбата и его окисленных форм – ДАК и ДКГК в общей эритроцитарной массе взрослых, страдающих ИЗСД, со стажем болезни более 10 лет; сравнение и сопоставление полученных результатов с данными, полученными ранее, в ходе работы со здоровыми детьми и страдающими ИЗСД. В эксперименте участвовал 21 взрослый в возрасте от 25 до 40 лет, 37 больных детей и группа контроля, включающая 10 здоровых детей. Результаты исследований отображены на диаграммах.
Рис.1. Содержание общей АК, АК, ДАК и ДКГК в эритроцитах здоровых детей и детей, страдающих ИЗСД (мг%)Рис. 2. Содержание общей АК, АК, ДАК и ДКГК в эритроцитах взрослых, страдающих ИЗСД (мг%)
Как следует из полученных результатов, в эритроцитах детей и взрослых, страдающих ИЗСД, наблюдается увеличение содержания окисленной форма АК-ДАК, что может свидетельствовать о нарушении процесса восстановления АК в ДАК, большем участии АК в метаболических процессах, нарушении транспорта АК в клетке.
Процентное содержание общей АК, АК, ДАК и ДКГК также демонстрирует превалирование окисленных форм АК над восстановленной.
Рис. 3. Содержание общей АК, АК, ДАК и ДКГК в эритроцитах здоровых детей и страдающих ИЗСД (%).
Рис. 4. Содержание общей АК, АК, ДАК и ДКГК в эритроцитах взрослых, страдающих ИЗСД (%).Все полученные данные согласуются с данными литературы об изменении общего количества АК в организме при патологии (нормальное содержание составляет 5 – 15 мг%) и соотношения «окисленная форма АК/восстановленная форма АК» в сторону увеличения первой.
1. Содержание общей АК в эритроцитах детей и взрослых, страдающих ИЗСД, составляет 19.52 мг% и 6,47 мг%, в эритроцитах здоровых детей – 12.48 мг%.
2. Содержание восстановленной АК в эритроцитах больных детей и взрослых составляет 4.1 и 2,01 мг% (20.5 и 31% от общей АК), в эритроцитах здоровых детей – 4.28 мг% (33%).
3. Содержание окисленных форм АК – ДАК и ДКГК в эритроцитах больных детей и взрослых составляет 15.5 и 4.46 мг% (79.5 и 69% от общей АК), в эритроцитах здоровых детей – 8.36 мг% (67%).
4. В общей эритроцитарной массе больных детей соотношение окисленная форма АК/ восстановленная форма АК составляет 4/1, что свидетельствует о превалировании окисленной формы АК над восстановленной.
5. В общей эритроцитарной массе здоровых детей это соотношение равно 2/1, т.е., налицо тенденция к росту содержания восстановленной АК.
Заключение
Уже давно доказали тот факт, что аскорбиновая кислота является постоянной составной частью тканей и органов человека. Важность выполняемых ею физиологических функций не подлежит сомнению. Некоторые из них давно известны и хорошо изучены. Например, то, что витамин С оказывает благоприятное воздействие на работу иммунной системы, нормализует эритропоэз и продукцию коллагена, является компонентом антиоксидантной системы клетки. Однако многочисленные исследования недавнего времени показали, что возможности этого вещества гораздо шире, чем представлялось до сих пор. К примеру, было обнаружено ценное свойство аскорбата нормализовать уровень сахара в крови, оказывая положительное воздействие на углеводный обмен. При выполнении этой и других биохимических функций аскорбиновая кислота обратимо окисляется в ДАК, при последующем воздействии окислителя необратимо переходит в ДКГК. По данным литературы, соотношение «окисленная форма АК/восстановленная форма АК» может изменяться при различных патологиях, как и ее общее содержание в организме. Одной из распространенных патологий является инсулинзависимый сахарный диабет. Поскольку ИЗСД является эндокринной патологией, протекающей с нарушением углеводного обмена, в регуляции которого аскорбат играет немаловажную роль, было бы логичным предположить, что его содержание в организме больного окажется иным, чем у здорового человека. Экспериментальные данные подтвердили это предположение. В организме больного ребенка содержание общей АК повышено на 37 % по сравнению с общей АК и составляет 19,52 мг%, тогда как нормальным считается наличие от 5 до 15 мг% аскорбата. Среднее значение АК у здорового ребенка – 12,48 мг%. В то время как содержание ДКГК в процентном соотношении практически не изменено и составляет у больных и здоровых детей 46 и 49,4 % соответственно (6,16 мг% и 8,96 мг%), концентрация ДАК у больных детей повышена против здоровых почти вдвое и составляет 33,5 % вместо 17,6 % (6,54 мг% и 2,2 мг%). Основные различия выявляются в процентном содержании восстановленной формы АК. Ее содержание у здоровых детей составляет 33 % общей АК (4,28 мг%), тогда как у больных детей оно ниже на 13 % и составляет 4,1 мг%. Таким образом, соотношение «окисленная форма АК/восстановленная форма АК» у больных детей составляет 4:1, в отличие от здоровых детей, у которых оно равняется 2:1.
На основании этих данных можно предположить следующие причины подобных изменений содержания общей АК и ее метаболических форм в организме больных ИЗСД детей:
1) При ИЗСД нарушены все виды обмена веществ в организме – углеводный, белковый и жировой. В последнем случае возрастает количество свободных радикалов, вследствие чего АОС испытывает большую нагрузку. Возрастает содержание одного из ее компонентов – аскорбата, он более активно включается в метаболические процессы, возможно, тем самым в какой-то мере компенсируется снижение концентрации другого ее компонента – С-SH;
2) Почти двукратное возрастание уровня ДАК в организме больного ребенка при практически неизменном количестве ДКГК может свидетельствовать о нарушении процесса восстановления ДАК в АК; возможно снижена активность фермента ДАК – редуктазы. При ИЗСД ее активность снижена на 50 %, что приводит к сокращению содержанияС-SH, необходимого для процесса восстановления ДАК в АК. Одновременно снижается активность ГБФДГ, в реакции которой образуется необходимый для работы С-R NADPH;
3) Нарушение транспорта АК в клетке.
Несколько иная картина наблюдается в отношении взрослых, страдающих ИЗСД. Здесь общее содержание АК находится близко к нижнему пределу нормы и составляет 6,47 мг%. Содержание ДКГК составляет 11,4 % (0,73 мг%), ДАК – 57,6 % (3,73 мг%), АК – 31 % (2,01 мг%). Сопоставляя эти показатели с таковыми у детей, можно заключить, что активное участие АК в работе АОС решено не количественным, а качественным путем. Так, доля неактивной ДКГК составляет 11 %, тогда как на долю метаболически активных АК и ДАК приходится 89 % от общего количества АК. Такое превалирование активных форм АК особенно в сочетании с повышенным содержанием АК может указывать на своеобразную «адаптацию» фермента ДАК-редуктазы в ходе многолетнего лечения болезни (свыше 10 лет). Для подтверждения данных предположений и выяснения механизма приспосабливаемости (если таковая имеется) необходимы дальнейшие исследования.
В настоящее время определенно сказать можно следующее: страдающие ИЗСД, особенно дети, в процессе лечения нуждаются в проведении антиоксидантной терапии.
1. Абрамова Ж.И., Оксенгендлер Г.И. Человек и противоокислительные вещества. –Л.:Наука, 1985. –230 С.
2. Авраамова Т.В., Титова Н.М. Руководство по большому биохимческому практикуму. –Красноярск: Изд-во КГУ, 1978, ч.1. –С.80-82.
3. Асатиани В.С. Ферментные методы анализа. –М.:Наука, 1969. –С.26-40.
4. Ахромеева Г.И. Определение дегидроаскорбиновой кислоты в пищевых продуктах //Вопросы питания. –1988. -№3. –С.66-88.
5. Ашкинази И.Я. Разрушение эритроцитов // Физиология системы крови. Физиология эритропоэза. –Л.:Наука, 1979. –С.274-334.
6. Березовский В.М. Химия витаминов. –М.:Пищевая промышленность, 1973. –С.230-300.
7. Борец В.М. Витамины. –М.:Наука, 1980. –29 С.
8. Бохински Р. Современные воззрения в биохимии. –М.:Мир, 1987. –С.120-154.
9. Браунштейн А.Е. Процессы и ферменты клеточного метаболизма. –М.:Наука, 1987. –44С.
10.Бременер С.М. Витамины. –М.:Медицина, 1974. –194С.
11.Бреслер В.М., Никифоров А.А. Транспорт органических кислот через плазматические мембраны дифференцированных эпителиальных слоёв у позвоночных. –Л.:Наука, 1981. –С.52-111.
12.Букин В.Н. Биохимия витаминов. –М.:Наука, 1982. –С.17-19.
13.Владимиров Г.Е. Об энергетической функции АТФ в клетке. –Л.:Наука, 1980. –44С.
14.Гаврилов О.К., Козинец Т.И., Черняк Н.В. Клетки костного мозга и периферической крови. –М.:Медицина, 1985. –288С.
15.Галактионов С.Г. Биологически активные. –М.:Молодая гвардия, 1988. –С.4-84.
16.Григорьев Г.П. Цитохром Р-450 и витамин С //Вопросы питания. –1983. -№4. –С.5-10.
17.Дегли С., Никольсон Д. Метаболические пути. –М.:Мир, 1973. –С.189-196.
18.Домбровская Ю.В. Витаминная недостаточность у детей. –М.:Медицина, 1983. –63С.
19.Ефимов А.С., Бездробный Ю.В. Структура и функции инсулиновых рецепторов. –Киев.:Наукова думка, 1987. –С.4-104.
20.Канунго М. Биохимия старения. –М.:Медицина, 1982. –194С.
21.Киверин М.Д. Витамин С и профилактика С-витаминозных состояний на Севере. –Сев.-Зап. книжное изд., 1971. –С.5-7.
22.Кон Р.М. Ранняя диагностика болезней обмена веществ. –М.:Медицина, 1986. –С.17-42.
23.Косяков К.С. Клиническая биохимия. –Л.:Медицина, 1997. –С.113-118.
24.Меньщикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы радикальных окислительных процессов // Усп. совр. биол. –1993. –№4. –С.442-455.
25.Мережинский М.Ф. Нарушения углеводного обмена при заболеваниях человека. –Минск.:Медицина, 1987. –С.22-28.
26.Моисеева О.И. Физиологические механизмы регуляции эритропоэза. –Л.:Наука, 1985. –185С.
27.Мосягина Е.Н., Владимирская Е.Б. Кинетика эритрона //Кинетика ферментативных элементов крови. –М.:Медицина, 1976. –С.101-122.
28.Мосягина Е.Н., Фёдоров Н.А., Гудим В.И. Эритропоэз // Нормальное кроветворение и его регуляция /Под ред. Н.А.Фёдорова. –М.:Медицина, 1976. –С.341-457.
29.Новое в гематологии /Под ред.А.И. Воробьёва, Ю.И.Лория. –М.:Медицина, 1974. –С.18-22.
30.Новикова С.Г. На приёме больной сахарным диабетом //Здоровье. –1997. -№3.-С.14-19.
31.Спиричев В.Б. Врождённые нарушения обмена витаминов. –М.:Медицина, 1995. –С.12-19.
32.Патологическая биохимия /Под ред. А.Ф. Симёнова. –М.:Медицина, 1994. –С.130-147.
33.Рубина Х.М. Биохимия эритроцитов //Физиология системы крови. Физиология эритопоэза. –Л.:Наука, 1978. –С.211-232.
34.Рубина Х.М. Некоторые данные о связи метаболизма эритроцитов с их кислородно-транспортной функцией //Проблемы гематологии и переливания крови. –1973. -№8. –35С.
35.Рысс М.Н Витамины. –Л.:Наука, 1963. –С.3-9.
36.Свободные радикалы в биологии /Под ред. У.Прайор. –М.:Мир, 1979. –С.272-308.
37.Смирнов Н.И. Витамины. –М.:Медицина, 1974. –С.34-40.
38.Соколовский В.В., Лебедева Л.В., Лиэлуп Т.Б. Определение аскорбиновой, дегидроаскорбиновой и дикетогулоновой кислот в биологических тканях // Лаб.дело. –1967. -№12. –С.160-162.
39.Суровова А.П. Витамины в нашем рационе // Здоровье. –1997. -№2. –С.17-20.
40.Схимниковский Б.Г. Авитаминозы у детей //Здоровье. –1998. -№6. –С.11-13.
41.Черницкий Е.А., Воробей А.В. Структура и функции эритроцитарных мембран. –Минск: Наука и техника, 1981. – С.23-56.
42.Черняк Н.Б. Биохимические процессы при созревании и старении эритроцитов //Нормальное кроветворение и его регуляция. –М.:Медицина,1976. –С.159-186.
43.Baker W.I. Urate and ascorbate: their possible roles as antioxidants in determining longevity of mammalian species //Arch. Biochem. and Biophis. –1987. -№2. –Р.451-457.
44.Basu S., Som S., Ded S. Dehydroascorbic acid reduction in human erythrocytes //J. Chromatogr. Biomed. Appl. –1991. -№1-2. –Р.529-542.
45.Burns J., Evans C. Ascorbic acid in human erythrocytes // J. Biol. Chem. – 1996. - №4. – P. 223-241.
46.Penney J., Zilua S. Role of ascorbate in our organism // J. Biochem. – 1994. - №2. – P. 37-49.
47.Pradhu H.R., Krishnamurthy S. Inhibition of ascorbate autooxidation by human blood //Curr. Sci. (India). –1986. -№8. –Р.403-405.
48.Sahashi Y., Mioki T., Hasegama T. Reduction of ascorbate in erythrocytes // J. Vitaminol. – 1996. - №12. – P.6 – 14.
49.Thompson R.Q. Ascorbic acid content of plasma and cellular components of blood //Anal.Chem. –1987. -№8. –Р.1119-1121.
50.Yamazaki M., Mioki T. Ascorbic acid is cellular components // J. Ferment. Technolog. – 1995. - №7. – P. 422-513.
The main aim of this work is the study of concentration ascorbic acid, dehydroascorbic acid and DCGA in the human’s erythrocytes. The concentrations of the AA, DAA & DCGA were learned in the common erythrocytes mass.
Our results showed that concentration of AA is lower that concentration of DAA, DCGA.
Содержание АК, ДАК и ДКГК в эритроцитах детей, страдающих инсулинзависимым сахарным диабетом (мг%)
| № |
S АК |
ДКГК |
ДАК |
АК |
| 1 |
27,32 |
13,06 |
7,9 |
6,36 |
| 2 |
27,68 |
16,66 |
8,9 |
2,12 |
| 3 |
12,56 |
5,3 |
3,52 |
3,74 |
| 4 |
17,86 |
10,02 |
4,16 |
3,68 |
| 5 |
19,78 |
11 |
6,36 |
2,42 |
| 6 |
17,84 |
10,66 |
6,70 |
0,84 |
| 7 |
26,64 |
12,14 |
7,8 |
6,7 |
| 8 |
13,18 |
4,14 |
3,88 |
5,16 |
| 9 |
18,04 |
10,26 |
4,40 |
3,38 |
| 10 |
19,74 |
11,12 |
6,22 |
2,4 |
| 11 |
27 |
16,94 |
8,06 |
2 |
| 12 |
18,14 |
10,8 |
6,82 |
0,52 |
| 13 |
19,76 |
8,48 |
4,24 |
7,04 |
| 14 |
14,82 |
8,32 |
5,30 |
1,2 |
| 15 |
27,52 |
8,48 |
9,32 |
9,68 |
| 16 |
17,01 |
8,15 |
6,8 |
2,06 |
| 17 |
19,5 |
7,01 |
9,1 |
3,39 |
| 18 |
16,4 |
6,4 |
5,43 |
4,57 |
| 19 |
17,7 |
5,22 |
7,92 |
4,56 |
| 20 |
12,4 |
4,81 |
6,1 |
1,49 |
| 21 |
16,33 |
7,49 |
6,4 |
2,44 |
| 22 |
17,77 |
6,29 |
9,2 |
2,21 |
| 23 |
23,27 |
10,01 |
7,6 |
5,66 |
| 24 |
18,8 |
7,26 |
8,13 |
3,41 |
| 25 |
20,5 |
8,16 |
7,3 |
5,04 |
| 26 |
22,55 |
9,25 |
6,24 |
7,06 |
| 27 |
17,74 |
9,14 |
6 |
2,6 |
| 28 |
19,22 |
7,17 |
7,3 |
4,75 |
| 29 |
16,38 |
6,19 |
6,29 |
3,9 |
| 30 |
24,14 |
10,21 |
7,24 |
6,69 |
| 31 |
16,88 |
8,19 |
5,3 |
3,39 |
| 32 |
19,02 |
9,14 |
4,9 |
4,98 |
| 33 |
19,74 |
6,7 |
7,16 |
5,88 |
| 34 |
22,16 |
10,2 |
8,12 |
3,84 |
| 35 |
16,01 |
6,9 |
5,49 |
3,62 |
| 36 |
13,3 |
7,1 |
4,2 |
2,08 |
| 37 |
19,2 |
9,03 |
6,59 |
3,58 |
| S |
19,52 |
8,96 |
6,54 |
4,1 |
| % |
100 |
46 |
33,5 |
20,5 |
Приложение 2
Содержание АК, ДАК и ДКГК в эритроцитах детей, страдающих инсулинзависимым сахарным диабетом и здоровых детей
       формаS АКДКГК ДАК АК S АК ДКГК ДАК АК формаS АКДКГК ДАК АК S АК ДКГК ДАК АК
АК М±m М±m М±m М±m М±m М±m М±m М±m
С 19.52 8.96± 0.9 6.54± 0.49 4.1± 0.04 12.48±0.5 6.16± 1.01 2.2 ± 0.56 4.28 ± 0.82
±0.89
% 100 46 33.5 20.5 100 49.4 17.6 33
Р <0.01 <0.05 <0.01 <0.01 <0.01 <0.05 <0.01 <0.01
|