Prostaglandines in ophthalmology
Prostaglandines are the group of biological active substances having influence on different processes in organism. They were discovered by Swedish scientists in 30–ths years of XX century. The prostaglandine effects realize by means of specific receptors. There are five main types of the receptors. FP receptors are most spreading in eye tissues. Prostaglandines take part not only in inflammation reaction, but have influence on blood–aqueous barrier penetration and on IOP level.
The discovery of prostaglandines influence on IOP level gave the opportunity to use them as a medicines. Prostaglandines lower IOP because of uveoscleral outflow increasing. There are two remedies – Rescula and Xalatan – today. Clinical research and experience show that xalatan has more strong IOP lowering effect. Preliminary research discovers possible neuroprotective effects of prostaglandines.
П
ростагландины – группа биогенных веществ, которые оказывают влияние на различные процессы в организме. В 1930–х годах У. Эйлер установил, что сперма человека и животных способна вызывать сокращение гладких мышц различных органов. Так как Эйлер предполагал, что эти вещества образуются в предстательной железе, он назвал их простагландинами (ПГ). Позже, в 1957 г. С. Бергстрем выделил ПГ из бараньих семенных пузырьков в кристаллическом виде и через несколько лет установил их структуру. В последующем ПГ были выделены из всех тканей животных, микроорганизмов.
По химическому строению простагландины относятся к 20–углеродным жирным кислотам, содержащим 5–углеродное лактонное кольцо (рис. 1). По строению этого кольца ПГ делят на подгруппы: ПГD, ПГE, ПГF, ПГ I (простациклины), TxA2
(тромбоксан) и др. Кроме того, при обозначении классов ПГ у каждой буквы указывается цифровой индекс, обозначающий общее число двойных связей в боковых углеводородных цепях, и индекс a или b, обозначающий расположение ОН–группы в положении С–9 по отношению к горизонтальной плоскости молекулы.
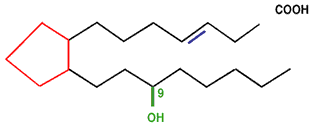
Рис. 1. Схема химического строения простагландинов
Источником для образования ПГ являются ненасыщенные жирные кислоты (НЖК), которые поступают в организм с пищей и в фосфорилированном виде входят в структуру мембран клеток. При нарушении структуры клеточных мембран из НЖК под воздействием фосфолипазы А2
образуется арахидоновая кислота. К увеличению содержания свободных НЖК приводят различные патогенные воздействия, вызывающие разрушение клеточных мембран. В физиологических условиях выходу НЖК способствуют катехоламины, брадикинин, ангиотензин II и другие факторы, активизирующие фосфолипазы. Под воздействием фермента циклооксигеназы из арахидоновой кислоты образуются первичные эндоперекиси (нестабильные простагландины). В последующем под влиянием антиокислительных систем клеток к кислороду присоединяется водород с образованием гидроксилов в кольце и боковых цепях и формируется молекула стабильных ПГ. Простагландины быстро метаболизируются во всех тканях, особенно в легких, печени, почках, селезенке. Схематично процесс образования ПГ изображен на рис. 2.

Рис. 2. Процесс образования простагландинов
ПГ являются активными веществами и в малых количествах выполняют регуляторную роль в клетках и тканях. Регуляция осуществляется с помощью образования молекул ПГ стимулирующего и тормозящего типа действия или путем изменения концентрации одного и того же ПГ. Например, ПГЕ2
расслабляет гладкие мышцы бронхов, а ПГF2a
вызывает их спазм. Простагландины F2a
и Е2
в малых (пороговых) дозах уменьшают спазм сосудов, а в больших дозах увеличивают его.
Регулирующее влияние ПГ осуществляется через модулирование активности (повышение или понижение) рецепторов клеток, изменение образования внутриклеточного медиатора цАМФ, изменение кинетики кальция в клетке.
В последние годы было выявлено несколько типов простагландиновых рецепторов, специфичных для разных классов ПГ. Наиболее широко в тканях глазного яблока человека представлены FP–рецепторы, которые были обнаружены в цилиарной мышце и эпителии, в трабекулярной ткани, в меланоцитах радужки и в эпителии капсулы хрусталика.
Классификация простагландиновых рецепторов и их распределение в тканях глаза представлены в табл. 1.

В настоящее время практически расшифрована структура некоторых простагландиновых рецепторов. Существование классов простагландиновых рецепторов обусловлено различным аминокислотным составом белковой молекулы. Однако их расположение в клеточной мембране сходно (рис. 3.). Они состоят из семи гидрофобных сегментов, которые погружены в клеточную мембрану. Молекула белка, образующего рецептор, имеет три петли, которые находятся на наружной поверхности клеточной мембраны, и три петли на внутренней поверхности мембраны. Один конец белковой молекулы, содержащий аминогруппу, находится на поверхности клетки, а другой конец, содержащий карбоксильную группу, находится во внутриклеточном пространстве.
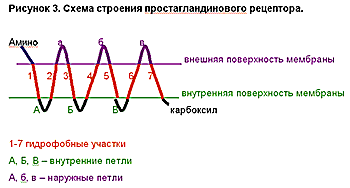
Рис. 3. Схема строения простагландинового рецептора
В организме человека простагландины играют огромную роль не только в развитии воспалительной реакции, вызывая усиление проницаемости сосудистой стенки, развитие болевого синдрома и повышение температуры тела. Они усиливают перистальтику кишечника, сокращение миометрия и гладких мышц сосудов, вызывают спазм бронхов, играют важную роль в агрегации тромбоцитов. По данным ряда авторов, ПГF способны тормозить фоновую активность в нейронах коры головного мозга.
Как и в других органах, в тканях глазного яблока ПГ участвуют в развитии воспаления, усиливая экссудативные процессы и гиперемию, вызывают сокращение сфинктера зрачка. Кроме того, они изменяют проницаемость гематоофтальмического барьера, что может способствовать развитию отека макулы.
Открытие влияния ПГ на офтальмотонус позволило начать их использование в качестве терапевтических препаратов. Ряд исследователей обнаружили, что при местном применении ПГE и ПГF вызывают снижение ВГД. Эффект ПГF и особенно их аналогов оказался более выраженным. Снижение офтальмотонуса при местном применении ПГ происходит вследствие усиления увеосклерального оттока водянистой влаги.
Согласно последним данным, усиление увеосклерального оттока связано с разрежением экстрацеллюлярного матрикса (ЭЦМ) ресничной мышцы. Взаимодействуя со специфическими рецепторами, простагландины F2a
вызывают усиление секреции матричных металлопротеаз (ММП) в тканях цилиарной мышцы. ММП секретируются, как неактивные проэнзимы, экстрацеллюлярно они превращаются в активные ферменты, которые могут разрушать фибриллы коллагена, в результате чего происходит разрежение ЭЦМ.
В 1994 г. в Японии впервые появился лекарственный препарат, который по химической структуре являлся аналогом ПГF2a
. Данный препарат получил торговое название Рескула – это 0,12% раствор унопростона изопропила, являющегося природным метаболитом простагландина F2a
. Через 2 года в США был зарегистрирован новый препарат Ксалатан
, содержащий 0,005% раствор латанопроста – синтетический фенил–замещенный аналог ПГF2a
.
Оба препарата являются пролекарствами, которые при прохождении через ткани роговицы под воздействием энзимов гидролизируются до активных кислот.
Латанопрост и унопростон обладают разной селективностью по отношениию к FP–рецепторам и разной липофильностью. Латанопрост более липофилен, и поэтому он более легко проникает через роговицу. Как показали сравнительные исследования сродства унопростона, естественного ПГF2a
и латанопроста по отношению к FP–рецепторам, естественный ПГ и латанопрост проявили одинаково высокую селективность по отношению к FP–рецепторам, в то время как сила действия и селективность унопростона была в 10 раз ниже.
На сегодняшний день в мире, в том числе и в России, проведены широкие клинические испытания эффективности обоих препаратов.
Сравнительные 6–месячные клинические исследования эффективности 0,12% унопростона и 0,5% тимолола (оба препарата применялись 2 раза в день) показали, что снижение ВГД на фоне терапии унопростоном составило 3–4 мм рт. ст., в то время как у больных, получавших тимолол, – 4–5 мм рт. ст.
При сравнении эффективности 0,12% унопростона, 0,5% тимолола и 0,5% бетаксолола у больных ПОУГ в течение 6 месяцев было выявлено, что наибольшим гипотензивным действием обладал тимолол (в среднем ВГД снизилось на 5–6 мм рт. ст.), бетаксолол и унопростон обладали приблизительно одинаковой эффективностью (в среднем снижение офтальмотонуса составило 5 мм рт. ст. в группе бетаксолола и 4–5 мм рт. ст. в группе унопростона).
Изучение возможности комбинированного применения унопростона показало, что эффективность комбинации унопростона и тимолола сравнима с гипотензивным эффектом комбинации латанопроста и плацебо.
Унопростон является декосоноидом, который образуется при метаболизме декосохеноидной кислоты (DHA). DHA относится к классу НЖК, как и арахидоновая кислота, принимает участие в образование ПГ. Она содержится в сетчатке и входит в состав мембран фоторецепторов.
Проведенные экспериментальные исследования влияния различных концетраций унопростона на сохранение ганглиозных клеток сетчатки при ее ишемии показали, что унопростон оказывает нейропротекторное действие. Однако широких исследований нейропротекторного действия унопростона не проводилось.
Сравнительные исследования эффективности 0,5% раствора тимолола малеата, применяемого 2 раза в день, и 0,005% раствора латанопроста, используемого 1 раз в день, показали, что латанопрост у большего числа больных и в большей степени снижает офтальмотонус. По данным Alma, у 56% больных, получавших латанопрост, ВГД было ниже или равно 17 мм рт.ст., а у 27% пациентов оно было ниже 15 мм рт.ст. В группе тимолола малеата только у 38% больных офтальмотонус был ниже 17 мм рт.ст. и у 14% – ниже 15 мм рт.ст.
Двойные слепые клинические исследования показали, что снижение офтальмотонуса на фоне применения латанопроста в течение 6 мес составило 8,0±0,1 мм рт.ст., а в группе тимолола ВГД уменьшилось на 6,7±0,1 мм рт.ст. Разница между двумя методами лечения составила 1,3 мм рт.ст.
Гипотензивное действие латанопроста более выражено по сравнению с 2% раствором дорзоламида гидрохлорида, применяемого 3 раза в день. По данным Hartleben, офтальмотонус был ниже 18 мм рт.ст. у 46% больных, получавших латанопрост, и только у 9% пациентов, использовавших дорзоламид.
Латанопрост более эффективен по сравнению с комбинацией тимолола и пилокарпина. Офтальмотонус снизился на фоне применения латанопроста в среднем на 5,4±0,3 мм рт.ст., а у больных, получавших комбинацию тимолола и пилокарпина, снижение ВГД составило 4,9±0,4 мм рт.ст. [7, 8].
Монотерапия латанопростом оказалась более эффективной по сравнению с комбинированным применением тимолола и дорзоламида. Через 3 мес лечения латанопростом ВГД уменьшилось на 5,2 мм рт.ст. (23% от исходного уровня). В группе больных, получавших комбинацию тимолола и дорзоламида, уменьшение офтальмотонуса составило 4 мм рт.ст. (17% от исходного уровня).
Таким образом, клинические исследования и практический опыт выявили более высокую эффективность латанопроста по сравнению с унопростоном.
Кроме того, учитывая, что терапия глаукомы носит длительный характер, выраженный эффект латанопроста, позволяющий у значительного числа больных достигать компенсации ВГД на фоне монотерапии, и удобный режим инстилляций препарата существенно улучшают качество жизни больных глаукомой.
Конечно, на сегодняшний день изучены далеко не все эффекты ПГ. Наиболее перспективным представляется изучение их нейропротекторного действия.
Литература:
1. Е.А. Егоров, О.А. Романова. Перспективы применения аналога простагландина F2a – латанопроста в гипетензивной терапии глаукомы.// Вестн. Офтальм., 1998; 4:19–20.
2. А.Н. Кудрин. «Фармакология» М. 1991.
3. A. Alm. Uveoscleral outflow.//Mostby–Wolf,1998.
4. M. Diestelhost (Ed.) Prostaglandins in ophthalmology.// Kaden Veglar, 1998.
5. Rescula Product Monograph.2000.
|