|  СОДЕРЖАНИЕ СОДЕРЖАНИЕ
Задание для курсового проекта
Введение ………………………………………………………... 4
1.Теоретические основы процесса………………………………5
1.1.Физико-химические основы воды………………………..10
1.2.Физико-химические свойства этилового спирта………...12
1.3.Техника безопасности……………………………………..15
2.Расчёт теплообменника………………………………………..16
3.Заключение……………………………………………………..22
4.Список использованных источников…………………………23
5.Приложение…………………………………………………….24
ВВЕДЕНИЕ
Значение и развитие химической промышленности.
Значение химической промышленности определяется тем, что она обеспечивает народное хозяйство огромным количеством продуктов, без которых была бы невозможна жизнь современного общества.
Химическая переработка ископаемого топлива, то есть каменного угля, нефти, природного газа, торфа и сланца, позволяет получить такие важнейшие продукты , как кокс, моторные топлива, смазочные масла, горючие газы и большое количество органических веществ. Без кокса невозможна современная металлургия, а следовательно, и все зависящие от неё отрасли хозяйства, в том числе машиностроение. Без бензина, лигроина и других моторных топлив была бы невозможна работа авиационного и автомобильного транспорта. Велико значение горючих газов в быту и промышленности, как беззольного, так и бездымного топлива. На базе органических веществ, полученных при переработке природных газов, нефти, угля, торфа и сланца, производятся красители, лаки, лекарственные препараты, спирты, взрывчатые вещества и другие продукты, потребляемые в самых различных производствах и в быту. Особенно большое значение имеют получаемые из продуктов переработки топлива высокомолекулярные синтетические материалы - смолы, используемые для производства пластических масс, синтетических волокон и каучуков.
Из угля (природных газов), воды и воздуха на химических заводах получают аммиак и азотную кислоту, а из них производят минеральные удобрения, различные синтетические вещества и другие материалы. Серная кислота, получаемая из природных минералов – серного колчедана или серы, применяется во многих производствах. При помощи её нерастворимые в воде минералы – апатит или фосфорит – перерабатывают в суперфосфат или другие фосфорные удобрения. Производство цветных металлов и машиностроение, текстильная, кожевенная и пищевая промышленности потребляют серную
кислоту или её соли. На транспорте применяют сернокислотные (свинцовые) аккумуляторы.
Из поваренной соли получают соляную кислоту, соду, едкий натр (гид-
роксид натрия) и хлор, которые в свою очередь применяют в производстве
алюминия, стекла, мыла, бумаги, хлопчатобумажных и шерстяных тканей,
пластических масс, искусственного волокна. Большое количество ценных
продуктов получают при химической переработке дерева, в том числе шёлк и штапель, бумагу, пластические массы, бездымный порох, активный уголь, уксусную кислоту, метиловый и этиловый спирты, скипидар, канифоль, ацетон. Химическими способами производят радиоактивные вещества, используемые в атомной энергетике.
Продолжается всестороннее развитие химической промышленности и в настоящее время. Особенно бурное её развитие происходит в восточных районах на базе имеющихся там богатых запасов сырья. Для новых заводов и реконструкции старых требуется громадное количество технически совершенного оборудования, поэтому быстро развивается химическое машиностроение. Новые крупные химические комбинаты производят на базе комплексного использования сырья разнообразные химические продукты; при этом происходит всё более тесное переплетение технологии неорганических и органических веществ и комбинирование химической промышленности, а также с производствами, относящимися к лёгкой и пищевой промышленности.
[4, с.8-10]
1.Теоретические основы процесса
Теплопередача – это наука о процессах распространения теплоты. Различают три различных способа переноса теплоты: теплопроводность, конвекцию и тепловое излучение. В реальных установках теплота передаётся комбинированным путём, однако вклад этих трёх составляющих в общий перенос теплоты неодинаков и определяется многими условиями: природой теплоносителя, агрегатным состоянием, температурным и гидродинамическим условиям и т.д.
В промышленности теплообмен между рабочими телами (теплоносителями) происходит в специально сконструированных аппаратах, которые называются теплообменниками. Они должны отвечать определённым общим требованиям: обладать высокой тепловой производительностью и экономичностью, обеспечивать заданные технологические условия процесса, быть просты по конструкции, компактны, обладать современным техническим и эстетическим дизайном, иметь длительный срок службы, соответствовать требованиям СНИП и ведомственным правилам Госгортехнадзора. Особые требования предъявляются к обеспечению надёжности работы аппаратов, возможности автоматического регулирования режимно-технологических параметров и аварийного отклонения.
В химической технологии теплообменные аппараты довольно широко распространены, применяются в различных производствах легкой и тяжелой промышленности. Для обеспечения того или иного технологического процесса применяются различные типы теплообменных аппаратов. Основную группу теплообменных аппаратов, применяемых в промышленности, составляют поверхностные теплообменники, в которых теплота от горячего теплоносителя передается холодному теплоносителю через разделяющую их стенку. Другую группу составляют теплообменники смешения, в которых теплота передается при непосредственном соприкосновении горячего и холодного теплоносителей.
Теплообменные аппараты классифицируются:
1. По назначению:
а) холодильники;
б) подогреватели;
в) испарители;
г) конденсаторы.
2. По конструкции:
- изготовленные из труб:
а) теплообменники «труба в трубе»;
б) оросительные теплообменники;
в) погружные змеевиковые;
г) тепобменники воздушного охлаждения;
д) из оребренных труб;
е) кожухотрубчатые теплообменники.
- с неподвижной трубной решеткой;
- с линзовым компенсатором;
- с плавающей головкой;
- с U-образными трубами.
3. По направлению движения теплоносителя:
а) прямоточные;
б) противоточные;
в) с перекрестным движением.
Кожухотрубчатые теплообменные аппараты используются для практической реализации таких процессов, как нагревание (охлаждение), конденсация и испарение. Соответственно аппараты называются теплообменниками, холодильниками, конденсаторами и испарителями.
Теплообменники предназначены для проведения процесса теплообмена между теплоносителями, которые не изменяют своего агрегатного состояния в процессе теплообмена: это газо-жидкостные и жидкостно-жидкостные аппараты для проведения процессов охлаждения и нагревания.
Холодильники предназначены для охлаждения водой или другими нетоксичными, не пожаро- и не взрывоопасными хладагентами жидких и газообразных сред. Работают, как правило, в области минусовых температур.
В соответствии с ГОСТ 15120-79, ГОСТ 15118-79 и ГОСТ 15122-79 кожухотрубчатые теплообменники и холодильники изготавливают двух типов: «Н» - с неподвижными трубными решётками и «К» - с компенсатором температурных напряжений на кожухе.
Необходимость использования компенсатора определяется предельно-допустимой разностью температур стенок труб и кожуха, равной 50ºС или сравнительно большой длиной теплообменных труб (более 6м).
Конденсаторы предназначены для конденсации насыщенных паров. Обычно конденсацию осуществляют на наружной поверхности пучка труб в межтрубном пространстве. В химической промышленности для нагревания жидкостей и газов за счёт теплоты конденсации насыщенных паров чаще всего используется насыщенный водяной пар.
Испарители предназначены для проведения процессов испарения
жидкости при кипении. При этом жидкость кипит в трубах, а в межтрубное пространство подаётся греющий агент . .
В соответствии со стандартом, кожухотрубчатые испарители в этом случае могут быть только одноходовыми и вертикального исполнения [4].
Из нашего технического задания (см. выше) следует, что нам надо подобрать кожухотрубчатый теплообменник (подогреватель) для нагревания насыщенным водяным паром смеси этанол-вода до температуры кипения.
Исходя из условий, которые приведены в техническом задании целесообразно назначить теплообменник типа ТНВ (теплообменник с неподвижными трубными решётками, вертикальный) ГОСТ 15122-79.
Т.к. эти теплообменники используются при температуре жидких и газообразных сред от -70 до +3500
С от 0,6 до 16 МПа поверхность теплообмена от 1 до 5000 м2
[1].
Достоинства этого теплообменного аппарата:
а) простота конструкции;
б) непрерывная передача тепла от одного теплоносителя к другому;
в) интенсивный теплообмен.
Недостатки:
а) металлоемкость;
б) температурные деформации;
в) невозможность разборки и чистки трубного пространства.
В итоге для данного процесса необходимо подобрать теплообменник типа ТНВ по ГОСТ 15122-79 и провести для него тепловой, гидравлический и конструктивно-механический расчёты.
[6, с.423- 434; 9, с.1044-1050]
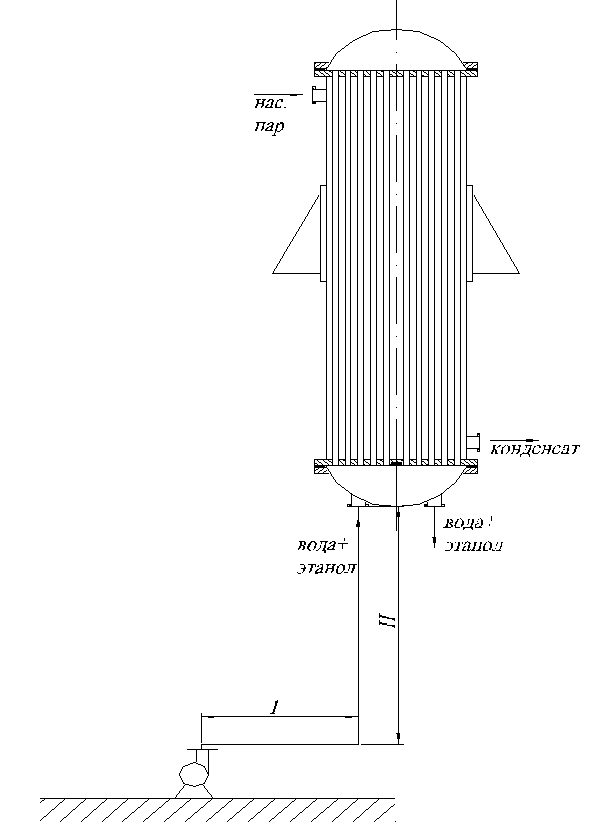
Рис.1:
Пример схемы теплообменного процесса.
 1.1.Физико-химические свойства воды 1.1.Физико-химические свойства воды
Вода - оксид углерода – Н2
О, молекулярная масса – 18,016, простейшее устойчивое соединение водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Изотопный состав.
Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (молекулярные %): 1
Н2
16
О -99,73; 1
Н2
18
О – 0,2; 1
Н2
17
О – 0,04; 1
Н2
Н16
О – 0,03; остальные 5 изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3
Н2
(или Т2
О). изотопный состав природной воды разного происхождения несколько варьирует. Особенно непостоянно отношение 1
Н/2
Н: в пресных водах – 6900, в морской воде – 5500, во льдах – 5500-9000.
Строение молекулы и физические свойства.
Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О-Н 0,0957 нм; валентный угол Н-О-Н 104,50
; дипольный момент 6,17*10-30
Кл*м; поляризуемость молекулы 1,45*10-3
нм3
; средний квадрупольный момент – 1,87*10-41
Кл*м2
, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы воды с другими атомами, молекулами и ионами, в том числе с другими молекулами воды в конденсирующих фазах, эти параметры изменяются.
Химические свойства.
Лишь незначительная доля молекул (при 250
С – 1 на 5*109
) подвергается электролитической диссоциации по схеме: Н2
О = Н+
+ ОН -
. Протон Н+
в водной среде, взаимодействуя с молекулами воды, образует Н3
О+
, объединяющийся с 1 молекулой Н2
О в Н5
О+
2
. Расстояние О…О в таких комплексах заметно короче длины нормальной водородной связи между нейтральными молекулами. Но поскольку протон находится не точно посередине этой укороченной связи, а ближе к одному из атомов О, можно считать, что в воде существует гидратированный ион оксония Н3
О+.
. Это явление играет большую роль в химических процессах, происходящих в различных системах, в том числе биологических. В частности, диссоциация воды – причина гидролиза солей слабых кислот и (или) оснований. Концентрация ионов Н+
и связанная с ней концентрация ионов ОН-
- важные характеристики водных растворов. Степень электролитической диссоциации воды заметно возрастает при повышении температуры.
Вода – реакционноспособное соединение. Она окисляется атомарным кислородом: Н2
О + О 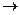 Н2
О2
. При взаимодействии воды с F2
образуется НF, а также О, О2
, О3
, Н2
О2
, F2
O и другие соединения. С остальными галогенами при низких температурах вода реагирует с образованием смеси кислот ННаl и ННаlО. При обычных условиях с водой взаимодействует до половины растворённого в ней Сl2
и значительно меньшие количества Вr2
и I2
. При повышенных температурах хлор и бром разлагают воду с образованием ННаl и Н2
О2
. При взаимодействии воды с F2
образуется НF, а также О, О2
, О3
, Н2
О2
, F2
O и другие соединения. С остальными галогенами при низких температурах вода реагирует с образованием смеси кислот ННаl и ННаlО. При обычных условиях с водой взаимодействует до половины растворённого в ней Сl2
и значительно меньшие количества Вr2
и I2
. При повышенных температурах хлор и бром разлагают воду с образованием ННаl и 
О2
. При пропускании паров воды через раскалённый уголь она разлагается и образуется так называемый водяной газ: Н2
О + С = СО + Н2
. При повышенной температуре в присутствии катализатора вода реагирует с СО, СН4
и другими углеводородами, например: Н2
О + СО = СО2
+ Н2
(cat. Fe); Н2
О + СН4
=СО + 3Н2
(cat.Ni или Co). Эти реакции используют для промышленного получения Н2
. Фосфор при нагревании с водой под давлением в присутствии
cat. окисляется в метафосфорную кислоту: 6Н2
О + 3Р 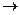 2НРО3
+ 5Н2
. Вода взаимодействует со многими металлами с образованием Н2
и соответствующего гидроксида. Со щелочными и щелочно-земельными металлами (кроме Мg) эта реакция протекает уже при комнатной температуре. Менее активные металлами разлагают воду при повышенной температуре , например, Мg и Zn – выше 1000
С, Fe – выше 6000
С (2Fe + 3H2
O 2НРО3
+ 5Н2
. Вода взаимодействует со многими металлами с образованием Н2
и соответствующего гидроксида. Со щелочными и щелочно-земельными металлами (кроме Мg) эта реакция протекает уже при комнатной температуре. Менее активные металлами разлагают воду при повышенной температуре , например, Мg и Zn – выше 1000
С, Fe – выше 6000
С (2Fe + 3H2
O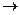 Fe2
O3
+ 3H2
). При взаимодействии с водой многих оксидов образуются кислоты или основания. Вода может служить cat., например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода – каталитический яд (для железного cat. при синтезе NH3
). Fe2
O3
+ 3H2
). При взаимодействии с водой многих оксидов образуются кислоты или основания. Вода может служить cat., например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода – каталитический яд (для железного cat. при синтезе NH3
).
Техническая вода.
Воду, расходуемую промышленными предприятиями, принято называть технической. Её применяют главным образом в качестве охлаждающего агента, транспортирующей среды для сыпучих материалов, растворителя. В целом по всем отраслям промышленности 70-75% от общего расхода воды применяют как хладагент по циркуляционной схеме. В этом случае вода лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей воды – вода, добавляемая в системы для восполнения неизбежных потерь, и атмосферный воздух, из которого вымываются в охладителях воды взвешенные вещества и газы, растворимые в воде.
Основными ионами, которые могут приводить к отложениям минеральных солей в системах, являются анионы НСО-
3
, СО2-
3
, ОН-
, SO2-
4
, РО3-
4
, SiO2-
3
, а также катионы Са2+
, Мg2+
, Fe2+*3+
, Аl3+
, Zn2+
. Наиболее часто встречающийся компонент солевых отложений – СаСО3
. Предотвратить отложение карбонатов можно подкислением воды Н2
SO4
или НСl, её рекарбонизацией (обычно обработка топочными газами, содержащими СО2
), действием полифосфатов (NaPO3
)6
и Na5
P3
O10
, органических фосфатов. Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в воду лобавляют ингибиторы коррозии: полифосфаты, ингибиторы на основе хромато-цинковых смесей. Для предупреждения обрастания оборудования бактериями воды в основном хлорируют (содержание Сl2
до 5 мл/л.), а иногда озонируют.
[8, с.763-769]

 1.2.Физико-химические свойства этилового спирта 1.2.Физико-химические свойства этилового спирта
Этиловый спирт (этанол) С8
Н6
О - бесцветная жидкость со своебразным запахом, легче воды Р=0,8г/см , кипит при t=78,30
С, хорошо растворяется в воде и сам является растворителем многих неорганических и органических веществ. Зная молекулярную формулу спирта и валентность элементов, можно представить его строение в виде двух структурных формул:
Н Н Н Н
Н-С-О-С-Н (1) Н-С-С-О-Н (2)
Н Н Н Н
Сопоставляя формулы, можно заметить, что если справидлива первая из них, то в молекуле спирта все атомы водорода
соединены с молекулами углерода , и можно предполагать,
что они одинаковы по свойствам . Если же истинна вторая
формула , то один атом водорода в молекуле соединён с атомом
углерода через кислород и он, по-видимому, будет отличаться
от других водородных атомов. Можно проверить
опытом, одинаковы или различны по свойствам атомы в спирте.
Помещают в пробирку со спиртом (не содержащий воды)
кусочек натрия. Начинается реакция, сопровождающаяся выделением газа. Нетрудно установить, что это водород. При
помощи другого, более сложного опыта можно определить,
сколько атомов водорода выделяется при реакции из каждой
молекулы спирта. В колбу с мелкими кусочками натрия
приливается по каплям из воронки определённое количество спирта. Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в цилиндр. Обьём вытесненной воды в цилиндре
соответствует обьёму выделившегося водорода.Опыт показывает, что из 0,1 моль спирта удаётся получить 1,12л. водорода. Это означает, что из 1 моль спирта натрий вытесняет 1,12л., т.е.
0,5 моль водорода. Иначе говоря, из каждой молекулы спирта натрием вытесняется только один атом водорода. Формула (1) не даёт обьяснения такому факту. Согласно этой формуле все атомы водорода равноценны. Наоборот, формула (2) отражает наличие одного атома, находящегося в особом положении: он соединён с атомом углерода через кислород; можно заключать, что именно этот атом водорода связан менее прочно. Он и вытесняется натрием. Следовательно, вторая из приведённых формул и будет структурной формулой этилого спирта. Чтобы подчеркнуть, что в молекуле спирта содержится гидроксильная группа-ОН, соединённая с углеводородным радикалом, молекулярную формулу этилового спирта часто пишут так: вторая из приведённых формул и будет структурной формулой этилого спирта. Чтобы подчеркнуть, что в молекуле спирта содержится гидроксильная группа-ОН, соединённая с углеводородным радикалом, молекулярную формулу этилового спирта часто пишут так:
СН3
-СН2
-ОН или С2 Н5ОН
Очивидно, здесь снова встречается влияние атомов друг
на друга. Чтобы понять сущность этого влияния, надо вернуться к электронному строению молекулы. Характер связей С-СuC-Н известен – это ковалентные q –связи. Атом О2
образует с атомом “H” и с углеводородным радикалом такие же связи, при этом его наружный электронный слой дополняется до октета.
Формулу спирта в таком случае можно изобразить так:
Н Н
Н С С О Н
Н Н
Однако распределение электронной плотности в молекуле спирта не такое равномерное, как в углеродах. Связь О-Н полимерная, так как наибольшая электронная плотность её смещена к атому О2
, как к элементу более электроотрицательному. Атом “Н” оказывается как бы более свободным от электронов, менее связанным с молекулой и поэтому может легко вытеснятся натрием. Смещение электронной плотности можно показать в формуле следующим образом:
Н Н
Н-С-С-О Н
Н Н
Химические свойства.
Спирты горят при поджигании, выделяет кислоту:
С 2
Н 5
ОН+3О2
-2СО+3Н 2
О+137Кдж.
 Легко воспламеняются синеватым почти не светящимся пламенем, и после сгорания их остаётся чёрный налёт. Легко воспламеняются синеватым почти не светящимся пламенем, и после сгорания их остаётся чёрный налёт.
Взаимодействие этилого спирта с натрием:
2С2Н5ОН+2Na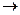 2C2Н5ОNa+H2 2C2Н5ОNa+H2
Продукт замещения водорода в этаноле называется этилатом натрия, он может быть выделен после реакции в твёрдом виде. Также реагируют со щелочными металлами другие растворимые спирты образуя соответствующие алкоголиенты .
Однако спирты к классу кислот не относятся, так как степень диссоциации их крайне незначительна, даже меньше чем у воды, их растворы не изменяют окраску индикаторов. Положение степени диссоциации спиртов по сравнению с водой можно обьяснить влиянием углеводородного радикала: смещение радикалом электронной плотности связи C–O в сторону атома кислород ведёт к увиличению на последнем уровне частичного отрицательного заряда вследствие чего он прочнее удерживает атом водорода. Можно повысить степень, если в молекулу ввести заместитель притягивающий к себе электроны химической связи.
У спиртов может вступать в реакцию не только гидроксильный атом водорода, но и вся гидроксильная группа. Если в колбе с присоеденённым к ней холодильником нагревать этиловый спирт с галогеноводородной кислотой, например, с бромоводородной (для образования бромоводорода берут смесь бромида калия или бромида натрия с серной кислотой), то через некоторое время можно заметить, что в пробирке под слоем воды собирается тяжёлая жидкость–бромэтан.
С2Н5ОН+НBr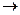 С2Н5Br+H2O С2Н5Br+H2O
Эта реакция тоже идёт с ионным расщеплением ковалентной связи С-О. Она напоминает реакцию оснований и этилового спирта, образуется бромистан. При нагревании с концентрированной кислотой в качестве катализатора спирты легко дигидратируются, т.е. отщепляют воду. Из этилового спирта при этом образуется этилен:
Н Н
Н –С –С –Н –СН2=СН2+Н2О
Н ОН
[9, с.994-997]
1.3.Техника безопасности
Этанол – растворитель в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, высокомолекулярных веществ. Сырьё в производстве диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов. Этанол из пищевого сырья часто используют для получения чистого этилена. Этиловый спирт – компонент антифриза, топливо для реактивных двигателей. В ряде стран – компонент автомобильного топлива: повышает октановое число, сокращает расход бензина, снижает содержание вредных веществ в выхлопных газах. Содержание этанола в автомобильном топливе в зависимости от сырьевой базы составляет от 10% в США до полной замены бензина этанолом в Бразилии.
Для технических целей часто используют денатурированный спирт (денатурат) – спирт-сырец, содержащий добавки красителя, окрашивающего этанол в сине-фиолетовый цвет, и специальных веществ, придающих ему неприятный запах и вкус; денатурат ядовит. В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов. Значительная часть этанола идёт на изготовление спиртных напитков.
Этиловый спирт чрезвычайно гигроскопичен, при концентрации выше 70% (по объёму) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении – алкоголизм.
Легко воспламеняется, температура самовоспламенения – 4040
С, пределы взрываемости: температурные 11-410
С, концентрационные 3,6-19% (по объёму), ПДК в атмосферном воздухе 5 мг/м3
, в воздухе рабочей зоны 1000 мг/м3
, ЛД50
9г/кг (крысы, перорально).
Наиболее крупные производители этанола (тыс. в год): Бразилия 7500 (1985), США 2700 (1986), Россия 1200 (1989), Великобритания 200 (1986), Япония 179 (1985).
Впервые этанол выделен из продуктов брожения в Италии в 11-12 вв.
Абсолютированный этанол получил перегонкой водного раствора над пота-
шом Ловиц Т.Е. (1796). В 1855г. Бертло М. синтезировал этиловый спирт че-
рез этилсерную кислоту. Производство синтетического этанола началось с
1930г. в США.
[9, с.997]
2.Расчёт теплообменника
Дано:
Хэт
= 0,4
Хв
= 0,6
Gсм
= 9000 кг/ч
t1
= 400
C
t2
= 600
C
T1
= 960
C
Gгр. в
= 20000кг/ч
1)Расход этанола равен:
Gэт
= Хэт
* Gсм
/3600, где (3)
[1,c.43]
Хэт
– объёмная доля этанола;
Gсм
– расход смеси;
3600 – перевод часа в секунды.
Gэт
= 0,4*9000/3600 = 1 (кг/с)
2)Расход воды:
Gв
= Хв
* Gсм
/3600, где
Хв
– объёмная доля воды.
Gв
= 0,6*9000/3600 = 1,5 (кг/с)
3)Расход греющей воды:
Gгр. в
= 20000/3600 = 5,556 (кг/с)
4)Таблица материального баланса:
| Приход (кг/с)
|
Расход (кг/с)
|
| Смесь
|
2,5
|
Этанол
|
1
|
| Греющая вода
|
5,556
|
Вода
|
1,5
|
| Греющая вода
|
5,556
|
| Всего:
|
8,056
|
Всего:
|
8,056
|
Gсм
= Gэт
+ Gв
= 1+1,5 = 2,5 (кг/с)
5)Теповая нагрузка теплообменника равна:
Q = Gсм
* Ссм
* (t2
– t1
), где (4)
[5, с.193]
Ссм
– удельная теплоёмкость смеси.
Ссм
= Сэт
* Хэт
+ Св
* Хв
, где (5)
[6, с.808]
Сэт
= 0,32 ккал/кг*град =0,32*4190 = 1340,8 Дж/кг*град
Св
= 4190 Дж/кг*град
Ссм
= 1340,8 * 0,4 + 4190 * 0,6 = 3050,32 (Дж/кг*град)
Q = 2.5*3050,32*(60-40) = 152516 (Дж/с) или (Вт)
6)Конечная температура воды рассчитывается по формуле:
Q = Gв
* Cв
* (T1
– T2
), где
T1
, T2
– начальная и конечная температуры воды соответственно.
T2
= T1
– Q/ Св
* Gв
T2
= 96-152516/4190*5,556 = 89,5 (0
С)
7)Средняя разность температур равна:
40 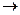 60 60
89,5 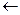 96 96
89,5-40 = 49,5 96-60 = 36
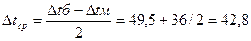 (0
С) (6) (0
С) (6)
[5, с.194]
8)Средняя температура смеси:
t ср.см
= 40+60/2 =50 (0
С)
9)Средняя температура воды равна:
t ср.в
= t ср.см +
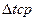 = 50+42,8 = 92,8 (0
С) = 50+42,8 = 92,8 (0
С)
10)Площадь трубного пространства:
Примем массовую долю смеси Wсм
= 200 кг/м2
*с, тогда площадь равна:
Sтр
= Gсм
/ Wсм
=2,5/200 = 0,0125 (м2
) (7)
 [5, с.195] [5, с.195]
Пусть количество труб n = 37, тогда внутренний диаметр трубки равен:
dвн
= 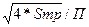 (8) (8)
[5, с.196]
dвн
= 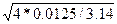 = 0,02 (м) = 0,02 (м)
Пусть толщина стенки трубки b будет равна 1см =0,001м, следовательно, на-
ружный диаметр равен:
dн
= dвн
+ 2*b (9)
[5, с.196]
dн
= 0,02+2*0,001 = 0,022 (м)
11)Критерий Рейнольдса для трубного пространства:
Reтр
= Wсм
* dэкв
/Мсм
, где (10)
[7, с.32]
dэкв
– эквивалентный диаметр;
Мсм
– вязкость смеси (этанол и вода).
dэкв.тр
= 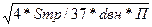 (11) (11)
[5, с.198]
dэкв.тр
= 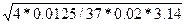 = 0,147 (м) = 0,147 (м)
Мсм
= 0,000545 (Н*сек/м2
)
[6, с.806-807]
Reтр
= 200*0,147/0,000545 = 53995
12)Критерий Прандтля для трубного пространства:
Prтр
= Mсм
*Cсм
/ λсм
, где (12)
[7, с.189]
λсм
– теплопроводность смеси (этанол и вода)
λсм
= 0,168 Вт/м*град
[6, с.810-811]
Prтр
= 0,000545 *3050,32 / 0,168 = 6,203
13)Критерий Нуссельта для трубного пространства:
Nuтр
= 0.023*Re0.8
*Pr0.4
(13)
 [7, с.192] [7, с.192]
Nu = 0.023*539950.8
*6.2030.4
= 249.7
14)Коэффициент теплоотдачи смеси равен:
α = Nu* λ / dэкв
(14)
[2, с.70]
α = 249,7* 0,168 / 0,147 = 285,4 (Вт/м2
*град)
15)Пусть диаметр кожуха Д = 0,25 м, тогда площадь межтрубного пространства равна:
Sмт
= П*Д2
/ 4 – 37*П*dн
2
/ 4 (15)
[6, с.444]
Sмт
= 3,14*0,252
/ 4 – 37*3,14*0,0222
/ 4 = 0,035 (м2
)
16)Эквивалентный диаметр межтрубного пространства равен:
dэкв.мт
=  (16) (16)
[6, с.445]
dэкв.мт
= 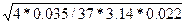 = 0,235 (м) = 0,235 (м)
17)Критерий Рейнольдса для межтрубного пространства:
Reмт
= Wв
* dэкв.мт
/Мв
, где
Мв
- вязкость воды;
Wв
– расход воды.
Мв
= 0,000357(Н*сек/м2
)
Wв
= Gв
/ Sмт
= 5,556/0,035 = 158,75(кг/м2
*с)
Reмт
= 158,75* 0,235 / 0,000357 = 104500
18)Критерий Прандтля для межтрубного пространства равен:
Prмт
= Mв
*Cв
/ λв
, где
λв
= 0,068 Вт/м*град
Cв
= 4190 Дж/кг*град
Prмт
= 0,000357 *4190 / 0,068 = 22
19)Критерий Нуссельта для межтрубного пространства:
Nuмт
= 1,16*( dэкв.мт
*Reмт
)0.6
* Prмт
0,33
(17)
[5, с.158]
Nuмт
= 1,16*( 0,235*104500)0.6
* 220,33
= 704,64
20)Коэффициент теплоотдачи воды:
α2
= Nuмт
* λв
/ dэкв.мт
α2
= 704,64* 0,068 / 0,235 = 203,896
21)Коэффициент теплопередачи:
К = ___________1_____________
1/ α + 1/ α2
+ b/λ + r1
* r2
, где (18)
[5, с.192]
r1
, r2
– коэффициенты загрязнения воды и смеси соответственно.
r1
= 0,0018 м2
*град/Вт
r2
= 0,0009 м2
*град/Вт
К = ___________1______________________________ = 88,8
1/ 285,4+ 1/ 203,896 + 0,001/17 + 0,0018 * 0,0009
22)Площадь теплообменника выводится из формулы:
Q = K*F*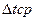 (19) (19)
[2, с.64]
F = Q / K*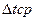
F = 152516/88.8*42.8 = 40.13 (м2
)
23)Длина трубок равна:
L = F/ n*П*dср
(20)
[5, с.192]
dср
= (dн
+ dвн
 ) / 2 ) / 2
dср
= (0,022 + 0,02 ) / 2 = 0,021(м) ) / 2 = 0,021(м)
L = 40,13/ 37*3,14*0,021 = 16,45(м)
Расчёт теплового баланса
Приход тепла со смесью:
Q1
= Gсм
* Cсм
* t1
Q1
= 2.5*3050.32*40 = 305032 (Вт)
Приход тепла с водой:
Q2
= Gв
*Cв
*Т1
= 5,556*4190*96 = 2234845 (Вт)
Расход тепла со смесью:
Q3
= Gсм
*Ссм
*t2
= 3050,32*2,5*60 = 457548 (Вт)
Расход тепла с водой:
Q4
= Gв
*Св
*Т2
= 5,556*4190*89,5 = 2083528 (Вт)
Потери в окружающую среду:
Qп
= 0,05*Q = 0,05*152516 = 7629 (Вт)
Результаты отражены в таблице теплового баланса:
| Приход тепла, Вт
|
Расход тепла, Вт
|
| Со смесью
|
305032
|
Со смесью
|
457548
|
| С водой
|
2234845
|
С водой
|
2083528
|
| Потери
|
7629
|
| Всего:
|
2539877
|
Всего:
|
2548705
|
(2539877+2548705)/2548705=0,04=4%
Расчёт верен.
[1, 2, 3, 4, 5, 6, 7]
3.Заключение
Развитие химической промышленности определяется в значительной степени совершенствованием химической техники. Техника химических производств развивается в основном в тех же направлениях, что и в других отраслях промышленности. Главной целью технического прогресса является
повышение производительности труда с одновременным улучшением качест-
ва продукции и снижением её себестоимости. Основные взаимосвязанные на-
правления развития химической техники: 1)увеличение масштабов производ-
ства, мощностей химико-технологических систем и отдельных аппаратов; 2)
интенсификация работы аппаратов; 3)снижение энергозатрат и максимальное
использование теплоты химических реакций; 4)уменьшение количества ста-
дий производства и переход к циклическим (замкнутым) системам; 5)замена
периодических процессов непрерывными; 6)механизация трудоёмких опера-
ций и автоматизация производства.
По данному курсовому проекту были произведены тепловой, гидравличсекий и конструктивно-механический расчёты теплообменного аппарата , необходимого для нагревания смеси этанол-вода до температуры кипения насыщенным водяным паром.
Вследствие чего по стандартным каталогам (ГОСТ 15118-79, ГОСТ 15120-79 и ГОСТ 15122-79) был выбран кожухотрубчатый теплообменник с неподвижными трубными решётка м м и. и.
В данном теплообменнике трубы, изготовленные из стали Ст3, расположены по окружности и закреплены в трубной решётке развальцовкой.
В месте подачи насыщенного водяного пара и отвода конденсата прикреплены два отбойника для предотвращения эрозии и износа труб.
Теплообменник установлен на четыре опоры типа OB – II – Б – 400 – 6 OH.
 Список использованных источников Список использованных источников
1. Баранов Д.А. Процессы и аппараты: Учеб. для студ. учреждений сред. проф. образования / Д.А. Баранов, А.М. Кутепов. – М.: Издательский центр «Академия», 2004.
ISBN 5-7695-1336-5
2. Иоффе И.Л. Проектирование процессов и аппаратов химической тех-
нологии: Учебник для техникумов.- Л.: Химия, 1991
ISBN 5-7245-0514-2
3. Каган С.З., Мартюшин С.И. Основные процессы и аппараты химичес-
кой технологии: Пособие по проектированию. 2-ое изд.. перераб. и
дополн.- М.: Химия,1991
4. Мухлёнов И.П. Общая химическая технология: Учеб. для химико- техн.спец.вузов. В 2-х т. Т-1: Теоретические основы химической технологии. 4-е изд., перераб. и дополн. – М: Высш. шк., 1984
5. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии: Учеб. пособие для вузов.
10-е изю., перераб. и дополн. – Л.: Химия, 1987
6. Плановский А.Н., Рамм В.М., Каган С.З. Процессы и аппараты химической технологии. 5-е изд., стереотипное.
7. Романков П.Г., Курочкина М.И., Мозжерин Ю.А., Смирнов Н.Н. Процессы и аппараты химической промышленности: Учеб. для техникумов.- Л.: Химия, 1989
8. Химическая энциклопедия: В 5 т.: Т.1: А-Дарзана/Ред.кол.: Кнунянц И.Л. и др.- М.: Сов.энцикл., 1988
9. Химическая энциклопедия: В 5 т.: Т.5: Под ред. Зефирова Н.С. и др.- М.: Большая Российская энцикл., 1998
|