Тема: Проектування реакторного блоку ізомеризації. Інтенсифікація процесу
Зміст
Вступ
1. Фізико-хімічні основи процесу
1.1 Термодинамічні закономірності реакції ізомеризації парафінових вуглеводнів
1.2 Кінетика й механізм ізомеризації парафінових вуглеводнів
1.1.1. Механізм ізомеризації на біфункціональних каталізаторах
1.3 Кінетика ізомеризації парафінових вуглеводнів
1.3.1 Кінетичні закономірності ізомеризації н-пентана на промислових каталізаторах
1.4 Реакції, що супроводжують ізомеризацію
1.5 Роль водню в здійсненні реакції ізомеризації парафінових вуглеводнів
1.6 Дезактивація алюмоплатинових каталізаторів вуглеводневими відкладеннями
2. Характеристика вихідної сировини, напівфабрикатів і виготовляємої продукції
3. Опис технологічної схеми
4. Технологічний розрахунок промислового реактора ізомеризації
4.1 Матеріальний баланс
4.2 Тепловий розрахунок
4.2.1 Розрахунок тепловтрат через стінку
4.2.2 Розрахунок кількості тепла, що надходить і йде з реакційною сумішшю, і теплоти реакції
4.3 Розрахунок аеродинамічного режиму й розмірів реактора
5. Конструювання реактора, розрахунки його основних деталей на міцність
5.1 Розрахунок корпуса апарата на міцність
5.1.1 Визначення товщини оболонки корпуса
5.1.. Визначення товщини стінки еліптичного днища
5.2 Розрахунок зміцнення отворів
5.2.1 Найбільший припустимий діаметр
5.3 Визначення тиску регенирації, пробного тиску й пускового тиску при мінусовій температурі
5.4 Розрахунок кришки на штуцері вивантаження каталізатора
5.5 Розрахунок температури зовнішньої стінки реактора
6. Екологічна обстановка на виробництві
7. Економічна оцінка удосконалень, впроваджених у проекті
Висновок
Список використаної літератури
В промисловості і в побуті достатньо високе значення має процес ізомеризації, оскільки за допомогою цього процесу ми отримуємо високоякісний бензин, який має достатньо високе октанове число. В результаті цього даний бензин можна використовувати, як паливо для автомобілів внутрішнього згорання (при низькому октановому числі двигун автомобіля псується і швидко виходить з ладу). А як ми знаємо, без автомобільного транспорту існувати держава не може. Це робота з вантажем, пасажирний транспорт, також автомобілі використовуються в побуті. Тому, актуальність даного курсового проекту досить висока.
Крім автомобільного напрямку використання процесу ізомеризації, даний процес використовується, як початкова ланка для отримання каучуку. Мається на увазі те, що процесом ізомеризації попередньо отримують і
-пентан, який в подальшому в реакторах каталітичної дегідратації отримують ізопрен, а той – для отримання ізопренового каучуку, який має велике значення в промисловості і побуті в загалі, тому що каучук використовується в основному для виготовлення, як в самій ж автомобільній галузі (шини, обладнання салону і т.д.) і в побуті (леноліуми та ін.). Крім того сам же і
-пентан використовується також, як розчинник в процесі полімеризації ізопрену.
Отже, вивчати процес ізомеризації потрібно. В результаті ми можемо вдосконалювати даний процес для зниження собівартості продукту. Цей показник являється дуже важливим в нинішніх умовах.
1. Ф
ізико-хімічні основи процесу
Реакції ізомеризації парафінових вуглеводнів є рівноважними:
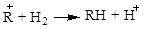 . .
Таблиця.2.1. Значення ентальпії 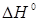 , Дж/моль, зміни ентропії , Дж/моль, зміни ентропії 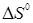 , Дж/(моль·К), і константи рівноваги Кр
для реакції ізомеризації парафінових вуглеводнів С4
– С6
у газовій фазі [2] , Дж/(моль·К), і константи рівноваги Кр
для реакції ізомеризації парафінових вуглеводнів С4
– С6
у газовій фазі [2]
| Реакція
|
300К |
500К |
700К |
| ΔН0
|
ΔS0
|
Кр
|
ΔН0
|
ΔS0
|
Кр
|
ΔН0
|
ΔS0
|
Кр
|
 н
-Бутан 2-метилпропан н
-Бутан 2-метилпропан |
8,4 |
15,5 |
4,5 |
8,2 |
15,3 |
1,2 |
8 |
14,8 |
0,7 |
 н
-Пентан 2-метилбутан н
-Пентан 2-метилбутан |
8 |
5,4 |
13 |
8,1 |
5,5 |
3,6 |
7,8 |
5,2 |
2,1 |
 н-
Пентан 2,3-диметилпропан н-
Пентан 2,3-диметилпропан |
19,5 |
42,5 |
15 |
18,7 |
40,5 |
0,7 |
17,4 |
38,3 |
0,2 |
 н
-Гексан 2-метилпентан н
-Гексан 2-метилпентан |
7,1 |
7,9 |
6,7 |
6,6 |
6,8 |
2,2 |
6,1 |
5,9 |
1,4 |
 н-
Гексан 3-метилпентан н-
Гексан 3-метилпентан |
4,4 |
8,6 |
2,1 |
4,3 |
8,6 |
1,03 |
4,4 |
8,6 |
0,8 |
 н
-Гексан 2,2 -диметилбутан н
-Гексан 2,2 -диметилбутан |
18,3 |
30,1 |
14,5 |
18,2 |
29,8 |
2,2 |
17,4 |
28,5 |
0,6 |
 н
-Гексан 2,3-диметилбутан н
-Гексан 2,3-диметилбутан |
10,6 |
22,7 |
4,6 |
10,7 |
23,2 |
1 |
10,5 |
22,9 |
0,4 |
Вони протікають практично без зміни об'єму, тому термодинамічна рівновага залежить від температури; низькі температури благочинять утворенню ізопарафінових вуглеводнів. Тепловий ефект реакції ізомеризації невеликий – від 2 до 20 кДж/моль – і мало міняється зі зміною температури. Дослідженню рівноваг реакцій ізомеризації парафінових вуглеводнів присвячене значне число робіт експериментального й розрахункового характеру. Спостережуване для деяких вуглеводнів розбіжність пояснюється недостатньо точним обчисленням термодинамічних величин. При розрахунку рівноважних сполук за значеннями констант рівноваги необхідно також ураховувати, що на практиці при протіканні реакції ізомеризації не завжди утворяться всі теоретично можливі ізомери; наприклад, у продуктах ізомеризації пентану були виявлені тільки два ізомери – н
-пентан і ізопентан (2-метилбутан); неопентан (2,2-диметилпропан) не був виявлений. Останнє викликано нестійкістю первинного карбкатіону – необхідноїтадії перегрупування вторинного карбкатіона. Через відсутність неопентана рівновага повинна розглядатися тільки між н
-пентаном і ізопентаном.
Те ж саме ставиться до ізомерів гептану: при проведенні ізомеризації відсутні 2,2-диметилпентан, 3,3-диметилпентан, 3-етилпентан, що пов'язане з утрудненнями кінетичного характеру.
Константи рівноваги реакцій ізомеризації парафінів С4
– С6
, ентальпія ізомеризації й зміна ентропії ізомеризації, обчислені на підставі спектроскопічних даних і даних про вільні енергії, наведені в табл. 2.1. При розрахунках констант рівноваги реакції ізомеризації використається різниця у вільних енергіях ізомерів:
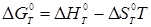 , ,
де 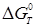 - вільна енергія ізомеризації; - вільна енергія ізомеризації;  - ентальпія ізомеризації; - ентальпія ізомеризації;
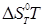 - ентропія ізомеризації. - ентропія ізомеризації.
Константа рівноваги ізомеризації обчислюється по рівнянню:
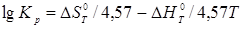
Сполука реакційної суміші розраховується на підставі констант рівноваги ізомеризації кожного вуглеводню в іншій:
Зміст і-го ізомеру = 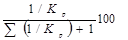 . .
Кінетика й механізм реакції ізомеризації залежать від типу каталізатора й умов проведення реакції. В умовах гетерогенного каталізу реакція ізомеризації парафінів протікає по термодинамічно контрольованому механізмі [2]. Кількісною оцінкою кінетичних параметрів реакційної здатності вуглеводнів є константа швидкості перетворення вуглеводню в ізомерний вуглеводень або суміш ізомерів. Вивчення шляхів цих перетворень і сполуки проміжних продуктів пов'язане з вивченням механізму реакції.
При здійсненні ізомеризації парафінових вуглеводнів на промислових алюмоплатинових каталізаторах, промотированих фтором і хлором, металцеолітних каталізаторах, а також сверхкислотах, особливості кінетики й механізму реакції обумовлені механізмом утворення проміжних сполук.
Запропоновано кілька механізмів утворення карбкатіона; один з них зводиться до міжмолекулярному гідридному переносу:
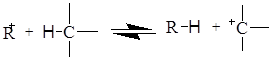
Існує інша точка зору, відповідно до якої карбкатіони можуть утворюватися з парафінів шляхом відщіплення гідрид-йона л’юісівською кислотою:
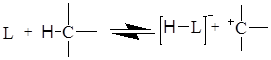
У цьому випадку шляхом рекомбінації протона й гідриду-іона може утворитися газоподібний водень.
Ізомеризація парафінових вуглеводнів у сверхкислотних середовищах відбувається шляхом протонування парафінонового вуглеводню по 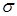 -зв'язку, при цьому утвориться некласичний карбонієвий іон із двухелектронним трьохцентровим зв'язком, наступне розщеплення якого приводить до утворення звичайного трехкоординованого карбкатіона й водню: -зв'язку, при цьому утвориться некласичний карбонієвий іон із двухелектронним трьохцентровим зв'язком, наступне розщеплення якого приводить до утворення звичайного трехкоординованого карбкатіона й водню:
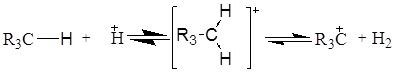
Розглядаючи механізм ізомеризації парафінових вуглеводнів на біфункціональних каталізаторах, що містить метали VIII групи, можна припустити три типових випадки, залежно від кислотності носія [2]:
1) на каталізаторах з дуже сильною кислотністю носія ізомеризація відбувається на кислотних центрах, роль металу зводиться до обмеження утворення коксу й запобіганню від дезактивації кислотних центрів; прикладом може служити процес на алюмоплатиновому каталізаторі, промотированому хлором;
2) на каталізаторах з дуже низькою кислотністю носія ізомеризація відбувається тільки на металевих центрах, і механізм реакції залежить від розміру кристалітів металу;
3) на каталізаторах із середньою кислотністю носія, таких як платина, на аморфному алюмосилікаті або на фторованому оксиді алюмінію, ізомеризація відбувається по звичайному біфункціональному механізму - утворення проміжних сполук на металевих ділянках і ізомеризація олефінів на кислотних ділянках.
Якщо ізомеризація протікає на поверхні металів, механізм відрізняється від біфункціонального. У випадку біфункціонального механізму в адсорбції парафінового вуглеводню на поверхні металу беруть участь два сусідніх атоми вуглецю, від парафінового вуглеводню можуть відчіплюватися два атоми водню з утворенням олефіна в газовій фазі, адсорбований олефін може піддатися гідрогенолізу. Якщо парафін адсорбується атомами вуглецю, які не є сусідніми, то можливі утворення нової С-С зв'язку, що приводить до п'яти- або шестичленним циклічних вуглеводнів, і їхнє наступне розкриття за рахунок розриву іншої С-С зв'язку. Для протікання такої реакції необхідно, щоб пов'язані з поверхнею атоми вуглецю й пов'язані із двома сусідніми атомами металу. Можливість протікання такої реакції була відкрита Го й Андерсеном.
Послідовність реакцій при такому механізмі ізомеризації:
1) два несуміжні С-Н зв'язки розриваються, а вуглеводень адсорбується на поверхні атомами вуглеводню, пов'язаними із сусідніми центрами метала;
2) зв'язок С-С утвориться між двома адсорбованими атомами вуглецю, що приводить до утворення циклопентанового або циклогексанового кільця, які можуть десорбуватися;
3) циклічні частки можуть повторно адсорбуватися на поверхні або заміщати атоми вуглецю, які пов'язані з поверхнею, на інші без десорбції, а С-С зв'язок може розірватися;
4) приєднання атома водню до адсорбованих часток і десорбція без утворення С-С зв'язку приводять до кістякової ізомеризації н
-гексана в 2-метилпентан. На рис. 2.1 показана схема ізомеризації для парафінових вуглеводнів С6
на поверхні металу.

Рис. 2.1. Схема реакції ізомеризації гексану на поверхні металу [2]:I – п’ятичленне кільце на поверхні.
Рис. 2.2. Зрушення зв'язку й циклічна ізомеризація 2-міти-пентану
Другим механізмом ізомеризації парафінів на металах є механізм зрушення зв'язку. Він передбачає утворення  - триадсорбованних сполук, пов'язаних із двома сусідніми атомами металу. Ізомеризація неопентана повинна включати адсорбцію на двох атомах металу, утворення зв'язку між атомами вуглецю на поверхні й розрив однієї зі зв'язків у короткоживучому циклопропановому кільці з утворенням 2-метилбутана. - триадсорбованних сполук, пов'язаних із двома сусідніми атомами металу. Ізомеризація неопентана повинна включати адсорбцію на двох атомах металу, утворення зв'язку між атомами вуглецю на поверхні й розрив однієї зі зв'язків у короткоживучому циклопропановому кільці з утворенням 2-метилбутана.
Вивчення реакції ізомеризації гексанів за допомогою мічених атомів 13
С дозволило визначити співвідношення механізмів реакції зрушення зв'язку й циклічної ізомеризації залежно від властивостей каталізатора. Оцінка розмірів кристалітів платини в каталізаторі показала, що у випадку кристалітів розміром менш 3 нм переважають циклічна ізомеризація й неселективний гідрогеноліз метилциклопентану, у той час як на більших кристалітах переважають зрушення зв'язку й селективний гідрогеноліз (рис. 2.2).
Для випадку металцеолітніх каталізаторів не існує однозначної точки зору на механізм реакції ізомеризації парафінових вуглеводнів: ряд авторів висловлюється за біфункціонального механізму [2], для морденітвмістного каталізатора існує пропозиція про чисто кислотний механізм.
Відносна сила металевих і кислотних центрів визначає стадію реакції, яка лімітує.
Вважається в кінетиці ізомеризації парафінових вуглеводнів на біфункціональних каталізаторах, за деяким виключенням, стадією, що лімітує загальну швидкість реакції ізомеризації. Вважається алкільне перегрупування карбкатіонів. Ця точка зору підтверджується даними про селективну дію різних промоторів і отрут на металеві й кислотні ділянки каталізатора. Серії дослідів по впливі фтору, натрію, заліза й платини на активність алюмоплатинових каталізаторів у реакції ізомеризації н
-гексана проводилися при 400 0
С, тиску 4МПа й зміні об'ємної швидкості подачі н
-гексана від 1,0 до 4,0  . Досліди на платинованому оксиді алюмінію, промотированому різними кількостями фтору - від 0 до 15% (рис. 2.3), показали, що в міру збільшення кількості фтору в каталізаторі до 5% спостерігався значний ріст його ізомеризуючої активності; оскільки питома поверхня каталізатора не піддавалася помітним змінам, ріст каталітичної активності пояснюється зміною хімічний властивостей активної поверхні, а саме посиленням кислотності. . Досліди на платинованому оксиді алюмінію, промотированому різними кількостями фтору - від 0 до 15% (рис. 2.3), показали, що в міру збільшення кількості фтору в каталізаторі до 5% спостерігався значний ріст його ізомеризуючої активності; оскільки питома поверхня каталізатора не піддавалася помітним змінам, ріст каталітичної активності пояснюється зміною хімічний властивостей активної поверхні, а саме посиленням кислотності.
У дослідах із платинованим алюмосилікатом зміна вихідної ізомеризуючої активності каталізатора досягалося отруєнням каталізатора натрієм (рис. 2.4). При збільшенні кількості Na2
O від 0,09 до 0,8%, тобто в 9 разів, константа швидкості ізомеризації зменшувалася приблизно теж в 9 разів.
Таким чином, умовою одержання високоактивного платинового каталізатора ізомеризації є застосування носія, що володіє високою кислотністю.
Далі був досліджений вплив домішок у носії, які, не викликаючи істотної зміни його кислотності, є отрутами в реакціях гідрування й дегідрування.

Рис. 2.3. Вплив змісту фтору в каталізаторі не глибину ізомеризації н-гексана
Рис. 2.4. Вплив змісту натрію в каталізаторі на швидкість ізомеризації н-гексана

Рис. 2.5. Вплив заліза на актив-ність каталізатора:
Крива [Fe2O3],% k
1 0,05 1,1
2 0,1 1,0
3 0,2 0,8
4 0,75 0,45
Рис. 2.6. Вплив платини на ак-тивність каталізатора:
Крива [Pt],% k
1 1 0,34
2 0,1 0,22
3 0,025 0,16
Зразки платинованого алюмосилікату, у які вводилися різні кількості заліза (у вигляді Fe 2
O3
), були випробувані в реакції ізомеризації н
-гексана (рис. 2.5). Активність каталізатора при збільшенні змісту Fe2
O3
в 15 разів знижувалася лише в 2,4 рази. Та обставина, що різка зміна дегідруючої активності каталізатора спричиняється лише відносно невелике зменшення глибини ізомеризації, підтверджується дослідами, проведеними на зразках каталізатора, у яких масова частка платини змінювалася від 0,025 до 1%, тобто в 40 разів. При цьому константа швидкості реакції ізомеризації н
-гексана зросла лише у два рази (рис. 2.6). Спільність кінетичних закономірностей для різних каталізаторів [на всіх каталізаторах спостерігається перший порядок реакції по вуглеводні й гальмування реакції надлишком водню (табл. 2.2) [2]] також указує на те, що стадією, що лімітує, є, що протікає на кислотних центрах носія.
У граничних випадках низького й високого парціального тиску водню й зниженого змісту металу що лімітують можуть стати стадії, що відбуваються на металевих центрах каталізатора.
У випадку металцеолітних каталізаторів стадія, що лімітує, залежить від загальної поверхні платини й розміру кристалітів металу, для каталізаторів з великою поверхнею металу стадія, що лімітує, - кістякова ізомеризація олефінів.
2.3.1 Кінетичні закономірності ізомеризації н-пентана на промислових каталізаторах
Становить інтерес аналіз кінетичних закономірностей, отриманих при вивченні ізомеризації парафінових вуглеводнів, наприклад н
-пентана, на промислових каталізаторах Pt – Al2
O3
– F, Pt – Al2
O3
– Cl і Pt – HM, особливо якщо врахувати, що механізм протікання даної реакції на них різний. Вивчення кінетики реакції проводилося в проточній установці при циркуляції водневмістного газу [2].
Таблиця 2.2 Кінетика реакцій ізомеризації н
-пентана на різних каталізаторах
| Каталізатор |
Р, Мпа |
t, 0
C |
Рівняння кінетики |
lg k
|
Е, 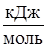 |
| Pt-Al2
O3
|
0,77-2,77 |
372 |
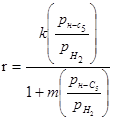 |
- |
- |
| Pt-Al2
O3
-F
|
3,5
|
360-385
|

|
42,5
|
172
|
| Pt-Al2
O3
-F |
0,1 |
420-480 |
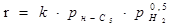 |
- |
- |
| Pt-Al2
O3
-Cl
|
0,9-4,1
|
130-160
|
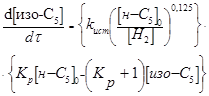
|
8,6
|
46
|
| H-M |
0,5-0,6 |
200-227 |
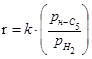 |
- |
129 |
| Pt-HM* |
0,217 |
240 |
 |
- |
148 |
| Pd-Ca |
0,1-5,0 |
300-360 |
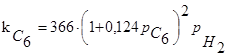 |
- |
- |
| HF-Sb5
** |
1 |
Від -20 до +20 |
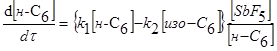 |
- |
60-80 |
*Для суміші С5
+С6.
**Для н
-гексана.
Кінетичні закономірності реакції ізомеризації н-пентана на алюмоплатиновому каталізаторі, промотированому фтором, були вивчені у зв'язку з розробкою технології процесу. Була встановлена залежність виходу ізопентана від мольного відношення водень:н
-пентана. Був вивчений також вплив парціальних тисків н
-пентана й водню на швидкість протікання реакції. Сполука вихідної сировини й продуктів реакції визначався за допомогою газорідинної хроматографії. Реакція протікала з високої селективністю; вихід продуктів розпаду не перевищував 1% [2]. Діаметр зерна каталізатора становив 1,5 мм. Для опису отриманих закономірностей було використане рівняння для випадку константи швидкості реакції:
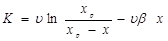
де К
- величина, пропорційна швидкості; 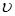 - об'ємна швидкість подачі сировини; - об'ємна швидкість подачі сировини;  - рівноважний зміст ізопентану в досліджуваних умовах; - рівноважний зміст ізопентану в досліджуваних умовах; 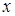 - глибина ізомеризації н
-пентана; - глибина ізомеризації н
-пентана;  - коефіцієнт, емпірично знайдений (результати обчислень показали, що це рівняння відповідає експериментальним даним, якщо прийняти - коефіцієнт, емпірично знайдений (результати обчислень показали, що це рівняння відповідає експериментальним даним, якщо прийняти  =1,25). Вплив лінійної швидкості потоку сировини на глибину ізомеризації досліджувалося шляхом зміни довжини шару каталізатора при однаковій об'ємній швидкості подачі сировини в реактор (температура 380 0
С, тиск 4МПа). =1,25). Вплив лінійної швидкості потоку сировини на глибину ізомеризації досліджувалося шляхом зміни довжини шару каталізатора при однаковій об'ємній швидкості подачі сировини в реактор (температура 380 0
С, тиск 4МПа).
Зміна розміру зерна каталізатора в межах від 3,2 до 1,5 мм не впливає на швидкість реакції ізомеризації н
-пентана: при діаметрі зерна 1,5 до 3,0 мм константа швидкості реакції рівнялася 0,19. Таким чином, можна затверджувати, що в обраних умовах реакція протікала в кінетичній області.
Для вивчення впливу парціального тиску н
-пентана на швидкість його ізомеризації були поставлені дві серії дослідів при парціальних тисках водню 3,0 і 7,5 МПа й 380 0
С. Парціальний тиск н
-пентана змінювалося від 0,2 до 2,5 МПа. Для кожного з обраних парціальних тисків н
-пентана знімалася кінетична крива шляхом зміни об'ємної швидкості подачі сировини від 0,5 до 7 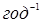 [2]. [2].
З даних рис. 2.7 видно, що при парціальному тиску водню 3,0 МПа швидкість реакції росте пропорційно тиску пентану до 1,0 МПа; подальше збільшення його до 1,5 МПа не впливає на швидкість реакції при зміні парціального тиску н
-пентана в цих межах. При парціальному тиску водню 7,5 МПа швидкість реакції зростала пропорційно збільшенню парціального тиску н
-пентана аж до 2,5 МПа (кср
=0,26).

Рис 2.7. Вплив парціального тиску н-пентана на швидкість реакції ізомеризації
Різний хід кривих на рис. 2.7 пояснюється тим, що при парціальному тиску водню 3,0 МПа насичення поверхні каталізатора н
-пентаном наступає при парціальному тиску останнього, близькому до 1,0 МПа; при збільшенні парціального тиску водню до 7,5 МПа ця межа насичення зрушується в область парціальних тисків н
-пентана, що перевищують 2,5 МПа.
Спостережувані факти вказують на існування адсорбційної рівноваги між реагуючими речовинами на поверхні платинового каталізатора, що у випадку підвищення парціального тиску водню зрушується убік переважної адсорбції водню й витиснення н
-пентана з поверхні каталізатора. Дійсно, як указують літературні дані, відносні адсорбційні коефіцієнти для н
-пентана й водню при 4000
С на платиновому каталізаторі рівні відповідно 1,0 і 6,4. Зі зробленого спостереження треба практичний висновок: при здійсненні процесів при загальному робочому тиску 4,0 МПа доцільно обмежити парціальний тиск н
-пентана величиною, що не перевищує 1,0 МПа.
Результати дослідів по впливі парціального тиску водню на процес ізомеризації н
-пентана при парціальних тисках н
-пентана 0,5 і 1,0 МПа й зміни парціального тиску водню від 1,5 до 9,0 МПа дані на рис. 2.8. При парціальному тиску н
-пентана 0,5 МПа й температурі 360, 380 і 400 0
С зменшення парціального тиску водню в тих же межах спостерігалися трохи інші закономірності. Зменшення парціального тиску водню від 9,0 до 6,0 МПа викликало пропорційне зниження константи швидкості реакції, однак далі ця залежність порушувалася:
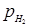
|
9,0 |
7,5 |
6,0 |
3,0 |
2,0 |
| kср
|
0,09 |
0,11 |
0,15 |
0,45 |
0,70 |
Як бачимо, при зміні парціального тиску водню від 6,0 до 3,0Мпа, тобто в 2 рази, константа швидкості реакції змінювалася в 3 рази.

Рис. 2.8. Вплив парціального тиску водню на глибину ізомеризації н
-пентана: а – парціальний тиск н
-пентана 0,5 МПа; б – 1,0 МПа.
Отримані результати можуть бути пояснені шляхом аналізу кривих рис. 2.7. Як уже вказувалося, при здійсненні дослідів при парціальному тиску водню 3,0 і 7,5 МПа зміна константи швидкості реакції ізомеризації зі збільшенням парціального тиску носить різний характер. При парціальному тиску водню 3,0 МПа й н
-пентана 1,0 МПа наступає перегин кривої; далі крива йде паралельно осі абсцис. У зв'язку із цим кінетичні закономірності при парціальному тиску н
-пентана 1,0 МПа справедливі тільки в області високих робочих тисків (6,0 – 9,0МПа), коли ще не наступає насичення поверхні каталізатора н
-пентаном.
На підставі результатів, отриманих при вивченні впливу парціального тиску водню й н
-пентана, можна припустити, що зміна робочого тиску в межах 1,5 – 10,0 МПа не повинне відбиватися на швидкості реакції за умови збереження парціального тиску н-
пентана не вище 1,0 МПа. При подальшому підвищенні парціального тиску н
-пентана збільшення робочого тиску повинне приводити до гальмування реакції ізомеризації. Результати дослідів (табл. 2.3) підтверджує ці припущення [2]. При підвищенні робочого тиску від 4,0 до 10,0 МПа, збереженні мольного відношення водень:н
-пентан =19 і зміні парціального тиску н
-пентана не змінювалася. Відповідно, і константа швидкості реакції залишилася постійною. При підвищенні робочого тиску в тих же межах, але при мольному співвідношенні водень:н
-пентан = 3 і зміні парціального тиску н
-пентана від 1,0 до 2,5 МПа константа швидкості реакції змінювалася від 0,46 до 0,26.
Що стосується самого факту гальмування реакції ізомеризації н
-пентана воднем, то відповідно до сталим у цей час поглядом на механізм реакції ізомеризації н
-парафінових вуглеводнів на біфункціональних каталізаторах, реакція протікає через стадію дегідрування парафінового вуглеводню з утворенням олефінового вуглеводню. Випливаючи цій схемі, гальмування реакції воднем можна пояснити зниженням концентрації олефіна внаслідок гідрування в парафіновий вуглеводень, а також явищами адсорбційного витиснення пентану воднем з поверхні каталізатора.
Таблица 2.3 Вплив робочого тиску на швидкість реакції ізомеризації н
-пентана при температурі 380 0
С
| Умови досліду |
Масова частка ізопентана в каталізаті, % |
k |
kср
|
| Р, МПа |
мольне відношення Н2
:н-С5
|
рн-
С5
|
рН2
|
v, год-1
|
| 4 |
3 |
1 |
3 |
0,5 |
48,6 |
0,56 |
0,59 |
| 1 |
38,6 |
0, 6 |
| 1,5 |
32,8 |
0,61 |
| 10 |
3 |
2,5 |
7,5 |
0,5 |
39,2 |
0,237 |
0,26 |
| 1 |
27,9 |
0,262 |
| 1,5 |
24,4 |
0,275 |
| 4 |
19 |
0,2 |
3,8 |
0,125 |
40 |
0,06 |
0,055 |
| 0,25 |
28 |
0,06 |
| 0,5 |
17,3 |
0,05 |
| 10 |
19 |
0,5 |
9,5 |
0,25 |
27,8 |
0,058 |
0,054 |
| 0,5 |
16,7 |
0,049 |
Представлялося необхідним вивчити вплив мольного співвідношення водень:н
-пентан на глибину ізомеризації. Була поставлена серія дослідів при 3800
С, підвищеному тиску й об'ємній швидкості н
-пентана 1,0 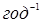 ; мольне відношення водень:н
-пентан мінялося в широких межах – від 2,3 до 34. Як сировина використалися два зразки н
-пентана: з домішкою 12,4% (зразок 1) і 0,7% (зразок 2) ізопентана. Результати представлені на рис. 2.9. У дослідах зі зразком 1 збільшення мольного відношення водень:н
-пентан від 2,3 до 34 зменшувало глибину ізомеризації з 37 до 15,6%. При роботі зі зразком 2 збільшення мольного відношення в п'ять разів (від 2,3 до 11,2) знижувало глибину ізомеризації втри рази (з 26,8 до 8,2%). Подібна залежність пояснюється тим, що зі збільшенням мольного відношення водень:н
-пентан знижується парціальний тиск н
-пентана й це спричиняє зменшення швидкості ізомеризації. Отже, доцільно вести процес ізомеризації н
-пентана при можливо більше низькому мольному відношенні водень:н
-пентан, припустимим з погляду збереження стабільності каталізатора; низька кратність циркуляції газу повинна також сприяти меншому віднесення ізопентана із циркулюючим газом у зону реакції. На підставі проведених досліджень було прийнято мольне відношення водень:н
-пентан = ; мольне відношення водень:н
-пентан мінялося в широких межах – від 2,3 до 34. Як сировина використалися два зразки н
-пентана: з домішкою 12,4% (зразок 1) і 0,7% (зразок 2) ізопентана. Результати представлені на рис. 2.9. У дослідах зі зразком 1 збільшення мольного відношення водень:н
-пентан від 2,3 до 34 зменшувало глибину ізомеризації з 37 до 15,6%. При роботі зі зразком 2 збільшення мольного відношення в п'ять разів (від 2,3 до 11,2) знижувало глибину ізомеризації втри рази (з 26,8 до 8,2%). Подібна залежність пояснюється тим, що зі збільшенням мольного відношення водень:н
-пентан знижується парціальний тиск н
-пентана й це спричиняє зменшення швидкості ізомеризації. Отже, доцільно вести процес ізомеризації н
-пентана при можливо більше низькому мольному відношенні водень:н
-пентан, припустимим з погляду збереження стабільності каталізатора; низька кратність циркуляції газу повинна також сприяти меншому віднесення ізопентана із циркулюючим газом у зону реакції. На підставі проведених досліджень було прийнято мольне відношення водень:н
-пентан = 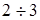 , при якому забезпечувалася досить стабільна робота каталізатора при обраному тиску. , при якому забезпечувалася досить стабільна робота каталізатора при обраному тиску.
Для вивчення впливу швидкості подачі н
-пентана й температури на глибину ізомеризації були поставлені досліди при 340–400 0
С, мольному відношенні водень:н
-пентан=2,5 і обраному тиску, об'ємна швидкість мінялася в межах 1,0–4,0 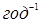 , а глибина ізомеризації – від 12 до 56,2%. , а глибина ізомеризації – від 12 до 56,2%.
Рис. 2.9. Вплив мольного відношення Н2
:н-
С5
Н12
на глибину ізомеризації н
-пентана. Цифри вказують на зміст н
-пентану. Рис. 2.10. Вплив зміни температури й об'ємної швидкості подачі сировини на глибину ізомеризації н
-пентана
Для вираження кількісної залежності між глибиною ізомеризації н
-пентана й швидкістю його подачі були використані кінетичні криві (рис. 2.10). Аналіз кривих показує, що при підвищенні температури на 20 0
С для збереження заданої глибини ізомеризації н
-пентана потрібно збільшити швидкість пропущення вуглеводню в 2,0 – 2,5 рази. Далі, з рис. 2.10 треба, що при об'ємній швидкості пропущення вуглеводню 1,0 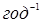 глибина ізомеризації 50% досягається при 380 0
С. Розрахована на підставі проведених дослідів гадана енергія активації склала 172 кДж/моль. глибина ізомеризації 50% досягається при 380 0
С. Розрахована на підставі проведених дослідів гадана енергія активації склала 172 кДж/моль.
Вивчення основних кінетичних закономірностей процесу низькотемпературної ізомеризації н
-пентана проводилася на алюмоплатиновому каталізаторі, що містить 10% хлору [2]. Вихідні вуглеводні й водень піддавалися очищенню й сушінню, каталізатор перед проведенням досліду хлорувався обробкою в газовій фазі парами чотирихлористого вуглецю. Попередніми дослідами, у яких лінійна швидкість змінювалася від 0,117 до 0,234 м/с, а розмір зерна від 2-3 до 0,5-1мм, було показано, що при розмірі зерна каталізатора 0,5-2мм і лінійної швидкості потоку 0,188 м/с реакція протікає реакція протікає в кінетичній області. Для математичного опису процесу був вивчений вплив зміни концентрації водню й н
-пентана в реакційній суміші, а також температури й об'ємної швидкості подачі сировини в наступних межах:
| Парціальний тиск, МПа |
| водню |
0,6–3,1 |
| н
-пентана |
0,3–1,0 |
| Температура, 0
С |
130–160 |
В умовах проведення дослідів реакція протікала з високим ступенем селективності. Для опису процесу було обране рівняння швидкості для оборотної реакції першого порядку:
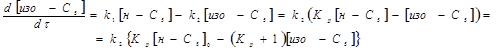 (2.2) (2.2)
де 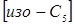 , , 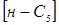 - концентрація ізопентана й н
-пентана в суміші; - концентрація ізопентана й н
-пентана в суміші; 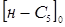 - вихідна концентрація н
-пентана в суміші; k1
, k2
– константи швидкості прямій і зворотної реакції ізомеризації н
-пентана, - вихідна концентрація н
-пентана в суміші; k1
, k2
– константи швидкості прямій і зворотної реакції ізомеризації н
-пентана, 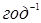 ; ; 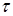 - час контакту, - час контакту, 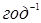 ; t – тривалість роботи каталізатора, ; t – тривалість роботи каталізатора, 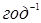 ; Кр
= ; Кр
=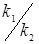 константа рівноваги реакції ізомеризації н
-пентана, RlnKp
=1861/T-1,299. константа рівноваги реакції ізомеризації н
-пентана, RlnKp
=1861/T-1,299.
За результатами кінетичних дослідів були отримані ефективні константи швидкості ke
, тобто значення кривим при підстановці в рівняння (2.2). Після аналізу залежності наведених констант швидкості виявлено, що значення цих величин пропорційні змісту водню. Ця залежність була представлена рівнянням
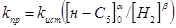
де 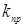 - наведена (до вихідного стану) константа швидкості реакції; - наведена (до вихідного стану) константа швидкості реакції; 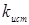 - щира константа швидкості реакції; [H2
] – концентрація водню в суміші; - щира константа швидкості реакції; [H2
] – концентрація водню в суміші; 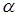 і і 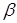 - коефіцієнти. Отримані з рівняння (2.3) значення констант швидкості реакції при 140 0
С виявилося рівними - коефіцієнти. Отримані з рівняння (2.3) значення констант швидкості реакції при 140 0
С виявилося рівними 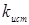 =0,00388 =0,00388  ; ; 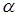 = =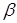 =0,125. Коефіцієнти =0,125. Коефіцієнти 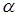 й й 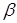 у вивчених межах (130–160 0
С) не залежать від температури; по рівнянню (2.3) були знайдені значення щирої константи швидкості прямій і зворотної реакції (табл. 2.4). у вивчених межах (130–160 0
С) не залежать від температури; по рівнянню (2.3) були знайдені значення щирої константи швидкості прямій і зворотної реакції (табл. 2.4).
Таблиця 2.4. Константи рівноваги й щирі константи швидкості прямій і зворотної реакції ізомеризації н
-пентана
| t, 0
C |
Kp
|
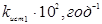 |
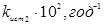 |
| 130 |
5,32 |
14,85 |
2,79 |
| 140 |
5,03 |
19,5 |
3,88 |
| 150 |
4,76 |
26,6 |
5,58 |
| 160 |
4,53 |
35,2 |
7,79 |
Таким чином, кінетичною моделлю процесу є рівняння
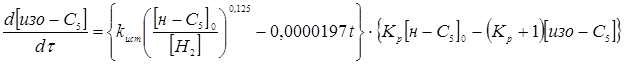
яке задовільно погодиться з результатами експериментів.
З використанням методики, заснованої на застосуванні методу найменших квадратів, була визначена довірча область для арреніусівської залежності константи швидкості реакції від температури; з імовірністю 90% значення енергії активації й логарифм передекспонента в рівнянні Арреніуса прямій і зворотній реакції низькотемпературної ізомеризації н
-пентана виявилося рівними:
Е1
=41,9 3 кДж/моль 3 кДж/моль |
lnk1
=-8,3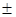 1,0 1,0 |
Е2
=49,9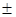 4 кДж/моль 4 кДж/моль |
lnk2
=-8,9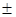 1,1 1,1 |
Таким чином, при вивченні кінетики реакції низькотемпературної ізомеризації н
-пентана на каталізаторі Pt – Al2
O3
– Cl було встановлено, що швидкість реакції зростає з підвищенням парціального тиску водню.
При вивченні реакції ізомеризації н
-пентана проточно-циркуляційним методом на алюмоплатиновому каталізаторі, промотированному фтором, спостерігався зворотний кінетичний ізотопний ефект при заміні водню на дейтерій. Швидкість реакції характеризувалася кількісним порядком по водні, рівним 0,5, причому швидкість обміну дейтерію в пентані в цих умовах вище швидкості ізомеризації.
Зазначені факти дозволяють припустити, що водень бере участь у повільній стадії реакції - ізомеризації адсорбованих фрагментів на кислотних центрах каталізатора.
Ізомеризацію н
-пентана на Н–мордениті вивчали в присутності водню проточній установці при температурах 200-230 0
С, парціальних тисках н
-пентана 0,05-0,8 МПа й водню 0,5-3,0 МПа, глибині ізомеризації н
-пентана до 10%, тобто вдалині від рівноваги. Досліди проводилися в умовах, що виключають вплив внутрішньої й зовнішньої дифузії. Швидкість реакції r
(у молях н 1 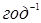 і мольному відношенні водень:н
-пентан=3:2; кількість продуктів гідрокрекінгу – вуглеводнів С1
– С4
– не перевищувало 2%. При температурі 360 0
С, тиску 2,0 МПа глибина ізомеризації н
-пентана становила 57%, тобто досягла 90% від рівноважної. і мольному відношенні водень:н
-пентан=3:2; кількість продуктів гідрокрекінгу – вуглеводнів С1
– С4
– не перевищувало 2%. При температурі 360 0
С, тиску 2,0 МПа глибина ізомеризації н
-пентана становила 57%, тобто досягла 90% від рівноважної.
Вивчення кінетики реакції проводили при глибині ізомеризації н
-пентана, що не перевищує 15%, швидкість ізомеризації знаходили по рівнянню
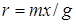
де т
– кількість подаваного н
-пентана, моль
/ ; х – глибина ізомеризації н
-пентана, %
; g – маса каталізатора, м
. ; х – глибина ізомеризації н
-пентана, %
; g – маса каталізатора, м
.
Було встановлено, що швидкість реакції не залежить від явища внутрішньої й зовнішньої дифузії.
2.4Реакції, що супроводжують ізомеризацію
Реакція ізомеризації супроводжується рядом побічних реакцій – крекінгу, гідрокрекінгу й диспропорціонування; так, молекула н
-гексана може піддаватися гідрокрекінгу в наступні продукти:
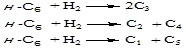
Необхідно відзначити, що основним напрямком реакцій гідрокрекінгу є перетворення н
-гексана в пропан і бутан, реакція з утворенням метану практично не має місця. Реакція диспропорціонування відбувається з утворенням парафінових вуглеводнів з більше низкою й високою молекулярною масою:

При протіканні реакції диспропорціонування парафінових вуглеводнів на морденітвмістних цеолітних каталізаторах у продуктах реакції не виявляються вуглеводні з молекулярною масою вище вихідного, тому що має місце реакція їхнього гідрокрекінгу

Тому основна реакція при здійсненні диспропорціонування гексана на цеолітному каталізаторі в середовищі водню приблизно відповідає сумарному рівнянню
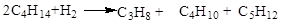
Про механізм реакції диспропорціонування парафінових вуглеводнів існують різні точки зору: для алюмоплатинових каталізаторів, модефіцированних хлором, припускають наступне протікання реакцій [2]:
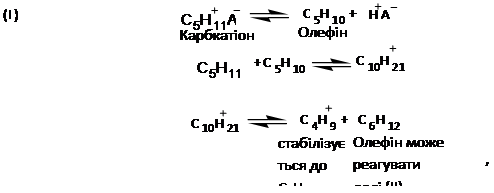
Карбкатіон у кислотній системі перебуває в рівновазі з олефінами (I), які разом з карбкатіоном можуть піддаватися алкілірованю (II) і реакції крекінгу (III). Гексан, що утвориться по рівнянню (III), може алкіліруватися із С5
-карбкатіоном до С11
-карбкатіонов і гептанів реакції можуть протікати значно швидше, тому що більше високомолекулярні карбкатіони можуть бути присутнім у більше високих концентраціях. Результатом високої концентрації вищих олефінов буде гідридний перенос від олефіна до карбкатіону, що приведе до утворення аллільних іонів карбонія, і у свою чергу, до дезактивації каталізатора. Реакцію диспропорціонування можна придушити, знизивши концентрацію карбкатіона й, отже, концентрацію олефінів. Додавання водню зрушити рівновага по рівнянню

Зменшення концентрації карбкатіона приводить до зниження швидкості диспропорціонування. Існує думка, що на цеолітвмістних каталізаторах, зокрема на морденіті в катіонзаміщених формах (Н, Мо, Са, Sr), диспропорціонування протікає за рахунок реакцій трансметіліровання. Найбільш істотну роль грають відщіплення й мас-міжмолекулярний перенос С2-фрагментів
. Деякі дослідники висловлюють за механізм реакцій за схемою конденсація - крекінг, тобто без утворення низькомолекулярних алкіліруючих агентів.
В промислових процесах ізомеризації н
-пентана й н
-гексана на каталізаторах Pt – Al2
O3
– F, Pt – Al2
O3
– Cl, Pt – НМ – Al2
O3
знайдений баланс між реакціями ізомеризації, гідрогрекінга й диспропорціонування, що дозволяє здійснити процес із високої селективністю; у випадку ізомеризації гептанів не досягнуто задовільних результатів.
При здійсненні процесів ізомеризації пентан-гексанових фракцій, що википають до 70 0
С, до складу їх крім пентанів і гексанів входять висококиплячі парафінові вуглеводні, нафтенові й ароматичні вуглеводні (бензол, метилциклопентан, циклогексан, гептани).
У процесі ізомеризації на платинових каталізаторах ці вуглеводні піддаються перетворенням відповідно до умов термодинамічної рівноваги для кожного вуглеводню по нижченаведених реакціях:
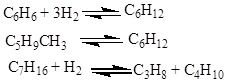
Вплив нафтенів на активність каталізаторів у реакції ізомеризації парафінів розрізняється залежно від природи каталізатора й умов здійснення реакції. У процесі високотемпературної ізомеризації на алюмоплатиновому каталізаторі, промотированному фтором, нафтени, поки їхня масова частка не перевищує 15%, практично не роблять впливу на глибину ізомеризації парафінового вуглецю.
2.5 Роль водню в здійсненні реакції ізомеризації парафінових вуглеводнів
Питання про вплив водню на протікання реакції ізомеризації парафінових вуглеводнів на розглянутих каталізатора не має чіткого тлумачення. На алюмоплатиновому каталізаторі, промотированому фтором, реакція ізомеризації парафінових вуглеводнів не відбувається під час відсутності водню; якщо каталізатор модифікований хлором, реакція в початковий період протікає й під час відсутності водню (те ж явище має місце й на фторидах металів V і VI групи, активованих фтороводнем), але із часом її швидкість поступово зменшується.
Щоб реакція ізомеризації на металвмістному каталізаторі протікала постійно, її необхідно здійснювати в середовищі водню. Це пов'язане з явищами адсорбції й дисоціації водню на металі й переносу часток водню з металу на носій Мають місце також явища конкурентної адсорбції водню й проміжних ненасичених сполук на поверхні каталізатора, при цьому частина цих сполук витісняється воднем з поверхні каталізатора, що також забезпечує його стабільну роботу.
Незважаючи на різний механізм перетворення вуглеводнів на всіх розглянутих каталізаторах, для них спостерігається спільність кінетичних закономірностей і гальмування реакції ізомеризації парафінових вуглеводнів надлишком водню. Для всіх каталізаторів залежність швидкості реакції від парціального тиску водню носить екстремальний характер після досягнення певної концентрації водню на поверхні каталізатора. Величина й положення максимуму залежать від типу каталізатора, температури й молекулярної маси парафінового вуглеводню.
При низькому тиску водню швидкість реакції ізомеризації визначається швидкістю утворення проміжних ненасичених сполук, які десорбуються в газову фазу шляхом витиснення їх з поверхні каталізатора воднем. Таким чином, швидкості реакції ізомеризації при збільшенні парціального тиску водню від нуля до певної величини пов'язане з явищами обмеження надлишкових концентрацій проміжних ненасичених сполук; тим самим водень перешкоджає утворенню з них міцно адсорбованих сполук на поверхні каталізатора. Зі збільшенням парціального тиску водню вище певного проміжні сполуки й водень починають конкурувати за ділянки поверхні, відповідальні за протікання реакції, і подальше збільшення тиску водню приводить до зменшення швидкості реакції.
У випадку здійснення реакції на алюмоплатиновому каталізаторах, промотированих фтором і хлором, і на металлцеолитних каталізаторах швидкості реакцій гідрокрекінгу й диспропорціонування мають максимальне значення під час відсутності водню, поступово зменшуються при збільшенні парціального тиску водню до деякої межі й збільшуються при подальшому його підвищенні.
Отже, існує оптимальне співвідношення концентрації водню й вуглеводню на поверхні каталізатора, при якому встановлюється рівновага між процесами регенерації поверхні каталізатора воднем і адсорбційним витисненням молекул вуглеводню воднем з поверхні каталізатора й обмеження протікання побічних реакцій. Визначення області оптимального співвідношення дуже важливо для вибору технологічних параметрів процесу, що визначають активність селективність і стабільність каталізатора. Нами було показано, що у випадку здійснення реакції ізомеризації н
-гексана на НF-Sb5
зі збільшенням парціального тиску водню швидкість реакцій гідрокрекінгу й диспропорціонування н
-гексана знижується, одночасно трохи знижується й швидкість його ізомеризації.
У присутності каталізаторів НCl – AlCl3
і HF – BF3
інгібірування воднем реакції гідрокрекінгу й диспропорціонування, а також реакції ізомеризації пояснюється зниженням концентрації карбкатіонов по реакції

Згідно поглядом Ола [2], взаємодія карбкатіона й молекули парафінового вуглеводню протікає через утворення проміжного пентакоординованного іона, що може розщеплюватися по декількох варіантах:
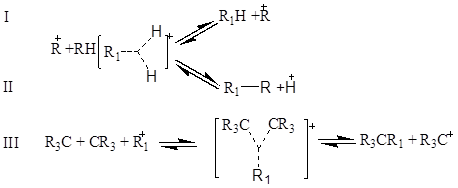
Аналізується комплекс причин, які можуть змінити активність каталізаторів при закоксовуванні, зокрема можливість хімічної взаємодії продуктів ущільнення з активними центрами каталізатора, фізична дезактивація, пов'язана з екрануванням і блокуванням коксом активної поверхні й пор, руйнування каталізаторів у процесі закоксовування й ін.
Інтенсивність отруєння каталізатора коксом визначається не тільки кількістю коксу, але й істотно залежить від умов коксування й природи каталітичної реакції.
Як можливі причини токсичності коксу для бифунциональних платинових, зміна розподілу коксу між металом і носієм при зміні умов коксових відкладень, зміна розподілу коксу між металом і носієм при зміна розподілу коксу між металом і носієм при зміні умов коксування, виборче травлення м6еталлических центрів, каталізуючих дану реакцію.
Вивчення процесу коксоутворення на алюмоплатинових каталізаторах не привело дотепер до однозначних висновків.
Для біфункціональних платинових каталізаторів була запропонована консекутивна схема утворення коксу, що полягає в протіканні ряду послідовних реакцій нерегулярної полімеризації й поліконденсації ненасичених проміжних продуктів, що утворяться в результаті дегідрування вуглеводнів і перерозподілу водню (рис. 2.10). Вихід коксу залежить від типу перетворюваного вуглеводню; до числа найбільш коксоагених відносяться дієнові, циклопентадієнові й інденові вуглеводні.
Першою стадією утворення коксу є виникнення на платинових центрах моноциклічних діолефінів, частково полімеризуючих в поліциклічні з декількома подвійними зв'язками; останні мігрують на кислотні центри носія, де піддаються крекінгу з утворенням нових ненасичених вуглеводнів, які потім полімеризуються. Звідси треба висновок, що падіння активності алюмоплатинових каталізаторів викликається нагромадженням на кислотних центрах носія проміжних сполук і їхньою наступною полімеризацією.

Рис. 2.10 Процес утворення коксу на алюмоплатиновому каталізаторі
У ряді робіт отруєння каталізатора коксом зв'язується з дією його на металеві центри.
Дані [2] указують на можливість зміни питомої активності металу в процесі завуглеводнення. Істотний вплив на зміну активності й селективності каталізатора робить структура коксових відкладень. Утворюючий неупорядкований вуглезмістний шар на поверхні металу токсичний для реакції дегідрування й не придушує реакції гідрогенолізу. Ступінь упорядкованості коксу визначається типом кристалічної грані металу й температурою реакції.
Контакт алюмоплатинових каталізаторів з вуглецевим середовищем приводить до зменшення поверхні металу внаслідок блокування його вуглеводневими відкладеннями, а також за рахунок його кристалізації й утворення шпінелі при взаємодії з носієм.
Однієї з важливих проблем, пов'язаних з дезактивацією алюмоплатинових каталізаторів під дією коксу, є розподіл вуглецю, що утвориться, між металом і носієм.
Показано [2], що кокс може блокувати й металеві, і кислотні центри каталізатора. За даними, у процесі ізомеризації кокс блокує в першу чергу платину й потім, у невеликому ступені, кислотні центри носія. Деякі автори використали методику виборчого отруєння різних активних центрів сірчистими й азотистими сполуками. Після отруєння каталізатор випробовували в реакції дегідрування циклогексану. У результаті прийшли до висновку, що завуглеводненню піддається й металеві, і кислотні центри каталізатора.
Таблиця 1. Характеристика вихідної сировини, напівфабрикатів і виготовляємої продукції
| Найменування сировини, матеріалів, реагентів, каталізаторів, напівфабрикатів, виготовленої продукції |
Міждержавний, державний або галузевий стандарт, технічні умови, або методика |
Показники якості, обов'язкові для перевірки (найменування й одиниця виміру) |
Норма (припустимі межі) по нормативній документації |
Область використання (застосування) |
| Сировина
|
Пентан-гексанова фракція із блоку ректифікації установки каталітичного риформінгу
ЛГ-35-11/300-95
|
СТП ПР 11-2004 |
1. Густина при 20 о
С, кг/м3
|
677 |
Сировина блоку ізомеризації |
| 2. Вуглеводневий склад, %мас.: |
| ізобутан |
0,04 |
| н
-бутан |
0,67 |
| неопентан |
0,48 |
| ізопентан |
9,6 |
| н
-пентан |
16,74 |
| 2-метилпентан |
14,2 |
| 3-метилпентан |
9,98 |
| н
-гексан |
21,32 |
| метилциклопентан |
11,26 |
| циклогексан |
9,09 |
| бензол |
3,52 |
| 2-метилгексан |
0,6 |
| 3-метилгексан |
0,39 |
| н
-гептан |
0,01 |
| димелпентан |
0,71 |
| триметилбутан |
0,9 |
| диметилциклопентан |
0,49 |
| 3. Загальна сірка, ppm мас., не більше |
0,5 |
| 4. Загальний азот, ppm мас., не більше |
0,1 |
| 5. Кисневмісні речовини, ppm мас., не більше |
0,5 |
| 6. Вода, ppm мас., не більше |
- |
| 7. Мідь, ppm мас., не більше |
20 |
| 8. Свинець, ppm мас., не більше |
10 |
| 9. Миш'як, ppm мас., не більше |
1 |
| Найменування сировини, матеріалів, реагентів, каталізаторів, напівфабрикатів, виготовленої продукції |
Міждержавний, державний або галузевий стандарт, технічні умови, або методика |
Показники якості, обов'язкові для перевірки (найменування й одиниця виміру) |
Норма (припустимі межі) по нормативній документації |
Область використання (застосування) |
| 10. Фториди, ppm мас., не більше |
- |
| 11. Бромне число, не більше |
4 |
| 12. HCl, ppm мас., не більше |
0,5 |
Водневмістний газ каталітичного риформінгу
ЛГ - 35-11/300-95
|
СТП ПР 12-2004 |
1. Вуглеводневий склад., % про.: |
Сировина блоку ізомеризації |
| водень |
77,9 |
| метан |
11,3 |
| этан |
5,6 |
| пропан |
3,8 |
| ізобутан |
0,7 |
| н-пентан |
0,7 |
| ізопентан |
- |
| н-пентан |
- |
| 2. H2S, ppm про., не більше |
1 |
| 3. NH 3, ppm про., не більше |
1 |
| 4. СО2, ppm про., не більше |
9 |
| 5. СО, ppm про., не більше |
1 |
| 6. HCl, ppm про., не більше |
5 |
| Виготовлена продукція |
| Ізомеризат |
СТП ПР 13-2004 |
1. Густина при 20 оС, кг/м3 |
662 |
| 2. Вуглеводневий склад, % мас.: |
| ізобутан |
0,06 |
| н-бутан |
0,09 |
| ізопентан |
25,99 |
| н-пентан |
10,49 |
| 2,2 – диметилбутан |
29,09 |
| 2,3 – диметилбутан |
5,26 |
| 2 – метилпентан |
8,02 |
| 3 – метилпентан |
1,15 |
| н-гексан |
0,21 |
| метилциклопентан |
0,44 |
| циклогексан |
1,52 |
| 2 – метилгексан |
0,23 |
| Найменування сировини, матеріалів, реагентів, каталізаторів, напівфабрикатів, виготовленої продукції |
Міждержавний, державний або галузевий стандарт, технічні умови, або методика |
Показники якості, обов'язкові для перевірки (найменування й одиниця виміру) |
Норма (припустимі межі) по нормативній документації |
Область використання (застосування) |
| 3 – метилгексан |
0,26 |
| 3 – етилгексан |
0,03 |
| 2,2 -диметилпентан |
0,05 |
| 2,3-диметилпентан |
0,21 |
| 2,4-диметилпентан |
0,03 |
| 3,3-диметилпентан |
0,09 |
Побічна продукція
|
н-гексан |
0,16 |
| метилциклогексан |
9,51 |
| 1,1-диметилциклогексан |
6,67 |
| н-октан |
0,35 |
| 2,2,3-триметилбутан |
0,02 |
| етилциклогексан |
0,07 |
| 3. Октанове число (дослідницький метод) |
88-89 |
| 4. Випробування на мідній пластині |
дотримує |
| Очищений газ стабілізації |
| СТП ПР 10-2004 |
СТП ПР 10-2004 |
1. Густина, кг/м3 |
1,18 |
На потреби |
| 2. Зміст водню, % об. |
36 |
| 3. Зміст HCl, ppm об. |
- |
3.
Опис технологічної схеми
Зрівняльна сировинна ємність C-1 призначена для забезпечення рівномірної безперебійної подачі сировини на реакторний блок. Сировина в ємності C-1 перебуває під захисною подушкою осушеного ВВГ. Суміш фракції НК-85o
С і пентан-гексанова фракція із блоку ректифікації установки каталітичного риформінгу з ємності C-1 насосом H-1/A(B) подається в трійник змішання. У трійнику змішання відбувається змішання сировини із водневмістним газом (ВВГ).
Для захисту від механічних домішок на прийомному трубопроводі насоса H-1/A(B) установлений фільтр Ф-1.
Газо-сировинна суміш (ГСС) нагрівається послідовно в теплообміннику холодного об'єднаної сировини T-1, у теплообміннику гарячого об'єднаної сировини T-2 і в теплообміннику T-3.
Схемою передбачена подача перфторетилену (С2
F4
) у лінію ГСС на виході з теплообмінника T-2. Промотор подається в технологічний потік дозувальним насосом H-2/A(B). Витрата перфторетилена регулюється ходом поршня насоса H-2/A(B). Перфторетилен зберігається в ємності C-2 під захисною азотною подушкою.
Сировина з температурою 380 0
С у початку циклу (4200
С – наприкінці циклу) надходить у перший по ходу (головний) реактор R-1 або R-2.
На різних етапах роботи блоку ізомеризації кожний реактор може перебуває як у головному так і хвостовому положенні. По висоті кожного реактора встановлені термопари для поточного контролю температури в шарі каталізатора.
Потік ГПС виходячи з головного реактора надходить у теплообмінник T-2, де частково приділяється теплота реакції, що виділилася в першому реакторі.
Необхідна температура ГПС на вході у хвостовий реактор досягається регулюванням витрати ГПС по байпасній лінії теплообмінника T-2.
Охолоджена ГПС із температурою 3500
С у початку циклу (4000
С – наприкінці циклу) надходить у другий – хвостовий реактор. Вихідний із другого реактора газо-продуктовий потік направляється в трубний простір теплообмінника T-1 і далі надходить у стабілізаційну колони.
Частина газо-продуктової суміші може проходити по байпасній лінії теплообмінника T-1 для забезпечення гнучкості в регулюванні температури. Така схема використається в тих випадках, коли каталізатор свіжий і необхідно більше глибоке проміжне охолодження між головним і хвостовим реакторами.
Реактора оснащені лініями продувки осушеним водневмістним газом, які розташовані на вході в кожний реактор. Продувка водневмістним газом використається для видалення вуглеводнів з реактора, при вивантаженні каталізатора, або для охолодження реактора під час аварійних ситуацій.
Схемою також передбачений відбір проб продукту вихідного з реакторів і теплообмінника T-1. Газо-продуктова суміш надходить у сепаратор-холодильник, де відбувається її охолодження до 400
С и стабілізація. Охолодження ГПС у сепараторі-холодильнику відбувається з допомогу оборотної води I-ої системи. Контроль тиску, температури й рівня рідини в сепараторі здійснюється за допомогою приладів установлених по місцю.
Схема традиційного технологічного розрахунку реактора та сама для різних процесів ізомеризації. У розрахунку використають дані про ефективний режим і матеріальний баланс, отримані на укрупненої лабораторній (пілотній) установці. За цим даними визначають потоки, що надходять у блоки поділи й ізомеризації, розміри й товщину стінок реактора, аеродинамічний і тепловий режим, конструкції опор і розподільних пристроїв, а також спосіб теплоізоляції. У цій главі обмежимося прикладом чисто технологічного розрахунку, що має на меті визначити параметри, що характеризують потоки реагуючої суміші.
Схема технологічного розрахунку не залежить від виду сировини, тому проілюструємо її для процесу одержання ізопентану з пентанової фракції (н.к. 850
С) прямогонного бензину. Кількість фракції, що надходить на переробку, становить 300 тис. т у рік. Хімічний склад її наступний [в % (мас.)]:
Таблиця 1. - Схема технологічного розрахунку
| Ізобутан |
0,04 |
Циклогексан |
9,09 |
| н
-бутан |
0,67 |
Бензол |
3,52 |
| Неопентан |
0,48 |
2-метилгексан |
0,6 |
| ізопентан |
9,6 |
3-метилгексан |
0,39 |
| н
-пентан |
16,74 |
н
-гептан |
0,01 |
| 2-метилпентан |
14,2 |
Диметилпентан |
0,71 |
| 3-метилпентан |
9,98 |
Триметилбутан |
0,9 |
| н
-гексан |
21,32 |
Диметилциклопентан |
0,49 |
| Метилциклопентан |
11,26 |
Розрахунок реактора можливий після складання матеріального балансу блоку поділу.
Розрахунок потоків у системі «поділ-ізомеризація». При розрахунку за 1 годину при стаціонарному режимі з 11605 кг н
-пентана, що виходить із реактора буде виділено й спрямовано на рециркуляцію 11200 кг н
-пентана. Тому що н
-пентан буде виділений з невеликою домішкою ізопентану ( 10%), та величина рециркулюючого потоку складе 12311,4 кг/год й у ньому буде втримуватися 91% (мас.) н
-пентана й 9% (мас.) ізопентану. Розраховуючи на річну продуктивність (326 робочих днів у році) величина рециркулюючого потоку н
-пентанової фракції складе 144487 т у рік. 10%), та величина рециркулюючого потоку складе 12311,4 кг/год й у ньому буде втримуватися 91% (мас.) н
-пентана й 9% (мас.) ізопентану. Розраховуючи на річну продуктивність (326 робочих днів у році) величина рециркулюючого потоку н
-пентанової фракції складе 144487 т у рік.
Із сировини буде витягнуто в блоці поділу:
300000·0,1674= 50220 т в рік
н
-пентанової фракції, і її загальний потік у реактор складе:
144487+67840=214395 т у рік.
Перейдемо тепер безпосередньо до розрахунку реактора.
1. Розрахунок годинного завантаження й об'ємного потоку сировини. При зазначеному щорічному числі днів нормальної експлуатації реактора (326 днів) годинне завантаження G0
складе:
G0
=214395/(326·24)=27,4 т/год=27400 кг/год=380,6 кмоль/год.
Об'ємний потік рідкої сировини (V0
) знаходимо по його масовому потоці G0
і щільності ρo
:
Vo
=Go
/ρo
=27,4:0,677=40,5 м3
/год.
2. Розрахуноккількостікаталізатора. Ізомеризаціюпроводятьунерухомомушарікаталізатора Pt на Al2
O3
+F приоб'ємнійшвидкостіподачірідкоїсировиниνo
=1,5 год-1
. Тодіобсягшаруючикаталізатораскладе Vk
= =V 0
/v0
=40,5/1,5=27 м3
. Принасипнійщільностікаталізатора, рівноїρнк
=0,65 т/м3
, загальнамасакаталізаторадорівнює:
Gk
=27·0,65=17,55 т.
3. Розрахунок кількості циркулюючого газу. Об'ємний склад (в об'ємних частках) циркулюючого газу задають на основі даних про роботу пілотної (або аналогічної промислової) установки. Він є наступним:
Розрахунок кількості циркулюючого газу
| водень |
77,9 |
| метан |
11,3 |
| этан |
5,6 |
| пропан |
3,8 |
| ізобутан |
0,7 |
| н
-пентан |
0,7 |
Помітимо, що співвідношення об'ємних потоків циркуляційного газу й рідкої сировини – кратність циркуляції (β, у м3
/м3
) можна розрахувати, знаючи мольне співвідношення H2
: вуглеводні (δ), об'ємну частку водню в циркулюючому газі (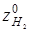 ), молекулярну масу (М) рідкої сировини і його щільність (ρ0
, кг/м3
): ), молекулярну масу (М) рідкої сировини і його щільність (ρ0
, кг/м3
):
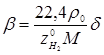
У розглянутому прикладі:
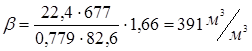
Для розрахунку масового потоку циркулюючого газу (Gцг
) можна використати співвідношення:
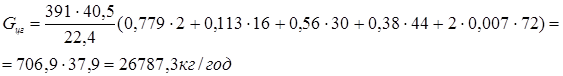
Зрозуміло, що мольний потік циркулюючого газу дорівнює 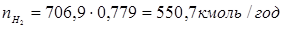 . .
4. Розрахунок складу газо-сировинної суміші, що надходить у реактор. На основі отриманих даних вище про кількість і состав потоків, що надходять у реактор, установлюємо склад газо-сировинної суміші (пентанова фракція + циркулюючий газ):
Таблиця 4.1 Склад газо-сировинної суміші, що надходить у реактор
| Компонент |
Кількість |
Частка в газо-сировинній суміші |
| кг/год |
кмоль/год |
масова |
мольна (об'ємна) |
| Водень |
1101,35 |
550,67 |
0,03388 |
0,506 |
| Метан |
1278,08 |
79,88 |
0,03932 |
0,0734 |
| Етан |
1187,59 |
39,59 |
0,03654 |
0,0364 |
| Пропан |
1181,94 |
26,86 |
0,03636 |
0,0247 |
| i
-Бутани |
356,28 |
4,95 |
0,01096 |
0,00455 |
| н
-Пентан |
24934 |
351,2 |
0,767 |
0,323 |
| Ізопентан |
2466 |
34,25 |
0,0759 |
0,0315 |
| Разом: |
32505,24 |
1087,40 |
1 |
1 |
Газо-сировинна суміш надходить у реактор при 653 K і 4МПа. Визначимо об'ємний потік цієї суміші (Vp
) на вході в реактор. Відповідно до рівняння ідеального газу, емеем:
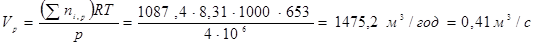
5. Розрахунок складу газо-продуктової суміші. Його виконують на основі даних про состав газо-сировинної суміші, а також на основі отриманих на пилотной установці даних про витрати водню й про виходи вуглеводнів при ізомеризації. За цим даними, витрати водню на гідрокрекінг становлять 0,2% (мас.) від сировини (від фракції C5
), а масові виходи продуктів при ізомеризації пентанової фракції [91% (мас.) н
-пентана й 9% (мас.) изопентана] розраховуючи на сировину наступні: 55,2% (мас.) н
-пентана, 41,2% (мас.) изопентана, 0,7 % (мас.) бутанів, 1% (мас.) пропану, 1,1% (мас.) етана, 0,8% (мас.) метану. Відповідно до цих цифр одержимо наступний склад газо-продуктової суміші:
Таблиця 4.2 Склад газо-продуктової суміші
| Компонент |
Кількість |
Частка в газо-сировинній суміші |
| кг/год |
кмоль/год |
масова |
мольна (об'ємна) |
| Водень |
1036,34 |
518,17 |
0,0319 |
0,496 |
| Метан |
1505,62 |
94,10 |
0,0463 |
0,09 |
| Етан |
1512,64 |
50,42 |
0,0465 |
0,0482 |
| Пропан |
1506,99 |
34,25 |
0,0464 |
0,0328 |
| Бутани |
551,31 |
9,51 |
0,017 |
0,0091 |
| н-Пентан |
14044,74 |
195,07 |
0,432 |
0,187 |
| Ізопентан |
12347,59 |
143,58 |
0,38 |
0,137 |
| Разом: |
32505,23 |
1045,10 |
1,00 |
1,00 |
Помітимо, що при технологічному розрахунку досить важливо знати витрати водню. Через малу масу водню, що витрачає, (0,1-0,3% (мас.) від кількості вуглеводнів) експериментальний вимір цієї величини приводить до більшого помилкам. Більше правильним є розрахункове визначення витрат водню по масах обмірюваних вуглеводнів, вимірюваних з достатньою точністю.
4
.2 Тепловий розрахунок
При розрахунку теплового балансу реактора визначають кількість тепла, що надходить і йде з реакційною сумішшю, витрати тепла на реакцію й тепловтрати через стінку. За даними теплового балансу визначають температуру потоку, що йде, що необхідно для розрахунку наступних апаратур. Почнемо з оцінки тепловтрат, тому що вони мають самостійне значення.
Метою розрахунку є перевірка ефективності ізоляційного матеріалу й визначення зміни температури в реакторі за рахунок тепловтрат. Розрахунок ґрунтується на визначенні коефіцієнта теплопередачі через стінку (k
t
) і поверхні теплопередачі (S
t
). Кількість тепла, переданого навколишньому середовищу за одиницю часу, становить QT
=kt
∙St
∙∆Tcp
, де ∆Tcp
–
середня різниця температур реакційної суміші (TCM
) і зовнішньої температури (TH
).
Значення kt
розраховують по відомому співвідношенню
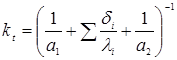
де a
1
і a
2
– коефіцієнти теплопередачі від потоку реагуючої суміші до стінки реактора й від стінки до зовнішнього середовища, а δi
і λi
– товщина й коефіцієнт теплопровідності i-
шару стінки. Стінка реактора звичайно тришарова: внутрішня футеровка (асбоцемент), метал (сталь) і зовнішня ізоляція (азбест). Товщина шару металу визначається тиском у реакторі й становить 3-7 мм, товщина ізоляційного й футеровочного шарів близька до 5 мм. Значення λ для сталі, асбоцемента й азбесту становлять 162, 2,2 і 0,5 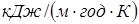 відповідно [2], відповідно [2], 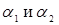 розраховують по емпіричних формулах; для режиму промислового реактора вони рівні 36,1 і 1,2 розраховують по емпіричних формулах; для режиму промислового реактора вони рівні 36,1 і 1,2 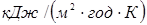 . Тоді kt
складе: . Тоді kt
складе:
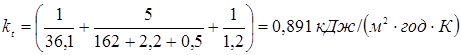 , ,
і навіть при максимальної ∆Tcp
=450 K маємо
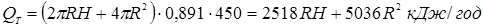
де R - радіус реактора, а H - його висота.
При розрахованих нижче розмірах реактора тепловтрати (QT
) складе усього 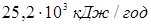 ,
що значно менше тепловбирання за рахунок реакції. Співвідношення тепловтрат через стінку й тепловбирання за рахунок реакцій не перевищує 0,005 (0,5%). Це означає, що промисловий реактор ізолюється досить ефективно. ,
що значно менше тепловбирання за рахунок реакції. Співвідношення тепловтрат через стінку й тепловбирання за рахунок реакцій не перевищує 0,005 (0,5%). Це означає, що промисловий реактор ізолюється досить ефективно.
Розрахуємо тепер, наскільки впаде температура в реакторі за рахунок тепловтрат у навколишнє середовище. Позначимо цю величину ∆TT
. Якщо G0,
cpo
і срцг
– масові потік і теплоємність вуглеводнів і циркулюючого газу, а 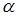 - масове співвідношення циркулюючого газу й вуглеводнів, то маємо: - масове співвідношення циркулюючого газу й вуглеводнів, то маємо:
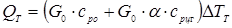

Для величин, наведених у технологічному розрахунку, маємо ∆TT
<10
С,
тобто тепловтрати мало міняють температуру в реакторі, і при розрахунках основного процесу можна вважати промисловий реактор адіабатичним.
Кількість тепла потоку реагентів (Qп1
) розраховують по масі (Gi
) і тепломісткості (qi
) компонентів потоку на виході при температурі Т0
:

Gi
наведені в таблицях 4.1 і 4.2; величини qi
і cpi
визначають як функції критичних параметрів (Tk
і pk
) і масових часток (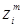 ) компонентів: ) компонентів: 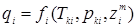 на основі таблиць і номограм. Спочатку розраховують (Qп1
) для вхідного потоку (приблизно на основі таблиць і номограм. Спочатку розраховують (Qп1
) для вхідного потоку (приблизно 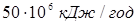 [2]). Потім, задаючись теплотою реакції на одиницю маси сировини, розраховують тепловиділення за рахунок реакції (Qp
). Оскільки тепловтрати через стінку відносно малі, приймаємо: [2]). Потім, задаючись теплотою реакції на одиницю маси сировини, розраховують тепловиділення за рахунок реакції (Qp
). Оскільки тепловтрати через стінку відносно малі, приймаємо:
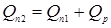
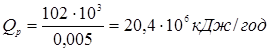
Тут 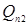 - кількість тепла, уносимое газо-продуктовим потоком. Знаючи - кількість тепла, уносимое газо-продуктовим потоком. Знаючи 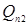 , далі підбором визначають температуру вихідного потоку (Tв
), для якої виконується умова: , далі підбором визначають температуру вихідного потоку (Tв
), для якої виконується умова: 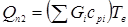 . .
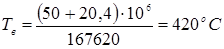
Такий метод визначення Tв
є наближеним не враховуюче одночасне протікання ізомеризації й гідрокрекінгу.
Лінійна швидкість потоку реагуючої суміші (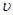 ) не повинна перевищувати швидкість витання ( ) не повинна перевищувати швидкість витання (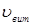 ), тобто швидкість, при якій починається рух зерен каталізатора. Звичайно користуються умовою: ), тобто швидкість, при якій починається рух зерен каталізатора. Звичайно користуються умовою: 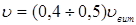 . Останню величину можна знайти з емпіричного рівняння, що зв'язує критерій Рейнольдса для витання . Останню величину можна знайти з емпіричного рівняння, що зв'язує критерій Рейнольдса для витання 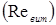 й критерій Архімеда й критерій Архімеда 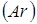
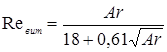
Причому
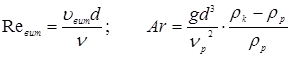 . .
Тут в – діаметр зерна каталізатора (0,003 м), 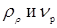 - щільність і кінематична в'язкість реакційного середовища; - щільність і кінематична в'язкість реакційного середовища; 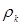 - гадана щільність каталізатора; g – прискорення вільного падіння. Значення - гадана щільність каталізатора; g – прискорення вільного падіння. Значення 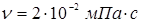 . Величину . Величину 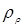 легко знайти по рівнянню ідеального газу: легко знайти по рівнянню ідеального газу:
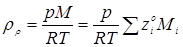
Величини 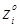 - мольні (об'ємні) частки компонентів реакційного середовища – дані в табл. 4.1. Так, для вхідного потоку маємо: - мольні (об'ємні) частки компонентів реакційного середовища – дані в табл. 4.1. Так, для вхідного потоку маємо:
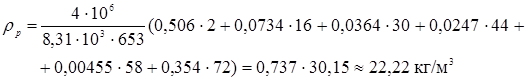
Значення 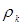 легко розрахувати по насипній щільності каталізатора легко розрахувати по насипній щільності каталізатора 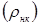 й пористості шаруючи (ε). Пористість визначається експериментально, і для обраного каталізатора вона становить 0,4. Тоді маємо: й пористості шаруючи (ε). Пористість визначається експериментально, і для обраного каталізатора вона становить 0,4. Тоді маємо:
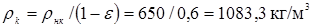
Тепер одержуємо можливість розрахувати критерій Архімеда:
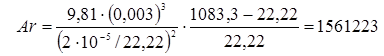
Тоді
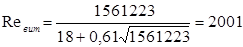
Тому
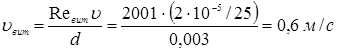
и. 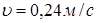 По лінійній швидкості газового потоку По лінійній швидкості газового потоку 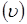 й об'ємному потоку реагуючої суміші, що надходить у реактор (Vp
), знайдемо діаметр реактора D
. Тому що й об'ємному потоку реагуючої суміші, що надходить у реактор (Vp
), знайдемо діаметр реактора D
. Тому що
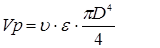 те те 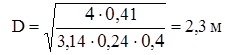
Прийнявши з деяким запасом і з урахуванням розмірів стандартних апаратур D=2,6 м, визначимо висоту реакційної зони по відомому обсязі каталізатора (Vk):
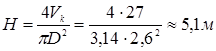
Для розрахунку перепаду тиску 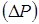 в потоці газів, що проходить через нерухомий шар каталізатора, використаємо рівняння Ергуна: в потоці газів, що проходить через нерухомий шар каталізатора, використаємо рівняння Ергуна:
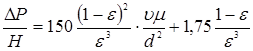
Звідси
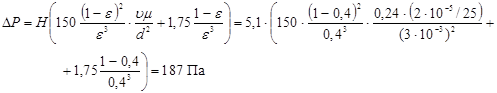
Розрахунок по цьому рівнянню показує, що перепад тиску в каталізаторному шарі висотою 5,1 м дорівнює 0,00019 МПа, тобто тиск у реакторі міняється не істотно.
5
. Конструювання реактора, розрахунки його основних деталей на міцність
Розрахунок проведений за ДСТ 14249-80 «Посудини й апарати. Норми й методи розрахунку на міцність.
5.
1 Визначення товщини оболонки корпуса
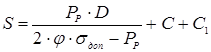 , ,
де:
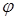 =1 - коефіцієнт міцності звареного шва; =1 - коефіцієнт міцності звареного шва;
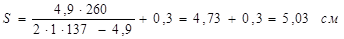 =137 МПа - допустима напруга для сталі 12 ХМ при температурі 3500
С; =137 МПа - допустима напруга для сталі 12 ХМ при температурі 3500
С;
С=0,3 см – збільшення до розрахункової товщини оболонки для компенсації корозії;
С1
=0- додаткове збільшення до розрахункової товщини стінки.
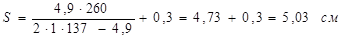
Приймаємо товщину стінки оболонки з урахуванням негативного відхилення в сортаменті на листову сталь за ДСТ -74 S=55мм.
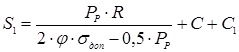
де:
R- радіус кривизни у вершині днища (для стандартних еліптичних днищ R=D).
Приймаємо товщину днища з урахуванням утоненя листа при штамповці S1
=60мм.
Розрахунок проведений по ДСТ 26-2045-77 «Посудини й апарати норми й методи розрахунку зміцнень отворів».
Найбільший припустимий діаметр, що, одиночного отвору, що не вимагає додаткового зміцнення в днище:
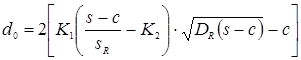 , ,
де: К1
=1,0; К2
=0,8 – коефіцієнти, обумовлені по ДСТ 26-2045-77;
s=s-c-c1
=4,69 см – розрахункова товщина стінки днища см.
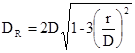
де: м - відстань від центра зміцнювального отвору до осі днища.
Розглянемо три типи отворів:
а) центральне розташованя (горловини корпуса реактора) га
= 0 см;
б) зміщений від осі штуцер «кармана» термопари гб
=85 см;
в) зміщений від осі штуцер вивантаження каталізатораь гв
=80 см.
DR
a
=2D=2·260=520 см.
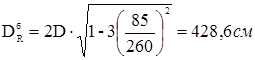
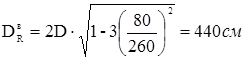
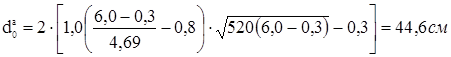
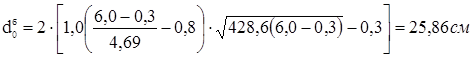

тобто потрібне зміцнення штуцерів-горловин верхньої й нижньої.
Для верхнього й нижнього днищ для подальшого розрахунку визначаємо найбільший допустимий діаметр отвору, що не вимагає додаткового зміцнення, при відсутності надлишкової товщини стінки:
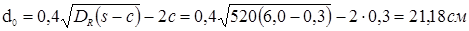 . .
5.3 Визначення тиску регенирації, пробного тиску й пускового тиску при мінусовій температурі
Розрахунок тиску, що допускає, при режимі регенирації вводиться при конічному переході діаметром 500 маємо Т=570 о
С,  то Для сталі 12XM, 08X18H10T то Для сталі 12XM, 08X18H10T
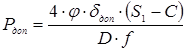
де f
– коефіцієнт форми днища визначається за ДСТ 14249-73 в залежності від кута 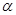 й відношення й відношення 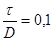 . f
=1,2. . f
=1,2.
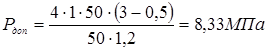 . .
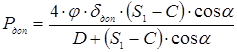

Приймаємо робочий тиск при регенирації 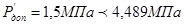 . .
Визначаємо пробне тиску при гідровипробуванні на підприємство-виготовлювача:
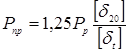
де 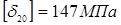 , , 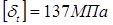 - допускає напряжение, що, для сталі 12 - допускає напряжение, що, для сталі 12
XM при T=20 o
і при T=350 o
.
 . .
Приймаємо 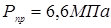 . .
Пусковий тиск при мінусовій температурі максимальна величина тиску середовища в апарату при пуску й обпресуванні холодного апарата.
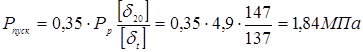
Приймаємо 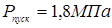 . .
Матеріал кришки - сталь 15X5M, прокладки 08X18H10T.
Допуск напруги при T=350 o
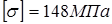 . Збільшення для компенсації корозії С=0,3 мм. . Збільшення для компенсації корозії С=0,3 мм.
| Dсн
=275 мм |
b= 16 мм |
| Dз
= 360 мм |
h2
=11 мм |
Розрахунок товщини кришки.
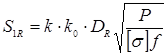
Де 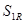 - розрахункова товщина стінки кришки. - розрахункова товщина стінки кришки.
k
– коефіцієнт, що залежить від конструкції зміцнення кришки.
ko
– коефіцієнт ослаблення кришки отвором.
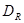 -
розрахунковий діаметр кришки, що дорівнює середнім діаметрам прокладки. -
розрахунковий діаметр кришки, що дорівнює середнім діаметрам прокладки.
f
– коефіцієнт міцності зварених швів .
Величина k
визначається за ДСТ 1429 – 80
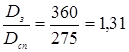
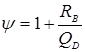
де 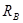 - болтове навантаження, H. - болтове навантаження, H.
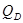 - рівнодіюча внутрішнього тиску на кришку, Н. - рівнодіюча внутрішнього тиску на кришку, Н.
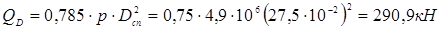
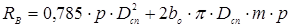
де bo
– ефективна ширина прокладки:
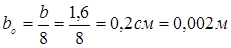
m
– прокладочний коефіцієнт для сталі 08X18H10T m
=6,5.
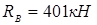
тоді
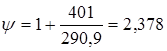
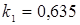 ; ; 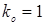 , тому що отвір для болтів у розрахунку не приймають. , тому що отвір для болтів у розрахунку не приймають.
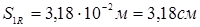
Виконавча товщина кришки
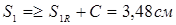
Приймаємо S1
=75мм.
Товщина кришки в місці ущільнення
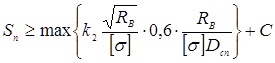
тут за ДСТ 14249- 80 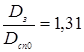 і k2
=0,45. і k2
=0,45.
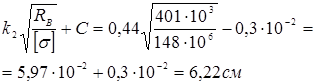
Прийнята товщина в місці ущільнення
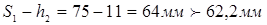
Визначаємо напруги в кришці при гідровипробуванні пробним тиском
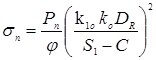
де Pn
- 6,6 МПа – тиск гідровипробування
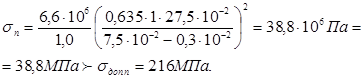
де 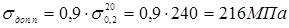 - допускає напряжение, що, при гідровипробуванні; - допускає напряжение, що, при гідровипробуванні; 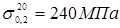 - боковий вівтар плинності стали 15X5M при T=20o
. - боковий вівтар плинності стали 15X5M при T=20o
.
5.5 Розрахунок температури зовнішньої стінки реактора
Тепловий потік через ділянку футеровки 1м2
визначається рівнянням
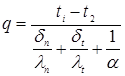
температура на границі покривного й теплоізоляційного шарів.
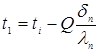
Температура зовнішньої стінки
Розглянемо два режими
1. режим реакції
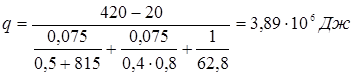
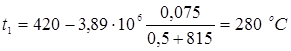

2. режим регенерації
6. Е
кологічна обстановка на виробництві
Тверді вимоги по змісту води й сірковмісних сполук у сировину ізомеризації обумовили необхідність наявності в комплексі ізомеризації блоку попереднього гідроочищення й осушувачів сировини й водню. Домішки, що видаляють із сировини при його підготовці, утилізуються на існуючих виробничих потужностях - установка виробництва сірки й установка відпарки кислої води - і не забруднюють навколишнє середовище. При організації технологічного процесу предгідроочистки й ізомеризації для захисту атмосферного повітря від забруднюючої дії установки передбачене здійснення технологічного процесу в герметично закритим апаратам, застосування насосів з подвійним торцевим ущільненням для перекачування нафтопродуктів і інші заходи. Це дозволить повністю виключити викиди нафтопродуктів і водню. Обладнання установки предгідроочистки й ізомеризації виконано з умовою дотримання всіх необхідних мір безпеки технологічного процесу, імовірність виникнення аварійних ситуацій мінімізується за рахунок застосування засобів автоматизації, систем сигналізації й блокувань.
7. Е
кономічна оцінка удосконалень, впроваджених у проекті
З розділу 1 кінетичне рівняння, яке описує процес ізомеризації на алюмоплатиновому каталізаторі, промотированому фтором:
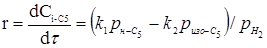
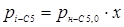

Звідси
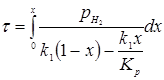
З рівняння (6.3) отримуємо час перебування для вибраного каталізатора.
З розділу 1: табл. 1.3  ; ; 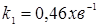 ; ;
табл. 1.1 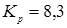 . .
При ступені перетворення 0,5, маємо:
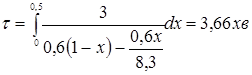
З розділу 1 кінетичне рівняння, яке описує процес ізомеризації на алюмоплатиновому каталізаторі, промотированому хлором:
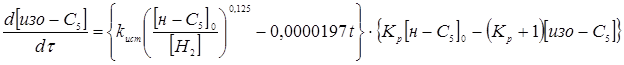
Враховуючи те, що алюмоплатиновий каталізатор промотується в промисловості перхлоретиленом, тому втрату активності каталізатором за проміжок часу t
можна не враховувати. Тоді рівняння, яке описує кінетику процесу ізомеризації прийме вигляд:
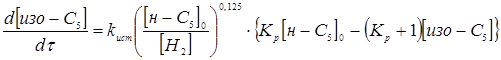
З даного рівняння виразимо час перебування при даному каталізаторі для ступеня перетворення 0,5.
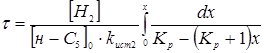
З табл. 1.4 і 4.1. маємо Кр
=
4,51;  ; ; 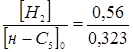 , маємо: , маємо:
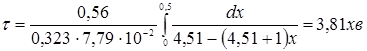
В результаті використання алюмоплатинового каталізатора промотированого фтором час перебування зменшується в 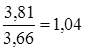 рази, тобто в даному випадку кількість каталізатора зменшується на 4 %. рази, тобто в даному випадку кількість каталізатора зменшується на 4 %.
У даному курсовому проекті по заданим характеристикам зроблений розрахунок основних технологічних і конструктивних параметрів реактора установки ізомеризації бензинової фракції з продуктивністю по сировині 200 тис. т в рік. А також було вивчено теоретичну основу хімічного процесу ізомеризації. В теоретичній основі висвітився, на практичних і чисто теоретичних основах, процес ізомеризації. В результаті можна говорити про те, що в даному курсовому проектові бралося до уваги не тільки теоретичні основи, а і досліди, які проводилися науковцями. Ці досліди і використалися в даному курсовому проекті.
Характеристика даного реактора, яка приведена в технологічному розрахунку даного курсового проекту:
загальний потік у реактор газової суміші становить 205206 кг в рік;
маса каталізатора 18210 кг;
об’ємний потік, який надходить у реактор 0,29 м3
/с;
висота шару каталізатора 5,3 м.
Корпус реактора виготовлений із хром-молібденової сталі марки 12ХМ.
В даному курсовому проекті реактор проектувався з футеровкою, яка захищає стінку реактора від високих температур. Тому розрахована температура стінки реактора не перевищує 450
С.
1. Жоров Ю.М. Изомеризация углеводородов: Химия и технология. - М.: Химия, 1983 - 304 с.
2. Бурсиан Н.Р. Технология изомеризации парафиновых углеводородов. - Л.: Химия, 1985- 192 с., ил.
3. Беркман Б.Е. Основы технологического проектирования производств органического синтеза. - М.: Химия, 1970.
4. Под редакцией С.И. Зусмановокой Расчет и конструирование нефтяной аппаратуры. - Вып. 20. М.: Отдел научн. информации, 19673 - 186 с.
5. С.В. Адельсон, П.С. Белов Примеры и задачи по технологии нефтехимического синтеза. - М.: Химия, 1987 - 192 с.
|