|
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ППиМЭ
Работа на тему:
Фотоэлектронная спектроскопия
Факультет: РЭФ
Группа: РФ1-32
Студент: Косенков В.Е.
Преподаватель: Величко А.А.
Дата: 19.12.2007
Отметка о защите:
Новосибирск, 2007
Фотоэлектронная спектроскопия
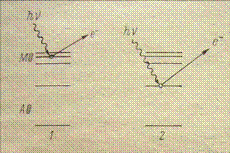
Фотоэлектронная спектроскопия(ФЭС) – это наиболее широко используемый метод для изучения электронной структуры заполненных состояний на поверхности и в приповерхностной области (глубина 20-40 Ǻ). Физической основой метода служит фотоэлектрический эффект, в котором электрон, первоначально находящийся в состоянии с энергией связи Ев
, поглощает фотон с энергией hν и покидает твердое тело с кинетической энергией:
Еkin
=hν – Ев
– Фо
, где Фо
= Еvacuum
– ЕFermi
;
 Для того, чтобы зарегистрировать фотоэлектрон, должны быть выполнены следующие условия:
· Энергия фотона должна быть достаточна, чтобы электрон смог покинуть твердое тело, то есть hν ≥ Ев
+ Фо
()
· Скорость электрона должна быть направлена в сторону внешней поверхности.
· Электрон не должен потерять энергию в столкновениях с другими электронами на своем пути к поверхности.
Диапазон энергий фотонов, используемый в материаловедении ,простирается от ультрафиолета (УФ) до рентгеновского излучения. Практически энергетический диапазон простирается от 10 эВ, что близко к энергии связи электрона в атоме водорода (13,6 эВ), до энергий около 100 кэВ. При этих энергиях фотоны могут, проникая в твердое тело, взаимодействовать с электронами внутренних оболочек. Фотоны низких энергий используются для исследования спектров излучения в видимой области, связанного с далеко расположенными, более слабо связанными электронами. Эти внешние электроны участвуют в образовании химических связей, поэтому они не связаны с отдельными атомами и, следовательно, непригодны для элементного анализа.
В зависимости от энергии фотонов (длины волны), используемых для возбуждения электронов, фотоэлектронная спектроскопия обычно подразделяется на два типа:
·   УФЭС (ультрафиолетовая фотоэлектронная спектроскопия), в которой используются фотоны ультрафиолетового спектрального диапазона 10-50 эВ (соответствующие длины волн от 1000 до 250А). В результате УФЭС используется для изучения валентной зоны и зоны проводимости. УФЭС (ультрафиолетовая фотоэлектронная спектроскопия), в которой используются фотоны ультрафиолетового спектрального диапазона 10-50 эВ (соответствующие длины волн от 1000 до 250А). В результате УФЭС используется для изучения валентной зоны и зоны проводимости.
· РФЭС (рентгеновская фотоэлектронная спектроскопия), в которой используется рентгеновское излучение с энергией квантов в диапазоне 100 эВ-10 кэВ (соответствующие длины волн от 100 до 1А). Как следствие РФЭС зондирует глубокие остовные уровни.
· Синхротронное излучение, в котором энегрии энергии фотонов от 40 до 1200 эВ. Позволяет исследовать остовные уровни и валентную зону.
Это разделение на два типа достаточно условно как с точки зрения объекта исследования (подразделение энергетических уровней на основные и валентные само по себе условно), так и с точки зрения используемых источников излучения (при использовании синхротронного излучения можно излучать фотоэмиссию от мягкого ультрафиолетового излучения до жесткого рентгеновского). Более того в обоих методах используются одни и те же физические процессы.
Рентгеноэлектронный спектрометр
| Рис.3. Спектрометр
1 – источник рентгеновского (ультрафиолетового) излучения
2 – образец
3 – анализатор
4 – детектор электронов
5 – усилитель
6 - самописец
|
|
 Из уравнения h
ν = Eсв
+ Eкин
видно, что если известны величины h
ν и Eкин
, то можно определить энергию ионизации Eион
или энергию связи Eсв
соответствующего уровня. Для определения Eкин
используются специально созданные электронные спектрометры. Электронный спектрометр (рис. 3) состоит из трех основных частей, в которых соответственно происходят генерация электронов, анализ их энергии и регистрация. В спектрометре поток ионизирующего излучения направляется на образец. Электроны могут быть выбиты из любой оболочки молекулы, ионизационный потенциал которой меньше энергии облучения. Выбитые электроны попадают в анализатор энергий электронов спектрометра. В анализаторе электроны описывают различные траектории в зависимости от своих энергий и напряжения, приложенного к электродам анализатора.
Наиболее распространен и хорошо известен сферический анализатор. В этом анализаторе к обкладкам сферического конденсатора прикладывается заданное напряжение. Разность потенциалов между двумя пластинами сферического конденсатора непосредственно связана с кинетической энергией электронов, прошедших через анализатор соотношением
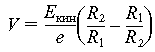
где Eкин
– кинетическая энергия электрона, V – разность потенциалов между двумя сферами радиусов R1
и R2
. Если менять напряжение на обкладках, то можно проанализировать спектр энергии Eкин
, которой обладают электроны, падающие на входную щель анализатора.
Исследуемое вещество облучают монохроматическим рентгеновским излучением. В качестве источника рентгеновских монохроматических квантов может быть использована обычная рентгеновская трубка, анод которой сделан из материала, имеющего достаточно интенсивную и узкую линию рентгеновского излучения. В качестве таких линий выступают обычно – линия Mg (hν = 1253,6 эВ) или -линия Al (hν = 1486,6 эВ).
В качестве детектора электронов может быть использован обычный электрометр или пропорциональный счетчик. В серийных промышленных спектрометрах применяются электронные умножители. В этих приборах каждый попавший в них фотоэлектрон выбивает лавину вторичных электронов, которые регистрируются электронной схемой как отдельный импульс. Интенсивность рентгеноэлектронной линии определяется числом импульсов в единицу времени.
Физический принцип.
В фотоэлектронной спектроскопии твердых тел анализируется кинетическая энергия электронов, испущенных при облучении твердых тел моноэнергетическими фотонами с энергией hν
hν = Еkin
+ ЕВ
+ Фо
, где Фо
= Еvacuum
– ЕFermi
;
где I – энергия связи(ионизации) атомного или молекулярного уровня системы. Энергия фотонов известна, кинетическая энергия фотоэлектрона Еkin регистрируется с помощью спектрометра, а работа выхода спектрометра легко определяется с помощью калибровочных экспериментов.
Значит легко можно определить энергию связи (ионизации) соответствующего электронного уровня, которая зависит от характера распределения электронов в исследуемой системе.


Отсюда видно, что спектр фотоэмиссии I(E) это своего рода отпечаток плотности заполненных состояний исследуемого материала.
Анализ с помощью ФЭС
Фотоэлектронный спектр натрия
На рис. 5 проиллюстрирован процесс рентгеновской фотоэмиссии натрия. Пики соответствуют энергиям характеристических электронов, покидающих твердое тело без процессов, приводящих к потерям энергии.

Рис. 5. Энергетический спектр электронов образца Na, при синхротронном облучении фотонами с энергией 100 эВ. На энергетической шкале приведена энергия связи, т. е. hv — Етн.
Пики соответствуют энергиям характеристических электронов, покидающих твердое тело без процессов, приводящих к потерям энергии. Хвосты со стороны большей энергии связи соответствуют электронам, претерпевшим неупругое рассеяние и потерю энергии на пути из образца и выходящим поэтому с меньшей кинетической энергией, что приводит к кажущемуся возрастанию энергии связи.
Линии 2s и 2p отчетливо видны в виде острых пиков, это и есть остовные уровни, положение которых определяется энергией связи электронов, что является характеристикой данного элемента. Т.е. присутствие пиков при данной энергии связи является свидетельством присутствия на поверхности данного элемента (содержит информацию о химическом составе поверхности).
Сравнивая энергии пиков на экспериментальном спектре с известными энергиями связи в элементах можно выяснить какие элементы присутствуют в данном материале.
Из измеренных амплитуд пиков на спектре РФЕС, можно определить концентрацию элементов, из которых состоит поверхность.
Хочу отметить, что в общем случае вероятность фотоэмиссии максимальна при энергии фотонов близкой к порогу ионизации и она быстро уменьшается, если энергия фотонов значительно превосходит энергию связи электронов. Поэтому РФЭС – это метод для исследования в основном глубоких остовных уровней. Для исследования валентной зоны нужна меньшая энергия и использование УФ источника возбуждения.
Энергии 100эВ недостаточна для вырывания электронов из K-оболочек Na, но достаточна для создания вакансий в L-оболочках.
Химический сдвиг
| Рис. 6. Химический сдвиг энергии связи линии Si2p в кремнии и SiO2
|
|
 Несмотря на постоянство энергии остовных уровней атома, в различных веществах имеется определенная разница в энергиях связи для данного атома при переходе от одного вещества к другому. Как следует из экспериментальных данных, энергия связи Есв
электронов остова несколько меняется при изменении характера химического окружения атома, спектр которого изучается. Несмотря на постоянство энергии остовных уровней атома, в различных веществах имеется определенная разница в энергиях связи для данного атома при переходе от одного вещества к другому. Как следует из экспериментальных данных, энергия связи Есв
электронов остова несколько меняется при изменении характера химического окружения атома, спектр которого изучается. 
| Рис. 7. Рентгеноэлектронный C1s-спектр этилового эфира трифторуксусной кислоты
|
|
Изменения энергии связи (ΔЕсв
) для электронного уровня одного и того же элемента в разных соединениях принято называть химическим сдвигом. Одними из важнейших результатов, полученных группой шведских физиков, являются демонстрация возможности измерения химических сдвигов на примерах рентгеноэлектронных спектров многих органических и неорганических соединений и создание аппаратуры, способной регистрировать соответствующие сдвиги. Сдвиг энергии внутренних электронов в зависимости от химического окружения показан на рис. 2 для линии Si2p. Энергия связи Si2p смещается более чем на 4 эВ при переходе от Si к SiO2
. Сдвиг энергии уровня обычно измеряется относительно свободного элемента. Средняя точность экспериментальных значений Есв
~ ± (0,1-0,2) эВ для твердых тел и около (± 0,04) эВ для газов. Для иллюстрации зависимости энергии связи электрона в атоме от химического окружения атома часто используют рентгеноэлектронный 1s-спектр углерода этилового эфира трифторуксусной кислоты (рис. 3). Четыре максимума C1s почти равной интенсивности в весьма изящной форме представляют четыре окружения атомов углерода в этой молекуле.
В табл. 2 приведены значения энергий связи для 2p-уровня серы в газообразных соединениях. Из табл. 2 видно, что изменения энергии связи внутренних электронов могут достигать очень значительных величин в ряду соединений этого элемента. 
Структура молекул
В настоящее время проведены многочисленные исследования, показывающие эффективность применения рентгеноэлектронной спектроскопии для решения различных вопросов структурной химии органических и неорганических соединений. Применение РФЭС в структурной химии можно показать на примере исследования 1s-спектров азота (N1s) в Na2
N2
O3
. До применения РФЭС предполагались три возможные структуры иона оксигипонитрата:
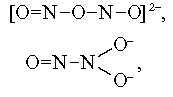
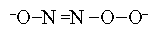
Рентгеноэлектронный спектр Na2
N2
O3
ясно указывает наличие структурно неэквивалентных атомов азота, и это исключает симметричную структуру (I). В то же время можно также ожидать, что структуры II и III будут давать две полосы в спектре N1s. Окончательный выбор между структурами (II) и (III) возможен только при анализе величины расщепления N1s полосы, связанной с различием величины электронной плотности на атомах азота.
Степень окисления
Рентгеноэлектронные спектры позволяют четко показать, что энергия связи внутреннего уровня атома в сильной степени зависит от степени окисления элемента, спектр которого изучается. Так, уже в первых работах было установлено, что при одинаковых ближайших соседях сдвиг внутренних уровней исследуемого атома в сторону увеличения Есв тем больше, чем больше степень окисления элемента в соединении.
При изучении поверхности металлов и сплавов часто возникают вопросы, является ли поверхность окисленной и какой именно компонент сплава окислен. Рентгеноэлектронные спектры в большинстве случаев помогают решить эту задачу, поскольку энергия связи электрона в металле обычно на несколько электронвольт меньше, чем в оксиде, причем с увеличением степени окисления также растет положительный химический сдвиг.
 Интересный эксперимент описан в книге К. Зигбана с сотрудниками. Металлический бериллий испарялся при давлении 10- 4
торр и осаждался на алюминиевую подложку. Образец облучали рентгеновскими квантами Kα
-линии Al и изучали выбитые 1s-электроны с целью определения энергии связи 1s-электрона в бериллии. Спектр (рис. 4) состоит из двух линий одинаковой интенсивности, расстояние между которыми равно 2,9 ± 0,1 эВ. Появление двух линий вместо одной можно объяснить тем, что металл частично окислен и одна из линий электронного спектра соответствует металлическому, а другая – окисленному бериллию. Для проверки этого предположения образец нагревали на воздухе до полного окисления бериллия и снова снимался электронный спектр. На этот раз была получена только одна 1s-линия. Ее положение совпадает с положением линии меньшей кинетической энергии на рис. 4. Следовательно, это линия бериллия в окисле. Для дополнительного доказательства бериллиевый образец, полученный испарением в вакууме, частично восстанавливали цирконием, после чего был получен его электронный спектр. Хотя в спектре видны обе линии, линия, соответствующая окислу, гораздо менее интенсивна. Интересный эксперимент описан в книге К. Зигбана с сотрудниками. Металлический бериллий испарялся при давлении 10- 4
торр и осаждался на алюминиевую подложку. Образец облучали рентгеновскими квантами Kα
-линии Al и изучали выбитые 1s-электроны с целью определения энергии связи 1s-электрона в бериллии. Спектр (рис. 4) состоит из двух линий одинаковой интенсивности, расстояние между которыми равно 2,9 ± 0,1 эВ. Появление двух линий вместо одной можно объяснить тем, что металл частично окислен и одна из линий электронного спектра соответствует металлическому, а другая – окисленному бериллию. Для проверки этого предположения образец нагревали на воздухе до полного окисления бериллия и снова снимался электронный спектр. На этот раз была получена только одна 1s-линия. Ее положение совпадает с положением линии меньшей кинетической энергии на рис. 4. Следовательно, это линия бериллия в окисле. Для дополнительного доказательства бериллиевый образец, полученный испарением в вакууме, частично восстанавливали цирконием, после чего был получен его электронный спектр. Хотя в спектре видны обе линии, линия, соответствующая окислу, гораздо менее интенсивна.
| Рис. 8. Рентгеноэлектронные Be1s-спектр
|
|
Поверхность твердого тела
Метод рентгеноэлектронной спектроскопии в настоящее время широко применяют для исследования поверхности твердых тел. В рентгеноэлектронной спектроскопии регистрируются электроны, вышедшие из слоя вещества, в котором они не успевают отдать часть своей кинетической энергии другим электронам и атомам в образце. Толщина этого слоя ~ 20 – 40 Ǻ, и, следовательно, рентгеноэлектронные спектры характеризуют только атомы поверхностного слоя. Вследствие этого рентгеноэлектронные спектры внутренних уровней атомов, входящих в соединение или материал, позволяют определять элементный состав поверхности, концентрацию элементов на поверхности, химическое состояние атомов на поверхности и приповерхностных слоях. Именно эти аналитические возможности метода позволяют изучать различные процессы, протекающие на поверхности.
Ультрафиолетовая фотоэлектронная спектроскопия.
Так как используются фотоны с низкой энергией происходит возбуждение только валентных уровней. Этот метод является инструментом изучения валентной полосы поверхности и её модификации в результате различных процессов на поверхности, таких как адсорбция, рост тонких пленок, химические реакции.
Для распределения плотности состояний в валентной зоне используется УФЭС с интегрированием по углам, которое в идеальном случае детектирует все фотоэлектроны, испускаемые над поверхностью образца.
Так же УФЭС с угловым разрешением позволяет определить закон дисперсии поверхностных состояний. Зависимость энергий связи фотоэлектронных спектров от угла выхода фотоэлектронов.
|