Министерство образования и науки Республики Казахстан
Западно-Казахстанский Государственный Университет
имени М. Утемисова
Мукашева М.М
Оксибензойные кислоты (фенолокислоты)
КУРСОВАЯ РАБОТА
Специальность 050112 – «Химия»
Уральск 2011
Министерство образования и науки Республики Казахстан
Западно-Казахстанский Государственный Университет
имени М. Утемисова
« Допущена к защите »
-------------- Заведующей
кафедрой ------------ Д .К. Мендалиева
КУРСОВАЯ РАБОТА
На тему : « Оксибензойные кислоты»
По специальности 050112 – « Химия »
Выполнила
:
М.М.
Мукашева
Научный руководитель
Старший преподователь кафедры «Хими
я
»
Ж.Н. Нуртаева
Уральск 2011
Оксибензойные кислоты — относятся к группе простейших фенольных соединений С6
— С1
-ряда, которые можно рассматривать как производные бензойной кислоты. Наряду с другими фенолами оксибензойные кислоты весьма широко распространены в природе: дубильные вещества, лигнин, некоторые гликозиды – это далеко не полный перечень природных веществ,построенных на их основе. Такие соединения, как салициловая, протокатеховая, ванилиновая, сиреневая и галловая кислоты обнаружены практически у всех покрытосеменных растений.
Оксибензойные кислоты - антисептики, входит в состав мазей, паст, присыпок и растворов для лечения кожных заболеваний . Ее применяют также в качестве консерванта некоторых пищевых продуктов, полупродукта в синтезе красителей и фунгицидов. Эфиры оксибензойных кислот и их соли – полупродукты в производстве душистых веществ. В больших масштабах оксибензойные кислоты потребляется в производстве азокрасителей.
Целью курсовой работы является рассмотрение химическую структуру оксибензойных кислот, изучить физико-химических свойств кислот и их производных и подробнее познакомиться о распространении в природе и применении этих феноло карбоновых соединений в разных отраслях науки.
Оксибензойные кислоты — кристаллические вещества, растворимы в спирте, этилацетате, диэтиловом эфире, а также в водных растворах гидрокарбоната и ацетата натрия. Вступают в реакцию сочетания с диазотированными ароматическими аминами с образованием окрашенных соединений. Эта реакция используется для обнаружения бензойных кислот на хроматограммах.
Оксибензойные кислоты по числу ОН группы делятся на :
- моногидрооксибензойные кислоты;
- дигидрооксибензойные кислоты;
- полиоксибензойные кислоты.
СВОЙСТВА ГИДРОКСИБЕНЗОЙНЫХ КИСЛОТ
Положение
группы
- ОН
|
Тривиальное название
|
Т. пл., °С
|

|
рК(20°С, вода)
|
Растворимость в
воде
, % по массе (25 °С) '
|
pK1
|
рК2
.
|
| Моногидроксибензойные кислоты (мол.м. 138,1)
|
| 2 |
Салициловая кислота |
159,5 |
1,443 |
2,7 |
7,5 |
1,80 |
| 3 |
- |
203 |
1,484 (25 °С) |
4,10 |
9,9 |
1,07 |
| 4 |
- |
216,3 |
1,482 (25 °С) |
4,60 |
9,3 |
0,49 (20 °С) |
| Дигидроксибензойные кислоты (мол.м. 154,1)
|
| 2,3 |
Пирокатеховая кислота |
204 |
1,542 |
2,8 |
10,1 |
. |
| 2,4 |
b-Резорциловая кислота |
227 |
- |
3,3 |
9,12 (4-ОН)* |
0,57 |
| 2,5 |
Гентизиновая кислота |
205 |
- |
3,1 |
10,2 |
2,10 |
| 2,6 |
g-Резорциловая кислота |
167 |
- |
1,05 |
- |
2,80 |
| 3,4 |
Пирокатехиновая кислота |
200-2 (с разл.) |
1,542 |
4,52 |
7,22** |
| 3,5 |
a-Резорциловая кислота |
238-240 |
- |
4,1 |
6,76** |
10,10 |
| Тригидроксибензойные кислоты (мол.м. 170,1)
|
| 2,3,4 |
Пирогаллоловая кислота |
207-8 (с разл.) |
- |
- |
- |
| 2,3,5 |
Оксигидрохиноновая кислота |
234,5-235 |
- |
- |
- |
- |
| 2,4,5 |
- |
217-218 (с разл.) |
- |
- |
- |
- |
| 2,4,6 |
Флороглюциновая кислота |
100 (с разл.) |
- |
- |
- |
- |
| 3,4,5 |
Галловая кислота |
240 (с разл.) |
1,694 (4°С) |
4,40 |
9,14 |
1,16 |
| 2,3,6 |
188,5-190 (с разл.) |
* рК3
15,6 (2-ОН). ** В 80%-ном 2-метоксиэтаноле.
Салициловая кислота
(от латинского слово « Salix
»
— ива, из коры которой она была впервые выделена) — 2-гидроксибензойная или фенольная кислота, С6
Н4
(ОН)СООН; Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы (Salix
.), откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria
, Spiraea digitata
).
Салициловая кислота – бесцветные кристаллы, легкорастворима в этаноле, диэтиловом эфире и других полярных органических растворителях, малорастворима в сероуглероде.
Растворимость в воде (г/л): (0о
С), 1.8 (20о
С), 8.2 (60о
С), 20.5 (80о
С).
Салициловая кислота - одна из наиболее распространенных оксибензойных кислот.

Основной промышленный способ синтеза салициловой кислоты и ее производных -карбоксилирование сухого фенолята Na (Кольбе-Шмитта реакция
) действием СО 2
при давлении 0,6 МПа, т-ре 185°С в течение 8-10 ч:

С многоатомными фенолами, например с резорцином, эта реакция проходит легче. Так, резорциловая кислота образуется уже при нагревании резорцина с раствором бикарбоната аммония:
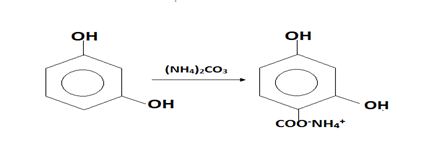
Резорцин резорцилат аммония
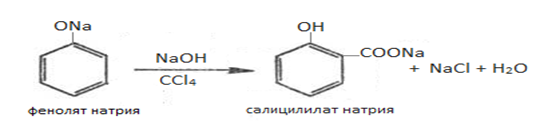
Салициловую кислоту можно также получить окислением салицилового альдегида или фенолят натрия с четыреххлористым углеродом и щелочью:
Является двухосновной кислотой: pK1
= 2,7, pK2
= 7,5.
Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной: в результате салициловая кислота значительно сильнее бензойной и своих изомеров, но не так активно, как фенол, такой орто-эффект оксигруппы обьясняется образованием водородной связи между функциональными группами, что увеличивает σ+
заряд на карбоксильном углероде:

Нуклеофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,4,6-тринитрофенолу), а бромирование — к 2,4,6-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-сульфобензойную) кислоту. При нагревании салициловая кислота декарбоксилируется до фенола, в промышленности салициловую кислоту обычно получают обратной реакцией — карбоксилированием фенолята натрия углекислым газом при 150—180 °C и давлении 5 атм (реакция Кольбе — Шмитта):

Следует обратить внимание, что такое карбоксилирование фенола, во-первых обратимо и, во-вторых, существенную роль в карбоксилирование в орто-положение к фенольному гидроксилу играет эффект взаимодействия координационной связи катионащелочного металла с кислородными лигандами с образованием хелатообразного промежуточного состояния: так, в орто-положение с образованием салицилата карбоксилирование происходит только в случае фенолятов натрия и лития, в случае фенолятов калия, рубидия и цезия карбоксилирование идёт по пара-положению — катионы этих щелочных металлов имеют больший радиус и координационная стабилизация переходного состояния невозможна. Об обратимости реакции говорит также перегруппировка дикалиевой соли салициловой кислоты в дикалиевую соль пара-гидроксибензойной кислоты и превращение натриевой соли пара-гидроксибензойной кислоты при нагревании в динатриевую соль салициловой кислоты.
Такое хелатообразование характерно для салициловой кислоты — так, качественный метод обнаружения салициловой кислоты основан на образовании интенсивно окрашенных в сине-фиолетовый цвет комплексов с хлоридом железа (III).
Салициловая кислота образует по функциональным группам два ряда производных. Хлористыми ацилами и ангидридами кислот ацилируется по гидроксигруппе; например , под действием ацетилангидрида превращается в ацетилсалициловую кислоту
(аспирин):

Хлор ангидрид салициловой кислоты образует с фенолами или спиртами сложные эфиры другого типа (по карбоксилу), например:

салициловая кислота салол
Салициловая кислота взаимодействуя с анилином в присутствии РСl3
ведет к салициланилиду:
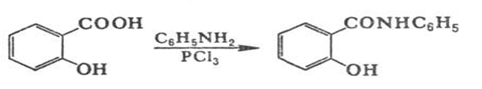
салициловая кислота салициланилид
Аспирин употребляется в качестве жаропонижающего и анальгетического средства, салол является антисептиком, рекомендуемым при желудочно-кишечных заболеваниях.
Каталитическое гидрирование на платине, а также восстановление натрием в изоамиловом спирте протекает с образованием пимелиновой кислоты ; промежуточно образуется тетрагидросалициловая кислота, которая гидролизуется по типу «кислотного расщепления » ацетоуксусного эфира:
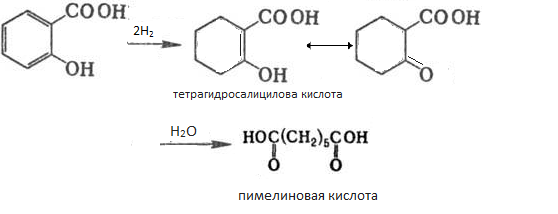
м
–Оксибензойная кислота получается при щелочном плавлении м-сульфобензойной кислоты:

п-
Оксибензойную кислоту синтезируют по Кольбе с применением калиевой щелочи. Ее метиловый эфир (по оксигруппе), называемый анисовой кислотой, получают окислением анетола ( метилового эфира п-
пропенилфенола):

В природе салициловая кислота встречается в различных растениях главном образом в виде гликозида ее метилового эфира и применяется в медицине.

В аналитической химии салициловая кислота – реагент для фотометрического определения Fe и Си, экстракционной отделения Th от других элементов; кислотно-основной люминесцентный индикатор (при рН 2,5-4,0 появляется синяя люминесценция); металлохромный индикатор для титриметрического определения Fe(III) при рН 1,8-3,0 (исчезает фиолетовое окрашивание) и T i(IV) при рН 2-3 (переход окраски от фиолетовой к бесцветной ).
Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженным жаропонижающим, противовоспалительным и болеутоляющим действием.
Салициловая кислота - антисептик, входит в состав мазей, паст, присыпок и растворов для лечения кожных заболеваний (напр., "салициловый спирт", представляющий собой раствор салициловой кислоты в этаноле, паста Лассара, мозольная жидкость и др.). Ее применяют также в качестве консерванта некоторых пищевых продуктов, полупродукта в синтезе красителей и фунгицидов. Эфиры салициловой кислоты и салицилаты (см. таблицу-2) – полупродукты в производстве душистых веществ. Ее натриевая соль применяется как лекарство при суставном ревматизме, а фениловый эфир (салол) - антисептик, рекомендуемым при желудочно-кишечных заболеваниях, пара-аминосалициловую кислоту (структурно близкую с пара-аминобензойной кислотой, необходимой туберкулезным микобактериям, и поэтому метаболически конкурирующую с ней) — как специфическое противотуберкулёзное средство. В больших масштабах салициловая кислота потребляется в производстве азокрасителей.
Полиоксибензойные кислоты весьма распространены в природе. Они содержатся в виде гликозидов или других производных во многих растениях. Такими являются, например, протокатеховая кислота (1) и ее производные : ванилиновая (2), изованилиновая (3) и вератровая (4) кислоты:

Протокатеховая кислота - эта кислота в 60-х годах представляла весьма крупный интерес для химиков, потому что ее постоянно открывали в продуктах разложения при помощи сплавления с едкими щелочами самых разнообразных смол, некоторых алкалоидов, красильных веществ и т. д. Впервые она была открыта Гессе в 1859 г., который получил ее окислением бромной водой хинной кислоты и так как ее эмпирическая формула отличается от формулы гидрохинона (С 6
Н 6
О 2
) на CO 2
, то она этим исследователем и была названа карбогидрохиноновой. Название протокатеховая было дано собственно кислоте, полученной Штреккером в 1861 г. при сплавлении с едким кали пипериновой кислоты.
В 1863г. Глазивец показал тожественность карбогидрохиноновой кислоты с П. Штреккера и это последнее название и удержалось в науке.
Протокатеховую кислоту обычно получают при нагревании пирокатехина в водном растворе ( NH4
)2
CO3
:

3,4-дигидроксибензойную кислоту синтезируют также щелочным омылением 3-хлор- или З-бром-4-гидроксибензойной кислоты под действием КОН (кат.-порошок Сu, 190-200 °С) или окислениемванилина Ag2
O. Щелочным плавлением 5-карбокси-1,3-бензолдисульфокислоты при 220-250° получают 3,5-дигидроксибензойную кислоту.
Протокатеховая кислота довольно трудно растворяется в холодной воде, хорошо - в горячей, спирте и эфире и почти не растворима, в кипящем бензоле, чем и отличается от весьма близких к ней других кислот. Характерны также для протокатеховая кислота цветные реакции с железными солями. Так, в присутствии хлорного железа кислота дает весьма интенсивное темно-зеленое окрашивание, переходящее от прибавления соды в темно-красное, а раствор ее солей от железного купороса становится фиолетовым.
Протокатеховая кислота восстановляет аммиачные растворы серебряных солей и при сухой перегонке или при сплавлении с едким кали переходит в пирокатехин по уравнению: С 6
Н 5
О 2
.СО 2
Н - CO 2
= С 6
Н 6
О 2
. Эта реакция важна потому, что она указывает, что в ней группа атомов С 6
H5
О 2
имеет одинаковое строение с пирокатехином, а так как известно, что этот последний есть метадиоксибензол, то и протокатеховая кислота имеет бензольное ядро, в котором два водорода групп СН, находящихся в орто-положении, замещены водными остатками, т. е. ее формула будет С 6
H3
(ОН) 2
СО 2
Н. Положение карбоксила (СО 2
Н) по отношению к оксигруппам доказывается на основании того, что сульфопараоксибензойная и сульфометаоксибензойная кислоты при сплавлении с едким кали дают протокатеховая кислота , а это указывает, что в ней один водный остаток стоит по отношению к карбоксилу в пара-, а другой в мета-положении. Следовательно, она есть пара-мета-диоксибензойная кислота
Из триоксибензойных кислот наибольшее значение имеет - галловая кислота (3,4,5-триоксибензойная кислота) —одна из наиболее распространенных растительных кислот. Она содержится в чернильных орешках, листьях чая, дубовой коре, корнях гранатового дерева и многих других растений. Не содержит галлия, несмотря на схожесть названия.
Галловая кислота открыта К. Шееле в 1786 году в вытяжках из чернильных орешков.
Образует кристаллогидрат с 1 молекулой воды (C7
H6
O5
·H2
0) — бесцветные кристаллы, темнеющие на свету. Галловая кислота хорошо растворима в кипящей воде, спирте, хуже — в эфире, плохо — в холодной воде; константа диссоциации К = 3,9-10−5
(25 °C).

Галловая кислота
При нагревании (100—120 °C) галловая кислота теряет воду; t пл
безводной галловой кислоты 240 °C (с разложением); с хлорным железом даёт сине-чёрное окрашивание.
Получают ее щелочным или ферментативным гидролизом танинов:

Обладает всеми свойствами гидроксикарбоновых кислот. Наиболее реакционноспособна ОН-группа в положении 4; например, при метилировании диметилсульфатом в присутствий 2 молей NaOH образуется 3,5-дигидрокси-4-метоксибензойная кислота, а в присутствий 5 молей NаОН-3,4,5-триметоксибензойная кислота. Галловая кислота восстанавливает, например, соли Аu и Ag до металлов, Fe2+
до Fe3+
. Щелочные соли галловой кислоты под действием О2
темнеют. Сухой перегонкой над пемзой в токе СО2
при 190-215 °С галловая кислота декарбоксилируется до пирогаллола. При нагр. ее с конц. H2
SO4
образуется гексагидроксиантрахи-нон (руфигалловая к-та):

Галловая кислота применялась издавна для получении черных чернил и ряда красок. Висмутовая основная соль галловой кислоты употребляется в качестве сильного антисептика под названием дерматол. Диметиловый эфир галловый кислоты – сиреневая кислота также получается при расщеплении нмогих природных соединений, в частности лигнина:

Галловую кислоту применяют в аналитической химии, для синтеза красителей (антрагаллола и др.), в микроскопии, как деполяризатор при использовании методов электрохимического анализа. При сухой перегонке галловой кислоты образуется пирогаллол:

Цветная реакция: сине-черное окрашивание с FeCl3
. Галловую кислоту применяют в произодстве пирогаллола, лекарственных веществ, красителей (галлофлавина, антрагаллола и др.), как реагент для отделения и фотометрического определения Bi(III) и Се(Ш), как цветеобразующую компоненту в тсрмочувствительных копировальных бумагах. Также галловая кислота является отправной точкой в одном из способов синтеза мескалина.
Сложные эфиры галловой кислоты- антиоксиданты жиров и масел.
Амид галловой кислоты, образованный 3,4,5-триметоксибензойной кислотой и гетероциклическим амином – морфолином, называется андаксином и применяется как транквилизирующий (успокаивающий) медикамент:

Образованные двумя молекулами ароматических полиоксикислот сложные эфиры, в которых одна выступает как кислота, а другая как фенол, называюися депсидами.
Примерами могут служить леканоровая кислота:

Леканоровая кислота
К группе фенольных кислот относятся и так называемые лишайниковые кислоты — специфические соединения, синтезируемые лишайниками. Исходным соединением в образовании лишайниковых кислот является орселлиновая кислота, широко распространенная в виде депсида леканоровой кислоты, обладающей бактерицидными свойствами.
Дубильные вещества
, экстрагируемые из некоторых растительных тканей, например из коры дуба, представляют собой производные депсидов. Дубильные вещества разделяются на два класса: гидролизуемые ( именно они и представляют собой сложные эфиры депсидов), негидролизуемые. Гидролизуемые дубильные вещества часто являются производными галловой и м
-галлоил галловой(«м
-дигалловой») кислоты.
Синтез м
-галлоилгалловой кислоты из галловой был осуществлен по следующей схеме:


Таннины
, извлекаемые из дубильных орешков, представляют собой глюкозу, ацелированную остатками м
-галлоилгалловой кислоты:

При гидролизе таннинов образуется глюкоза, м
-галлоилгалловая кислота и небольшое количество галловой кислоты.
Таннины,добываемые из разных видов дубильных орешков, несколько различаются по числу ацилов и по соотношению между остатками галловой и галлоилгалловой кислот. Даже танины, выделяемые из одного того же растения, представляют собой смесь веществ.
Общей чертой дубильных веществ, в том числе и синтетических, является большой молекулярный вес, ароматическая природа и кислотные свойства. Все это позволяет им проявлять свое главное практическое свойство – связываясь с белками, модифицировать их, например, осаждать белки из раствора, как это делает танин с альбуминами, или «дубить», превращая шкуру кожу. Водный раствор танина, будучи нанесен на обожженное тело, связывает ядовитые белковые продуктыраспада тканей и способствует заживлению тканей.
Связанный с танином альбумин (танальбумин), попадая в пищеварительный тракт, по мере переваривания альбумина высвобождает танин, который связывает белковые токсины болезнетворных бактерий.
Таннины применяются для протравки хлопчатобумажных тканей при крашении (для закрепления красителя), в медицине и в других областях.
Содержание
Введение
Оксибенойные кислоты (фенолокислоты)
|