Министерство здравоохранения
Запорожский государственный медицинский университет
Кафедра фармацевтической химии
Курсовая работа
на тему: Анализ лекарственной формы состава:
Rp.: Amidopyrini 0,3
Dibazoli 0,02
Выполнил: студент IV курса 6 группы
фармацевтического факультета
Суховой Д. В.
Проверила: преподаватель кафедры
фармацевтической химии
Проценко Т. В.
«Запорожье – 2001»
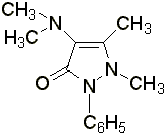
Амидопирин
– белые кристаллы или белый кристаллический порошок без запаха, слабогорького вкуса. Температура плавления 110 – 113 °С. Медленно растворяется в воде, легко – в спирте и в хлороформе.
Водные растворы имеют щелочную реакцию среды. Проявляет свойства восстановителя, с ионами тяжёлых металлов образует устойчивые комплексы.
Реакции подлинности
на амидопирин основаны на его способности окисляться с образованием окрашенных продуктов:
1.1
Реакция с нитратом серебра
(ГФ Х): к раствору амидопирина прибавляют 1-2 капли раствора нитрата серебра; появляется сине-фиолетовое окрашивание, затем выпадает серый осадок восстановленного серебра.
1.2
Реакция с хлоридом окисного железа
(ГФ Х): к раствору амидопирина прибавляют раствор окисного железа, при этом появляется быстро исчезающее сине-фиолетовое окрашивание, затем выпадает бурый осадок. После подкисления несколькими каплями разведённой соляной кислоты появляется интенсивное сине-фиолетовое окрашивание.
1.3
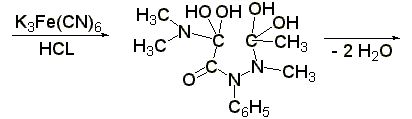
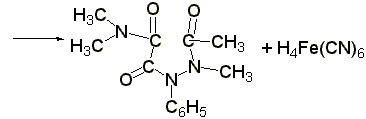
Реакция образования берлинской лазури
(ГФ Х):к раствору 0,01-0,02 г амидопирина в 1-2 мл воды прибавляют 2 мл свежеприготовленного раствора феррицианида калия, 1 каплю раствора хлорида окисного железа. Появляется тёмно-синее окрашивание:
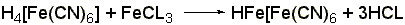
Методы количественного определения:
2.1
Титрование в неводных растворителях
(ГФ Х) проводят в среде безводной уксусной кислоты 0,1 н. раствором хлорной кислоты (индикатор – раствор тропеолина 00 в метиловом спирте). Э= М.м.
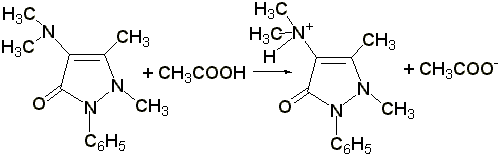
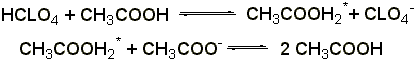
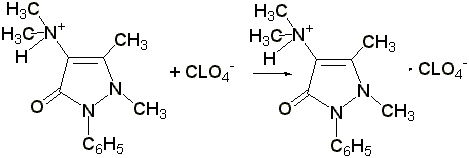
2.2 Титрование соляной кислотой
. Препарат растворяют в воде, прибавляют 2 капли раствора метилового оранжевого, 1 каплю раствора метиленового синего и титруют 0,1 н. раствором соляной кислоты до появления красно-фиолетовой окраски:
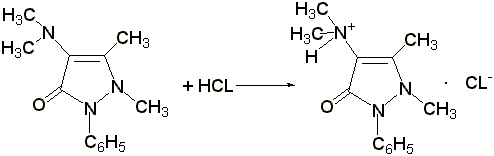
Э= М.м., 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02313 г амидопирина.
2.3
Цериметрическое определение
. К 0,02 г препарата прибавляют 2-3 мл разведённой серной кислоты, 1 каплю раствора о
-фенантролина (ферроина) и титруют 0,1 н. раствором сульфата церия (IV) до исчезновения красного окрашивания:
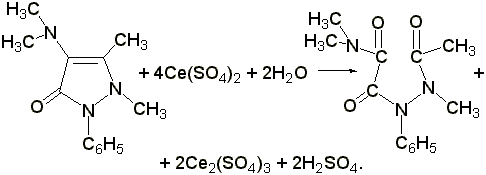
Э= М.м. /4, 1 мл 0,1 н. раствора сульфата церия соответствует 0,00587 г амидопирина.
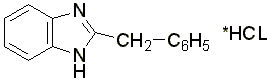
Дибазол
– белый или белый со слегка сероватым или желтоватым оттенком кристаллический порошок, горько – соленого вкуса. Гигроскопичен. Температура плавления 182-186 °С. Трудно растворим в воде, легко – в спирте, трудно или практически нерастворим в других органических растворителях.
Проверка подлинности дибазола:
3.1
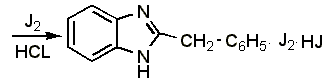
Образование полийодида.
В 3-5 мл воды растворяют 0,01-0,02 г препарата, прибавляют 3 капли разведённой соляной кислоты, 2-3 капли 0,1 н. раствора йода и взбалтывают. Образуется красно-серебристый осадок полийодида состава:
3.2
Образование серебряной соли.
В 1 мл спирта растворяют 0,01-0,02 г препарата, прибавляют 1 мл концентрированного раствора аммиака и 2-3 капли раствора нитрата серебра; образуется белый осадок серебряной соли дибазола:
| Препарат
|
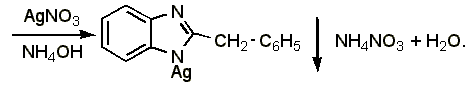
|
3.3
Реакция окисления ванадатом аммония.
В 1 мл хлороформа растворяют 0,01-0,02 г препарата, прибавляют 3-5 капель 1% раствора ванадата аммония в концентрированной серной кислоте и встряхивают. Слой хлороформа постепенно окрашивается в вишнёвый цвет.
3.4
Реакция с нитратом кобальта.
К 0,01 г препарата прибавляют 3 капли 3% спиртового раствора нитрата кобальта. Образуется голубое окрашивание.
3.5 Реакция с концентрированной серной кислотой.
К нескольким крупинкам препарата прибавляют 5-6 капель концентрированной серной кислоты. При этом образуется оксониевая соль, что вызывает появление ярко-жёлтого окрашивания, постепенно переходящего в кирпично-красное. От прибавления нескольких капель воды окраска исчезает.
3.6
Реакция с серной и азотной кислотами.
Несколько крупинок препарата помещают в пробирку и прибавляют 2 мл смеси, состоящей из 1 мл концентрированной азотной кислоты и 9 мл концентрированной серной кислоты. Появляется красное окрашивание. Прибавляют по каплям при постоянном помешивании и охлаждении 5 мл воды. Окраска переходит в коричневую, жёлтую, а затем в оранжевую. При взбалтывании полученного раствора с 3 мл хлороформа хлороформный слой окрашивается в фиолетовый цвет.
3.7 Реакция с сульфатом меди и роданидом аммония.
Крупинку препарата растворяют в капле воды и прибавляют по 1 капле 0,1н. раствора соляной кислоты, 3% раствора сульфата меди и 2% раствора роданида аммония. Появляется коричневый осадок.
Количественное определение.
4.1
Реакция образования серебряной соли.
Около 0,015-0,03 г препарата растворяют в 1 мл воды (при анализе дибазола в жидких лекарственных формах объём раствора, содержащий 0,015-0,03 г препарата, упаривают на водяной бане до 1-1,5 мл), добавляют 5 мл 95% спирта, 1 мл 25% раствора аммиака, взбалтывают и оставляют стоять в течении 10-15 минут. Фильтруют через небольшой фильтр, колбу и осадок промывают водой (по 1-2 мл на каждое промывание) до отрицательной реакции фильтрата на ион серебра (обычно на промывание расходуется 15 20 мл воды, большое количество воды может привести к частичному растворению осадка). Затем осадок с фильтром переносят в ту же колбу, прибавляют 1-2 мл азотной кислоты (плотность 1,2), слегка подогревают до растворения осадка, охлаждают, прибавляют 30 мл воды и титруют из полумикропипетки 0,1 н. раствором роданида аммония (индикатор – железоаммониевые квасцы):
Препарат
|
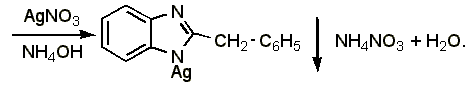
|
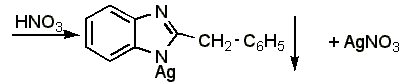
Э=М.м., 1 мл 0,1 н. раствора роданида аммония соответствует 0,02445 г дибазола.
4.2
Ацидиметрическое определение дибазола после выделения основания.
К точной навеске одного порошка прибавляют 2 мл 0,1 н. раствора серной кислоты и по каплям 3% раствор перманганата калия в 0,5 н. растворе серной кислоты до стойкого розового окрашивания (на водяной бане при температуре 60 °C). Избыток перманганата калия разлагают путём прибавления 1-2 капель 5% раствора щавелевой кислоты. Раствор количественно переносят в делительную воронку, добавляют небольшими порциями гидрокарбонат натрия до щелочной реакции на лакмус и основание дибазола извлекают хлороформом (3 раза по 15 мл). хлороформные извлечения фильтруют через безводный сульфат натрия, хлороформ удаляют, остаток растворяют в 2-3 мл спирта, добавляют 20 мл воды и титруют из полумикропипетки 0,1 н. раствором соляной кислоты до розового окрашивания, индикатор – метиловый оранжевый (V1
мл); 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02447 г дибазола.
4.3
Прямая аргентометрия.
К массе лекарственной формы, содержащей 0,001 г дибазола, прибавляют 0,5 мл ацетона и 1% раствора ацетата натрия, приготовленного на 1% растворе крахмала, 2 капли 5% раствора хромата калия и титруют 0,01 н. раствором нитрата серебра (в конце медленно, взбалтывая после прибавления каждой капли титранта) до устойчивого буроватого окрашивания:
Препарат
|
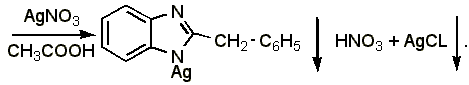
|
Э= М.м. / 2, 1 мл 0,01 н. раствора нитрата серебра соответствует 0,001223 г дибазола.
4.4
Прямое алкалиметрическое определение дибазола.
0,15 г препарата (точная навеска) растворяют в 10 мл предварительно нейтрализованного по фенолфталеину спирта и титруют с тем же индикатором 0,1 н. раствором едкого натра до слабо-розового окрашивания.
1 мл 0,1 н. раствора едкого натра соответствует 0,2447 г дибазола, которого в препарате должно быть не менее 99,0% в пересчёте на сухое вещество:
 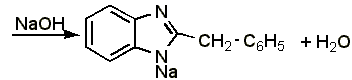
Для анализа данного препарата применимы следующие методы:
Качественный анализ.
Дибазол.
Образование полийодида (химизм см. реакцию 3.1).
Амидопирин.
Реакция образования берлинской лазури (химизм см. реакцию 1.3).
Количественный анализ.
Дибазол.
Прямое алкалиметрическое определение дибазола (методика и химизм см. 4.4).
Расчёт навески:
|
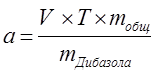 . .
|
Процентное содержание: 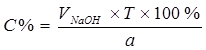 . .
Амидопирин.
Титрование соляной кислотой (методика и химизм см. 2.2).
Расчёт навески:
|
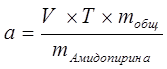 . .
|
Процентное содержание: 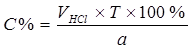 . .
Литература:
1. Н. П. Максютина, Ф. Е. Каган, Л. А. Кириченко, Ф. А. Митченко – «Методы анализа лекарств».
2. В. Г. Беликов – «Фармацевтическая химия».
3. Государственная фармакопея СССР. – 10-е издание. - М.: Медицина, 1968 г.
|