|
«УТВЕРЖДАЮ»
«СОГЛАСОВАНО»
Директор Федерального Председатель Научноинститута педагогических методического совета ФИПИ измерений по химии

Единый государственный экзамен по ХИМИИ Демонстрационный вариант КИМ 2009 г.
подготовлен Федеральным государственным научным учреждением
«ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»

П
(2009 - 2 )
Единый государственный экзамен по ХИМИИ
Пояснения к демонстрационному варианту
При ознакомлении с Демонстрационным вариантом 2009 года следует иметь в виду, что задания, включённые в демонстрационный вариант, не отражают всех элементов содержания, которые будут
проверяться с помощью вариантов КИМ в 2009 году
. Полный перечень вопросов, которые могут контролироваться на едином государственном экзамене 2009 года, приведен в кодификаторе, помещённом на сайте www.fipi.ru
.
Назначение демонстрационного варианта заключается в том, чтобы дать возможность любому участнику ЕГЭ и широкой общественности составить представление о структуре будущих КИМ, количестве заданий, их форме, уровне сложности: базовом, повышенном и высоком. Приведённые критерии оценки выполнения заданий с развёрнутым ответом (тип «С»), включённые в этот вариант, позволят составить представление о требованиях к полноте и правильности записи развёрнутого ответа.
Эти сведения позволят выпускникам выработать стратегию подготовки и сдачи ЕГЭ в соответствии с целями, которые они ставят перед собой.
Единый государственный экзамен по ХИМИИ
Демонстрационный вариант 2009 г.
Инструкция по выполнению работы
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут). Работа состоит из 3 частей и включает 45 заданий.
Часть 1 включает 30 заданий (А1–А30). К каждому заданию дается 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
Часть 2 состоит из 10 заданий (В1–В10), на которые надо дать краткий ответ в виде числа или последовательности цифр.
Часть 3 содержит 5 наиболее сложных заданий по общей, неорганической и органической химии. Задания C1–C5 требуют полного (развернутого) ответа.
Постарайтесь выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
За выполнение различных по сложности заданий дается один или более баллов. Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
(2009 - 4 )
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1–А30) поставьте знак «
× » в клеточку, номер которой соответствует номеру выбранного вами ответа.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Ca0
2) K+
3) Cl+
4) Sc0
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Li, Na, K, Rb
2) Sr, Ca, Mg, Be
3) In, Ga, Al, B
4) Sn, Ge, Si, C
Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
Одинаковую степень окисления хлор имеет в каждом из двух соединений:
1) CrCl3
и Cl O2 7
2) KClO4
и Cl O2 7
3) KCl и HClO
4) KClO2
и BaCl2
Атомную решетку в кристаллическом состоянии имеет
1) иод
2) вода
3) поваренная соль
4) кремнезем
В перечне веществ
1) K2
О
2) FeO
3) Cl2
О7
4) CO2
5) Al2
O3
6) N2
O5
к кислотным оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1, 2, 3 2) 3, 4, 6 3) 2, 4, 5 4) 3, 5, 6
В каком ряду простые вещества расположены в порядке усиления их металлических свойств?
1) Na, Mg, Al
2) K, Na, Be
3) Na, K, Rb
4) Ba, Sr, Ca
Соединения состава K3
ЭО4
и K2
HЭO4
может образовать
1) азот 2) фтор 3) фосфор 4) бром
Верны ли следующие суждения об окислительных свойствах азота?
А. Азот является более слабым окислителем, чем хлор.
Б. Азот является окислителем в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Оксид углерода (IV) взаимодействует с каждым из двух веществ:
1) Na2
SO4
и KNO3
2) H2
SO4
и HNO3
3) SiO2
и N2
O5
4) NaOH и MgO
Гидроксид калия взаимодействует с каждым из двух веществ:
1) NH3
и HCl
2) CO2
и CuCl2
3) H SO2 4
и NaNO3
4) MgO и HNO3
Нитрат алюминия в растворе взаимодействует с
1) KCl 2) Fe(NO3
)2
3) MgCl2
4) Ca(OH)2
В схеме превращений веществ
N2 ⎯⎯⎯⎯⎯⎯→ ⎯⎯⎯→ ⎯⎯⎯⎯⎯→+H , p, t ,2 ° кат. X1 +HCl X2 +NaOH, t° X3
конечным продуктом «X3
» является
1) азот
2) аммиак
3) гидрат аммиака 4) оксид азота (II)
Изомерами положения кратной связи являются
1) 2-метилбутан и 2,2-диметилпропан
2) пентин-1 и пентен-2
3) пентадиен-1,2 и пентадиен-1,3
4) бутанол-1 и бутанол-2
Соединением, в котором все атомы углерода находятся в состоянии sp
2
-гибридизации, является
1) этилбензол
2) бензол
3) метилциклогексан 4) бутен-1
Этанол взаимодействует с
1) метанолом 2) метаном 3) водородом 4) медью
Верны ли следующие суждения о свойствах глюкозы?
А. Раствор глюкозы проводит электрический ток.
Б. Для глюкозы характерна реакция брожения.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В схеме превращений
C H2 6
→ →X C H OH2 5
веществом «X
» является
1) C H Br2 5
2) CH OH3
3) C H2 2
4) C H2 5
− −O C H2 5
Взаимодействие хлорида меди (II) с железом относится к реакциям
1) разложения 2) обмена 3) замещения 4) соединения
Для увеличения скорости химической реакции
Fe(тв) + 2H+ = Fe2+ + Н2 (г)
необходимо
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
1) N2(г) + 3H2(г) R 2NH3(г) + Q
2) N2O4(г) R 2NO2(г) – Q
3) CO2(г) + H2(г) R CO(г) + H2O(г) – Q
4) 4HCl(г)
+ O2
R 2H2
O(г)
+ 2Cl2(г)
+ Q
Слабым электролитом является
1) хлороводородная кислота
2) сульфат натрия
3) сероводородная кислота
4) гидроксид лития
Образование осадка происходит при взаимодействии растворов
1) нитрата меди (II) и серной кислоты
2) сульфата железа (III) и хлорида бария
3) хлорида кальция и нитрата натрия
4) азотной кислоты и фосфата калия
Оксид серы (IV) является восстановителем в реакции
1) SO2
+ CaO = CaSO3
2) 2SO2
+ O2
= 2SO3
3) SO2
+ 2H2
S = 3S + 2H2
O
4) SO2
+ NaOH = NaHSO3
Кислую среду имеет водный раствор
1) нитрата меди (II)
2) нитрата бария
3) ацетата калия
4) карбоната натрия
Ацетилен в лаборатории можно получить при взаимодействии
1) углерода с водородом
2) карбида алюминия с водой
3) карбида кальция с водой 4) хлорметана с натрием
Уксусная кислота может реагировать с каждым из двух веществ:
1) метанолом и серебром
2) гидроксидом меди (II) и метанолом
3) серебром и гидроксидом меди (ll) 4) магнием и метаном
Верны ли следующие суждения о правилах обращения с веществами?
А. В лаборатории можно исследовать вещества на вкус и запах.
Б. Пробирку с бензолом нельзя нагревать на открытом пламени.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Для получения аммиака в промышленности используют
1) хлорид аммония
2) нитрат аммония
3) атмосферный азот 4) азотную кислоту
В соответствии с термохимическим уравнением
C(тв) + O2(г) =CO2(г) + 402 кДж
1206 кДж теплоты выделяется при горении угля массой
1) 72 г 2) 36 г 3) 7,2 г 4) 108 г
-9 )
Часть 2
Ответом к заданиям этой части (В1–В10) является набор цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
В заданиях В1–В5 на установление соответствия запишите в таблицу цифры выбранных вами ответов под соответствующими буквами, а затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов и других символов. (Цифры в ответе могут повторяться.)
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА КЛАСС (ГРУППА)
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А) H4
P2
O7
1) кислота
Б) HPO3
2) основание
В) Ba(OH)2
3) основный оксид
Г) ZnO 4) амфотерный оксид
5) кислотный оксид
6) соль
Установите соответствие между схемой химической реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ
|
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
|
| А) FeCl3
+ HI → FeCl2
+ +I2
HCl
|
1)
|
Fe+3 → Fe+2
|
| Б) FeCl2
+ Cl2
→ FeCl3
|
2)
|
2I−→ I02
|
| В) KClO4
→ KCl + O2
|
3)
|
2O−2→ O02
|
| Г) Fe O3 4
+ HI → FeI2
+ +I2
H O2
|
4)
|
Fe+2 → Fe+3
|
| |
5)
|
Cl+7 → Cl−
|
| |
6)
|
Cl02 → 2Cl−
|
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
| ФОРМУЛА СОЛИ
|
ПРОДУКТ НА КАТОДЕ
|
| А) Al(NO3
)3
|
1) водород
|
| Б) Hg(NO3
)2
|
2) алюминий
|
| В) Cu(NO3
)2
|
3) ртуть
|
| Г) NaNO3
|
4) медь
|
| |
5) кислород
|
| |
6) натрий
|
| А
|
Б
|
|
В
|
Г
|
| |
|
|
|
|
| Установите соответствие между
|
названием соли и отношением её к
|
| гидролизу.
НАЗВАНИЕ СОЛИ
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ
|
| А) пропионат аммония
|
1) не гидролизуется
|
| Б) сульфид цезия
|
2) гидролизуется по катиону
|
| В) сульфид алюминия
|
3) гидролизуется по аниону
|
| Г) карбонат натрия
|
4) гидролизуется по катиону и аниону
|
| А
|
Б
|
|
В
|
Г
|
| |
|
|
|
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
|
| А) MgO + SO2
→
|
1) MgSO3
|
| Б) MgO + SO3
→
|
2) MgSO3
+ Н2
|
| В) MgO + H2
SО3
→
|
3) MgSO3
+ Н2
O
|
| Г) MgO + H2
SО4
→
|
4) MgSO4
|
| |
5) MgSO4
+ H2
|
| |
6) MgSO4
+ H2
O
|
- 11 )
Ответом к заданиям В6–В8 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания сначала в текст работы, а затем перенесите их в бланк ответов № 1 без пробелов и других символов.
Взаимодействие пропена и хлороводорода протекает
1) по цепному радикальному механизму
2) с промежуточным образованием частицы CH3
– CH+
– CH3
3) без катализатора
4) с разрывом π-связи в молекуле пропена
5) с образованием дихлорпропана
6) с преимущественным образованием 1-хлорпропана
Ответ: _________________.
Для предельных одноатомных спиртов характерны реакции
1) этерификации
2) поликонденсации
3) нейтрализации
4) окисления
5) дегидратации 6) гидратации
Ответ: _________________.
Водный раствор аминоуксусной кислоты взаимодействует с
1) гидроксидом кальция
2) бензолом
3) бромоводородом
4) хлорбензолом
5) магнием
6) толуолом
Ответ: _________________.
Ответом к заданиям В9, В10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
К 50 г раствора хлорида кальция с массовой долей 4% добавили 1 г этой же соли и 10 г воды. Массовая доля соли в полученном растворе равна ________ %. (Запишите число с точностью до десятых.)
Масса соли, образовавшейся при растворении оксида меди (II) массой 20 г в избытке серной кислоты, равна ________ г. (Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
Часть 3
Для записи ответов к заданиям этой части (С1–С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции:
NO + КClO + …→ КNO3
+ КCl + … .
Определите окислитель и восстановитель.
Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора.
Напишите уравнения четырех возможных реакций между этими веществами.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C H OH2 5 ⎯⎯⎯⎯⎯→ ⎯⎯⎯⎯⎯⎯⎯⎯→ ⎯⎯⎯⎯⎯⎯→ ⎯⎯→ →Al O ,4002 3 o X1 KMnO ,H O, 04 2 o −20o X2 HBr (изб.), to X3 to этин C H O.2 4
Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (ρ = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%.
Установите молекулярную формулу кислоты.
(2009 - 13 )
Инструкция по проверке и оценке работ учащихся по химии
ЧАСТЬ 1
Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным.
| № задания
|
Ответ
|
|
№ задания
|
Ответ
|
|
№ задания
|
Ответ
|
| А1
|
2
|
А11
|
2
|
А21
|
2
|
| А2
|
1
|
А12
|
4
|
А22
|
3
|
| А3
|
1
|
А13
|
2
|
А23
|
2
|
| А4
|
2
|
А14
|
3
|
А24
|
2
|
| А5
|
4
|
А15
|
2
|
А25
|
1
|
| А6
|
2
|
А16
|
1
|
А26
|
3
|
| А7
|
3
|
А17
|
2
|
А27
|
2
|
| А8
|
3
|
А18
|
1
|
А28
|
2
|
| А9
|
3
|
А19
|
3
|
А29
|
3
|
| А10
|
4
|
А20
|
4
|
А30
|
2
|
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ на задания В1 – В8 ставится 2 балла, за правильный неполный – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов.
За правильный ответ на задания В9 и В10 ставится 1 балл, за неверный ответ – 0 баллов.
| №
|
Ответ
|
| В1
|
1124
|
| В2
|
2432
|
| В3
|
1341
|
| В4
|
4343
|
| В5
|
1436
|
| В6
|
234
|
| В7
|
145
|
| В8
|
135
|
| В9
|
4,9
|
| В10
|
40
|
ЧАСТЬ 3
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНКИ ВЫПОЛНЕНИЯ ЗАДАНИЙ С РАЗВЁРНУТЫМ ОТВЕТОМ
За выполнение заданий ставится: С1 – от 0 до 3 баллов; С2, С4 – от 0 до 4 баллов; С3 – от 0 до 5 баллов; С5 – от 0 до 2 баллов.
Используя метод электронного баланса, составьте уравнение реакции:
NO + КClO + …→ КNO3
+ КCl + … .
Определите окислитель и восстановитель.
Ответ
:
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
1) Составлен электронный баланс:
2  N+2
– 3ē
→ N+5 N+2
– 3ē
→ N+5
3 Cl+1
+ 2ē
→ Cl–1
2) Расставлены коэффициенты в уравнении реакции:
2NO + 3КClO + 2КОН = 2КNO3
+ 3КCl + Н2
О
3) Указано, что азот в степени окисления +2 (или оксид азота за счет азота +2) является восстановителем, а хлор в степени окисления +1 (или гипохлорит калия за счет хлора +1) – окислителем.
|
|
| Ответ правильный и полный, включает все названные выше элементы
|
3
|
| В ответе допущена ошибка только в одном из элементов
|
2
|
| В ответе допущены ошибки в двух элементах
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
3
|
C2
Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора.
Напишите уравнения четырех возможных реакций между этими веществами.
Ответ
:
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
Написаны четыре уравнения возможных реакций указанными веществами:
1) Na2
S + H2
S = 2NaHS
2) 3Na2
S + 2AlCl3
+ 6H2
O = 3H2
S↑ + 2Al(OH)3
↓ + 6NaCl 3) Na2
S + Cl2
= 2NaCl + S↓
4) H2
S + Cl2
= 2НCl + S↓
|
между
|
|
| Правильно записаны 4 уравнения возможных реакций
|
|
4
|
| Правильно записаны 3 уравнения реакций
|
|
3
|
| Правильно записаны 2 уравнения реакций
|
|
2
|
| Правильно записано 1 уравнение реакции
|
|
1
|
| Все элементы ответа записаны неверно
|
|
0
|
| Максимальный балл
|
4
|
*Примечание.
Дополнительно записанные (правильно или ошибочно) уравнения реакций не оцениваются.
C3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al O ,4002 3 o
C H OH2 5 ⎯⎯⎯⎯⎯→ ⎯⎯⎯⎯⎯⎯⎯⎯→ ⎯⎯⎯⎯⎯→ ⎯⎯→ →X1 KMnO ,H O, 04 2 o −20o X2 HBr (изб.), t X3 t этин C H O.2 4
Ответ
:
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений: 1) C2H5OH ⎯Al O , 400°⎯⎯⎯⎯→2 3 CH2 = CH2 + H2O
0 20o
− o
2) 3CH2
= CH2
+ 2KMnO4
+ 4H O2
⎯⎯⎯⎯→3CH2
− CH2
+ 2MnO2
+ 2KOH
| |
OH OH
3)CH2
−CH2
+2HBr⎯⎯→t
°
CH2
−CH2
+2H O2
| | | |
OH OH Br Br
4) CH2 −CH2 + 2KOH(спиртов.)⎯⎯→ ≡t° CH CH + 2H O2 + 2KBr
| |
Br Br
O
5)  CH ≡ CH + H2
O ⎯HgSO
⎯⎯⎯→4
CH3
– C CH ≡ CH + H2
O ⎯HgSO
⎯⎯⎯→4
CH3
– C
H
|
|
| Ответ правильный и полный, включает все названные выше элементы
|
5
|
| Правильно записаны 4 уравнения реакций
|
4
|
| Правильно записаны 3 уравнения реакций
|
3
|
| Правильно записаны 2 уравнения реакций
|
2
|
| Правильно записано 1 уравнение реакции
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
5
|
C4
Магний массой 4,8 г растворили в 200 мл 12%-ного раствора серной кислоты (ρ = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
Ответ
:
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
1) Составлено уравнение химической реакции:
Mg + H2
SO4
= MgSO4
+ H2
↑
2) Рассчитаны массы веществ, полученных в ходе реакции:
n(Mg) = n(MgSO4
) = n(H2
) = m(Mg)/M(Mg) = 4,8/24 = 0,20 моль, n(H2
SO4
) = 1,05·200·0,12/98 = 0,26 моль – в избытке, m(MgSO4
) = n(MgSO4
)·M(MgSO4
) = 0,2·120 = 24 г m(H2
) = n(H2
)·M(H2
) = 0,2·2 = 0,4 г
3) Рассчитана масса раствора: m1
(раствора) = ρ·V(H2
SO4
) = 1,05·200 = 210 г
m2
(раствора) = m1
(раствора) + m(Mg) − m(H2
) = 210 + 4,8 − 0,4 = = 214,4 г
4) Найдена массовая доля MgSO4
: w
(MgSO4
) = m(MgSO4
)/m2
(раствора) = 24/214,4 = 0,112 или 11,2%.
|
|
| Ответ правильный и полный, включает все названные выше элементы
|
4
|
| В ответе допущена ошибка в одном из названных выше элементов
|
3
|
| В ответе допущена ошибка в двух из названных выше элементов
|
2
|
| В ответе допущена ошибка в трех из названных выше элементов
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
4
|
C5
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Ответ
:
| Содержание верного ответа и указания к оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
1) Записана общая формула аминокислоты и рассчитана её молярная масса:
Сn
H2n
(NH2
)COOH.
2 16⋅
w
(O)= 
Mкислоты
Mкислоты
=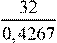 = 75 (г/моль). = 75 (г/моль).
2) Найдено число атомов углерода в молекуле кислоты и установлена ее формула:
М = 12n + 2n + 16 + 45 = 75; 14n = 14 n = 1
Формула кислоты NH2
CH2
COOH
|
|
| Ответ правильный и полный, включает все названные выше элементы
|
2
|
| Правильно записан первый элемент ответа
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
2
|
|