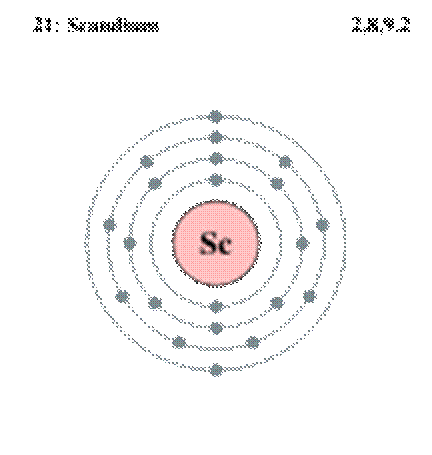
Sc
|
21 |
| 44,95591
|
| [Ar]3d1
4s2
|
| Скандий
|
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ «МАМИ»
КОНТРОЛЬНАЯ РАБОТА
по дисциплине «ХИМИЯ»
на тему: «Химический элемент - Скандий»
Подготовил студент
4 ЭФ 2 Тарасов С.В.
Научный руководитель:
Патрушева О.А.
МОСКВА 2010
Содержание
· История Скандия и происхождение его названия
· Физические свойства Скандия
· Химические свойства Скандия
· Мировые ресурсы Скандия
· Распространение Скандия в природе
· Получение и производство Скандия
· Применение Скандия
· Металлургия
· Сплавы скандия
· Сверхтвёрдые материалы
· Микроэлектроника
· Источники света
· Изотопы скандия
· Ядерная энергетика
· Медицина
· Лазерные материалы
· Производство солнечных батарей
· МГД-генераторы
· Рентгеновские зеркала
· Огнеупорные материалы
· Производство фианитов
· Люминофоры
· Литература
История
Скандия и происхождение его названия
Ска́ндий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементовД. И. Менделеева, с атомным номером 21 и атомной массой 44,9559, обозначается символом Sc (лат. Scandium
). Простое вещество скандий (CAS-номер: 7440-20-2) — легкий металл серебристого цвета с характерным желтым отливом, который появляется при контакте металла с воздухом.
Известен один природный стабильный изотоп 45
Sc. Из искусственных радиоактивных изотопов важнейший 46
Sc с периодом полураспада 84 сут.
Скандий был предсказан Д. И. Менделеевым в 1870 году и выделен в 1879 году Л. Ф. Нилъсоном из минералов гадолинита и эвксенита, найденных в Скандинавии (лат. Scandia), отсюда и название элемента.
Физические свойства Cкандия
Скандий существует в двух кристаллических модификациях: α и β; при обычной температуре устойчива α-модификация с гексагональной решеткой (а = 3,3080 Å и с = 5,2653 Å), выше 1350 °С - β-модификация с кубической объемноцентрированной решеткой. Плотность Скандия в α-форме при 25 °С 3,020 г/см3
, атомный радиус 1,64 Å, ионный радиус 0,75Å, (tпл
1539 °С, tкип
2700 °С, выше 1600 °С летуч. При 25 °С удельная теплоемкость 25,158 кдж/(кг·К) [6,01 ккал/(г·°С)], удельная электрическое сопротивление (54-70,7)·10-6
ом·см;
Скандий слабый парамагнетик, его атомная магнитная восприимчивость 236·10-6
(20 °С). Скандий - мягкий металл, в чистом состоянии легко поддается обработке - ковке, прокатке, штамповке.
Химические свойства Cкандия
Sc - первый переходный элемент с одним 3d-электроном; конфигурация внешних электронов атома 3d1
4s2
. По химическому поведению сходен с другими переходными элементами в степени окисления +3 (например, Ti3+
, Fe3+
, Mn3+
), элементами подгруппы Al, Be, а также элементами иттриевой подгруппы, вместе с которыми его иногда относят к редкоземельным элементам.
На воздухе покрывается защитной оксидной пленкой толщиной до 600Å, заметное окисление начинается при 250 °С. При взаимодействии с водородом (450 °С) образуется гидрид ScH2
, с азотом (600-800 °С) - нитрид ScN, с галогенами (400-600 °С) - соединения типа SсСl3
.
Также Скандий реагирует с бором и кремнием при температуре выше 1000 °С.
В воде соединения Скандия заметно гидролизуются с образованием основных солей. Ионы Sc3+
склонны к полимеризации, образованию комплексных ионов различного типа, состав которых зависит от природы аниона и рН среды, например Sс(СО3
)2
-
, Sc (SO4
)3
3-
. Основные соли в растворе легко переходят в аморфный гидрооксид.
Металл легко растворяется в соляной, азотной и серной кислотах (с понижением концентрации кислоты скорость растворения Скандия резко падает и с 0,001 н. растворами он не реагирует). Соли соляной, серной, азотной, роданистоводородной и уксусной кислот хорошо растворяются в воде, а соли фосфорной, щавелевой и плавиковой кислот мало растворимы; некоторой летучестью обладают ацетилацетонат и его фторпроизводные. На Скандий практически не действуют разбавленные растворы NaOH (10%) и смесь концентрированных HNO3
и HF (1 : 1).
Мировые ресурсы скандия
Колоссальные ресурсы скандия сосредоточены в России и бывшем Советском Союзе (данные по добыче весьма разрозненны, но объёмы добычи по оценкам независимых специалистов равны или превышают официальную мировую добычу). В целом по оценкам независимых специалистов в настоящее время, основными продуцентами скандия (оксида скандия) являются Россия, Китай, Украина и Казахстан. В определённой степени в ближайшие годы ожидается значительный объём поступлений скандиевого сырья из Австралии, Канады, Бразилии.
Следует также отметить, что запасы редкоземельного сырья в Монголии, содержащего скандий, это также перспективный источник скандия для скандиевой промышленности и развития металлургии скандия.
Распространение Cкандия в природе
Среднее содержание скандия в земной коре 10 г/т. Содержание Скандия в морской воде 4·10-5
г/л.
Известно два собственных минерала Скандия: тортвейтит (Sc, Y)2 Si2
O7
(Sc2O3 до 53,5%) и стерреттит Sc[PO4
] • 2H2
O (Sc2
O3
до 39,2%), но встречаются они чрезвычайно редко.
Скандий является типичным рассеянным элементом и слабым мигрантом и входит в состав многих минералов.
По химическим и физическим свойствам к скандию близки иттрий, лантан и лантаноиды. Во всех природных соединениях скандий, так же как и его аналоги алюминий, иттрий, лантан, проявляет положительную валентность, равную трём, поэтому в окислительно-восстановительных процессах он участия не принимает.
В процессе формирования магматических пород и их жильных производных скандий в главной своей массе рассеивается преимущественно в тёмноцветных минералах магматических пород и в незначительной степени концентрируется в отдельных минералах постмагматических образований.
Основные минералы-носители скандия: флюорит (до 1% Sc2O3), касситерит (0,005-0,2%), вольфрамит (0-0,4%), ильменорутил (0,0015-0,3%), торианит (0,46% Sc2O3), самарскит (0,45%), виикит (1,17%), ксенотим (0,0015-1,5%), берилл (0,2%), баццит (скандиевый берилл, 3-14,44%). Всего известно более сотни скандий-содержащих минералов
Так как, в горных породах содержание Скандия различно, и в связи с тем, что по свойствам скандий близок к Mg, Al, Ca, Mn2
+,Fe2
+, TR, Hf, Th, U, Zr, то главная его масса рассеивается в минералах, содержащих эти элементы.
Наиболее высокие (30 г/т Sc2
O3
) концентрации скандия приурочены к ультраосновным и основным породам, в составе которых ведущую роль играют железо-магнезиальные минералы (пироксен, амфибол и биотит), в которых широко развито гетеровалентное замещение скандием Fe2
+ и магния, а замещение циркония – в поздние стадии магматического процесса и в пегматитах.
В породах среднего состава среднее содержание Sc2
O3
- 10 г/т, в кислых – 2 г/т, здесь скандий рассеивается также в тёмноцветных минералах (роговой обманке, биотите) и устанавливается в мусковите, цирконе, сфене.
Также имеет место изовалентное замещение скандием элементов группы TR, особенно в существенно иттриевых минералах (ксенотим, ассоциация Sc – Y в тортвейтите и замещение Al в берилле).
Получение и производство Cкандия
Скандий является рассеянным литофильным элементом (элемент горных пород), поэтому для технологии добычи этого элемента важно полное извлечение его из перерабатываемых руд и по мере развития металлургии руд-носителей скандия, его ежегодный объём добычи будет возрастать.
Скандий преимущественно в виде оксидов извлекают попутно при гидро- и пирометаллургической переработке вольфрамовых, оловянных, титановых, урановых руд и бокситов. Оксиды хлорируют или фторируют при повышенной температуре, а затем компактный металлический Скандий (выход ~99,5%) получают термическим восстановлением его хлорида или фторида металлическим кальцием с последующей дистилляцией (возгонкой) Sc в высоком вакууме 133,3·10-6
н/м2
(10-6 мм рт. ст.) при 1600-1700 °С.
Скандий смело можно назвать металлом XXI века и прогнозировать резкий рост его добычи, рост цен и спрос в связи с переработкой огромного количества каменных углей (особенно переработка каменных углей России) на жидкое топливо.
Применение Скандия
Скандий моноизотопный элемент и на 100 % состоит из атомов скандий-45.
Металлургия
Применение скандия в виде микролегирующей примеси оказывает значительное влияние на ряд практически важных сплавов, так например прибавление 0,4 % скандия к сплавам алюминий-магний повышает временное сопротивление на 35 %, а предел текучести на 65—84 %, и при этом относительное удлинение остаётся на уровне 20—27 %. Добавка 0,3—0,67 % к хрому, повышает его устойчивость к окислению вплоть до температуры 1290°C, и аналогичное, но ещё более ярко выраженное действие оказывает на жаростойкие сплавы типа «нихром» и в этой области применение скандия куда как эффективнее иттрия. Оксид скандия обладает рядом преимуществ для производства высокотемпературной керамики перед другими оксидами, так как прочность оксида скандия при нагревании возрастает и достигает максимума при 1030 °C, в то же время оксид скандия обладает минимальной теплопроводностью и высочайшей стойкостью к термоудару. Скандат иттрия это один из лучших материалов для конструкций работающих при высоких температурах. Определённое количество оксида скандия постоянно расходуется для производства германатных стёкол для оптоэлектроники.
Сплавы скандия
Главным по объёму применения скандия является его применение в алюминиево-скандиевых сплавах, применяемых в спортивной экипировке (мотоциклы, бейсбольные биты и т. п.) — везде, где требуется высокопрочные материалы. В сплаве с алюминием скандий обеспечивает дополнительную прочность и ковкость. Предел прочности на разрыв у чистого скандия около 400 МПа (40 кг/мм), у титана например 250—350 МПа, а у нелегированного иттрия 300 МПа. Применение скандиевых сплавов в авиации и ракетостроении позволит значительно снизить стоимость перевозок и резко повысить надёжность эксплуатируемых систем, в то же время при снижении цен на скандий и его применение для производства автомобильных двигателей так же значительно увеличит их ресурс и частично КПД. Очень важно и то обстоятельство что скандий упрочняет алюминиевые сплавы легированные гафнием. Важной и практически не изученной областью применения скандия является то обстоятельство что подобно легированию иттрием алюминия, легирование чистого алюминия скандием так же повышает электропроводность проводов и эффект резкого упрочнения имеет большие перспективы для применения такого сплава для транспортировки электроэнергии (ЛЭП). Сплавы скандия наиболее перспективные материалы в производстве управляемых снарядов. Ряд специальных сплавов скандия композитов на скандиевой связке весьма перспективен в области конструирования скелета киборгов. В последние годы важная роль скандия (и отчасти иттрия и лютеция) выявилась в производстве некоторых по составу суперпрочных мартенситностареющих сталей, некоторые образцы которых показали прочность свыше 700 кг/мм (свыше 7000 МПа).
Сверхтвёрдые материалы
Скандий используется для получения сверхтвёрдых материалов. Так, например, легирование карбида титанакарбидом скандия весьма резко поднимает микротвёрдость (в 2 раза), что делает этот новый материал четвёртым по твёрдости после алмаза (около 98,7 — 120 ГПа), нитрида бора (боразона), (около 77—87 ГПа), сплава бор-углерод-кремний (около 68—77 ГПа), и существенно больше чем у карбида бора(43,2 — 52 ГПа), карбида кремния (37 ГПа), микротвёрдость сплава карбида скандия и карбида титана около 53,4 ГПа (у карбида титана например 29,5 ГПа). Особенно интересны сплавы скандия с бериллием, обладающие уникальными характеристиками по прочности и жаростойкости. Так, например, бериллид скандия (1 атом скандия и 13 атомов бериллия) обладает наивысшим благоприятным сочетанием плотности, прочности и высокой температуры плавления, и может явится лучшим материалом для строительства аэрокосмической техники, превосходя в этом отношении лучшие сплавы из известных человечеству на основе титана, и ряд композиционных материалов (в том числе ряд материалов на основе нитей углерода и бора).
Микроэлектроника
Оксид скандия (температура плавления 2450°C) имеет важнейшую роль в производстве супер-ЭВМ: ферриты с малой индукцией при использовании в устройствах хранения информации позволяют увеличить скорость обмена данными в несколько раз из-за снижения остаточной индукции с 2 - 3 КГаусс до 0,8 - 1 КГаусс.)
Источники света
Порядка 80 кг скандия (в составе Sc2
O3
) в год используется для производства осветительных элементов высокой интенсивности. Иодид скандия добавляется в ртутно-газовые лампы, производящие очень правдоподобные источники искусственного света, близкого к солнечному, которые обеспечивают хорошую цветопередачу при съёмке на телекамеру.
Изотопы скандия
Радиоактивный изотоп Sc-46 (период полураспада 83,83 сут) используется в качестве «метки» в нефтеперерабатывающей промышленности, для контроля металлургических процессов, и лечения раковых опухолей.Изотоп скандий-47 (период полураспада 3,35 сут) один из лучших источников позитронов.
Ядерная энергетика
В атомной промышленности с успехом применяется гидрид и дейтерид скандия — прекрасный замедлитель нейтронов, и мишень (бустер) в мощных и компактных нейтронных генераторах. Диборид скандия (температура плавления 2250 °C) применяется в качестве компонента жаропрочных сплавов, а так же как материал катодов электронных приборов. В атомной промышленности находит применение бериллид скандия в качестве отражателя нейтронов, и в частности этот материал, равно как и бериллид иттрия предложен в качестве отражателя нейтронов в конструкции атомной бомбы.
Медицина
Важную роль оксид скандия может сыграть в медицине (высококачественные зубные протезы).
Лазерные материалы
Высокотемпературной сверхпроводимости, производстве лазерных материалов (ГСГГ). Галлий-скандий-гадолиниевый гранат при легировании его ионами хрома и неодима позволил получить 4,5 % КПД и рекордные параметры в частотном режиме генерации сверхкоротких импульсов, что даёт весьма оптимистичные предпосылки для создания сверхмощных лазерных систем для получения термоядерных микровзрывов уже на основе чистого дейтерия (инерциальный синтез) уже в самом ближайшем будущем. Так, например, ожидается что в ближайшие годы лазерные материалы на основе ГСГГ и боратов скандия займут ведущую роль в разработке и оснащении лазерными системами активной обороны для самолётов и вертолётов в развитых странах, и параллельно с этим развитие крупной термоядерной энергетики с привлечением гелия-3 (добываемого на Луне), в смесях с гелием-3 лазерный термоядерный микровзрыв уже получен.
Производство солнечных батарей
Оксид скандия в сплаве с оксидом гольмия используется в производстве фотопреобразователей на основе кремния в качестве покрытия. Это покрытие имеет широкую область прозрачности (400—930 нм), и снижает спектральный коэффициент отражения света от кремния до 1—4 %, и при его применении у такого модифицированного фотоэлемента увеличивается ток короткого замыкания на 35—70 %, что в свою очередь позволяет увеличить выходную мощность фотопреобразователей в 1,4 раза.
МГД-генераторы
Хромит скандия используется как один из лучших и наиболее долговечных материалов для изготовления электродов МГД-генераторов, к основной керамической массе добавляют предварительно окисленный хром и спекают, что придаёт материалу повышенную прочность и электропроводность. Наряду с диоксидом циркония как электродным материалом для МГД-генераторов, хромит скандия обладает более высокой стойкостью к эрозии соединениями цезия (используемого в качестве плазмообразующей добавки).
Рентгеновские зеркала
Скандий широко применяется для производства многослойных рентгеновских зеркал (композиции: скандий-вольфрам, скандий-хром, скандий-молибден). Теллурид скандия очень перспективный материал для производства термоэлементов (высокая термо-э.д.с, 255 мкВ/К и малая плотность и высокая прочность).
Огнеупорные материалы
В последние годы значительный интерес для авиакосмической и атомной техники приобрели тугоплавкие сплавы (интерметаллические соединения) скандия с рением (температура плавления до 2575 °C), рутением (температура плавления до 1840 °C), железом (температура плавления до 1600 °C), (жаропрочность, умеренная плотность и др).Важную роль в качестве огнеупорного материала специального назначения оксид скандия (температура плавления 2450 °C) играет в производстве сталеразливочных стаканов для разливки высоколегированных сталей, по стойкости в потоке жидкого металла оксид скандия превосходит все известные и применяемые материалы (так например наиболее устойчивая окись иттрия уступает в 8,5 раз оксиду скандия) и в этой области можно сказать незаменим. Его широкому применению препятствует лишь весьма высокая цена, и в известной степени альтернативным решением в этой области является применение скандатов иттрия армированных нитевидными кристаллами оксида алюминия для увеличения прочности, а так же применение танталата скандия.
Производство фианитов
Важную роль играет оксид скандия для производства фианитов, где он является самым лучшим стабилизатором. Некоторое количество скандия расходуется для легирования жаростойких сплавов никеля с хромом и железом (нихромы и фехрали) для резкого увеличения срока службы при использовании в качестве нагревательной обмотки для печей сопротивления.
Люминофоры
Борат скандия, равно как и борат иттрия применяется в радиоэлектронной промышленности в качестве матрицы для люминофоров.
Литература
http://ru.wikipedia.org/wiki
http://www.chem100.ru/index.htm
Для защиты реферата
Ска́ндий — элемент побочной подгруппы третьей группы, четвёртого периода периодической системы химических элементовД. И. Менделеева, с атомным номером 21 и атомной массой 44,9559, обозначается символом Sc (лат. Scandium
). Простое вещество скандий (CAS-номер: 7440-20-2) — легкий металл серебристого цвета с характерным желтым отливом, который появляется при контакте металла с воздухом.
Известен один природный стабильный изотоп 45
Sc. Из искусственных радиоактивных изотопов важнейший 46
Sc с периодом полураспада 84 сут.
Скандий был предсказан Д. И. Менделеевым в 1870 году и выделен в 1879 году Л. Ф. Нилъсоном из минералов гадолинита и эвксенита, найденных в Скандинавии (лат. Scandia), отсюда и название элемента.
Скандий существует в двух кристаллических модификациях: α и β; при обычной температуре устойчива α-модификация с гексагональной решеткой (а = 3,3080 Å и с = 5,2653 Å), выше 1350 °С - β-модификация с кубической объемноцентрированной решеткой.
Скандий слабый парамагнетик, его атомная магнитная восприимчивость 236·10-6
(20 °С). Скандий - мягкий металл, в чистом состоянии легко поддается обработке - ковке, прокатке, штамповке.
Sc - первый переходный элемент с одним 3d-электроном; конфигурация внешних электронов атома 3d1
4s2
. По химическому поведению сходен с другими переходными элементами в степени окисления +3 (например, Ti3+
, Fe3+
, Mn3+
), элементами подгруппы Al, Be, а также элементами иттриевой подгруппы, вместе с которыми его иногда относят к редкоземельным элементам.
На воздухе покрывается защитной оксидной пленкой толщиной до 600Å, заметное окисление начинается при 250 °С. При взаимодействии с водородом (450 °С) образуется гидрид ScH2
, с азотом (600-800 °С) - нитрид ScN, с галогенами (400-600 °С) - соединения типа SсСl3
.
Также Скандий реагирует с бором и кремнием при температуре выше 1000 °С.
В воде соединения Скандия заметно гидролизуются с образованием основных солей. Ионы Sc3+
склонны к полимеризации, образованию комплексных ионов различного типа, состав которых зависит от природы аниона и рН среды. Основные соли в растворе легко переходят в аморфный гидрооксид.
Металл легко растворяется в соляной, азотной и серной кислотах (с понижением концентрации кислоты скорость растворения Скандия резко падает и с 0,001 н. растворами он не реагирует).
На Скандий практически не действуют разбавленные растворы NaOH (10%) и смесь концентрированных HNO3
и HF (1 : 1).
Колоссальные ресурсы скандия сосредоточены в России и бывшем Советском Союзе (данные по добыче весьма разрозненны, но объёмы добычи по оценкам независимых специалистов равны или превышают официальную мировую добычу). В целом по оценкам независимых специалистов в настоящее время, основными продуцентами скандия (оксида скандия) являются Россия, Китай, Украина и Казахстан.
Среднее содержание скандия в земной коре 10 г/т. Содержание Скандия в морской воде 4·10-5
г/л.
Известно два собственных минерала Скандия: тортвейтит (Sc, Y)2 Si2
O7
(Sc2O3 до 53,5%) и стерреттит Sc[PO4
] • 2H2
O (Sc2
O3
до 39,2%), но встречаются они чрезвычайно редко.
Скандий является типичным рассеянным элементом и слабым мигрантом и входит в состав многих минералов.
В процессе формирования магматических пород и их жильных производных скандий в главной своей массе рассеивается преимущественно в тёмноцветных минералах магматических пород и в незначительной степени концентрируется в отдельных минералах постмагматических образований.
Так как, в горных породах содержание Скандия различно, и в связи с тем, что по свойствам скандий близок к Mg, Al, Ca, Mn2
+,Fe2
+, TR, Hf, Th, U, Zr, то главная его масса рассеивается в минералах, содержащих эти элементы.
Скандий является рассеянным литофильным элементом (элемент горных пород), поэтому для технологии добычи этого элемента важно полное извлечение его из перерабатываемых руд и по мере развития металлургии руд-носителей скандия, его ежегодный объём добычи будет возрастать.
Скандий преимущественно в виде оксидов извлекают попутно при гидро- и пирометаллургической переработке вольфрамовых, оловянных, титановых, урановых руд и бокситов.
Скандий смело можно назвать металлом XXI века и прогнозировать резкий рост его добычи, рост цен и спрос в связи с переработкой огромного количества каменных углей (особенно переработка каменных углей России) на жидкое топливо.
Оксид Скандия идет на изготовление ферритов для элементов памяти быстродействующих вычислительных машин. Радиоактивный 46
Sc используется в нейтронно-активационном анализе и в медицине. Сплавы Скандия, обладающие небольшой плотностью и высокой температурой плавления, перспективны как конструкционные материалы в ракето- и самолетостроении, а ряд соединений Скандия может найти применение при изготовлении люминофоров, оксидных катодов, в стекольном и керамическом производствах, в химической промышленности (в качестве катализаторов) и в других областях.
|