| МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ
АГРАРНЫЙ УНИВЕРСИТЕТ»
Кафедра химии
Курс лекций по дисциплине
«НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(для студентов инженерно – технологического факультета)

Гродно 2012
УДК: 546 (076.5)
ББК 24.1 Я 73
Р 13
Рецензенты: доктор биологических наук, профессор кафедры химии Учреждения образования «Гродненский государственный аграрный университет» З.В. Горбач, кандидат химических наук, доцент кафедры общей и неорганической химии Учреждения образования «Белорусский государственный технологический университет» Л.И.Хмылко.
Апанович, З.В.
Курс
лекций по дисциплине «Неорганическая химия».
Р 13 Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович. – Гродно: ГГАУ , 2012. – 146с. Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
| УДК
:
546 (076.5)
ББК 24.1 Я 73
|
|
Рекомендовано межфакультетской методической комиссией инженерно – технологического факультета 24 апреля 2009 г. (протокол №8).
© УО «Гродненский государственный аграрный университет», 2012
© Апанович З.В., 2012
Содержание
| ЛЕКЦИЯ 1
Тема:
s
- Элементы
I
группы
|
|
| 1. Общая характеристика элементов I А группы.
|
7
|
| Особенности лития и его соединений
|
|
| 2. Водород. Получение. Физические и химические свойства. Особенности положения в периодической системе
|
15
|
| 3. Вода и ее свойства. Экологическое и биологическое значение воды
|
18
|
| 4. Пероксид водорода. Окислительно-восстановительная двойственность Н2
О2
|
21
|
| 5. Биогенные свойства элементов I А группы
|
23
|
| ЛЕКЦИЯ 2
Тема:
s
– Элементы
II
группы
|
|
| 1. Общая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов (Ca, Sr, Ba) их бинарных соединений, гидроксидов и солей. Способы получения
|
28
|
| 2. Особенности соединений бериллия
|
34
|
| 3. Жесткость воды и ее влияние на живые организмы
|
36
|
| 4. Важнейшие соединения (в практическом отношении) элементов II А группы
|
38
|
| 5. Биогенная роль элементов II-А группы. Применение в сельском хозяйстве
|
39
|
| ЛЕКЦИЯ 3
Тема:
p
– Элементы
III
группы
|
| 1. Общая характеристика элементов III-A группы
|
41
|
| 2. Бор. Получение. Химические свойства
|
43
|
| 3. Алюминий
|
48
|
| 4. Биогенная роль
|
52
|
| ЛЕКЦИЯ 4
Тема: р - Элементы
IV
группы
|
| 1. Общая характеристика IV-A группы
|
54
|
| 2 Химия углерода
|
57
|
| 3. Химия кремния
|
66
|
| 4. Химия германия, олова, свинца (Ge, Sn, Pb)
|
69
|
| 5. Биогенная роль
|
70
|
| ЛЕКЦИЯ 5
Тема: р - Элементы
V
группы
|
| 1. Общая характеристика элементов V-А группы
|
71
|
| 2. Химия азота
|
74
|
| 3. Химия фосфора
|
92
|
| 4. Биогенная роль
|
99
|
ЛЕКЦИЯ 6
Тема: р - Элементы VI группы
|
| 1. Общая характеристика элементов VI-A группы
|
101
|
| 2. Химия кислорода
|
104
|
| 3. Химия серы
|
113
|
| 4. Биогенная роль
|
125
|
| ЛЕКЦИЯ 7
Тема: р - Элементы
VII
группы (галогены)
|
|
| 1.Общая характеристика элементов VII-A
|
128
|
| 2.Особые свойства фтора, как наиболее электроотрицательного элемента
|
131
|
| 3.Способы получения галогеноводородов и их свойства
|
137
|
| 4.Кислородсодержащие соединения галогенов
|
140
|
| 5.Биогенная роль (фтор и йод как микроэлементы)
|
145
|
ЛЕКЦИЯ 1
Тема:
s
- Э
лементы
I
группы
1. Общая характеристика элементов
I
А группы. Особенности лития и его соединений.
В периодической системе всего 14
s
-элементов
(включая водород и гелий). Это элементы I А и II А групп. Элементы I А группы – щелочные металлы
Li, Na, K, Rb, Cs, Fr. Все они имеют на внешнем электронном уровне атома по одному электрону ns
1
, сильно удаленному от ядра, с низким потенциалом ионизации. Всегда проявляют степень окисления +1.

Сверху вниз в подгруппе возрастает радиус атома элементов за счет возникновения новых электронных уровней.
В группах по мере увеличения числа энергетических уровнейатомные радиусы растут
. Переход нейтрального атома в катион  , сопровождается уменьшением радиуса поскольку в катионе заряд ядра удерживает меньшее число электронов. Очевидно, с возрастанием заряда ионный радиус катиона будет падать. , сопровождается уменьшением радиуса поскольку в катионе заряд ядра удерживает меньшее число электронов. Очевидно, с возрастанием заряда ионный радиус катиона будет падать.
Энергия ионизации – это та энергия, которую необходимо затратить на отрыв внешнего электрона у невозбужденного атома. Строение внешних оболочек ns
1
, поэтому они имеют низкие энергии ионизации, уменьшающиеся при переходе по подгруппе сверху вниз.
Связь электрона с ядром ослабевает при этом за счет увеличения радиуса атома и экранирования заряда ядра предшествующими внешнему электрону оболочками, увеличивается расстояние электрона от ядра и энергия ионизации уменьшается.
С ростом заряда ядра от
Na
к
Fr
усиливаются восстановительные свойства, это самые активные металлы
. Их стандартные электродные потенциалы j° отрицательные и имеют большое абсолютное значение. Наиболее отрицателен j° лития равный -3,02 В по сравнению с ионами других щелочных металлов (ион Li+
имеет среди них наименьший радиус), хороший комплексообразователь. Энтальпия гидратации катионов лития велика (∆Н° гидрат.
= - 486,6 кДж/моль). Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов. Металлический литий – самый сильный восстановитель, а ион Li+
самый слабый окислитель.
С увеличением порядкового номера, уменьшается относительная электроотрицательность (ОЭО).
Все щелочные металлы образуют одинаковую кристаллическую структуру. У щелочных металлов тип металлической структуры – объемно - центрированная кубическая упаковка (ОЦКУ).
| Координационное число равно 8.
|
|
 От Li к Cs увеличиваются размеры атомов и межъядерные расстояния в кристаллических решетках. Так как химическая связь большей длины является менее прочной, то по мере роста межъядерного расстояния уменьшается прочность кристаллических решеток, поэтому снижаются температуры плавления и кипения. Щелочные металлы активно окисляются кислородом воздуха при обычной температуре, поэтому их хранят под слоем керосина или бензина.
4Э
+
О2
=
2Э2
О
Взаимодействуют с другими окислителями (галогенами, серой, фосфором), образуя соединения LiCl, Li2
S, Li3
P, NaBr, Na2
S.
С азотом взаимодействует только литий при обычной температуре.
6
Li
+
N
2
=
2
Li
3
N
Нагревая щелочной литий в струе газообразного водорода получают гидрид.
2
Li
+
Н2
=
2
LiH
-
.
С кислородом образуют оксиды, пероксиды, надпероксиды, озониды.
4
Li
+
O
2
→ 2
Li
2
O
– оксид лития
2
Na
+
O
2
→
Na
2
O
2
– пероксид натрия
K
+
O
2
→
KO
2
– надпероксид (супероксид калия)
Пероксиды содержат диамагнитный ион О2
2-
, надпероксиды– парамагнитный ион О2
-
.
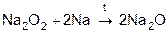
Оксиды Na и K могут получиться при недостатке кислорода. Элементы могут образовывать озониды по реакции с озоном:
K
+
O
3
→
KO
3
KOH
+
O
3
→
KO
3
+
O
2
+
H
2
O
Все озониды, пероксиды, надпероксиды сильные окислители и разлагаются водой.
 KO2
+ H2
O → KOH + O2
+ H2
O2 KO2
+ H2
O → KOH + O2
+ H2
O2
KO2
+ H2
O(
теплая
)
→ KOH + O2
КО
3
+ H2
O → KOH + O2
Причем разложение может идти как обменное взаимодействие.
Na2
O2
+ 2H2
O
→ 2NaOH + H2
O2
Оксиды щелочных металлов Ме2
О – кристаллические термически устойчивые вещества, при взаимодействии с водой образуют щелочи.
Ме2
О + Н2
О = 2МеО
H
 Ме2
O
+
H
2
O
→ 2
MeOH
лабораторные способы Ме2
O
+
H
2
O
→ 2
MeOH
лабораторные способы
2
Na
+ 2
H
2
O
→ 2
NaOH
+
H
2
↑ получения щелочей
карбонатный способ получения щелочей:
Na2
CO3
+ Ca(OH)2
→ CaCO3
↓ + 2NaOH
В промышленности NaOH получают электролизом раствора поваренной соли:
NaCl
+
H
2
O
электролиз
→
NaOH
+
Cl
2
+
H
2
K ( - ) 2H2
O + 2e = H2
+ 2OH-
A ( + ) 2Cl- - 2e
=
Cl2
Этим способом получают достаточно чистый NaOH.
Оксиды и гидроксиды
| Li2
O
Na2
O
K2
O
Rb2
O
Cs2
O
Fr2
O
|
растворимость
|
LiOH
NaOH
KOH
RbOH
CsOH
FrOH
|
сила оснований
|
Гидроксиды щелочных металлов МеОН – твердые кристаллические вещества, легкоплавки, хорошо растворяются в воде с выделением тепла (кроме LiOH), полностью диссоциируют на ионы, сила оснований растет от Li к Fr.
ЭОH ® Э+
+ OH-

Более активно реагируют с водой непосредственно щелочные металлы.

Интенсивность взаимодействия с водой увеличивается в ряду Li - Cs, Rb и Cs реагируют с Н2
О со взрывом.
Свойства гидроксидов
Все растворимы в воде – щелочи.
LiOH, NaOH, KOH, RbOH, CsOH, FrOH
реакционная способность увеличивается
1) реакция нейтрализации:
NaOH + HCl
→
NaCl + H2
O
2) c кислотными оксидами:
NaOH + CO2
→
NaHCO3
2NaOH + CO2
→
Na2
CO3
+ H2
O
3) с амфотерными оксидами:
2NaOH + BeO + H2
O → Na2
[Be(OH)4
]
4) с неметаллами:
С
l
2
+
KOH
→
KCl
+
KClO
+
H
2
O
холодная
С
l
2
+
KOH
→
KCl
+
KClO
3
+
H
2
O
горячая
3S + 6NaOH → 2Na2
S + Na2
SO3
+ 3H2
O
5) с амфотерными металлами:
2Al + 2NaOH + 6H2
O
→
2Na[Al(OH)4
] + 3H2
6) с солями:
2
AlCl
3
+ 6
NaOH
(недост.)
→
2
Al
(
OH
)3
+ 6
NaCl
AlCl3
+
4
NaOH(
избыт
.)
→
Na[Al(OH)4
] + 3NaCl
7) с амфотерными гидроксидами:
Zn(OH)2
+ 2NaOH
→
Na2
[Zn(OH)4
]
Щелочи жадно поглощают из воздуха влагу и СО2
, т.е. содержат примесь Н2
О (в виде кристаллогидратов NaOH×H2
O) и карбонатов.
Щелочи при плавлении разрушают стекло и фарфор

ΔG0
298
= -100кДж
За счет этого щелочи нельзя долго хранить в посуде с пришлифованными пробками, они прилипают вследствие взаимодействия щелочи со стеклом.
Твердые щелочи и их концентрированные растворы разрушают живые ткани, особенно опасно попадание частиц твердой щелочи в глаза (приводит к слепоте).
Не только с кислотами, но даже с водой большинство щелочных металлов реагируют со взрывов – отсюда шутливые плакаты с серьезным подтекстом в студенческих практикумах: «Не хотите быть уродом, не бросайте натрий в воду!»
Особенности лития и его соединений
Литий существенно отличается от остальных элементов IA группы. Особые свойства характерны для всех элементов II периода. В отличие от остальных ионов щелочных металлов, у которых по 8 электронов на предвнешнем уровне ион Li+
имеет только 2 электрона. У лития на кайносимметричной 2р-орбитали нет еще ни одного электрона.
Связь лития с другими элементами имеет менее ионный характер, что приближает его к магнию (диагональное сходство элементов в периодической системе). В периодической системе только у 2-го или даже 3-го элемента А групп полностью проявляются характерные свойства. Аномальное поведение Li заключается в том, что у Li самое отрицательное значение электродного потенциала и можно ожидать, что Li поэтому должен быть самым активным из всех металлов. Но это не так. По активности он близок к Mg, Ca.
Поэтому низкое значение электродного потенциала объясняется тем, что у Li самая высокая энергия гидратации из-за малого размера атома. Такая закономерность справедлива лишь для всех водных растворов. По химическим свойствам Li отличается от щелочных металлов, как и его соединения.
Подобно соединениям магния малорастворимы в воде LiF, Li2
CO3
, Li3
PO4
. LiOH менее других растворим в воде.
Li взаимодействует с азотом Li3
N,
6
Li
+
N
2
→ 2
Li
3
N
-3
(нитрид лития),
с кремнием − Li4
Si,
4
Li
+
Si
→
Li
4
Si
(силицид лития)
с углеродом – Li2
С2
,
2
Li
+ 2C = 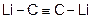 (ацетиленид лития)
(ацетиленид лития)
с водородом − LiH,
2
Li
+
H
2
→ 2
LiH
(гидрид лития)
с кислородом − Li2
O
4
Li
+
O
2
→ 2
Li
2
O
(оксид лития)
Гидроксиды МеОН, за исключением LiOH выдерживают нагревание до более 1000°С, LiOH разлагается при температуре красного каления (550 – 6000
С).
Кислородосодержащие соединения (LiOH, LiNO3
, Li2
CO3
) при нагревании разлагаются.


Li2
CO3
 Li2
O + CO2
↑
Li2
O + CO2
↑
Малый радиус иона Li+
обусловливает возможность координации лигандов вокруг этого иона, образование большого числа двойных солей, различных сольватов, высокую растворимость ряда солей лития в органических растворителях (подобно магнию).
Аналогию в свойствах соединений лития и магния можно объяснить близостью величин их ионных радиусов
r (Li+
) = 0,068 нм, r (Mg+2
) = 0,074 нм.
Получение элементов
I
А группы
Получение
Li
:
1) В промышленности – электролизом расплавов солей:
2
LiCl 2
Li
+
Cl
2
2
Li
+
Cl
2
расплав
K ( -) Li+
+ 1e →Li0
A (+) 2Cl-
- 2e →Cl2
Электролизом водных растворов щелочных металлов их получить нельзя.
2) Остальные металлы получают в основном:
а) металлотермией
из расплавов солей или оксидов;
LiCl + Na
 Li + NaCl
Li + NaCl
CsCl + Na
 Cs + NaCl
Cs + NaCl
Na – получить трудно, т.к. tпл
Na и NaCl близки, и для понижения tпл
необходимы добавки.
Наиболее чистый Na, K получают
б) электролизом расплавов их хлоридов или гидроксидов.
 расплав расплав
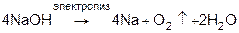
Реже используется восстановление соединений щелочных металлов Al, Si или коксом; полученные при этом металлы не отличаются высокой чистотой из-за частичного образования алюминатов, карбидов, силицидов.

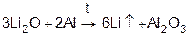


Возможность протекания этих реакций объясняется более высокой летучестью щелочных металлов по сравнению с Si, С, Al (tкипения
(Al) = 2467°C, а tкипения
(Na) = 983°C).
Получение соды по методу Сольве
Исходные вещества NH3
, CO2
, NaCl,
вначале получают CO2
CaCO
3
 CaO
+
CO
2 CaO
+
CO
2
В теплый насыщенный раствор NaCl пропускают аммиак, а затем углекислый газ, вначале образуется NH4
HCO3
1)
 ,
,
далее он вступает в обменную реакцию с NaCl
2)  . .
Из 4-х солей наименее растворим в воде NaHCO3
, который выпадает в осадок, затем при нагревании
3)  . .
2. Водород (
Hydrogenium
– воду рождающий)
Имеет 3 изотопа: протий  , дейтерий , дейтерий  или Д и тритий или Д и тритий  или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения. или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5×10-5
%. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода.
Водород – s-элемент, в различных вариантах периодической системы помещают его то в I A, вместе со щелочными металлами, то в VII A вместе с галогенами, а иногда рассматривают отдельно.
Со щелочными металлами он сходен в том, что образует положительный ион Н+
и играет роль восстановителя.
Но с галогенами у него больше сходства: в гидридах активных металлов (CaH2
, NaH), содержится ион Н-
, подобный ионам Г-
(NaCl, CaCl2
). Молекулы водорода и галогенов двухатомны (Н2
, Cl2
, Br2
). Для водорода, как и для фтора, хлора, характерны газообразное состояние и неметаллические свойства. Потенциалы ионизации водорода и галогенов близки. Атомы водорода легко замещаются атомами галогенов в органических соединениях. Поэтому вариант ПС, где Н возглавляет VII А группу более правилен.
Особенности водорода – единственный валентный электрон водорода находится непосредственно в зоне действия атомного ядра. Особенностями строения атома водорода обусловлено существование водородной связи.
Получение
Н2
В промышленности водород получают из воды и углеводородов. При этом восстановителем водорода при температуре (600-900°С) являются атомы углерода
 . .
Конверсия метана с водяным паром:
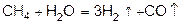 . .
При более высокой температуре (950-1100°) можно получить разложением метана особо чистый водород и углерод.

В лаборатории:
1) при действии разбавленного раствора кислоты на активный металл (в аппарате Киппа):
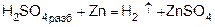
или

2) щелочные металлы и щелочноземельные вытесняют водород из воды.
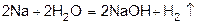
3) действием едких щелочей на металлы


или 
4) разложением гидридов типичных металлов водой
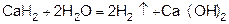
5) электролизом воды (электролиз водных растворов щелочей).
2H2
O 2H2
+ O2 2H2
+ O2
Физические свойства.
В обычных условиях водород – это самый легкий газ без цвета, запаха и вкуса, плохо растворим в воде.
Атомарный водород гораздо активнее молекулярного, для которого нужны дополнительные затраты энергии на расcпаривание электронов.
По электроотрицательности занимает промежуточное положение между неметаллами и металлами. И в реакциях с неметаллами и кислородсодержащими веществами играет роль восстановителя.
Химические свойства Н2
Водород легко соединяется с кислородом, горит на воздухе или в атмосфере чистого кислорода бледно-синим пламенем.
1) 
Если состав смеси приближается к стехиометрическому
(2 объема Н2
и 1 объем кислорода), то смесь называется “гремучим газом”, т.к. реакция имеет в этом случае взрывной характер.
Водородно-кислородное пламя, имеющее температуру 2500°-2800°С используют для плавления тугоплавких металлов и автогенной сварки.
2)  (при температуре 450 – 5000
С и повышенном давлении, в присутствии катализатора). (при температуре 450 – 5000
С и повышенном давлении, в присутствии катализатора).
3)  (при нагревании). (при нагревании).
4)  (при повышении температуры и давления, в присутствии катализатора). (при повышении температуры и давления, в присутствии катализатора).
5)  (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н-
(гидрид-ион). (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н-
(гидрид-ион).
3. Вода и ее свойства. Экологическое и биологическое значение Н2
О
Три изотопа водорода 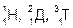 и три стабильных изотопа кислорода 16
О, 17
О, 18
О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т2
18
О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма. и три стабильных изотопа кислорода 16
О, 17
О, 18
О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т2
18
О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
Физические свойства.
Чистая вода бесцветная, прозрачная жидкость, без запаха и вкуса. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как у всех других веществ, а возрастает и максимальной плотностью обладает вода при 4°С, а при дальнейшем нагревании плотность ее уменьшается. Вода обладает аномально большой теплоемкостью равной 4,18 , песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2
О – Н2
S – H2
Se – H2
Te,
Tкипения
, °С 100 -60 -41 -2
Если от H2
Te к Н2
S температура кипения закономерно уменьшается, то при переходе от Н2
S к Н2
О резко увеличивается. Это объясняется наличием водородной связи между молекулами воды, вследствие кулоновского взаимодействия положительно заряженного атома водорода одной молекулы и электроотрицательным атомом кислорода другой

Такое взаимодействие затрудняет отрыв молекул друг от друга, т.е. уменьшает их летучесть, а, следовательно, повышает температуру кипения.
Молекула воды из-за sp3
-гибридизации орбиталей атома кислорода имеет угловую конфигурацию, а атомы водорода, соединенные с сильно-электроотрицательным атомом кислорода, определяют ее способность к установлению четырех водородных связей с соседними молекулами.

Химические свойства Н2
О
Вода – очень активный реагент по следующим причинам:
а) за счет ориентационного взаимодействия с полярными молекулами других веществ;
б) установления водородных связей;
в) проявления донорных свойств со стороны атома кислорода по отношению к частицам – акцепторам электронных пар;
г) электролитической диссоциации при обычных условиях (ионы Н+
гидратируются, образуя ионы Н3
О+
).
1.
При температуре выше 1000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
 . .
2.
Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).

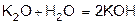
3.
Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Например: кристаллогидрат сульфата натрия Na2
SO4
×10H2
O (глауберова соль), Na2
CO3
×10H2
O - кристаллическая сода.
Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений.
Аквакомплексы – лигaндами является вода, [Co(H2
O)6
]Cl2
, [Al(H2
O)6
]Cl3
, [Cr(H2
O)6
]Cl3
и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(H2
O)4
]SO4
×H2
O – медный купорос.
4. Пероксид водорода. Окислительно - восстановительная двойственность Н2
О2
1. Строение молекулы
. Структурная формула Н - О – О - Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н - О молекула Н2
О2
сильно полярна. Между молекулами Н2
О2
возникает довольно прочная водородная связь, поэтому в обычных условиях Н2
О2
– сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150°С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение (σ) больше, чем у Н2
О.
В молекуле Н2
О2
связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы:
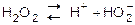 I ст. К1
= 2,6×10-12
. I ст. К1
= 2,6×10-12
.
 II ст. практически не протекает, II ст. практически не протекает,
т.к. подавляется диссоциацией Н2
О, которая протекает в большей степени, чем Н2
О2
. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2.
С некоторыми основаниями Н2
О2
взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2
+ H2
O2
= BaO2
+ 2H2
O
соль
пероксида водорода
3.
В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2
О2
-1
+ Н2
О2
-1
= О2
0
+ 2Н2
О-2
Н2
О2
= Н2
О+ О
Неустойчивость Н2
О2
обусловлена непрочностью связи О - О.
Атомы кислорода в молекуле Н2
О2
связаны непосредственно друг с другом неполярной ковалентной связью. Связи О - Н полярны. Поэтому молекула Н2
О2
также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО
2
+
Н
2
SO4
= BaSO4
¯
+ H2
O2
в отличие от оксидов
SnO2
+
2H2
SO4
= Sn(SO4
)2
+
2H2
O
Этой реакцией пользуются для различия оксидов и пероксидов.
 Н 0.95 А0
= 0,095нм Н 0.95 А0
= 0,095нм
1,48 А0
= 0,148нм
120°
О О
95°
Н
ЕО-О
= 210 кДж/моль ЕО-Н
= 468 Дж/моль
Молекула нелинейна, две связи О - Н расположены не симметрично, а в 2-х плоскостях под углом 120°. Поэтому полярность mН2
О2
> mН2
О.
4.
Окислительно-восстановительная двойственность Н2
О2
Н2
О2
+ 2К
I
=
I
2
+ 2
KOH
окислитель восстановитель
Н
2
О
2
+ Ag+
2
O = 2Ag0
+ O2
+ H2
O
восстановитель окислитель
H2
O2
+ KMnO4
+ H2
SO4
→ O2
+ MnSO4
+ K2
SO4
+ H2
O
H2
O2
+ KI + H2
SO4
→ H2
O + I2
+ K2
SO4
Na2
O2
и K2
O2
– используют для регенерации кислорода в подводных лодках и в изолирующих противогазах.
2Na2
O2
+ 2CO2
→ 2Na2
CO3
+ O2
↑
Наличие атомарного кислорода сообщает Н2
О2
и Na2
O2
сильные окислительные свойства. Na2
O2
способен гидролизоваться с образованием H2
O2
по реакции
Na2
O2
+ 2H2
O = 2NaOH + H2
O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2
О2
, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
5. Биогенная роль элементов
I
А группы
Литий.
Недостаток лития в пищевом рационе способствует заболеваемости маниакально-депрессивными психозами, шизофренией и др. Для депрессивных больных характерен избыток, а для страдающих маниями – недостаток натрия в клетках. Роль же лития важна для выравнивания натрий -калиевого баланса в организмах больных.
Биологическая роль
K
и
Na
. Взаимосвязь ионов
K
и
Na
в биологических системах. Калий как необходимый элемент цитоплазмы, натрий как элемент межклеточных растворов
Содержание натрия в организме человека массой 70 кг составляет 60г. Из этого 44% натрия находится во внеклеточной жидкости и 9% - во внутриклеточной. Концентрация Na+
внутри клетки приблизительно в 15 раз меньше, чем во внеклеточной жидкости. Наоборот, концентрация К+
приблизительно в 35 раз выше внутри клетки, чем вне ее.
Остальное количество находится в костной ткани, являющейся местом депонирования иона Na+
в организме (около 40%). Натрий – основной внеклеточный ион, в организме находится в виде растворимых солее NaCl, Na3
PO4
, NaHCO3
, распределен в сыворотке крови, спинномозговой жидкости, по всему организму, глазной жидкости, пищеварительных соках, желчи, почках, легких, мозге. Натрий поддерживает постоянство осмотического давления и кислотно-основное равновесие (фосфатная буферная система Na2
HPO4
+ NaH2
PO4
).
Натрий содержится в поваренной соли, овощах. Натрий концентрируют в больших количествах водоросли, ламинарии, фукусы. Высокие содержания натрия способна переносить сахарная свекла.
. В поддержании кислотно - щелочного равновесия в организме важнейшая роль принадлежит натрию. Его главная обязанность поддерживать нормальное кровяное давление, защищать организм от потери жидкости, влиять на мышечную активность.
Радиоактивный 24
Na
используется в качестве метки для определения скорости кровотока и для лечения некоторых форм лейкимии.
NaCl
– основной источник соляной кислоты для желудочного сока. Непрерывное, избыточное появление NaCl в организме способствует развитию гипертонии. Около 90% потребляемого натрия выводится мочой, а остальные – с потом и калом.
Изотонический раствор
NaCl
(0,9%)
для инъекций вводят подкожно, внутривенно при обезвоживании организма и при интоксикациях, а также применяют для промывания глаз, слизистой оболочки носа, а также для растворения лекарственных препаратов.
Гипертонические растворы
NaCl
(3-5-10%)
применяют наружно в виде компрессов и примочек при лечении гнойных ран. Применение таких компрессов способствует, по законам осмоса, отделению гноя из ран и плазмолизу бактерий.
NaCl
– используется для консервирования продукции сельского хозяйства (соления, квашения овощей).
NaOH
– (каустическая сода) используется в мыловаренной, кожевенной, фармацевтической, текстильной промышленность и в сельском хозяйстве, 10%-ый раствор входит в состав силамина, применяемого в ортопедической практике для отливки огнеупорных моделей.
NaHCO
3
(питьевая, чайная сода) – применяют в виде полосканий, промываний при воспалительных заболеваниях глаз, слизистых оболочек верхних дыхательных путей. Действие основано на гидролизе, раствор имеет слабощелочную среду.
NaHCO3
+ H2
O ↔ NaOH + H2
CO3
.
При воздействии щелочей на микробные клетки происходит осаждение клеточных белков и вследствие этого гибель микроорганизмов. NaHCO3
применяется в кондитерском деле, в медицине, в лабораторной практике.
NaHCO3
– используют при повышенной кислотности (ацидоз), взаимодействует с кислыми продуктами, образуя натриевые соли органических кислот, которые выводятся с мочой, а СО2
с выдыхаемым воздухом.
NaHCO3
+ HCl = NaCl + H2
O + CO2
– нейтрализуется избыточная соляная кислота. Слишком большая доза NaHCO3
приводит к алкалозу, что не менее вредно, чем ацидоз.
Na
2
CO
3
– (кальцинированная сода).
Na
2
CO
3
• 10
H
2
O
– (кристаллическая сода), потребляется мыловаренной, стекольной, текстильной, бумажной, нефтяной промышленностью.
Na
2
SO
4 •
10
H
2
O
– глауберова соль (мирабилит) или слабительное. Эта соль медленно всасывается из кишечника, что приводит к повышению осмотического давления и накоплению воды в кишечнике, содержимое его разжижается, и каловые массы быстрее выводятся из организма.
Na
2
B
4
O
7
· 10
H
2
O
-
(бура) применяется наружно, как антисептическое средство для полосканий, спринцеваний, смазываний. Антисептическое действие аналогично NaHCO3
и связано с гидролизом и с образованием противомикробного лекарственного средства борной кислоты.
Na2
B4
O7
+ 7H2
O ↔ 4H3
BO3
+ 2NaOH
NaNO
3
– натриевая (чилийская) селитра, азотное удобрение с нитратной формой азота.
Na
3
[
AlF
6
] – криолит
Наибольшее практическое значение среди соединений натрия имеют: NaOH – каустическая сода, NaHCO3
– питьевая сода, Na2
CO3
- кальцинированная сода, Na2
CO3
×10H2
O – кристаллическая сода.
Калий.
Содержание калия в организме 70 кг приблизительно 160г. Калий - основной внутриклеточный катион, распространен по всему организму: печень, почки, сердце, костная ткань, мышцы, кровь, мозг. Ионы К+
играют важную роль в физиологических процессах – сокращении мышц, функционировании сердца, проведении нервных импульсов. Калий антагонист натрия. Калий в отличие от натрия «работает» внутри клеток, где участвует в регулировании водного баланса. Необходим калий для нормальной работы сердечной мышцы.
Почти все соли калия хорошо растворимы в воде, но в отличие от солей натрия не содержат кристаллизационной воды. Вместе с азотом и фосфором, калий – один из основных элементов питания растений, при отсутствии его они погибают.
Забирают из почвы калий подсолнечник, лен, конопля и калий накапливается в их стеблях. Калий участвует в процессе фотосинтеза, приводит к снижению содержания сахаров в корнеплодах свеклы и крахмала в зерне, отмиранию листьев растений, снижению всхожести семян, восприимчивости к грибковым заболеваниям.
Na и К присутствуют в почвах в трех основных формах – необменной, обменной, водорастворимой. Основная масса щелочных металлов (более 99 %) в необменной форме. В обменной форме калия больше чем натрия, т.к. калий прочнее удерживается почвенными ионообменниками. Натрий входит в ППК только в солонцах и засоленных почвах. В почвенных растворах натрий преобладает над калием. Катионы Na+
слабо удерживаются почвенными массами, мигрируют на далекие расстояния. Накапливаются в океанах, морях, соленых озерах.
Соли натрия накапливаются в почвах засушливых районов, вызывая засоление. Засоленные почвы (солонцы, солончаки, солоди) содержат много Na2
CO3
, Na2
SO4
, NaCl. Для этих почв характерны щелочная среда, высокое осмотическое давление, так называемая физиологическая сухость. Это нарушает поступление воды в корни растений, вызывает их увядание и гибель. Эти почвы подвергают нейтрализации и рассолонцеванию. Для этого вносят гипс CaSO4
•2H2
O (гипсование).
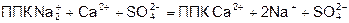
Особенно велика биогенная роль калия. В культурных растениях большие содержания калия обнаружены в картофеле, свекле, табаке, изюме, черносливе, цветной капусте, редьке, абрикосах, подсолнечнике. В животных организмах калий имеется в печени, селезенке. Велико содержания калия в эритроцитах, крови животных. В организмах калий находится в виде минеральных солей органических кислот (щавелевой, лимонной, пировиноградной). Установлено, что соли калия не могут быть заменены в организме никакими другими солями.
При недостатке калия в почвах растения поражаются грибковыми и бактериальными болезнями, листья их бледнеют и отмирают.
При нарушении деятельности почек у животных калий накапливается в крови, что приводит к тяжелым расстройствам функций сердца, мышц, центральной нервной системы. Калий играет большую роль в обмене веществ и фотосинтезе. Ферсман сказал о значении калия для организмов «Калий – основа жизни растений».
KCl
– концентрированное калийное удобрение, является сырьем для получения сильвинита (
KCl
×
NaCl
).
KNO
3
– калийная селитра, сложное удобрение, содержит два элемента питания растений – калий и азот, используется в производстве тугоплавкого стекла и черного пороха.
KPO
3
– метафосфат, сложное удобрение содержит – два элемента калий и фосфор.
K
2
SO
4
– самое дорогое из калийных удобрений, т.к. методы получения дороги.
K
2
CO
3
(поташ) – зола, необходим в мыловарении, стекольном производстве, в фотографии, при крашении тканей.
K2
O
×
Al2
O3
×
6H2
O
– полевой шпат (ортоклаз).
ЛЕКЦИЯ 2
Тема:
s
- Э
ЛЕМЕНТЫ
II
ГРУППЫ
1. Общая характеристика элементов
II
А группы. Физические и химические свойства щелочноземельных металлов
Ca
,
Sr
,
Ba
), их бинарных соединений, гидроксидов и солей
Be, Mg, Ca, Sr, Ba, Ra – элементы II А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами.
Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226
Ra.
Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь  ), за счет чего атомы могут быть двухвалентными. ), за счет чего атомы могут быть двухвалентными.
2s 2p
| Be [He] 2s2
Be* [He] 2s1
2p1
|
|
 
Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов.
У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка)
Ca, Sr – ГКУ (гранецентрированная кубическая упаковка)
Ba – ОЦКУ (объемно-центрированная кубическая упаковка)

ГПУ ГКУ ОЦКУ
Температура плавления и кипения бериллия, а также твердость значительно превосходит остальные элементы подгруппы, это связано с тем, что бериллий образует наиболее прочную кристаллическую решетку. Стандартный электродный потенциал уменьшается сверху вниз, соответственно. Восстановительная активность увеличивается от Ве к Ra, но они менее активные восстановители, чем щелочные металлы.
Незакономерное изменение физических свойств: плотности, температуры плавления, температуры кипения обусловлены существенными различиями в строении пространственных кристаллических решеток.
В свободном состоянии это легкие металлы, тверже щелочных, самый мягкий барий, имеют серебристо-белый цвет.
Для элементов II-A группы характерна степень окисления +2, соединения со степенью окисления +1 – неустойчивы.
Все окисляются на воздухе и бериллий, и магний покрываются плотной пленкой оксидов, защищающей их от воздействий. Но остальные металлы взаимодействуют с кислородом воздуха более энергично, поэтому хранят также как и щелочные.
При нагревании все металлы сгорают на воздухе с образованием оксидов.
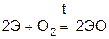
При высоких температурах взаимодействуют с азотом, образуя нитриды.
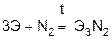
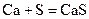




Взаимодействуют с водой, вытесняя водород, все кроме бериллия, магний реагирует медленно и только при высоких температурах, а остальные бурно, т.к. в ряду стандартных электродных потенциалов находятся левее водорода.
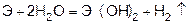

Магний сначала образует оксид, а затем гидроксид.
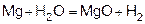
Магний покрыт оксидной плёнкой MgO, который растворяется в H2
O при нагревании.

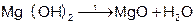

Гидролиз бинарных соединений (
при нагревании)
Са
S + 2H2
O → Ca(OH)2
+ H2
S↑
Ca3
P2
+ 6H2
O → 3Ca(OH)2
+ 2PH3
↑
CaC2
+ 2H2
O → Ca(OH)2
+ C2
H2
↑
CaH2
+ 2H2
O → Ca(OH)2
+ 2H2
↑
Ca3
N2
+ 6H2
O → 3Ca(OH)2
+ 2NH3
↑
Mg2
Si + 4H2
O → 2Mg(OH)2
+ SiH4
↑
Ca, Sr, Ba легко взаимодействуют с водородом, а Be, Mg – не взаимодействуют.
Наряду с обычными оксидами в отличие от Be и Mg образуют пероксиды
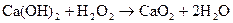
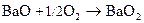
Гидроксиды щелочноземельных металлов – сильные основания (щелочи). Be(OH)2
- aмфолит.
Mg(OH)2
– как основание средней силы хорошо растворяется в кислотах и в растворах солей аммония
 . .
С ростом ионных радиусов Э2+
в ряду Be-Ba растет растворимость гидроксидов и усиливаются основные свойства в ряду Са(ОН)2
– Sr(OH)2
–Ba(OH)2
. Об этом можно судить по значениям  образования ЭСО3
в реакции: образования ЭСО3
в реакции:

BeCO3
MgCO3
CaCO3
SrCO3
BaCO3
 ,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0 ,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0
Малорастворимые гидроксиды бериллия и магния получают с помощью реакций обмена между солями этих металлов и щелочами.
MgCl
2
+ 2
KOH
→
Mg
(
OH
)2
↓ + 2
KCl
Гидроксиды рассматриваемых элементов разлагаются при нагревании.

Из разбавленых кислот (кроме HNO3
) эти металлы вытесняют водород
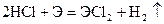
 ; ;
разбавленную HNO3
восстанавливают до иона аммония, концентрированную как активные металлы до N2
О


Способы получения
Получение бериллия.
1. Из оксидов, фторидов пирометаллургическим методом, т.е. при высокой температуре (восстановители – CO, C, Mg).
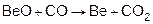


2. Электролиз расплавов солей.
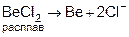
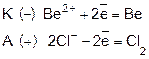
Получение магния
из оксидов восстановлением C и Si


Mg + H2
≠
Ca - электролизом расплавов солей, Sr и Ba- алюмотермией
3
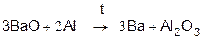
Растворимость солей:
Хорошо растворимы: хлориды, бромиды, иодиды и нитраты.
Плохо растворимы сульфаты (кроме MgSO4
), карбонаты, фосфаты, силикаты. Сульфиты – малорастворимы в воде и сильно гидролизуются.
Все соли бария токсичны, применяются в сельском хозяйстве как инсектициды – яды для борьбы с вредными насекомыми (BaCl2
, BaCO3
).
2. Особенности бериллия
Также как литий отличается от элементов I-A группы, Be – отличается от элементов II-А группы.
Атом Ве имеет на предвнешнем электронном уровне только два электрона, в отличие от остальных элементов II-A группы, у которых их по 8. У него наименьший радиус. Поэтому Ве проявляет диагональное сходство с Al.
Ве и его аналоги при нагревании с галогенами образуют галогениды ЭГ2
. Их получают также действуя НГ на металл или на Э(ОН)2
.
Be + Cl2
→ BeCl2
ЭГ2
– кристаллические вещества.
В молекуле BeCl2
в наружном слое 4 электрона. Ве – может быть акцептором электронных пар и образовывает две связи по донорно-акцепторному механизму. Cl – донор электронной пары.

В итоге при конденсации BeCl2
образуются линейные полимерные цепи. Бериллий образует бинарные соединения:
Be + O2
= 2BeO
Be + S  BeS BeS
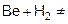

и разлагаются водой
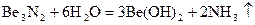
В обычных условиях бериллий не образует простых ионов, как и для алюминия, для него характерны катионные и анионные комплексы, где координационное число Be равно 4 (Кч.
Be
= 4); в водных растворах не существует иона Be2+
так как он гидратирован.
Также как и алюминий бериллий обладает амфотерными свойствами, растворяется и в кислотах и в щелочах
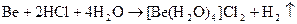
Be + 2H+
+ 4H2
O = [Be(H2
O)4
]2+
+ H2
↑

Be + 2OH-
+ 2H2
O = [Be(OH)4
]2-
+ H2
↑
Be пассивируется концентрированной азотной и серной кислотами, но при нагревании реагируют с этими кислотами:

Амфотерный оксид Ве взаимодействует при сплавлении как с кислотными так и с основными оксидами.
 (бериллат натрия) (бериллат натрия)
 (ортосиликат бериллия). (ортосиликат бериллия).
Как и оксид, амфотерны сульфиды и галогениды бериллия.
BeS + Na2
S → Na2
BeS2
кис
.
осн
.
BeS + SiS2
→ Be2
[SiS4
]
осн
.
кис
.
BeF2
+ NaF → Na2
[BeF4
]
кис
.
осн
.
BeF2
+ SiF4
→ Be[SiF6
]
осн. кис.
Амфотерен и гидроксид бериллия
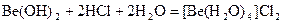

Соль бериллия, образованную слабой кислотой, можно получить только непосредственно соединением элементов, но нельзя получить смешиванием водных растворов, так как идет совместный гидролиз солей.
Все соединения Ве токсичны. С учетом особенностей его свойств, применяется в атомной технике, электронике.
3. Жесткость воды, ее влияние на живые организмы.
В природных водах содержатся соли кальция, например, благодаря растворимости гипса CaSO4
×2H2
O. В присутствии СО2
растворяются в воде карбонаты кальция и магния


Вода, в которой много растворимых солей Ca и Mg считается жесткой. Жесткость воды выражается числом миллиэквивалентов ионов Са2+
и Mg+2
, содержащихся в 1 л Н2
О.
 (мг- экв/л), (мг- экв/л),
где  и и  - концентрация Са+2
и Mg+2
(мг-экв/л). - концентрация Са+2
и Mg+2
(мг-экв/л).
Вода считается мягкой, если в литре воды содержание кальция и магния менее 4 мг-экв/л, средней 4-8, жесткой 8-12, очень жесткой – более 12 мг-экв/л.
В жесткой воде мыло плохо пенится, снижается его моющие действия, т.к. соли Ca и Mg образуют с ним нерастворимые соединения. Мыло – Na-соли высокомолекулярных кислот, натрий замещается на Ca2+
и образуется осадок.
В жесткой воде плохо развариваются овощи. У животных нарушается Ca-Mg обмен.
Только растворимые соли Ca и Mg обуславливают жесткость воды. Различают временную
и постоянную
жесткость
воды. Временная (карбонатная) жесткость
воды связана с наличием в воде растворимых гидрокарбонатов Ca и Mg. Ее устраняют нагреванием (кипячением).
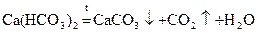
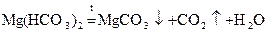
или добавлением известковой воды, фосфатов
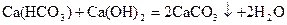 , или , или
3Ca(HCO3
)2
+ 2Na3
PO4
= Ca3
(PO4
)2
↓ + 3Na2
CO3
+ 3H2
O + 3CO2
↑
Устранить жесткость – значит получить нерастворимые соли. При этом образуется накипь СаСO3
и MgCO3
. Накипь плохо проводит тепло, вызывает увеличение расхода топлива.
Постоянная жесткость
обусловлена наличием в растворе Са и Mg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды и извести

MgSO4
+ Ca(OH)2
= Mg(OH)2
+ Ca SO4
¯
Общая жесткость
– сумма временной и постоянной жесткости.
Общую жесткость можно удалить действием соды и известкового молока (содово-известковый способ).

 . .
Все это химические способы устранения жесткости.
Ионы Са2+
и Mg2+
можно удалить из воды посредством катионитов (ионообменных смол), сложных веществ, нерастворимых в воде, способных обменивать свои катионы.
 (R – сложный кислотный остаток) (R – сложный кислотный остаток)
Ионы Са2+
и Mg2+
из воды переходят в катиониты.
Для восстановления катионита, его промывают концентрированным раствором NaCl, катионит потом снова можно использовать для очистки воды.

4. Важнейшие соединения элементов
II
-А группы
BeO
,
MgO
– для производства огнеупорных материалов, М
gO
– жженая магнезия, применяется для нейтрализации при отравлении кислотами, входит в состав зубных порошков.
СаО
– негашеная известь.
BaO
2
– для производства Н2
О2
и как отбеливающее средство.
Са(ОН)2
– гашенная известь (известковое молоко) дешевое растворимое основание.
СаСО3
– карбонат кальция – главная составная часть известняка, мела, мрамора. Служит для производства (негашеной, гашеной и хлорной извести).
Са
SO
4
– используют для штукатурных работ, в медицине для изготовления отливочных форм и слепков, наложения повязок при переломах.
2
CaSO
4
×
H
2
O
– алебастр (в строительстве)
Са
SO
4
×
2
H
2
O
– гипс (в строительстве)
CaCl
2
– широко применяется в медицине для внутренних инъекций.
| применяются в медицине (слабительное)
|
|
MgSO4
×
7H2
O
 MgCl2
×
6H2
O MgCl2
×
6H2
O
Раствор Ва(ОН)2
– баритовая вода – лабораторный реактив для открытия СО2
.
Ba
(
NO
3
)2
– в пиротехнике.
5. Биогенная роль элементов
II
-А группы. Применение в сельском хозяйстве
Кальций
– микроэлемент.
Кальцию принадлежит исключительно важная биогенная роль. Он необходим организмам для скелетообразования, костной ткани, зубов, сердечной и нервной деятельности.
Кальций играет большую роль в процессах фотосинтеза, образования белков, различных органических кислот. В животных организмах его присутствие необходимо для свертывания крови, осаждения казеина (сложного белка) при действии сычужного фермента. Избыток ионов кальция подавляет возбудимость мышечной ткани и нервных волокон, повышает тонус сердечной мышцы, действие нервной системы.
Радиоактивный изотоп кальция (45
Са) широко используется в биологии и медицине при изучении процессов минерального обмена в живых организмах, процессов усвоения кальция растениями.
Многие растения являются кальцефильными, например европейская лиственница, европейская пихта, пушистый дуб. Для своего развития они требуют повышенные концентрации кальция в почвах с нейтральной или слабощелочной средой.
Ион Са2+
- антагонист иона Mg2+
, Ca2+
в отличие от Mg2+
является внеклеточным катионом. При поступлении избытка солей Mg наблюдается усиленное выделение кальция из костной ткани.
Основная масса Са находится в костной и зубной тканях. Са, вводимый с пищей только на 50% всасывается в кишечнике. Плохое всасывание является следствием образования труднорастворимого Са3
(РО4
)2
. Кальций не используется внутри клетки, он выступает в качестве строительного материала в организме, в костях, зубах. Скелет – основное хранилище кальция в организме.
Нарушение нормального обмена веществ приводит к отложениям различных кальциевых солей в различных органах (образование «камней», глаукомы, артериосклеротические изменения сосудов и др.). Ионы кальция участвуют в обмене веществ, они поддерживают в норме свертываемость крови.
Ежедневная нормальная доза кальция для здорового человека составляет 1 г. Кальций содержит шпинат, молочный продукты, сыр, абрикосы.
Са – почвообразующий элемент. Почвы с высоким содержанием Са отличаются хорошей структурой и высоким плодородием. Почвы бедные Са наоборот имеют высокую кислотность.
Почвы редко нуждаются в увеличении содержания Са2+
и Mg2+
. Но карбонаты Са и Mg вносят в почвы для химической мелиорации – устранение избыточной кислотности (известкование
) и устранение избыточной щелочности (гипсование
).
ППК Н2
+
+ СаСО3
= ППК Са2+
+ Н2
О + СО2
ППК
Na2
+
+ Ca2+
+ SO4
2-
=
ППК
Са
2+
+ 2Na+
+ SO4
2-
Хорошо растворимый Na2
SO4
вымывается из почвы.
Магний
– необходимая часть молекулы хлорофилла растений, без которого не могут происходить процессы фотосинтеза и развитие растительного мира.
Магниевое микроудобрение – доломит MgCO3
×CaCO3
.
В растениях магний участвует также в превращениях фосфорных соединений, в образовании жиров, в синтезе и распаде углеводов. При недостатке магния в почвах у растений возникают заболевания – хлороз (разрушение хлорофилла, обесцвечивание хлоропласта), у животных мышечные судороги, наблюдается остановка роста конечностей. Белое вещество мозга содержит Mg больше, чем серое, спинной мозг больше, чем головной. Богаты Mg абрикосы, персики, цветная капуста, картофель, помидоры. Магний содержат орехи, мед, морские продукты, хлеб из обойной муки, фасоль, горох, овсяная и гречневая крупа.
Стронций
– концентрируется в костях, частично заменяя кальций. Радиоактивный изотоп 90
Sr вызывает лучевую болезнь. Он поражает костную ткань и в особенности костный мозг. Накопление 90
Sr в атмосфере и в организме способствует развитию лейкемии и рака костей. Применение ЭДТА для удаления 90
Sr приводит к дополнительному вымыванию Са из костей. Поэтому используют не кислоту, а Na2
CaЭДТА – комплекс.
Избыток стронция вызывает ломкость костей, стронциевый рахит и др. Причина – замена кальция костного вещества стронцием: ион стронция легко вымывается из костей и наступает их разрушение.
ЛЕКЦИЯ 3
Тема:
p
– Элементы
III
группы
1. Общая характеристика элементов
III
-
A
группы.
Известно 30 р - элементов в периодической системе, это элементы, расположенные в III-A - VIII-A группах. У р - элементов заполняется электронами р- подуровень внешнего электронного уровня.
III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома, причем у бора на предвнешнем слое атома – 2 электрона, у алюминия – 8 электронов, Ga, In, Tl – 18 электронов. III группа самая элементоемкая – содержит 37 элементов, включая лантаноиды и актиноиды. Все элементы металлы, за исключением бора.
При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р - подуровня начинается после того, как заполняется 3d10
электронная оболочка. Под действием 3d10
- электронов электронная оболочка всего атома сжимается и размер атома уменьшается (эффект в - сжатия).
Монотонного (последовательного) изменения металлических свойств не наблюдается. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия, и вновь постепенно растут при переходе к таллию. Обусловлено это тем, что атома Ga происходит сжатие электронной оболочки за счет в –электронов (эффект в – сжатия) , In, Tl (в отличие от B и Al) содержат по 18 электронов на предпоследнем слое. Поэтому нарушается линейное изменение свойств (rат, Тпл и т.п.) от Al к Ga.
Температура кипения закономерно уменьшается от B к Tl. Температура плавления незакономерно из-за особенностей строения кристаллической решетки.
Самый легкоплавкий металл – Ga (Тпл = 29,8˚С).
В невозбужденном состоянии конфигурация внешнего уровня ns2
np1
, в возбужденном состоянии - ns1
np2
.
В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения большинства этих элементов, в которых их степень окисления +1, очень неустойчивы и наиболее характерна для них степень окисления +3 в возбужденном состоянии, т.к. на перевод электрона из s-состояния в р - надо немного энергии.
| 2s
|
2p
|
| 5
B 2s2
2p1
|
¯
|
|
(+1)
|
| 5
B 2s1
2p2
|
|
|
¯
|
(+3)
|
B – неметал, Al – еще не типичный металл, Ga, In, Tl –типичные металлы. Соединения: ЭН3
, Э2
О3
, Э(ОН)3
.
 B [He] 2s2
2p1
В
2
Н
6 B [He] 2s2
2p1
В
2
Н
6
| растет восстановительная способность, устойчивость
|
|
Al
[
Ne
]3
s
2
3
p
1
(
AlH
3
)
n
Ga
[
Ar
]4
s
2
4
p
1
(
GaH
3
)
n
In
[
Kr
]5
s
2
5
p
1
(
InH
3
)
n
Tl
[
Xe
]6
s
2
6
p
1
TlH
3
Э
2
О
3
B2
O3
кислотный оксид
Al
2
O
3
амфотерный оксид
Ga
2
O
3
амфотерный оксид (с преобладанием основных свойств)
In
2
O
3
амфотерный оксид (с преобладанием основных свойств)
Tl
2
O
( Tl2
O3
) основной оксид
Э(ОН)3
| нарастают
основные
свойства
|
|
  H
3
BO
3
ортоборная кислота H
3
BO
3
ортоборная кислота Al
(
OH
)3
амфотерный гидроксид
Ga
(
OH
)3
амфотерный гидроксид
In
(
OH
)3
амфотерный гидроксид TlOH
основной гидроксид
Образуют соединения с галогенами ЭГ3
, серой Э2
S3
, азотом ЭN.
Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, способность образовывать многочисленные полимерные структуры, стеклообразование оксидов.
2. Бор. Получение. Химические свойства
Бор по своим свойствам наиболее схож с элементом IV-A группы кремнием («диагональное сходство»).
Бор – кристаллическое вещество, черного цвета, тугоплавкое при t = 2300 С.
Наиболее распространены две модификации бора: аморфный и кристаллический. Аморфная модификация наиболее реакционноспособна.
Получение бора
1. Термическое разложение гидридов бора:
B
2
H
6
 2
B
+ 3
H
2
2
B
+ 3
H
2
2. Магнийтермией из оксида бора:
B2
O3
+ 3Mg
 3MgO + 2B
3MgO + 2B
B2
O3
+ Zn
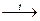 ZnO + B
ZnO + B
3. Из хлорида бора:
2
BCl
3
+ 3
Zn
 3
ZnCl
2
+ 2
B
3
ZnCl
2
+ 2
B
Непосредственно активно бор реагирует только со фтором, однако при нагревании протекает взаимодействие с кислородом, азотом, углеродом.
B + 2F2
→ BF4
4B + 3O2
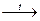 2B2
O3
2B2
O3
2B + N2
 2BN
2BN
4
B
+ 3C
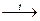 B
4
C
3 B
4
C
3
Бор реагирует с горячими концентрированными кислотами H2
SО4
и HNO3
B + H2
SO4
конц
.
→ H3
BO3
+ SO2
↑ + H2
O
B + HNO3
конц
.
→
H
3
BO
3
+
NO
2
↑ +
H
2
O
Со щелочами реагирует только в присутствии сильных окислителей:
B
+
NaOH
+
H
2
O
2
→
NaBO
2
+
H
2
O
Однако аморфный бор может реагировать со щелочами при кипячении:
B
аморфн
.
+ NaOH
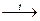 NaBO2
+ H2
↑
NaBO2
+ H2
↑
SiO2
+ B → Si + B2
O3
Галогениды
бора
BF3
BCl3
BBr3
BI3
газ газ жидкость твердый
Ecвязи
кДж 644 443 376 284
 устойчивость падает устойчивость падает
ВСl3
образуется посредством взаимодействия трех электронов атома бора в возбужденном состоянии. Образуется три связи по спин - валентному (обменному) механизму.
| Тип гибридизации бора – sp2
|
|
 
Так как в галогениде BГal3
имеется свободная орбиталь за счет атома бора, то в этом случае молекула BГal3
может быть акцептором электронной пары и участвовать в образовании связи по донорно-акцепторному механизму.
| F] -
→ [BF4
-
] атом бора (sp3
гибридизация)
|
|
  Ион имеет тетраэдрическую структуру
| BF3
+ NH3
→ BF3
· NH3
(валентность бора = 4)
|
|
 Галогениды бора имеют кислотный характер и гидролизуются:
BCl
3
+
H
2
O
→
H
3
BO
3
+
HCl
BF
4
+
HF
→
H
[
BF
4
]
(сильная кислота)
Кислотные галогениды реагируют с основными галогенидами:
В
F
3
+
NaF
=
Na
[
BF
4
]
С водородом бор непосредственно не реагирует. Гидриды бора получают не прямым взаимодействием с водородом, а косвенным путем.
Например, действием соляной кислоты на борид магния.
М
g
3
В2
+ 6
HCl
®
В2
Н6
+3М
gCl
2
Получается смесь бороводородов (боранов). Бораны известны газообразные, жидкие и твердые.
В2
Н6
– диборан – газ
В4
Н10
–
тетраборан – жидкость
В10
Н14
– твердый боран.
Они имеют неприятный запах и очень ядовиты. Большинство из них самовоспламеняются и разлагаются водой.
2В4
Н10
+ 11 О2
= 4В2
О3
+ 10 Н2
О
В2
Н6
+ 6 Н2
О = 2Н3
ВО3
+ 6Н2
В молекулах бороводородов атомы бора связаны водородными «мостиками».

Бораны – особый вид соединений, в них образуется электроннодефицитная связь. В их молекулах электронов меньше, чем необходимо для образования двухэлектронных связей. Это так называемая «банановая связь», образуется в результате перекрывания двух sp3
-гибридных орбиталей атомов бора и одной s-орбитали атома водорода. Каждый мостиковый атом водорода образует с двумя атомами бора общую двухэлектронную трехцентровую связь В – Н – В.
Соединения с дефицитом электронов являются акцепторами электронов.
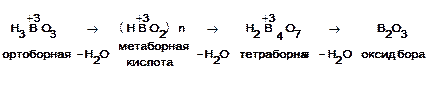
при температуре 
4НВО2
= Н2
В4
О7
+ Н2
О
Н2
В4
О7
= 2В2
О3
+ Н2
О
H
2
B
4
O
7
↔ 2
H
+
+
B
4
O
7
2-
(кислых солей не образует)
В отличие от обычных кислот ортоборная кислота не отщепляет Н+, а вызывает смещение равновесия диссоциации воды, присоединяя за счет донорно-акцепторного взаимодействия OH-, выступает в роли одноосновной.
B(OH)3
+ H2
O → B(OH)4
-
+ H+
Кд
= 5,8 ·10-10
Координационное число бора по кислороду равно 3, поэтому кислородные соединения бора образуют полимерные соединения (полибораты).
Все кислоты превращаются в ортоборную:
HBO2
+ H2
O → H3
BO3
H2
B4
O7
+ 5H2
O → 4H3
BO3
Если ортоборная наиболее устойчивая кислота, то соли ее не существуют в обычных условиях по сравнению с солями мета- и тетраборной кислот. Так при действии на раствор борной кислоты гидроксидом натрия получается не ортоборат, а тетраборат натрия (при недостатке NaOH) или метаборат (в избытке NaOH):
2
NaOH
нед
+ 4
H
3
BO
3
=
Na
2
B
4
O
7
+ 7
H
2
O
NaOH
изб
+
H
3
BO
3
=
NaBO
2
+ 2
H
2
O
При избытке щелочи образующийся тетраборат натрия превращается в метаборат натрия:
Na
2
B
4
O
7
+ 2
NaOH
изб
= 4
NaBO
2
+
H
2
O
Кислотный гидролиз тетрабората натрия приводит к образованию ортоборной кислоты:
Na2
B4
O7
+ 2HCl + 5 H2
O = 2NaCl + 4 H3
BO3
3.
Алюминий
По содержанию в земной коре занимает первое место среди металлов и третье среди всех элементов, после кислорода и кремния.
Металлические свойства его выражены сильнее, чем у бора. Химические связи алюминия с другими металлами в основном ковалентного характера. Тип кристаллической структуры - ГПУ.
В отличие от бора атом алюминия имеет свободные d-подуровни на внешнем уровне. У Al3+
небольшой радиус и довольно высокий заряд, за счет чего он является комплексообразователем с координационным числом 4 или 6. Соединения Al более устойчивы, чем бора.
Получение алюминия
В промышленности Al получают электролизом расплава Al2
O3
в криолите (Na3
AlF6
)
Al2
O3
→ Al+3
+ AlO3
-3
K (-) Al+3
+ 3e = Al0
A
(+) 2
AlO
3
-3
– 6
e
=
Al
2
O
3
+
 O
2 O
2
Ga, In, Tl – рассеянные элементы, встречаются в оксидных и сульфидных рудах. В этом случае соответствующие соединения концентрируют и действуют восстановителями.
Э2
O
3
+ 3
H
2
→ 2Э + 3
H
2
O
Э2
O
3
+
CO
→ 2Э +
CO
2
Химические свойства алюминия
1. Не взаимодействует с Н2
.
2. Как активный металл реагирует почти со всеми неметаллами без нагревания, если снять оксидную пленку.
4Al + 3O2
→ 2Al2
O3
2Al + 3Cl2
→ 2AlCl3
Al + P → AlP
3. Реагирует с Н2
О:
Алюминий – активный металл с большим сродством к кислороду. На воздухе покрывается защитной пленкой оксида. Если пленку уничтожить, то алюминий активно взаимодействует с водой.
2Al + 6H2
O  = 2Al(OH)3
+ 3H2
= 2Al(OH)3
+ 3H2

4. С разбавленными кислотами:
2
Al
+ 6
HCl
→ 2
AlCl
3
+ 3
H
2
2Al + 3H2
SO4
→ Al2
(SO4
)3
+ 3H2
С концентрированными HNO3
и H2
SO4
при обычных условиях не реагирует, а только при нагревании.
5. Со щелочами:
2
Al
+ 2
NaOH
 2
NaAlO
2
+ 3
H
2
2
NaAlO
2
+ 3
H
2
С водными растворами щелочей алюминий образует комплексы:
2Al + 2NaOH + 10 H2
O = 2Na+
[Al(OH)4
(H2
O)2
]-
+ 3H2
↑
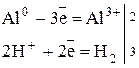
или
Na[Al(OH)4
],
Na
3
[
Al
(
OH
)6
],
Na
2
[
Al
(
OH
)5
]
– гидроксоалюминаты. Продукт зависит от концентрации щелочи.
4
Al
+ 3
O
2
→ 2
Al
2
O
3
Al2
O3
(глинозем) встречается в природе в виде минерала корунда (по твердости близок к алмазу). Драгоценные камни рубин и сапфир – тоже Al2
O3
, окрашенный примесями железа, хрома
Оксид алюминия
– амфотерен. При сплавлении его со щелочами получаются соли метаалюминиевой кислоты HAlO2
. Например:
 .
.
Также взаимодействует с кислотами
 . .
Белый студенистый осадок гидроксида алюминия
растворяется как в кислотах
Al(OH)3
+ 3HCl = AlCl3
+ 3 H2
O,
так и в избытке растворов щелочей, проявляет амфотерность
Al(OH)3
+ NaOH + 2H2
O = Na[Al(OH)4
(H2
O)2
]
При сплавлении со щелочами гидроксид алюминия образует соли метаалюминиевой или ортоалюминиевой кислот

 .
.
А
l(OH)3
 Al2
O3
+ H2
O
Al2
O3
+ H2
O
Соли алюминия сильно гидролизуются. Соли алюминия и слабых кислот превращаются в основные соли или подвергаются полному гидролизу:
AlCl
3
+
HOH
↔
AlOHCl
2
+
HCl
Al
+3
+
HOH
↔
AlOH
+2
+
H
+
pH>7 протекает по I ступени, но при нагревании может протекать и по II ступени.
AlOHCl
2
+
HOH
↔
Al
(
OH
)2
Cl
+
HCl
AlOH
+2
+
HOH
↔
Al
(
OH
)2
+
+
H
+
При кипячении может протекать и III ступень
Al(OH)2
Cl + HOH ↔ Al(OH)3
+ HCl
Al(OH)2
+
+ HOH ↔ Al(OH)3
+ H+

 . .
Соли алюминия хорошо растворимы.
AlCl3
– хлорид алюминия является катализатором при переработке нефти и различных органических синтезах.
Al2
(SO4
)3
×18H2
O – сульфат алюминия применяется для очистки воды от коллоидных частиц, захватываемых Al(OH)3
образовавшихся при гидролизе и снижении жесткости
Al2
(SO4
)3
+ Ca(HCO3
)2
= Al(OH)3
+ CO2
↑ + CaSO4
↓
В кожевенной промышленности служит протравой при крошении хлопчатобумажных тканей – KAl(SO4
)2
×12H2
O –сульфат калия-алюминия (алюмокалиевые квасцы).
Основное применение алюминия – производство сплавов на его основе. Дюралюмин – сплав алюминия, меди, магния и марганца.
Силумин – алюминий и кремний.
Основное их достоинство – малая плотность, удовлетворительная стойкость против атмосферной коррозии. Из алюминиевых сплавов изготавливают корпуса искусственных спутников Земли и космических кораблей.
Используется алюминий как восстановитель при выплавке металлов (алюминотермия)
Cr2
O3
+ 2 Al t
= 2Cr + Al2
O3
.
Также применяют для термитной сварки металлических изделий (смесь алюминия и оксида железа Fe3
O4
) называемая термитом дает температуру около 3000°С.
При движении от Ga к Tl кислотные свойства оксидов ослабевают, а основные усиливаются. В связи с этим Тl2
O3
не взаимодействует со щелочами. Устойчивость оксидов сверху вниз падает. Тl2
O3
при небольшом нагревании разлагается. Тl2
O растворяется в H2
O.
Т
l
2
O
+
H
2
O
→ 2
TlOH
TlOH – щелочь
По размерам ион Тl+1
близок к иону К+
, отсюда близость свойств этих соединений. Получают их из оксидов восстановлением H2
(CO). У Ga как и у алюминия амфотерные свойства.
Ga + NaOH + H2
O → Na[Ga(OH)4
] + H2
Могут реагировать с галогенами:
Tl
+
Cl
2
→
TlCl
Tl + Cl2
→ TlCl3
Ga + Cl2
→ GaCl3
Соединения Ga, In, Tl – ядовиты.
4. Биогенная роль элементов
III
A
группы
Все элементы III-А группы относятся к примесным микроэлементам. Массовая доля их в организме человека приблизительно 10-5
%. Биологическое действие их недостаточно изучено. Бор концентрируется в легких (0,34 мг), щитовидной железе (0,3 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце. Имеются данные, что бор снижает активность адреналина.
Алюминий концентрируется в сыворотке крови, легких, печени, почках, костях, ногтях, волосах. Al +3
замещает Са+2
, Mg+2
. (У них одинаковые координационные числа, равные 6, радиус атома и энергия ионизации). Избыток Al в организме тормозит синтез гемоглобина.
Tl – весьма токсичный элемент, так как подавляет активность ферментов, содержащих тиогруппы -SH, наблюдается выпадение волос. Ионы Тl+
и К+
являются синергистами (совместно действующий в одном направлении).
Борная кислота применяется в медицине как дезинфицирующее средство, Бура Na
2
B
4
O
7
×
10
H
2
O
применяется при спаивании металлов. Бура в расплавленном состоянии растворяет оксиды металлов, при соприкосновении наколенного паяльника с бурой, оксиды металлов растворяются в ней (поверхность очищается) и припой хорошо пристает к поверхности металла.
Бор – микроэлемент, оказывает специфическое влияние на углеводный обмен в растениях, необходим для нормального роста и деления клеток, образования семян.
Болотные и подзолистые почвы бедны бором. При борном голодании растения не образуют семян или их мало. Внесение борных удобрений повышает урожай сахарной свеклы, бобовых и овощных культур, менее реагируют на борные удобрения злаковые культуры.
Подкормку ведут через почву или опрыскиванием (внекорневая подкормка), эффективна предпосевная подкормка семян водными растворами борной кислоты. Применяют: бораты магния, бородатолитовое удобрение, боросуперфосфат, бородвойной суперфосфат, термические бораты.
Н3
ВО3
– антисептическое средство, высокая растворимость борной кислоты в липидах обеспечивает быстрое проникновение ее в клетки через липидные мембраны. В результате происходит свертывание белков (денатурация) цитоплазмы микроорганизмов и их гибель. Как антисептик применяют буру Na2
В4
О7
×10Н2
О. Фармакологическое действие препарата обусловлено гидролизом соли с выделением Н3
ВО3
.
К
Al
(
SO
4
)2
×
12
H
2
O
– алюмокалиевые квасцы. К
Al
(
SO
4
)2
– жженые квасцы применяют для полосканий, промываний и примочек при воспалительных процессах слизистых оболочек и кожи, применяют как кровоостанавливающее средство при порезах.
Жженые квасцы – в виде присыпок как вяжущее и высушивающее средство при потливости ног. Осушающее действие связано с тем, что жженые квасцы медленно поглощают воду.
Al – почвообразующий элемент. Наибольшее его количество стимулирует прорастание семян; избыток – снижает интенсивность фотосинтеза, нарушает фосфорный обмен, задерживает рост корневой системы.
Присутствие Al+3
в почве обуславливает вредную для растений обменную кислотность почвенного раствора. Ионы Al+3
поглощаются почвенными коллоидами, но под действием солей (KCl) вытесняются из почвы

Полученная соль AlCl3
гидролизуется по уравнению
Al
3+
+
HOH
↔
AlOH
2+
+
H
+
,
и в результате гидролиза повышается концентрация ионов Н+
(понижается pH).
ЛЕКЦИЯ 4
Тема: р - Элементы
IV
группы
1. Общая характеристика группы
В IV-A группе находятся р - элементы C, Si, Ge, Sn, Pb. Конфигурация атома в невозбужденном состоянии ns2
nр2
, в возбужденном состоянии ns1
nр3
, все 4 электрона неспаренные.
| 2s
|
2p
|
| С 2s2
2p2
|
¯
|
|
|
(+2)
|
| С* 2s1
2p3
|
|
|
|
|
( -4, +4)
|
Радиусы атомов закономерно растут с увеличением порядкового номера, ионизационный потенциал соответственно уменьшается.
В большинстве неорганических соединений углерод и кремний проявляют степень окисления +4. Но от германия к свинцу прочность соединений со степенью окисления +4 уменьшается, более стабильна низкая степень окисления +2. Могут проявлять степени окисления - 4 в гидридах.
Углерод стоит в середине 2-го периода, он одинаково может притягивать и отдавать электроны, промежуточное значение электроотрицательности приводит к тому, что углерод образует ковалентные связи со всеми реакционноспособными элементами периодической системы, стоящими от него слева (в том числе Н), справа (О, N, галогены) и снизу (Si,Ge, Sn, Pb).
Li Be B C N O F
ОЭО
1 1,5 2 2,5 3 3,5 4
Невозможность донорно - акцепторного взаимодействия в возбужденном состоянии обусловливает примерно одинаковую прочность одинарных связей с водородом. Четырехвалентность углерода предоставляет широкие возможности для разветвлений цепей углеродных атомов и образования циклических структур.
C
- типичный неметалл
Si
- типичный неметалл
Ge
- есть металлические свойства
Sn
- металлические свойства преобладают над неметаллическими
Pb
- металлические свойства преобладают над неметаллическими
| Увеличение восстано-вительных свойств, уменьшение устойчивости молекул
|
|
 
| Увеличение основных свойств и устойчивости молекул.
Нерастворимы в воде
|
|
    
 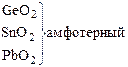
| уменьшение устойчивости молекул
|
|
 Кремний по распространенности в земной коре занимает второе место (после кислорода). Если углерод – основа жизни, то кремний – основа земной коры. Он встречается в громадном многообразии силикатов и алюмосиликатов, песка. Германий, олово, свинец достаточно редкие элементы. Аморфный уголь (сажа) черного цвета, аморфный кремний – порошок бурого цвета. Кристаллический кремний – полупроводник. Важные сорта аморфного угля – кокс, древесный уголь. Германий как и кремний, полупроводник, имеет алмазоподобную решетку, по внешнему виду типичный металл серебристо-белого цвета. Олово имеет модификации белое (b-модификация устойчива выше 286 К серебристо-белый металл, серая - a-модификация (серое олово) имеет алмазоподобную решетку. Свинец – темно-серый металл.
2. Химия углерода
Углерод встречается в природе в свободном виде и в соединениях. Его аллотропные видоизменения – алмаз, графит, карбин, фуллерен.
Алмаз – самое твердое вещество в природе. Твердость по шкале Маоса -10, тем не менее он хрупок. Ограненный алмаз имеет более 20 граней и называется бриллиантом, используется в ювелирной промышленности. Масса бриллианта измеряется в каратах (1 карат = 0,2 г). Существенные различия в свойствах алмаза и графита обусловлены особенностями строения их кристаллов.
1. Кристаллическая решетка алмаза
атомная. Каждый атом углерода расположен в центре тетраэдра, четыре вершины которого заняты другими атомами углерода. Все атомы находятся на одинаковых расстояниях друг от друга. Кристалл алмаза (диэлектрик) – имеет плотную упаковку с высокой компактностью и твердостью. Атомы углерода в sp
3
-гибридизации.
2. В кристаллах графита
атомы углерода расположены в углах правильных шестиугольников, находящихся в параллельных плоскостях. Под внешним воздействием такой кристалл легко расслаивается на чешуйки. Графит в отличие от алмаза очень мягок.
Атомы углерода в графите в sp
2
-гибридизации.

3. Карбин
– твердое кристаллическое вещество.

Это линейный полимер углерода, в котором чередуются одинарные и тройные связи.
Атомы углерода в карбине в sp
-гибридизации
.
 a- карбин (полиин) a- карбин (полиин)
 = b- карбин (поликумулен) = b- карбин (поликумулен)
Карбин – наиболее стабильная форма углерода, a- карбин обладает полупроводниковыми свойствами.
4. Фуллерен
– четвертая аллотропная модификация углерода. Его молекулы имеют четное число атомов углерода и имеют состав С60
, С70
, С80
и т.д. Молекула С60
имеет вид футбольного мяча, построенного из пяти- и шестигранных углеродных циклов с общими ребрами.
Водородные соединения углерода – углеводороды являются объектом изучения в органической химии.
К неорганическим соединениям углерода относятся СО
и СО2
.
С + О2
®
СО2
С + О2
®
СО
С + Н2
®
СН4
С +
S
2
®
CS
2
(сероуглерод)
С +
F
2
®
С
F
4
Из галогенидов СГаl самое большое значение имеет СCl4
– бесцветная, достаточно токсичная жидкость. В обычных условиях СCl4
химически инертен. Применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров и для получения фреона CF2
Cl2
.

CF4
–
газ
; CCl4
–
жидкий
; CBr4
–
твердый
.
С
+ H2
SO4
конц
®
СО
2
+ SO2
+ H2
O
С
+ HNO3
конц
®
СО
2
+ NO2
+ H2
O
Химическая связь в молекуле СО.
Распределение электронов в возбужденном атоме углерода и в кислороде таково, что между ними возможно образование двух химических связей – в атоме кислорода имеются 2 неспаренных электрона. Однако при переходе одного электрона от кислорода к углероду в образовавшихся ионах С-
и О+
будет по 3 неспаренных электрона, аналогично электронной конфигурации азота. При соединении этих ионов образуется тройная связь, аналогичная молекуле N2
, поэтому свойства СО и N2
очень близки.
СО
С 2s2
2p2
С +1е = С-
О 2s2
2p4
О -1е = О+
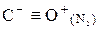
Возможно иное объяснение образования тройной связи в молекуле СО.
| С 2s2
2p2
|
¯
|
¯
|
¯
|
| О 2s2
2p4
|
¯
|
¯
|
|
|
Невозбужденный атом углерода имеет 2 неспаренных электрона, которые могут образовать 2 общие электронные пары с 2-мя неспаренными электронами атома кислорода (по обменному механизму). Однако имеющиеся в атоме кислорода 2 спаренные р -электрона могут образовывать тройную химическую связь, поскольку в атоме углерода имеется одна незаполненная ячейка, которая может принять эту пару электронов.
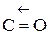 Тройная связь образуется по донорно-акцепторному механизму, направление стрелки от донора кислорода к акцептору – углероду. Тройная связь образуется по донорно-акцепторному механизму, направление стрелки от донора кислорода к акцептору – углероду.
Подобно N2
- СО обладает высокой энергией диссоциации (1069 кДж), плохо растворим в воде, инертен в химическом отношении. СО – газ без цвета и запаха, безразличный несолеобразующий, не взаимодействует с кислотными щелочами и водой при обычных условиях. Ядовит, т.к. взаимодействует с железом, входящим в состав гемоглобина. При повышении температуры или облучении проявляет свойства восстановителя.
Получение:
в промышленности


в лаборатории:
 ; ;
 . .
В реакции СО вступает лишь при высоких температурах.
Молекула СО имеет большое сродство к кислороду, горит образуя СО2
:
СО + 1/2О2
= СО2
+ 282 кДж/моль.
Из-за большого сродства к кислороду СО используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.).
С
O
+
Cl
2
=
COCl
2
(фосген)
 
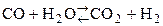

Наибольший интерес представляют карбонилы металлов (используются для получения чистых металлов). Химическая связь по донорно-акцепторному механизму, имеет место p-перекрывание по дативному механихму.
 (пентакарбонил железа) (пентакарбонил железа)
Все карбонилы – диамагнитные вещества, характеризуются невысокой прочностью, при нагревании карбонилы разлагаются
[Ni(CO)4
] → 4CO + Ni (карбонил никеля).
Как и СО карбонилы металлов – токсичны.
Химическая связь в молекуле СО2
В молекуле СО2
sp
-
гибридизация атома углерода. Две sp-гибридные орбитали образуют 2 s-связи с атомами кислорода, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями атомов кислорода p-связи, которые располагаются в плоскостях перпендикулярных друг другу.
О ═ С ═ О
Под давлением 60 атм. и комнатной температуре СО2
сгущается в бесцветную жидкость. При сильном охлаждении жидкая СО2
застывает в белую снегоподобную массу, возгоняющуюся при Р = 1 атм и t = 195К(-78°). Спрессованная твердая масса называется сухим льдом, СО2
не поддерживает горения. В нем горят лишь вещества, у которых сродство к кислороду выше чем у углерода: например,
2
Mg
+
CO
2
®
2
MgO
+
C
.
СО2
реагирует с
NH
3
:


(
карбамид
мочевина
)
2
СО
2
+ 2Na2
O2
®
2Na2
CO3
+O2
Мочевина разлагается водой:
CO
(
NH
2
)2
+ 2
H
2
O
®
(
NH
4
)2
CO
3
→ 2NH3
+
СО
2
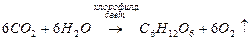 фотосинтез
фотосинтез

 . .
СО
2
получают в технике:
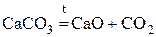
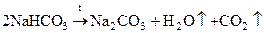
из кокса 
В лаборатории (в аппарате Киппа):
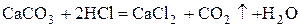 . . 
Угольная кислота и ее соли
Растворяясь в воде, углекислый газ частично взаимодействует с ней, образуя угольную кислоту H2
CO3
; при этом устанавливаются равновесия:

К1
= 4×10-7
К2
= 4,8×10-11
– слабая, неустойчивая, кислородсодержащая, двухосновная кислота. Гидрокарбонаты растворимы в Н2
О. Карбонаты нерастворимы в воде, кроме карбонатов щелочных металлов, Li2
CO3
и (NH4
)2
CO3
. Кислые соли угольной кислоты получают, пропуская избыток СО2
в водный раствор карбоната:
 , ,
либо постепенным (по каплям) добавлением сильной кислоты в избыток водного раствора карбоната:
Na2
CO3
+ HNO3
®
NaHCO3
+ NaNO3
При взаимодействии со щелочами или нагревании (прокаливании) кислые соли переходят в средние:


Соли гидролизуются по уравнению:
 I ступень I ступень
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Gr3+
, Al3+
, Ti4+
, Zr4+
и др.
Практическое значение имеют соли - Na2
CO3
(сода), CaCO3
(мел, мрамор, известняк), K2
CO3
(поташ), NaHCO3
(питьевая сода), Са(НСО3
)2
и Mg(HCO3
)2
обусловливают карбонатную жесткость воды.
Сероуглерод (
CS
2
)
При нагревании (750-1000°С) углерод реагирует с серой, образуя сероуглерод,
органический растворитель (бесцветная летучая жидкость, реакционноспособное вещество), огнеопасен и летуч.

Пары CS2
– ядовиты, применяется для фумигации (окуривания) зернохранилищ против насекомых - вредителей, в ветеринарии служит для лечения аскаридоза лошадей. В технике – растворитель смол, жиров, йода.


С сульфидами металлов CS2
образует соли тиоугольной кислоты – тиокарбонаты.
 . .
Эта реакция аналогична процессу
 . .
Тиокарбонаты
– желтые кристаллические вещества. При действии на них кислот выделяется свободная тиоугольная кислота.
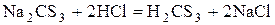
Она более стабильна чем Н2
СО3
и при низкой температуре выделяется из раствора в виде желтой маслянистой жидкости, легко разлагающейся на:

Соединения углерода с азотом (СN)2
или С2
N2
– дициан,
легко воспламеняющийся бесцветный газ. Чистый сухой дициан получают путем нагревания сулемы с цианидом ртути (II).
HgCl2
+ Hg(CN)2
®
Hg2
Cl2
+ (
С
N)2
Другие способы получения:
4HCN
г
+
О
2
 2(CN)2
+2H2
O
2(CN)2
+2H2
O
2HCN
г
+
С
l2 (CN)2
+ 2HCl
(CN)2
+ 2HCl

Дициан по свойствам похож на галогены в молекулярной форме X2
. Так в щелочной среде он, подобно галогенам, диспропорционирует:
(
С
N)2
+ 2NaOH = NaCN + NaOCN
Циановодород
- НСN ( ), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают: ), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают:

Циановодород получают в промышленности по каталитическим реакциям.

 . .
Соли синильной кислоты – цианиды, подвержены сильному гидролизу. CN-
- ион изоэлектронный молекуле СО, входит как лиганд в большое число комплексов d-элементов.
Обращение с цианидами требует строгого соблюдения мер предосторожности. В сельском хозяйстве применяют для борьбы с особо опасными насекомыми – вредителями.
Цианиды получают:
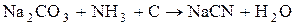 . .
 . .
Соединения углерода с отрицательной степенью окисления
:
1) ковалентные (SiC карборунд)  ; ;
2) ионноковалентные;
3) металлические карбиды.
Ионноковалентные разлагаются водой с выделением газа, в зависимости от того какой выделяется газ, их делят на:
метаниды
(выделяется СН4
)
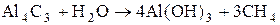

ацетилениды
(выделяется С2
Н2
)

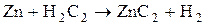

Металлические карбиды – соединения стехиометрического состава образованные элементами 4, 7,8 групп посредством внедрения атомов Ме в кристаллическую решетку углерода.
3. Химия кремния
Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O - Si, Si - F более прочны, чем у углерода.
Для кремния известны оксиды состава SiO и SiO2
.Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO2
.
2SiO +
О
2
t
®
2SiO2
SiO
2
– кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок.
Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO4
4-
которые через атом кислорода соединены друг с другом.
  
Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы.
Важные природные силикаты 3MgO×H2
O×4SiO2
тальк, 3MgO×2H2
O×2SiO2
асбест.
Как и для SiO2
для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na12
[(Si,Al)O4
]12
.
Наиболее прочный галогенид SiF4
разлагается только под действием электрического разряда.
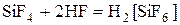 гексафторокремниевая кислота (по силе близка к H2
SO4
). гексафторокремниевая кислота (по силе близка к H2
SO4
).
(SiS2
)n
– полимерное вещество, разлагается водой:

Кремниевые кислоты.
Соответствующие SiO2
кремниевые кислоты не имеют определенного состава, обычно их записывают в виде xH2
O • ySiO2
– полимерные соединения
Известны:
H2
SiO3
(H2
O×SiO2
) – метакремниевая (не существует реально)
H4
SiO4
(2H2
O×SiO2
) – ортокремниевая (простейшая реально существующая только в растворе)
H2
Si2
O5
(H2
O×2SiO2
) – диметакремниевая.
Кремниевые кислоты – плохо растворимые вещества, для H4
SiO4
характерно коллоидное состояние, как кислота слабее угольной (Si менее металличен, чем С).
В водных растворах идет конденсация ортокремневой кислоты, в результате образуются поликремниевые кислоты.

Силикаты – соли кремневых кислот, в воде нерастворимы, кроме силикатов щелочных металлов.
Растворимые силикаты гидролизуются по уравнению
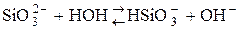
Желеобразные растворы натриевых солей поликремневых кислот называются «жидким стеклом». Широко применяются как силикатный клей и в качестве консерванта древесины.
Сплавлением Na2
CO3
, CaCO3
и SiO2
получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот.
 Силикат записан как смешанный оксид. Силикат записан как смешанный оксид.
Силикаты больше всего используются в строительстве. 1 место в мире по выпуску силикатной продукции – цемент, 2-е – кирпич, 3 – стекло.
Строительная керамика – облицовочная плитка, керамические трубы. Для изготовления санитарно-технических изделий – стекло, фарфор, фаянс, глиняная керамика.
4. Химия германия, олова, свинца (
Ge
,
Sn
,
Pb
)
GeO, SnO – сильные восстановители. Все оксиды и гидроксиды (II) амфотерны, реагируют как с кислотами, так и основаниями.
Диоксиды Ge, Sn получают синтезом из простых веществ. Диоксид свинца в 2 стадии получают. У свинца 2 простых оксида PbO и PbO2
. Рb2
О3
– смешанный оксид или РbРbО3
– метаплюмбат свинца (II). Рb3
О4
(2 PbO • PbO2
- сурик).
Диоксиды не образуют с водой кислот. Со щелочами дают гидроксокомплексы
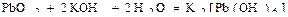 (гексагидроксоплюмбат (IV)). (гексагидроксоплюмбат (IV)).
PbO2
– сильный окислитель.
Pb + О2
® Pb3
О4
– – красный краситель, свинцовый сурик можно рассматривать как соль Pb2
2+
(PbO4
) (ортоплюмбат свинца II).
Pb3
O4
+ HNO3
® PbO2
+ Pb(NO3
)2
+ H2
O.
Sn + HCIконц
 Sn+2
CI2
+ H2
Sn+2
CI2
+ H2
Sn + H2
SOконц
 Sn+4
(SO4
)2
+ SO2
Sn+4
(SO4
)2
+ SO2
 +
H2
O
+
H2
O
Sn + HNO3
разб Sn (NO3
)2
+ NH4
NO3
+ H2
O
Sn (NO3
)2
+ NH4
NO3
+ H2
O
Sn + HNO3
конц H2
Sn+2
O3
+ NO2
+ H2
O
H2
Sn+2
O3
+ NO2
+ H2
O
β
-
оловянная
t
Sn + NaOH конц
 Na2
Sn+2
O2
+ H2
O
Na2
Sn+2
O2
+ H2
O
станнит (соль оловяннистой кислоты
H
2
SnO
2
)
В водных растворах станниты дают гидроксостанниты.
Na2
Sn+2
O2
+ 2H2
O  Na2
[Sn+2
(OH)4
]; Na2
[Sn+2
(OH)3
]
Na2
[Sn+2
(OH)4
]; Na2
[Sn+2
(OH)3
]
Sn(OH)2
++ HCI  SnCI2
+ H2
O
SnCI2
+ H2
O
амфонит
Sn(OH)2
+ 2NaOH  Na2
[Sn(OH)4
]
Na2
[Sn(OH)4
]
тетрагидроксостаннит
SnO2
кислотные свойства
Sn(OH)4
амфотерный, с преобладанием кислотных, H2
SnO3
– оловянная кислота (α и β), растворяется в кислотах и щелочах.
H2
SnO3
+ 2NaOH + H2
O  Na2
[Sn(OH)6
] Na2
[Sn(OH)6
]
H2
SnO3
+ 4HCI  SnCI4
+ 3H2
O SnCI4
+ 3H2
O
SnCI4
+ 3H2
O  H2
SnO3
+ 4HCI H2
SnO3
+ 4HCI дымообразователь, дымит во влажном воздухе. дымообразователь, дымит во влажном воздухе. 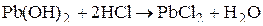

Ge(OH)2
® Sn(OH)2
® Pb(OH)2
усиление основных свойств

Ge(OH)4
® Sn(OH)4
® Pb(OH)4
усиление основных свойств

2PbCO3
×Pb(OH)2
– белая краска – свинцовые белила.
Pb(CH3
COO)4
– тетраэтилсвинец – летучая ядовитая жидкость, добавляется к бензину для повышения его качеств как моторного топлива.
5. Биогенная роль
Значение углерода в природе и сельском хозяйстве
Среди биомолекул клетки важнейшими является 4 класса веществ: 1) белки, 2) нуклеиновые кислоты; 3) углеводы; 4) липиды. В природе главное горючее – ископаемые угли (антрациты, каменные и бурые угли). Главное транспортное горючее – нефть. Горючий природный газ, содержит 80-99% СН4
– экологически чистое бытовое и промышленное топливо.
Основная форма углерода в гидросфере – это растворенный в воде СО2
и НСО3
-
. Она является буферной системой, поддерживающей содержание СО2
в атмосфере на постоянном уровне. В атмосфере – углерод в виде СО2
, его содержание меньше чем в гидросфере. Атмосфера и гидросфера интенсивно обмениваются СО2
.
Наземные растения и фитопланктон ассимилируют СО2
атмосферы и НСО3
-
гидросферы, превращая их в биомассу. Одним из основных источников поступления СО2
в атмосферу служит дыхание растений и фитопланктона.
Углерод инертный элемент. Поэтому служит основой для конструкционных материалов.
Кремний
– микроэлемент, в котором растения не испытывают недостатка. Главный минерал – кварц, содержание его превышает 60% массы почвы и достигает 90% в песчаных почвах.
Алюмосиликаты – полевые шпаты и слюды, за счет обменных реакций в почвенных растворах образуются вторичные алюмосиликаты, группа глинистых минералов, возникающих в процессе выветривания. Они обладают набухаемостью, пластичностью, способностью к ионному обмену. Освобождаются ионы K+
, Na+
, Mg2+
, Ca2+
, Fe2+
, Fe3+
и создаются благоприятные химические условия корневого питания растений.
В стеблях растений присутствие Si увеличивает их прочность и уменьшает полегаемость. Внесение в почву силиката Na повышает усвоение фосфатов.
ЛЕКЦИЯ 5
Тема: р - Элементы
V
группы
1.
Общая характеристика элементов
V
-А группы
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены
. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация п
s
2
п
p
3
).
В соединениях элементы проявляют степень окисления от -3 до 5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.

При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.
Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.
Закономерно нарастает от N к Bi ионный радиус, но он много меньше атомного. Это связано с тем, что внешние электроны находятся на значительном расстоянии от ядра по сравнению с предвнешними, и когда атом теряет внешние электроны, переходит в ион, радиус иона соответственно ниже радиуса атома. Плотность закономерно нарастает.
Незакономерность изменения свойств (Tпл
и Ткип
) обусловлена особенностью строения кристаллической решетки. Если азот – это газ, то последний элемент группы находится в твердом агрегатном состоянии.
В кристаллической решетке молекулы белого фосфора связаны межмолекулярными силами (силы Ван дер Ваальса), а так как они очень слабы, то белый фосфор легко распадается на молекулы под влиянием различных воздействий (температуры, растворителя). По этой причине он легко плавится при 44°С в бесцветную жидкость, при 275°С кипит.
Для элементов, не проявляющих металлических свойств стандартные электронные потенциалы отсутствуют.
Электронное строение внешних энергетических уровней атомов азота и фосфора следующие:

У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.
У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.
Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3
, в которых степень их окисления -3.
NH
3
аммиак
PH
3
фосфин
AsH
3
арсин
SbH
3
стибин
BiH
3
висмутин
AsH3
, SbH3
газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.
Все элементы VА группы имеют оксиды типа Э2
О5
и гидроксиды НЭО3
или Н3
ЭО4
, которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2
О3
и соответствующие гидроксиды НЭО2
или Н3
ЭО3
, у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3
(тригалиды), которые (за исключением NF3
) гидролизуются по схеме:
ЭГ3
+ 3Н2
О = Н3
ЭО3
+ 3НГ
Э
Cl
3
+
H
2
O
=
H
3
ЭО3
+ 3Н
Cl
но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, например
SbCl
3
+
H
2
O
=
SbOCl
+ 2
HCl
Группу SbO+
называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5
, а для фосфора и сурьмы пентахлориды ЭCl5
.
Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком.
Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+
( AsH3
- арсин).
2.
Химия азота
Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015
т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами.
В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ.
Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2
распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами.
Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6
Li
+
N
2
= 2
Li
3
N
С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере):
N
2
+
O
2
= 2
NO
С водородом реакция идет при нагревании (t ≈ 450-5000
С), под давлением и в присутствии катализатора
N
2
+ 3
H
2
= 2
NH
3
Пропуская азот через раскаленный кокс можно получить (дициан) – соединение азота с углеродом N ≡ C — C ≡ N. С другими неметаллами кроме бора свободный азот не реагирует.
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N
2
= 2
N
∆
H
0
= 946 кДж/моль
Строение молекулы N2

Получение
N
2
В промышленности – сжижением воздуха с выделением фракций азота.
В лаборатории разложением нитрита аммония или азида натрия
NH4
NO2
= N2
+ 2 H2
O
2 NaN3
= 3 N2
+ 2 Na
или 2
NH
3
+ 3
Br
=
N
2
+ 6
HBr
Водородные соединения азота
С водородом азот образует два соединения: аммиак
NH
3
и гидразин
N
2
H
4
(H2
N – NH2
). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH
4
Cl
+
NaOH
=
NaCl
+
NH
3
+
H
2
O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N
2
+ 3
H
2
↔ 2
NH
3
∆ Н0
= - 82,4
( Катализатор
Pt
;
t
= 450 - 5000
С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3
– бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3
поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.

Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония
NH
4
+
.

NH3
очень хорошо растворим в воде, но максимальная концентрация ω(NH3
)= 25%. В растворе имеют место равновесия:
NH3
+ H2
O ↔ NH3
• H2
O NH3
• H2
O ↔ NH4
OH
NH4
OH ↔ NH4
+
+ OH–
K
д
NH4OH
= 1,8 • 10- 5
Основная масса NH3
в растворе находится в виде гидрата аммиака NH3
· H2
O. Поэтому, хотя NH4
OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3
имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
4
NH
3
+ 3
O
2
= 2
N
2
+ 6
H
2
O
,
а в присутствии катализатора платины
4
NH
3
+ 5
O
2
= 4
NO
+ 6
H
2
O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4
+
.
NH3
+ HCl = NH4
Cl
NH3
+ H2
SO4
= (NH4
)2
SO4
В этих реакциях ион аммония подобен ионам одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов водорода получаются нитриды
, содержащую группу N-3
, 2-х атомов водорода – имиды
NН-2
, одного атома водорода - амиды
NН2
-
.
2 NH3
+ 6Na = 2Na3
N +3H2
нитрид
натрия
NH3
+2Na = Na2
HN + H2
имид
натрия
2 NH3
+2Na = 2NaH2
N + 3H2
амид
натрия
NH3
всегда - восстановитель, окисляется до N2
или NO.
t
CuO
+
NH
3
→
Cu
+
N
2
+
H
2
O
На этом свойстве основано применение NH3
и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4
Cl = Cu +N2
+HCl + H2
O
CuO
+
NH
4
Cl
=
Cu
+
CuCl
2
+
H
2
O
Реагирует с более сильными окислителями
NH3
+ KMnO4
+ H2
SO4
→ N2
+ MnSO4
+ K2
SO4
+ H2
O
Аммиак участвует в реакциях комплексообразования, где NH3
является лигандом – донором электронов.
CuSO4
+ 4NH3
= [Cu(NH3
)4
]SO4
Кн
= 10-13
Hg(NO2
)2
+ 4NH3
= [Hg(NH3
)4
](NO3
)2
Кн
=
10-20
Водные растворы NH3
используют для получения гидроксидов металлов.
Fe
2
(
SO
4
)3
+
NH
3
+
H
2
O
=
Fe
(
OH
)3
↓ + (
NH
4
)2
SO
4
Соли аммония все растворимы в воде, разлагаются при температуре различным образом
(NH4
)2
Cr2
O7
= Cr2
O3
+ N2
+ 4H2
O
NH4
NO2
= N2
+ 2H2
O
NH4
NO3
= NO + 2H2
O
NH4
Cl = NH3
+ HCl
Гидразин и гидроксиламин
Строение молекулы и характерные реакции: присоединения, окислительно-восстановительные. Соли гидразиния и гидроксиламмония.
Молекула гидразина N
2
H
4
достаточно устойчива, несмотря на эндотермичность ∆Н0
= 50,2 кДж/моль. Гидразин – жидкость.

При растворении в воде образует гидраты N2
H4
· H2
O и N2
H4
· 2H2
O
Соли гидразония – N2
H4
· HCl (N2
H5
Cl) ; N2
H4
· H2
SO4
(N2
H6
SO4
)
При взаимодействии с О2
выделяется большое количество тепла
N2
H4
+ O2
= N2
+ 2H2
O ∆H0
= – 621,5
кДж
/
моль
N2
H4
и его производные – сильные восстановители
N
2
H
4
+ 2
I
2
=
N
2
+ 4
HI
при действии сильных восстановителей может быть окислителем, при нагревании диспропорционирует, проявляет окислительно – восстановительную двойственность.
N2
H4
+ Zn + 4HCl = ZnCl2
+ 2NH4
Cl
3N2
H4
= N2
+ 4NH3
Для N2
H4
характерны реакции присоединения за счет донорно-акцепторного взаимодействия – входит во многие комплексные соединения в качестве лигандов, реагирует с H2
O, с кислотами, образуя соли аммония и гидразиния.
N2
H4
+ H2
O = N2
H5
+
+ OH–
N2
H4
+ HCl = [N2
H5
]Cl
N2
H4
+ 2HCl = [N2
H6
]Cl2
N2
H4
+ H2
SO4
= [N2
H6
]SO4
ZnCl
2
+ 2
N
2
H
4
= [
Zn
(
N
2
H
4
)2
]
Cl
2
Гидразин более сильный восстановитель, чем NH3
и окисляется чаще всего до N2
.
5N2
H4
+ 4KMnO4
+ 6H2
SO4
= 5N2
+ 4MnSO4
+ 2K2
SO4
+ 16H2
O
Гидроксиламин
NH
2
OH
, производное NH3
в котором один водорода при взаимодействии с водой дает гидрат гидроксиламина NH2
OH · H2
O.
Гидроксиламин NH2
OH – слабое основание за счёт азота, проявляет свойства донора электронной пары, участвует в реакциях присоединения.
NH2
OH +HCl = ( NH3
OH)Cl ( NH2
OH •HCl)
Соли гидроксиламина (NH3
OH)Cl, (NH3
OH)HSO4
- восстановители.
Для NH2
OH характерны свойства восстановителя и окислителя он может восстанавливаться до N2
, а также может окисляться до NH3
, NH4
+
.
В щелочной среде наиболее характерны свойства восстановителя
NH2
OH + J2
+ KOH = KJ + N2
+ H2
O
NH2
OH + KMnO4
+ H2
SO4
= N2
+ MnSO4
+ K2
SO4
+ H2
O
В кислой среде чаще всего он восстановитель, но може быть и окислителем
NH2
OH +FeSO4
+ H2
SO4
= (NH4
)2
SO4
+ Fe2
(SO4
)2
+ H2
O
 NH3 NH3
N2
H4
+ KMnO4
+ H2
SO4
= N2
+ K2
SO4
+ MnSO4
+ H2
O
HN
3
,
NH
2
OH
Получение: восстановление азотной кислоты атомарным водородом при электролизе раствора
HNO
3
+ 6
H
+
+ 6
e
=
NH
2
OH
+
H
2
O
При взаимодействии с HNO2
можно получить азотистоводородную кислоту
HN
3
.
N
2
H
4
+
HNO
2
=
HN
3
+ 2
H
2
O
HN3
– непрочная жидкость; ее соли (азиды) также непрочные соединения
Степень окисления азота в азид- ионе –1/3, а азидиона – 1.
На самом деле у азота
H
–
N
-3
=
N
+5
≡
N
-3
[ :N–
= N+
= N–
:]–1
[ N ≡ N = N ]–1
· ·
· ·
2HN3
+ 2Na = 2NaN3
+H2
2
NaN
3
= 2
Na
+ 3
N
2
Азотистоводородная кислота слабая ( = 10–5
). Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+
, взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3
(азиды меди и ртути взрываются при комнатной температуре). = 10–5
). Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+
, взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3
(азиды меди и ртути взрываются при комнатной температуре).
HN3
– окислитель – смесь HN3
и HCl по окислительным свойствам аналогична царской водке, что обусловлено образованием атомарного хлора
4H2
+ HN3
= 3NH3
HN3
+ 2HCl = 2Cl + N2
+ NH3
Сильными окислителями HN3
окисляется.
10HN3
+ 2KMnO4
+ 3H2
SO4
= 15N2
+ 2MnSO4
+ K2
SO4
+ 8H2
O
2
N
3
–
– 2
e
= 3
N
2
º
| 5
Mn
+7
+5
e
=
Mn
+2
| 2
Кислородные соединения азота
В кислородных соединениях
азот проявляет степень окисления от +1 до +5.
N2
O ; NO ; N2
O3
; NO2
; N2
O4
; N2
O5
Оксиды N2
O и NO – несолеобразующие, остальные солеобразующие.
Оксид азота (I) и оксид азота (II) – бесцветные газы, оксид азота (III) – синяя жидкость, (IV) – бурый газ, (V) – прозрачные бесцветные кристаллы.
Кроме N2
O, все они чрезвычайно ядовиты. Закись азота N2
O обладает весьма своеобразным физиологическим действием, за которые ее часто называют веселящим газом. Вот как описывают действия закиси азота английский химик Хэмфри Дэви, который с помощью этого газа устраивал специальные сеансы: «Одни джентльмены прыгали по столам и стульям, у других развязывались языки, третьи обнаружили чрезвычайную склонность к потасовке». Вдыхание N2
O вызывает потерю болевых ощущений и поэтому применяется в медицине как анестезирующее средство.

МВС предполагает в молекуле N
2
O
наличие ионов N+
и N–
sp-гибридизация
+
N
–
N
O
За счет sp-гибридизации ион N+
дает 2σ связи: одну с N–
и другую с атомом кислорода. Эти связи направлены под углом 180º друг к другу и молекула N2
O линейна. Структуру молекулы определяет направленность σ связей. Оставшиеся у N+
два p-электрона образуют еще по одной π-связи: одну с ионом N–
и другую с атомом кислорода. Отсюда N2
O имеет строение
σ σ
:
N–
= N+
= O :
· · · ·

Склонность NO2
к димеризации – следствие нечетного числа электронов в молекуле (парамагнитна).
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2
O3
взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2
, которая существует только в разбавленных растворах, так как легко разлагается
2
HNO
2
=
N
2
O
3
+
H
2
O
.
HNO2
может быть более сильным восстановителем, чем HNO3
, о чём свидетельствуют значения стандартных электродных потенциалов.
HNO
3
+ 2 Н+
+ 2е =
HNO
2
+ Н2
О Е0
= + 0,93 В
HNO2
+
Н
+
+ 1
е
= NO + H2
O
Е
0
= + 1,10
В
HNO
2
+ 1
e
=
NO
+
H
+
Е0
= + 1,085 В
Ее соли нитриты – устойчивы. HNO2
- кислота средней силы (К ≈ 5 · 10–4
). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+
и OH–
.
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2
–
в NO3
–
.
5NaNO2
+ 2KMnO4
+ 3H2
SO4
= 5NaNO3
+ 2MnSO4
+ K2
SO4
+ 3H2
O
Сильные восстановители обычно восстанавливают HNO2
до NO.
2NaNO2
+ 2KI + 2H2
SO4
= Na2
SO4
+2NO + I2
+ K2
SO4
+2H2
O
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3
HNO
2
=
HNO
3
+ 2
NO
+
H
2
O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2
N–NO – канцерогенных веществ.
Важнейшее соединение азота –
HNO
3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3
– бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
N2
+ O2
→ 2NO
2NO + O2
→ 2NO2
4NO2
+ O2
+ 2H2
O → 4HNO3
Высококонцентрированная HNO3
имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
4
HNO
3
= 4
NO
2
+ 2
H
2
O
+
O
2
HNO3
– очень опасное вещество.
Важнейшее химическое свойство HNO3
состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
NO2
→ HNO2
→ NO → N2
O → N2
→ NH3
(NH4
NO3
)
и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3
на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
Свойства концентрированной и разбавленной
HNO
3
1) Действие концентрированной HNO3
на малоактивные металлы (Cu, Hg, Ag)
Cu + 4 HNO3
= Cu(NO3
)2
+ 2NO2
↑ + 2H2
O
2) Действие разбавленной HNO3
на малоактивные металлы
3Cu + 8 HNO3
= 3Cu(NO3
)2
+ 2NO↑ + 4H2
O
3) Действие концентрированной кислоты на активные металлы
4Ca + 10HNO3
= 4Ca(NO3
)2
+ N2
O↑ + 5H2
O
4) Действие разбавленной HNO3
на активные металлы
4Ca + 10 HNO3
= 4Ca(NO3
)2
+ NH4
NO3
+ 3H2
O
Одна из наиболее сильных кислот, характерны все реакции кислот: реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами. Специфичное свойство – ярко выраженная окислительная. В зависимости от условий (концентрации, природы восстановителя, температуры) HNO3
может принимать от 1 до 8 электронов.
Ряд соединений N с различными степенями окисления:
NH3
; N2
H4
; NH2
OH ; N2
O ; NO ; N2
O3
; NO2
; N2
O5
NO3
–
+ 2H+
+ 1e = NO2
+ H2
O
NO3
–
+ 4H+
+ 3e = NO + 2H2
O
2NO3
–
+10H+
+ 8e = N2
O + 5H2
O
2NO3
–
+12H+
+ 10e = N2
+ 6H2
O
NO
3
–
+ 10
H
+
+ 8
e
=
NH
4
–
+ 3
H
2
O
Образование продуктов зависит от концентрации, чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3
не взаимодействует при обычных условиях с Fe, Cr, Al, которым она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
Большинство неметаллов и сложных веществ восстанавливается HNO3
до NO (реже NO2
).
3P + 5HNO3
+ 2H2
O = 3H3
PO4
+ 5NO
S + HNO3
= H2
SO4
+ 2NO
3C
+ 4HNO3
= 3CO2
+ 4NO + 2H2
O
ZnS + 8HNO3 k
= ZnSO4
+ 8NO2
+ 4H2
O
6HCl + 2HNO3 k
=3Cl2
+ 2NO + 4H2
O
Запись окислительно-восстановительной реакции с участием HNO3
обычно условна, т.к. образуется смесь азотсодержащих соединений, а указывают тот продукт восстановления, который образовался в большем количестве.
Золото и платиновые металлы растворяются в «царской водке» – смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты, которая обладает сильнейшим окислительным свойством, растворяет «царя металлов» – золото.
Au + HNO3
+4HCl = H[AuCl4
] + NO↑ + 2H2
O
HNO3
– сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
2
KNO
3
= 2
KNO
2
+
O
2
Состав других продуктов зависит от положения металла в РСЭП.
Левее
Mg
=
MeNO
2
+
O
2
до магния
MeNO3
=
Mg – Cu
= MeO + NO2
+ O2
правее магния.
правее
Cu
=
Me
+
NO
2
+
O
2
менее активных металлов
Нитраты аммония разлагаются
NH4
NO3
→ N2
O + 2H2
O
NH4
NO3
→ N2
+ NO + H2
O
Нитриты не разлагаются, кроме NH4
NO2
NH
4
NO
2
→
N
2
+ 2
H
2
O
Получение азотной кислоты
t
В лабораторных условиях – KNO
3тв
+
H
2
SO
4
k
=
KHSO
4
+
HNO
3
↑
В промышленности: аммиачный или контактный способ.
Каталитическое окисление в контактном аппарате (катализатор – платинородиевые сетки)
t,k
1) 4NH3
+ 5O2
→ 4NO + 6H2
O
2) NO
+
O
2
→
NO
2
при обычной t и повышенном P ≈ 600 – 1100 кПа
3) 4NO2
+ O2
+ H2
O → 4HNO3
ω
(50 – 60%)
Соли
азотной
кислоты
.
Азотные удобрения
Нитраты – практически все хорошо растворимы в H2
O, поэтому природные месторождения редки. Основное количество получают искусственным путем на химических заводах, из HNO3
и гидроксидов.
Получают:
1) Взаимодействием с металлами, основаниями, амфотерными основаниями щелочами, нерастворимыми основаниями, аммиаком или его водным раствором, с некоторыми солями.
2) NO2
с растворами щелочей
2Ca(OH)2
+ NO2
= Ca(NO3
)2
+ Ca(NO2
)2
+ 2H2
O
В кислой
среде нитраты проявляют окислительные свойства подобно разбавленной HNO3
3FeCl2
+ KNO3
+ 4HCl = 3FeCl3
+ KCl + NO↑ + H2
O
В щелочной
окисляют активные металлы (Mg, Al, Zn)
4Zn + NaNO3
+ 7NaOH + 6H2
O = 4Na2
[Zn(OH)4
] + NH3
↑
Наиболее сильные окислительные свойства нитраты проявляют при сплавлении
t
Cr2
O3
+ 3NaNO3
+ 4KOH = 3K2
CrO4
+ 3NaNO2
+ 2H2
O↑
Наиболее важные азотные удобрения:
Нитраты натрия, калия, аммония и кальция применяются главным образом как минеральные азотные удобрения
и называются селитрами
.
 NH
4
NO
3
(
NH
4
)2
SO
4
сульфат аммония NH
4
NO
3
(
NH
4
)2
SO
4
сульфат аммония
KNO
3
селитры
NH
3
•
H
2
O
аммиачная вода
NaNO
3
NH
4
H
2
PO
4
аммофос
Ca(NO3
)2
(NH4
)2
HPO4
диаммофос
CO
(
NH
2
)2
мочевина, карбамид
Питательная ценность удобрения растворяется по ω(N) в нем.
В мочевине ω(N) = (2•14)/ (12 + 16 + 28 + 4)= 28/60 = 0,47 (47%).
В NH4
NO3
– азот в нитратной и аммиачной форме (35%), (NH4
)2
SO4
– наиболее ценное удобрение, так как азота больше всего в хорошо усвояемой форме.
К азотным удобрениям, как источникам азотного питания растений для повышения урожайности относят также органические удобрения (навоз, компост и др.), а также зеленые удобрения (люпин).
3. Химия фосфора
Фосфор
(лат. Phosphorus) - один из наиболее распространенных элементов в земной коре. В свободном состоянии в природе не встречается из-за высокой химической активности. В связанном виде входит в состав около 200 минералов, главным образом апатитов 3Ca3
(PO4
)2
*CаХ2
(Х=Cl, F, OH)2
и фосфоритов Ca3
(PO4
)2
.
Известно 11 аллотропных модификаций фосфора, наиболее изучен белый, красный и черный фосфор. Белый фосфор
имеет молекулярную формулу P4
и представляет правильный тетраэдр с углом между связями в 60О
.  
Белый фосфор очень ядовит. Смертельная доза для человека составляет 0,15 г. Уже при комнатной температуре белый фосфор легко испаряется и его пары окисляются. Энергия этих реакций переходит частично в световую, что является причиной свечения белого фосфора в темноте.
Он легко загорается (возможно самовоспламенение). Обращаться с ним надо крайне осторожно. Хранить необходимо под водой.
Красный фосфор
получают при длительном нагревании белого фосфора при температуре 280-340 О
С под давлением и без доступа воздуха. Это темно-красное мелкокристаллическое мало-летучее вещество.
Содержание фосфора в человеческом организме составляет около 1 % от его массы.
280 - 340° С 200° С
Pбел
→
Ркрасн
Pбел
→
Рчерн
Красный фосфор почти не ядовит и менее огнеопасен, чем белый. Самовозгорание не происходит, однако зажечь его легко и горение протекает очень бурно.
- в основе полимеры, получаются размыканием тетраэдра P4
.
Наиболее устойчивой формой фосфора является черный фосфор
. По внешнему виду и свойствам напоминает графит, жирный на ощупь, разделяется на чешуйки, проводит электрический ток. Не ядовит, химически наименее малоактивен, воспламеняется только при температуре 490 О
С.
Хотя фосфор является электронным аналогом азота, но наличие в валентном электронном слое атома свободных в - орбиталей делает соединения фосфора не похожими на соединения азота.
Различие между соединениями азота и фосфора связано с образованием донорно-акцепторных π-связей между атомами фосфора и донорами электронных пар, особенно кислородом. Поэтому при переходе от N к P прочность связей Э-Н вследствие увеличения размера атома снижается, однако связи Э-О значительно упрочнятся.
Образование донорно-акцепторных связей объясняет интенсивное взаимодействие фосфора с кислородом, устойчивость и многообразие кислородных соединений фосфора.
Наиболее устойчивая степень окисления +5. В этой степени окисления соединения фосфора не проявляют окислительные свойства из-за ее стабильности, в отличии от азота. Т.к. имеются свободные 3d – орбитали, то по сравнению с азотом валентных возможностей больше и максимальная валентность фосфора может быть 5, редко 6.
Получение:
1. Из фосфоритной муки сплавлением с углеродом и оксидом кремния
Ca3
(PO4
)2
+ C +SiO2
→ P4
+ CaSiO3
+ CO
2. Из фосфата Са, при температуре выше 1500о
С
Ca3
(PO4
)2
+ C → CaO + P4
+ CO
Химические
свойства
:
P + O2
= P2
O3
P + O2
= P2
O5
P + S = P2
S3
P
+
Cl
2
=
PCl
3
P
+
H
2
не идет
Реагирует
с
кислотами
P + HNO3
= H PO4
+ NO + H2
O
P + H2
SO4
= H3
PO4
+ SO2
+ H2
O
Реагирует
со
щелочами
P + KOH + H2
O = KH 2
PO2
+ PH3
↑
Соединения: В отличие от азота фосфор непосредственно не реагирует с водородом. Гидрид фосфора (РН3
) фосфин получают гидролизом фосфида кальция.
Са3
Р2
+ 6Н2
О
®
3Са(ОН)2
+ 2РН3
↑
Фосфин
– бесцветный ядовитый газ с запахом гнилой рыбы. Самовоспламеняется на воздухе
2РН3
+ 4О2
®
P
2
O
5
+ 2Н2
О
Мало растворим в воде и в отличие от NH3
не реагирует с ней.
С очень сильными бескислородными кислотами образует соли фосфония аналогично аммиаку.
РН3
+
HI
=
PH
4
I
иодид фосфония
Дифосфин
(аналог гидразина) (Р2
Н4
) – представляет собой жидкость, самовоспламеняющуюся на воздухе.
Кислородные соединения фосфора
При недостатке воздуха или медленном окислении белого фосфора получают ядовитый фосфористый ангидрид Р2
О3
точнее (Р4
О6
), а при избытке воздуха или в кислороде фосфорный ангидрид Р4
О10
.
4Р + 3О2
= 2Р2
О3
4Р + 5О2
= 2Р2
О5
в воде растворяется с образованием ортофоcфористой кислоты
Р2
О3
+ 3
H
2
О = 2
H
3
РО3
Н2
[HPO3
] 2-х основная средней силы
Н3
РО3
– фосфористая кислота, максимум двухосновная, т.к. атом водорода, связанный непосредственно с фосфором, не способен к замещению, ее изображают нередко формулой Н2
[НРО3
] средней силы, соли – фосфиты.
2Н3
РО4
= Н4
Р2
О7
+ Н2
0 К(Н4
Р2
О7
) = 3*10-2

Фосфористый ангидрид белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V) – белые кристаллы.
Р2
О3
+ О2
®
Р2
О5
Р2
О5
не может быть получен дегидратацией фосфорных кислот из-за высокой экзотермичности реакции его с водой. На этом основано применение Р2
О5
как осушителя, водоотнимающего средства, в этом отношении он превосходит все вещества. Он отнимает от сложных веществ даже связанную воду.
В зависимости от соотношения числа молекул воды и оксида фосфора (V) Р2
О5
образует несколько типов фосфорных кислот.
Р2
О5
+ 3Н2
О = 2Н3
РО4
КН3РО4
=7,5*10-3
средней силы кислота

Ион РО4
3-
имеет тетраэдрическую конфигурацию вследствие sp3
гибридизации атомных орбиталей.
При упаривании ортофосфорной кислоты образуется дифосфорная (пирофосфорная) кислота.
Дифосфорная кислота более сильная, чем ортофосфорная, она четырехосновная.
При недостатке воды образуется полимерная метафосфорная
кислота, в виде стеклообразной массы, хорошо растворимой в воде.
n
Р2
О5
+
n
Н2
О = 2 (НРО3
)
n
К = 1,6*10-3
где n – от 3 до 8. средней силы
Из кислот в степени окисления +5 наибольшее применение находит ортофосфорная кислота. Она не ядовита и поэтому применяется в пищевой промышленности для приготовления сиропов. Поскольку она трехосновная, то образует средние и кислые соли.
Na3
PO4
– ортофосфат натрия, Na2
HPO4
- гидроортофосфат натрия, NaH2
PO4
– дигидроортофосфат натрия. Первичные фосфаты обычно хорошо растворимы в воде, почти все вторичные и третичные растворимы мало.
Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как важнейшие минеральные удобрения, содержащие фосфор в связанном виде. Фосфор необходим для нормального развития растений. Фосфорные удобрения составляют половину всех производимых минеральных удобрений. Наиболее распространены:
Ca
3
(
PO
4
)2
– фосфоритная мука
Са(Н2
РО4
)2
+ Са
S
О4
–
простой суперфосфат
Са(Н2
РО4
) –
двойной суперфосфат
СаНРО4
-
преципитат
NH
4
H
2
PO
4
, (
NH
4
)2
HPO
4
–
аммофос, комбинированное удобрение.
Получение удобрений
Суперфосфат
– эту смесь солей кальция получают обработкой фосфоритов или апатитов рассчитанным количеством технической серной кислоты.
Са3
(РО4
)2
+ 2Н2
S
О4
= Са(Н2
РО4
)2
+ 2Са
S
О4
(Р2
О5
» 20%)
Полезная часть суперфосфата – растворимый в воде дигидрофосфат кальция, хорошо усваиваемый растениями. Сульфат кальция является балластом. Поэтому выгоднее получать двойной суперфосфат.
Для этого сначала получают фосфорную кислоту
Са3
(РО4
)2
+ 3Н2
SO
4
= 3
CaSO
4
↓ + 2
H
3
PO
4
а затем удобрения
Са3
(РО4
)2
+ 4Н3
PO
4
= 3
Ca
(
H
2
PO
4
)2
- концентрированное фосфорное удобрение.
Кроме суперфосфата хорошим фосфорным удобрением кислых почв служит преципитат
. Его получают нейтрализацией фосфорной кислоты известью.
Н3
РО4
+ Са(ОН)2
= СаНРО4
↓ + 2Н2
О
гидрофосфат кальция нерастворим в воде, но растворяется в почвенных кислотах.
А
ммофос –
комбинированное удобрение, включает азот и фосфор.
NH
3
+
H
3
PO
4
=
NH
4
H
2
PO
4
2
NH
3
+
H
3
PO
4
= (
NH
4
)2
HPO
4
Кислородсодержащие кислоты фосфора делят на 2 группы:
1) со связью Р-Н и 2) без нее.
Со связью Р-Н менее устойчивы (энергия Р-О > энергии связи Р-Н), поэтому легко окисляется кислородом.
Фосфорноватистая Н3
Р+1
О2
– одноосновная
, не имеющая ангидрида (довольно сильная К = 8,5*10-2
).

Соли – гипофосфиты – хорошо растворимы в Н2
О.
Гипофосфиты и Н3
РО2
– энергичные восстановители (особенно в кислой среде).
Ортофосфористая Н3
+3
РО3
– Н2
[
HPO
3
]
– двухосновная
, образуется при взаимодействии Р4
О6
с холодной Н2
О. Это кристаллическое вещество, кислота средней силы К= 8·10-3
.

При нагревании Н3
РО3
диспропорционирует.
4Н3
РО3
®
3Н3
РО4
+ РН3
Пирофосфористая - Н4
Р2
О5
.
Фосфорноватая кислота Н4
Р2
О6
–четырехосновная, средней силы (К =6,1·10-3
), ангидрид её не известен.

Известно соединение Р2
О4
, но оно при взаимодействии с Н2
О дает Н3
РО3
и Н3
РО4
, т.е. диспропорционирует подобно N2
O4
Фосфористофосфорная Н4
Р2
О6
- трехосновная тот же состав, что и фосфорноватая, но отличается строением.

3.
Биогенная роль
Азот
в живом веществе 3·10%, т.е. мы живем в азотной атмосфере, умеренно обогащенной кислородом и в очень малых количествах другими элементами.
Термин «азот» означает безжизненный. Это название он получил за свою инертность к реакциям с другими элементами. В то же время известно, что без азота трудно представить себе жизнь на земле и что азот и жизнь - понятия неотделимые.
В биосфере азот образуется при бактериальном брожении белковых веществ, а также в результате разложения азотсодержащих веществ, входящих в состав горных парод.
Характерно, что растения и животные потребляют не свободный, а связанный азот, находящийся в почве в форме азотнокислых и аммиачных солей.
Функции перевода свободного азота в связанный выполняют азотофиксирующие бактерии, которые, поглощая азот воздуха, используют его для синтеза белков и других органических соединений.
Азотные соединения, особенно нитраты, загрязняют биосферу, вредны для организма и могут быть причиной отравления человека. Азот в почве находится в форме недоступных растениям органических веществ, которые разлагаются бактериями на простые соединения NH3
, СО2
, Н2
О, соли. Процесс выделения аммиака называют аммонизацией. Аммиак с кислотами почвы образуют соли, усвояемые растениями.
Атмосферный азот фиксируется клубеньковыми бактериями, живущими на корнях бобовых растений. Эти бактерии усваивают азот воздуха, создают из него азотные вещества, используемые растениями для синтеза белков.
Фосфор
– принадлежит к относительно распространенным элементам земной коры. Кларк его 8·10-2
%. Ферсман назвал его элементом жизни и мысли. В организме животных, растений и человека фосфора содержится от сотых-десятых до целых процентов. Наибольшее его количество концентрируется в костной ткани (у человека в костях содержится 5,05 %, в зубной эмали – 17 % фосфора). Относительно много фосфора в тканях мозга и мышцах. Фосфор в организмах обеспечивает энергетические процессы. При недостатке фосфора в организме (ниже 0,1 %) у животных развивается заболевания костей.
Мышьяк
– в разных случаях и видах выступает как яд и как целительное средство. История дает немало случаев использования мышьяка в качестве яда для отравления противников. Симптомы мышьякового отравления –металлический вкус во рту, рвота, боли в животе: при сильном отравлении –судороги, паралич, смерть.
В то же время мышьяк ¾ важнейший компонент многих лекарств. В небольших количествах соли мышьяковой и мышьяковистой кислот улучшают питание животных, усиливают процессы ассимиляции и усвоения азота и фосфора.
На основе мышьяка страны НАТО изготавливают смертоносное оружие.
Ортоарсенаты используются в сельском хозяйстве как инсектициды.
Na2
НА
sO4
, Na3
AsO4
CaH
А
sO4
,
Са
3
(AsO4
)2
ЛЕКЦИЯ 6
Тема
:
р - Элементы
VI
группы
1.Общая характеристика элементов
VI-
A группы
Элементы VI-A группы - это кислород, сера, селен, теллур и радиоактивный металл полоний. Кислород и сера – неметаллы. Полоний металл серебристо белого цвета, напоминающий по физическим свойствам свинец, селен и теллур, занимающие промежуточное положение, являются полупроводниками. Кислород, сера, селен, теллур – имеют неметаллический характер, называются «халькогены», т.е. образующие руды.
На внешнем уровне атомов этих элементов содержится 6 электронов: ns
2
np
4
. В атомах элементов Se, Te и Po электроны внешнего уровня экранируются от ядра десятью d-электронами предвнешнего уровня, что ослабляет их связь с ядром и способствует проявлению металлических свойств этих элементов.
Особенность строения атома кислорода – отсутствие d-подуровня, поэтому валентность кислорода равна 2, но за счёт неподелённых электронных пар кислород может быть донором электронных пар.

8
O[He] 2s2
2p4
16
S[Ne] 3s2
3p4

 

У серы и остальных халькогенов возможен переход p и s-электронов в d–состояние. Поэтому валентность их может быть 2,4,6.

У теллура радиус атома больше, чем у полония за счёт лантаноидного сжатия, т. к. полоний стоит за лантаном. У Po нет радиуса иона, т.к. это радиоактивный элемент. Электроотрицательность элементов группы больше, чем у элементов V-A гр., от кислорода к теллуру закономерно уменьшается. Неметаллические свойства ослабевают с увеличением порядкового номера элементов. Нет монотонного изменения t0
C плавления - обусловлено особенностями кристаллической решётки.
С увеличением порядкового номера халькогенов понижается окислительная активность нейтральных атомов и растёт восстановительная активность отрицательных ионов.
Водородные соединения (гидриды).
При обычных условиях Н2
О – жидкость, остальных –газы. Все гидриды обладают восстановительными свойствами.
 
 
 
Все оксиды ЭО2
и ЭО3
кислотные, им соответствуют кислоты.


Чем меньше угол, тем меньше полярность, Н2
О – самая полярная
2. Химия кислорода
По электроотрицательности кислород уступает только фтору, степень окисления его в большинстве соединений равна –2, но может проявить +2 и +4, а также +1 и –1 в соединениях со связью –O-O-. Подобно фтору образует соединения почти со всеми элементами (кроме гелия, неона и аргона).  Две аллотропные модификации: молекулярный кислород и озон. Наиболее устойчива молекула О2
. Однозначного решения в изображении электронной структуры молекулы О2
еще не найдено. (По методу ВС). Две аллотропные модификации: молекулярный кислород и озон. Наиболее устойчива молекула О2
. Однозначного решения в изображении электронной структуры молекулы О2
еще не найдено. (По методу ВС).
Однако жидкий кислород – обладает парамагнитными свойствами, втягивается в магнитное поле, значит, у него есть неспареные электроны. Учитывая парамагнетизм молекулы О2
можно изобразить строение так:

-
длинна связи между неспаренными электронами неодинакова.
 Более правильно объясняет строение молекулы О2
ММО: Более правильно объясняет строение молекулы О2
ММО:

Два неспаренных электрона на π - разрыхляющих орбиталях обуславливают парамагнетизм молекулы кислорода.
 



Для молекулярных ионов:
О2
+
, О2
0
, О2
-
, О2
-2
N (кратность связи) 2,5 2 1,5 1
т.е. положительный молекулярный ион О2
+
- самый прочный
При заполнении одной π·2pу
орбитали образуются надпероксиды со связью O==O, имеющей кратность 1,5.
О2
+ ē → О2
-
Na
+
O
2
→
Na
+
O
2
-
надпероксид.
При заполнении обеих π*2p орбиталей происходит образование пероксидов с одинарной слабой связью :О−О:
:О≡О: + 2ē → [:
O
–
O
:]2-
2
Na
+
O
2
→
Na
2
+
O
2
-2
- пероксид
После заполнения 2х π*
2p и σ*
2p орбиталей четырьмя электронами связи молекулы О2
разрываются и образуются оксиды со степенями окисления-2.
:О≡О: + 4ē → 2О-2
О2
+ 4
Na
→ 2
Na
2
O
оксид.
Лабораторные способы получения О2
1.Термическое разложение солей
2
KNO
3
= 2
KNO
2
+
O
2
2 K
С
lO3
= 2 KCl + 3 O2
2 KMnO4
= K2
MnO4
+ MnO2
+ O2
BaO
2
=
BaO
+ ½
O
2
Промышленные способы получения О2
1. Сжижение воздуха (tкип
(O2
)= -183o
C), tкип
(N2
)= - 196o
C)
2.Электролизом водных растворов щелочей, который сводится к электролизу H2
O

Химические свойства О2
1.Плохо растворим в воде
2. Реагирует с большинством металлов и неметаллов
2Са + О2
= 2СаО
 О2
+
N
2
эл. разряд
2
NO
(t ≈ 3000o
C) О2
+
N
2
эл. разряд
2
NO
(t ≈ 3000o
C)
4P + O2
= 2P2
O5
H2
S + O2
= SO2
+ H2
O
2
ZnS
+ 3
O
2
= 2
ZnO
+ 2
SO
2
CH
4
+
O
2
=
CO
2
+
H
2
O
K
+
O
2
=
K
[
O
2
]-
-
надпероксид калия
 2
Na
+
O
2
=
Na
2
O
2
- пероксид натрия 2
Na
+
O
2
=
Na
2
O
2
- пероксид натрия
Чем сильнее выражены основные свойства, тем меньше значение энергии Гиббса для реакции с H2
O
Na2
O + H2
O = 2 NaOH
∆G = -147 кДж/моль
MgO + H2
O = Mg(OH)2
∆G = - 17 кДж/моль
Al2
O3
+ H2
O = Al(OH)3
∆G = - 7 кДж/моль

Молекула озона О3.
О3
– голубоватый газ с сильным запахом, означает «пахучий»: в сосновых лесах его много, у морского побережья, после грозы. Образуется из О2
под действием УФ излучения и при грозовых разрядах:
 3О2
hν
2О3
∆
G
= - 323 кДж 3О2
hν
2О3
∆
G
= - 323 кДж
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, которые при обычной температуре распадаются с образованием атомарного кислорода, который активнее молекулы кислорода О2
, на этом и основано окислительное действие его . .
O3
↔
O2
+ O
Δ
H=-142
кДж
/
моль
Окисляет почти все металлы, действуют на неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. (Один кислород имеет с.о. равную +4).Молекула имеет угловое строение.



Связь трехцентровая ( центральный атом О+4
находится в sp2
-гибридизации, связи его с двумя крайними атомами кислорода неравноценны, одна двойная, одна одинарная).
Две sp2
- гибридные орбитали образуют σ-связи, а 3-я гибридная орбиталь расположена перпендикулярно плоскости молекулы, образуя 3х-центровую 2х-электронную связь с крайними атомами кислорода. Предполагается что центральный aтом кислорода находится в возбужденном состоянии и по донорно-акцепторному механизму пара электронов помещается на пустую орбиталь.

Качественная реакция на озон, крахмальная бумага, смоченная раствором KI синеет в присутствии озона в результате выделения I2
,озон более сильный окислитель, чем О2
с ним эта реакция не протекает.

Земля окружена слоем озона, располагающегося на высоте 25 км от её поверхности. Он образуется за счёт поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи. Вызывает беспокойство возможное разрушение озонового слоя выхлопными газами реактивных самолётов. Сейчас этот вопрос актуален и широко освещается в печати.
Химичесие свойства О3
1. С Металлами
Al + O3
→ Al2
O3
+ O2
2. Со сложными веществами
PbS
+ 2
O
3
→
PbSO
4
+
O
2
3. Со щелочами
2
KOH
+ 7/3
O
3
→
O
2
+ 2
KO
3
+
H
2
O
озонид калия
Кроме степени окисления +4, кислород может проявлять степень окисления +2 в соединении со фтором O+2
F2
и +1 О2
+1
F2
2 F2
+ 2 NaOH → 2NaF + O+2
F2
+ H2
O-2
Окислительно-восстановительная двойственность пероксида водорода Н2
О2
Степень окисления кислорода равна -1, т.е. имеет промежуточное значение между степенью окисления кислорода в Н2
О (-2) и в молекуле кислорода (0)
.
   Н2
О-2
, Н2
О2
-1
, О2
, О+2
F2
- Н2
О-2
, Н2
О2
-1
, О2
, О+2
F2
-
восстановитель двойственность окислитель
т.е. Н2
О2
проявляет свойства и окислителя и восстановителя. С сильными восстановителями выступает в роли окислителя.





Производные Н2
О2
надкислоты и надоснования (пероксосоединения). Обязательно наличие пероксидной цепочки (− О – О−). Надкислоты получаются при замещении водорода в молекуле Н2
О2
на кислотные радикалы.

При замене одного атома водорода на металл получаем надоснования К−О−ОН, можно рассматривать как кислые соли пероксида водорода называют гидропероксидами. КО2
Н.
Важнейшее применение Na2
O2
и К2
О2
основано на реакции регенерации кислорода.
2Э2
О2
+ 2СО2
= 2Э2
СО3
+ О2
Пероксиды используют как источники кислорода для дыхания в автономных системах (подводные лодки, летательные аппараты, батискафы).
- Химия серы
16
S
[
Ne
] 3
s
2
3
p
4


Существует в нескольких аллотропных формах:
• жёлтая ромбическая сера
(α-сера), при комнатной температуре стабильна.
• моноклинная
(β-сера), состоит из молекул S8
, которая имеет циклическое «зубчатое» строение.
• пластическая сера


При плавлении ромбической серы цепочки разбиваются и S8
связывается в S6
, S4
, S∞ .
Если расплавить ромбическую серу при t до 119º
С, то это легко подвижная жидкость. При повышении t до 200º
С вязкость резко повышается и образуется смола. Это связано с разрывом S8
и образованием цепочек пластической серы, которые скручиваются друг с другом. При t>250º
C цепочки пластической серы рвутся и опять образуется легко подвижная жидкость, состоящая из колец S4
, S2
. Т. о. при нагревании состав молекул меняется. t = 444º
C – закипает. Сера - типичный неметалл. В Н2
О не растворима. Взаимодействуют почти со всеми элементами:
S + C = CS2
S + F2
= SF6
S + Fe = FeS
S + Na = Na2
S
S + H2
= H2
S
S + HNO3(
конц
.)
= H2
SO4
+ NO2
+ H2
O
S
+
NaOH
=
Na
2
S
+
Na
2
SO
3
+
H
2
O
с концентрированными растворами щелочей при t S – диспропорционирует
Сероводород
H
2
S
– газ, образуется при действии гнилостных бактерий на серусодержащие белки, поэтому его запах ассоциируется с запахом тухлых яиц. Вдыхание чистого сероводорода может привести к мгновенной смерти; даже его 0,01%-ное содержание в воздухе опасно для человека, т. к. он может накапливаться в организме, соединяясь с железом , входящим в состав гемоглобина, образуя сульфид - FeS. Это приводит к тяжелому кислородному голоданию и удушью. Причём окраска крови становится чёрно-зелёной.
 В H2
S угол отталкивания меньше, чем у Н2
О В H2
S угол отталкивания меньше, чем у Н2
О
Сера менее электроотрицательна, чем кислород, связь слабее поляризована.
H2
S в лаборатории получают действуя на суфиды кислотой
FeS
+ 2HCl → FeCl2
+ H2
S↑

Различно реагируют с Н2
О
Основн. Na2
S + H2
O → NaHS + NaOH
(гидролиз)
Амф. Al2
S3
+ 6H2
O → Al(OH)3
+ H2
S↑
Кисл.SiS2
+ 3H2
O → H2
SiO3
↓ + 2H2
S↑
Растворимы в Н2
О сульфиды щёлочных и щелочноземельных металлов
2
NaOH
+
H
2
S
→
Na
2
S
+
H
2
O
Нерастворимые сульфиды можно получить взаимодействием соответствующей соли с Н2
S
MnSO
4
+
H
2
S
→
MnS
↓ +
H
2
SO
4
CuS, PbS- чёрные ZnS –белый
телесный
1. Есть сульфиды , которые можно перевести в растворимое состояние действием кислот
FeS
+ 2
HCl
→
FeCl
2
+
H
2
S
2. Которые нерастворимы в разбавленных кислотах, но реагируют с окислителями
CuS + HNO3
→ CuSO4
+ NO2
+ H2
O
вост. ок.
3. Растворяются в растворах сульфидов щелочных металлов
As
2
S
3
+ 3
Na
2
S
= 2
Na
3
AsS
3
H2
S и сульфиды - сильные восстановители.
4.Сплавление различных по природе сульфидов
Na
2
S
+
CS
2
→
Na
2
CS
3
– тиокарбонат натрия
 H2
S хорошо растворим в спирте, несколько хуже в воде, придавая раствору слабокислый характер. Водный раствор называется сероводородной кислотой, двухосновна. H2
S хорошо растворим в спирте, несколько хуже в воде, придавая раствору слабокислый характер. Водный раствор называется сероводородной кислотой, двухосновна.
H
2
S
↔
H
+
+
HS
-
↔ 2
H
+
+
S
-2
слабая кислота.
К1
=6∙10-8
К2
=1∙10-14
Образует средние (сульфиды) и кислые (гидросульфиды) соли.
H2
S и сульфиды могут окислятся до S, SO2
, SO4
2-
H2
S + Br2
+ H2
O → H2
SO4
+ HBr
H2
S + H2
SO4
→ S + H2
O
H2
S + O2
→ S + H2
O
H2
S + O2
→ SO2
+ H2
O
H2
S-2
+ I2
→ HI-
+ S0
H2
S + HNO3
конц
→ S0
↓ + NO2
+ H2
O
Сульфаны (полисульфиды водорода)
Т. к. связь S−S прочна, то существуют полисульфиды водорода (сульфаны) H2
S2
, H2
S3
, H2
S4
и т. д. В воде проявляют свойства более сильных кислот, чем H2
S, поэтому гидролизуются меньше. А их соли полисульфиды используются, как пестициды.
H
2
SX
X
=1÷8
Na
2
S
+
S
=
Na
2
S
2
Na
2
S
+2
S
=
Na
2
S
3
Они имеют зигзагообразные цепи. Сульфаны – это жёлтые, вязкие жидкости с резким запахом, растворимые в растворах щелочей с образованием поли-сульфидов щёлочных металлов.



Диоксид серы
(сернистый газ) SO2
– бесцветный газ, с резким запахом, хорошо растворим в воде, менее токсичен , чем сероводород. Водный раствор называется сернистой кислотой, которая не существует в свободном виде.
SO2
+ H2
O
↔
H+
+HSO
-
3
↔
2H+
+SO3
2-
К1
= 2∙10-2
; К2
= 6∙10-8
.
Кислота средней силы.Образует средние соли сульфиты, кислые – гидросульфиты.
При нагревании сульфиты диспропорционируют:

SO
2
сернистый газ, ангидрид сернистой кислоты (H2
SO3
). Один из основных источников загрязнения атмосферы, менее токсичен, чем H2
S.
SO
2
– бесцветный газ с резким запахом.
Получение
SO
2
При сгорании серы S
+
O
2
→
SO
2
↑
при сгорании H2
S 2H2
S + 3O2
→ 2SO2
↑ + 2H2
O
при взаимодействии металлов с конц. H2
SO4
:
Cu + 2H2
SO4 k
онц
= CuSO4
+ SO2
↑ + 2H2
O
при обжиге сульфидов 2CuS + 3O2
= 2CuO + 2SO2
↑
или дисульфида железа 4
FeS
2
+ 11
O
2
= 2
Fe
2
O
3
+ 8
SO
2
↑
Химические свойства
SO
2
1) Реакции без изменения степени окисления (типичный кислотный оксид)
SO2
+ Ca(OH)2
→ CaSO3
+H2
O
SO2
+ 2NaOH → Na2
SO3
+ H2
O
SO2
+ NaOH → NaHSO3
Na2
SO3
+ SO2
+ H2
O → 2 NaHSO3
2) реакции с понижением степени окисления
SO
2
+ 2
H
2
S
→ 3
S
↓ +
H
2
O
3) реакции с повышением степени окисления
+4 +6
Na
2
SO
3
+
Cl
2
+
H
2
O
→
Na
2
SO
4
+ 2
HCl
В ряду соединений серы H
2
S
-2
,
S
0
8
,
S
+4
O
2
,
S
+6
O
3
- если сера в промежуточной степени окисления, то обладает окислительно-восстановительной двойственностью.
SO2
- окислитель:
SO2
+ H2
S → S + H2
O
SO2
+ C → S + CO2
↑
SO2
+ 2CO → S + 2CO2
↑
SO2
– восстановитель:
400-500,
v2
o5
2
SO
2
+
O
2
↔ 2
SO
3
SO
2
+
Br
2
+
H
2
O
→
H
2
SO
4
+ 2
HBr
SO
2
+
HNO
3
K
онц
→
H
2
SO
4
+ 2
NO
2
↑
Pb
+4
O
2
+
SO
2
→
Pb
+2
SO
4
SO2
– ангидрид сернистой кислоты, при растворении (40 V в 1 V H2
O), образует неустойчивую сернистую кислоту
H
2
SO
3
SO
2
+Н2
О ↔
H
2
SO
3
H2
O + SO2
↔ H2
SO3
↔ H+
+ HSO4
-
↔ 2H+
+ SO3
2-
К1
=1,6∙10-2
К2
=6,1∙10-8
H2
SO3
в свободном виде не выделена, также как SO2
обладает двойственностью, её растворы при нагревании окисляются.
2H2
SO3
+
О
2
→ 2H2
SO4
H2
SO3
+ Br2
+ H2
O → H2
SO4
+ 2HBr
H2
SO3
+ 2H2
S → 3S↓ + H2
O
Соли получают:
1) KOH + SO2
→ KHSO3
2KOH + SO2
→ K2
SO3
+ H2
O
2) CaCl
2
+
Na
2
SO
3
→
CaSO
3
↓ +
NaCl
3) Пропусканием SO2
в растворы солей более слабых кислот
Na
2
С
O
3
+
SO
2
→
Na
2
SO
3
+
CO
2
↑
средние в кислые
Na
2
SO
3
+
SO
2
+ Н2
О → 2
NaHSO
3
Кислые в средние
NaHSO
3
+
NaOH
→
Na
2
SO
3
+
H
2
O
Сульфиты и гидросульфиты разлагаются сильными кислотами
t
NaHSO3
+ HCl → NaCl + H2
O + SO2
↑
t
K2
SO3
+ H2
SO4
→ K2
SO4
+ H2
O + SO2
↑
2Na2
SO3
+ O2
→ 2Na2
SO4
Сульфиты диспропорционируют 4K2
SO3
→ K2
S + 3K2
SO4
Na2
SO3
+ S → Na2
S2
O3
– тиосульфат.
Подвергаются гидролизу
SO3
2-
+ HOH ↔ HSO
-
3
+ OH-
К
2
SO3
+ HOH ↔
К
HSO3
+
К
OH
Триоксид серы (серный ангидрид)
SO
3
SO3
– ангидрид H2
SO4
. Бесцветная жидкость при
160
С < t <42ºC, затвердевает при t < 160
С, в газовой фазе при t > 42ºC, tкип
= +45ºС, ядовит, молекула имеет sp2
гибридизацию, форму плоского треугольника, угол между связями - 120º.

В технике SO3
получают окислением SO2
в присутствии катализатора (Pt, оксиды ванадия)
Pt
2
SO
2
+
O
2
= 2
SO
3
– ангидрид серной кислоты
SO
3
+
H
2
O
=
H
2
SO
4
В водных растворах H2
SO4
– сильная двухосновная кислота. Гидратация H2
SO4
сопровождается выделением большого количества теплоты за счёт образования гидратов:
H2
SO4
∙ H2
O
H2
SO4
∙ 2H2
O
H2
SO4
∙ 4H2
O
Поэтому смешивать H2
SO4
c водой следует очень осторожно.
В виде SO3
только в газовой фазе, хорошо полимеризуется в жидком состоянии циклический триммер, в кристаллические – зигзагообразные цепи. Термически нестоек при t>700º разлагается:
>700
0
С
2
SO
3
↔ 2
SO
2
+
O
2
SO3
–типичный кислотный оксид, бурно реагирует с водой (Н2
О)
SO3(
кр
)
+ H2
O
ж
→ H2
SO4
ж
SO3
+ Ba(OH)2
→ BaSO4
↓ + H2
O
SO3
+ CaO → CaSO4
SO3
+ NaOHP
→ NaHSO4
SO3
+ 2NaOHK
→ Na2
SO4
+ H2
O
S+6
(высшая) – поэтому сильнейший окислитель
5
SO
3
+ 2
P
→
P
2
O
5
+ 5
SO
2
↑
3
SO
3
+
H
2
S
→ 4
SO
2
↑ +
H
2
O
SO3
растворяется в безводной H2
SO4
образуя олеум. Вливают серную кислоту тонкой струйкой в воду, а не наоборот.
Концентрированная H2
SO4
поглощает пары воды, поэтому её применяют в качестве осушителя; она отнимает воду и от органических веществ обугливая их. Полиамиды (капрон, нейлон), шёлк быстро разрушаются ею, шерсть более устойчива к её действию.
Получение
H
2
SO
4
1) константный способ. катализатор – Pt, кислота получается любой концентрации. SO2
поглощается H2
SO4
получается олеум. Конценрацию (98%) получают смешиванием олеума с разбавленной H2
SO4
.
Схема получения:
O2
O2
H2
O
FeS2
→ SO2
→ SO3
→ H2
SO4
катализ
2) нитрозный способ: катализатор – оксиды азота. Конечный продукт содержит 78% H2
SO4
2
NO
+
O
2
→ 2
NO
2
SO2
+ NO2
+ H2
O → H2
SO4
+ NO
Химические
свойства
H2
SO4
Концентрированная H2
SO4
(ω=93 – 98%) более сильный окислитель (особенно при нагревании), окисляет даже металлы после Н2
; не окисляет Fe(только при нагревании), Au, Pt- новые металлы.
В зависимости от концентрации:
t
(
Ag
,
Cu
)
Zn
+
H
2
SO
4
K
→
ZnSO
4
+
SO
2
↑ +
H
2
O
3Zn + 4H2
SO4
→ 3ZnSO4
+ S↓ + 4H2
O
ω
=50%
4Zn + 5H2
SO4
→ 4ZnSO4
+ H2
S↑ + 4H2
O
Конц. H2
SO4
окисляет неметаллы:
t
2P + H2
SO4
→ 2H3
PO4
+ 5SO2
↑ + 2H2
O
t
S + 2H2
SO4
→ 3SO2
↑ + 2H2
O
При комнатной t HI, HBr, H2
S
8HI +H2
SO4
→ 4I2
+ H2
S↑ + 4H2
O
H2
S + H2
SO4
→ S + SO2
↑ + 2H2
O
Разбавленная обладает всеми типичными свойствами кислот:
1) Изменяет окраску индикаторов.
2) Реакции с:
Oсновными оксидами CaO + H2
SO4
= CaSO4
+ H2
O
Амфотерными оксидами ZnO + H2
SO4
= ZnSO4
+ H2
O
Щёлочами KOH
+
H
2
SO
4
=
K
2
SO
4
+
H
2
O
Нерастворимыми основаниями
Cu(OH)2
+ H2
SO4
= CuSO4
+ 2H2
O
Солями K2
С
O3
+ H2
SO4
= K2
SO4
+
СО
2
+ H2
O
K2
SiO3
+ H2
SO4
= K2
SO4
+ H2
SiO3
↓
С аммиаком 2NH3
+ H2
SO4
= (NH4
)2
SO4
И его водными растворами NH
3
∙Н2
О +
H
2
SO
4
=
NH
4
Н
SO
4
+ Н2
О
При взаимодействии с Ме в РСЭП до Н2
разб. H2
SO4
обладает окислительными свойствами за счёт ионов Н+
Fe
+
H
2
SO
4
p
→
FeSO
4
+
H
2
(у металлов реализуется низшая степень окисления).
Важное свойство её нелетучесть, поэтому используют для получения летучих кислот путём вытеснения из сухих (крист).
KCl
кр.
+
H
2
SO
4
K
→
KHSO
4
+
HCl
↑
Безводная H2
SO4
– вязкая маслянистая жидкость, требует осторожного обращения во избежание разбрызгивания вливать надо H2
SO4
в воду, а не наоборот.
Тиосоединения
. При замене в сульфат-ионе одного атома кислорода на атом серы образуются тиосульфат –ионы S2
O3
2-
.
В лаборатории тиосульфаты получают при кипячении раствора сульфита с порошком серы.
Na2
S+4
O3
+ S0
= Na2
S2
+6/ -2
O3

Тиосерная кислота неустойчива из-за протекания внутримолекулярного окислительно-восстановительного процесса. Поэтому при подкислении тиосульфатов они начинают выделять свободную серу и SO2.

Сильные кислоты вытесняют из тиосульфатов тиосерную кислоту:
Na2
S2
O3
+ 2HCl = H2
S2
O3
+ 2NaCl =H2
O + SO2
↑+ S↓
Na2
S2
O3
+ 2HCl → 2NaCl + SO2
↑ + S↓ +H2
O
Наличие в тиосульфатах S-2
придаёт им восстановительные свойства.
В фотографии кристаллогидрат Na2
S2
O3
∙5H2
O (под названием гипосульфит) является основным компонентом для приготовления закрепляющих растворов, т.к. образует с ионами Ag+
прочные комплексы [Ag+
(S2
O3
)2
]3-
, удаляет из фотоэмульсии неизрасходованные галогениды серебра.
Пиросульфаты
– соли пиросерной кислоты (двусерной), H
2
S
+6
2
O
7
.
Это смесь SO3
и H2
SO4
, так называемый олеум (смесь полисерных кислот), состав можно представить H
2
SO
4
∙
xSO
3
.


Пероксосульфаты
H
+
2
SO
-2
5
(пероксомоносерная)
(мононадсерная)


Применение солей
Na
2
SO
4
∙ 10
H
2
O
– глауберова соль (в производстве соды, стекла)
2
CaSO
4
∙
H
2
O
– алебастр (лепка, шины при переломах)
MgSO
4
∙ 7
H
2
O
– (горькая соль) в медицине слабительное.
CuSO
4
∙ 5
H
2
O
– для борьбы с вредителями сельского хозяйства.
FeSO
4
∙ 7
H
2
O
– для очистки воды, консервирования (предохранение древесины от гниения)
BaSO
4
– медицине рентгеноконтрастное вещество.
ZnSO
4
∙ 7
H
2
O
– цинковый купорос – протрава при крашении тканей.

4. Биогенная роль
Кислород
– самый распространенный и самый активный и химически подвижный элемент земной коры. Кислород входит в состав свыше 1200 минералов. Господствуют среди них соли кислородных кислот и оксиды. Кислород образует соединения со всеми химическими элементами (кроме благородных газов) и с большинством из них реагирует непосредственно.
ОН-
- составная часть воды – составляет 70% живого вещества.
Кислород входит практически во все жизненно важные молекулы. Исключительно велика его роль в процессах фотосинтеза. Выделяясь при фотосинтезе, он поступает в атмосферу.
С содержанием кислорода в воздухе, воде и почве связаны многие жизненные процессы. Например «горная болезнь» вызывается недостатком кислорода в высокогорных условиях.
Из рыб наименее требователен к содержанию кислорода карась, который спокойно живёт в заросших прудах, где почти весь кислород расходуется на окисление органических веществ. В то же время карп очень требователен в этом отношении. Ещё больше кислорода требуют форель и другиевиды рыб горных рек и водоёмов.
Ежегодно в мире сжигается 7-8 млрд. т. органического топлива, на что расходуется около 10-12 млрд.т. свободного кислорода атмосферы. Только один реактивный лайнер при перелете из Америки в Европу за 8 часов расходует 70-75т. кислорода. Примерно такое количество кислорода могут произвести за тоже время 25-50 тыс. га леса. Но советский географ Давитал подсчитал, что даже при 5% ежегодного прироста сжигаемого топлива уже примерно через 150-180 лет содержание кислорода в атмосфере может снизится до критического для человека предела.
Уменьшение парциального давления на 1/3 вызывает кислородное голодание, а на 2/3 – смертельный исход.
Сера
– важнейший биофильный элемент, активно захватывается живым веществом, входит в состав белков и других соединений. Сера – относительно распространенный химический элемент. Содержание в земной коре равен 5·10-2
%. В различных количествах сера входит в состав всех растительных и животных организмов. Особенно её много в белках. Её можно назвать «связывающим веществом» белка, поскольку главной функцией серы является обеспечение полипептидных связей в молекуле белка. Сульфидная сера содержится в крови многих позвоночных животных. Она – важный компонент многих биологически активных веществ (например, витаминов), гормонов инсулина и катализатора глютатиона. В животных организмах сера обнаружена в нервных тканях, в хрящах и костях, в желчи. Животные усваивают этот элемент в основном в виде аминокислот, но всасываться из пищеварительного тракта могут и неорганические соединения (сульфаты, сероводород и т. д. )
Все органические соединения серы – суфамидные препараты: сульфидин, сульфазол, сульгин, сульфодимизин, стрептоцид и др. подавляют активность многочисленных микробов. Многие антибиотики также содержат в своём составе серу.
SO2
и H2
SO3
обесцвечивают многие красители, образуя бесцветные соединения, которые могут снова разлагается при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие их отличается от белящего действия хлора. Обычно SO2
белят шерсть, шёлк, солому. SO2
убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др.Используют при перевозке и хранении фруктов и ягод.
Ca
(
HSO
3
)2
– сульфитный щелок – обрабатывают древесину и бумажную массу.

Серный цвет – коллоиднодисперсная сера – используется как инсектицид и фунгицид.
Важнейшее для сельского хозяйства соединение H2
SO4
в огромных количествах расходуется для производства фосфорных удобрений.
Серу используют в медицине, сельском хозяйстве как в свободном так и связанном виде. Молотую серу используют для опыливания растений против вредителей. SO2
окуривают зернохранилища. Растения усваивают её из растворимых в воде сульфатов. В ветеринарии серные мази используют для лечения кожных заболеваний. Идёт на изготовление спичек.
В производстве резины серу (или её соединения) используют для вулканизации каучука, т. е. поперечного «сшивания» его макромолекул. При введении в каучук максимального количества серы в результате вулканизации получается эбонит - жёсткий материал, обладающий электроизоляционными свойствами. Сера используется при изготовления чёрного пороха, сероуглерода, H2
SO4
.
Селен используют для изготовления выпрямителей и фотоэлементов. Многие селениды и теллуриды применяют как полупроводники. Добавка селена к стеклу и эмали окрашивает их в красный цвет.
ЛЕКЦИЯ 7
Тема: р - Элементы
VII
группы (галогены)
1.Общая характеристика элементов
Элементы фтор, хлор, бром, иод, астат составляют главную подгруппу VII группы – семейство галогенов
(в переводе с греческого соль рождающие). Объясняется их способностью образовывать бинарные соединения типа NaCl за счёт проявления ими окислительных свойств.
На внешнем уровне у них 7 электронов ns
2
np
5
,
электронная конфигурация обусловливает характерную степень окисления всех элементов в их соединениях (-1). В то же время для хлора, брома и иода известны соединения, где их степени окисления имеют положительные значения: +1, +3, +5, +7. 
До завершения оболочки не достаёт 1 электрона. Поэтому галогены – сильные окислители. Это типичные неметаллы (за исключением At, и отчасти иода). Обладают большим сродством к электрону (сродство к электрону – энергия, которая выделяется при присоединении к атому одного электрона).
Легко присоединяют электрон Э + е-
= Э-
, достраивая электронную оболочку до устойчивой оболочки атомов ближайших благородных газов. Радиус иона больше радиуса атома, так как при присоединении электронов радиус увеличивается. Окислительная способность (т.е. способность присоединять электроны у галогенов уменьшается от F к At). Поэтому фтор вытесняет все следующие за ним галогены, у йода и астата появляются металлические признаки.
При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Наl2
 - F2
, Cl2
, Br2
, I2
. - F2
, Cl2
, Br2
, I2
.
Сила связи Э – Э уменьшается вниз по группе за исключением связи F – F, которая неожиданно слабее (причина этого, по-видимому, состоит в более близком расположении неподелённых электронных пар из-за малых размеров атома фтора, отталкивание неподелённых электронных пар ослабляет связь). В Cl2
, Br2
, I2
– дативная связь дополнительная, за счёт спаренных p-электронов одного атома и вакантных d-орбиталей другого.

Аномальное изменение энергии связи связано с различными размерами атомов. ЕF
2
< ECl
2
за счёт малых размеров атома F. На близком расстоянии атомы отталкиваются друг от друга. С одной стороны в молекуле Cl2
действуют силы отталкивания между неподелёнными электронными парами, находящихся на близком расстоянии. Самой прочной молекулой является молекула Cl2
. Это связано с тем, что в дополнение к образованию связи по спин-валентному механизму, происходит добавочное взаимодействие свободных электронных пар одного атома хлора со свободной в орбиталью другого - по донорно-акцепторному механизму. Такие дополнительные связи называются дативными
и приводят к упрочнению молекулы. 
Уменьшение энергии связи от Cl2
к I2
объясняется увеличением расстояний между атомами. Увеличение tплавл.
связано с тем, что с увеличением размера атома возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, а чем более прочная связь между молекулами, тем более высокая tплавл.
.
Физические свойства галогенов существенно различаются: так, при нормальных условиях F2
– зеленовато – жёлтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании а организм человека вызывает отёк лёгких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей.
Cl2
– также газ желто – зеленого цвета, но сжижается легко; Br2
– красно- коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл). I2
– фиолетовые кристаллы. Для человека смертельная доза 2-3 г йода, но в форме иодид - ионов безвреден.
Общая характеристика VII группы

Галоводороды
- летучие водородные соединения галогенов, хорошо растворимы в воде, ведут себя в водных растворах как кислоты. Сила кислот (способность к диссоциации на ионы) растёт сверху вниз, т. к. уменьшается прочность связи Н – Э в молекулах от F к At.
2.Особые свойства фтора,
как наиболее электроотрицательного элемента
Фтор
. Из всех галогенов у него наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7.

Строение молекулы F2
по МВС
 
(обменный механизм)
Строение молекулы F2
по ММО

Исключительная химическая активность фтора обусловлена с одной стороны большой прочностью образуемых им связей, так энергия связи H - F 566кДж/моль, с другой стороны низкой энергией связи в молекуле F2
– 151кДж/моль.
Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома.
Низкое значение энергии связи в молекуле F2
, объясняется сильным отталкиванием электронных пар, находящихся на π- орбиталях, обусловленным малой длинной связи F – F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы и энергия активации реакций с элементарным фтором обычно невелика, поэтому процессы с участием F2
протекают очень быстро.
Нахождение в природе
F
CaF2
- плавиковый шпат
Na3
[AlF6
] – криолит
Ca+2
5
(PO4
)-3
3
F - фтораппатит
Cl
NaCl - поваренная (каменная соль)
KCl∙NaCl- сильвинит
KCl∙MgCl2
∙6H2
O- карналит
Br
в нефтяных скважинах
I
в морской воде
Способы получения
F
2
- только электролизом расплавов солей (в смеси с HF) KF∙HF

Электроды из Ni, либо сплавов Ni с Fe, Mn, Cu, т. к. F2
очень активен и реагирует почти со всеми элементами. Ni устойчив в атмосфере фтора за счёт образования плёнки NiF2
. Поэтому F2
хранят в баллонах, выполненных на основе сплавов никеля.
CoF
3
=
CoF
2
+ ½
F
2
в лаборатории разложением фторидов.
С
l
2
в лаборатории действием сильных окислителей на соляную кислоту
2KMnO4
+ 16HCl → 5Cl2
+ 2MnCl2
+ 2KCl + 8H2
O
(при обычной температуре)
MnO
2
+ 4
HCl
→
Cl
2
+
MnCl
2
+ 2
H
2
O
PbO2
+ 4HCl → PbCl2
+ Cl2
+ 2H2
O
2
AuCl
3
→ 2
Au
+ 3
Cl
2
Промышленный способ – электролиз водных растворов поваренной соли NaCl
электролиз
2NaCl + 2H2
O → H2
+ Cl2
+ 2NaOH
K ( - ) 2H2
O + 2ē = H2
+ 2
О
H-
А ( + ) 2Cl-
- 2ē = Cl2
Br
2
и I
2
получаются реакциями замещения
2KBr + Cl2
→ 2KCl + Br2
Na
Э
+ MnO2
+ H2
SO4
→
Э
2
+MnSO4
+ Na2
SO4
+ H2
O (
Э
=Br2 ,
I2
)
NaI + NaNO3
+ H2
SO4
→ I2
+ NO2
+ Na2
SO4
Химические свойства галогенов
Стандартная энтальпия диссоциации ∆Н > 0 (энергия поглощается)
Э2(г)
= 2Э(г)
Первое сродство к электрону галогена X
(г)
+ ē =
X
-
(г)
∆Н<0 (энергия выделяется).
Энергия выделяется при образовании галогенида
M
+
(г)
+
X
-
(г)
→
MX
(тв)
Фтор
реагирует со взрывом со всеми металлами и неметаллами, кроме O2
, N2
, Гal2
при этом во всех соединениях с фтором элементы имеет высшую степень окисления.
Например:
SiO
2
+ 2
F
2
=
Si
+4
F
4
+
O
2
(во фторе горит SiO2
, H2
O)
t = 0º – 90º Н
2
O + F2
=
Н+
F + O+2
F2
(H2
O + F2
=HF + O2
(O3
)

2 Au + 3F2
= 2AuF3
5P + 5F2
= 2PF5
2
NH3
+ 3F2
= 6HF + N2
F2
+ NaOHP
→ NaF + OF2
+ H2
O
2F2
+ 4NaOH
К
→ 4NaF + O2
+ 2H2
O
(
O
3
)
F
2
+
Xe
→
XeF
4
В ряду Cl2
, Br2
, I2
окислительная активность падает, а восстановительная активность увеличивается, поэтому, если протекает реакция,
Cl2
+ I2
+ H2
O→HCl + HIO3
ок
.
восст
хлор выступает в роли окислителя.
1) Галогены реагируют с неметаллами, образовывая галогениды:

2) С металлами, которые приобретают высшую степень окисления:
2
Fe
+ 3
Cl
2
→ 2
FeCl
3
3) реагируют с H2
, только Br2
и Cl2

4)Cl2
и Br2
реагируют с H2
Oобразуя хлорную и бромную воду, а с I2
реакция практически не протекает
Г
al
2
+
H
2
O
→
H
Г
al
+
H
Г
alO
5) Гal взаимодействует с растворами щёлочей, продукты зависят от температуры
Cl2
+NaOH → NaCl + NaClO + H2
O
t >70ºC
3
Cl
2
+ 6
NaOH
→ 5
NaCl
+
NaClO
3
+ 2
H
2
O
с I2
один продукт, NaIO3
, а NaIO – не образуется.
I
2
+
NaOH
→
NaI
+
NaIO
3
+
H
2
O
В ряду Cl2
– Br2
– I2
– металлические свойства усиливаются, что связано с увеличением размера атома. Поэтому I2
реагируя с концентрированной HNO3
, образует катион I+
, или присутствует в кислотном остатке в виде IO3
-
.
I2
+ AgNO3
→ AgI + INO3
I2
+ HNO3
конц
.
→ HIO
3
+
NO
2
+
H
2
O
IСlO4
– перхлорат йода, йод в катионной форме неустойчив

Водные растворы HГаl – кислоты, сила кислот ↓ увеличивается.
- Способы получения галогеноводородов и их свойства
HF
H2
+ F2
– не получается из-за высокой Q
1)С
aF
2
+
H
2
SO
4
→
CaSO
4
↓ + 2
HF
↑
t
летуча
2)
KHF
2
→
KF
+
HF
hν
HCl
1)
H
2
+
Cl
2
→ 2
HCl
2)
NaCl
к
+
H
2
SO
4 конц.
→
NaHSO
4
+
HCl
↑
3) BCl3
+ H2
O → H3
BO3
+ HCl↑

Протекает ОВР
NaBr + H2
SO4
→ Br2
+ SO2
+ Na2
SO4
+ H2
O
NaI + H2
SO4
→ I2
+ S + Na2
SO4
+ H2
O
(
H
2
S
)
Поэтому HBr и HI получают гидролизом галогенидов фосфора.
PBr5
+ 4H2
O → H3
PO4
+ 5HBr-
PBr3
+ H2
O → HBr↑+ H3
PO3
-
PI3
+ 3H2
O → H3
PO3
+ 3HI
Безводный HF неэлектролит, а в жидком HF возможны процессы ионизации.
2HF → H+
+ HF2
-
3HF → HF2
-
+ H2
F+
Жидкий HF образует целые цепочки, состоящие из молекул HF-
(6,8) (HF)4
, (HF)6
, (HF)8
, только при t = 3500ºС возможен разрыв связи H – F.
Вследствие наличия сильной водородной связи даже в парах молекулы HF ассоциированы. HF может смешиваться с Н2
О в неограниченном количестве, образуя слабую плавиковую кислоту, при этом между молекулами HF и Н2
О также возникают водородные связи.


HF хранят в сосудах из платины или полиэтилена. В стеклянном сосуде хранить нельзя т. к. в стекле есть SiO2
, а плавиковая кислота разрушает стекло.
SiO
2
+ 4
HF
=
SiF
4
+ 2
H
2
O
– реакция травления стекла
SiF
4
+ 2
HF
=
H
2
[
SiF
6
]
Для HF характерны обычные свойства кислот
Zn + 2HF = ZnF2
+H2
3HF + Al(OH)3
= AlF3
+3H2
O
HF + KOH = KHF2
+ H2
O
NH3
+2HF = NH4
HF2
Фториды – в основном нерастворимые соединения. Как и другие бинарные соединения они бывают:
Основные - галогениды металлов.
Амфотерные - с амфотерными элементами.
Кислотные - с неметаллами.

2
KF
+
SiF
4
→
K
2
[
SiF
6
]
3
NaF
+
AlF
3
→
Na
3
[
AlF
6
] 2
KF
+
BeF
2
→
K
2
[
BeF
4
]
O K O K
3SiF4
+ 2AlF3
→ Al2
[SiF6
]3
K O
2KI + HgI 2
→ K2
[HgI4
] KBr + AlBr3
→ K[AlBr4
]
К О
Для элементов 2-го периода К.ч. = 4
3-го периода К.ч. = 6
Основные фториды гидролизуются, только растворимые в воде:
2
NaF
+
H
2
O
→
NaHF
2
+
NaOH
Кислотные гидролизуются с образованием 2-х кислот:

Свойства Н
Cl
, Н
Br
, Н
I
Водные растворы – сильные кислоты, галогениды – сильные восстановители:
t
2HCl-
+ O2
↔ 2H2
O-2
+ Cl2
0
процесс
Дикона
при t < 6000
С окислитель - кислород, при высоких – хлор, поэтому процесс может протекать в прямом и обратном направлениях.
HI
-
+
O
2
→
HI
+5
O
3
+
H
2
O
Восстановительные свойства НГаl проявляются в реакциях с кислотами:

HBr + H2
SO4
к
.
→ Br2
+ S +H2
O
HI I2
(H2
S)
HBr + H2
SO4
разб
.
→
Br
2
+
SO
2
+
H
2
O
I
2
Для всех этих кислот характерны реакции с Ме, с основными оксидами, с основаниями и некоторыми солями. НCl при взаимодействии с сильными окислителями окисляется до свободного хлора.
PbO
2
+ 4
HCl
→
PbCl
2
+
Cl
2
+
H
2
O
Гидролиз галогенидов
Основной галогенид – с образованием сильного электролита:
MgCl
2
+
HOH
↔
MgOHCl
+
HCl
2KF + HOH → KHF2
+ KOH
Кислотный галогенид - с образованием 2-х кислот
PCl5
+ H2
O → H3
PO4
+ HCl
4.
Кислородсодержащие соединения галогенов
Галогены непосредственно с кислородом не взаимодействуют. Это обусловлено небольшой энергией связи Г-О и невозможностью использовать высокие температуры для осуществления реакций окисления, т.к. для них ∆S0
<0, оксиды получают косвенным путём.
При 25ºС сравнительно стабильны следующие кислородные соединения:
+1 +4 +6 +7
Cl
2
O
ClO
2
Cl
2
O
6
Cl
2
O
7
в соединениях с О2
хлор проявляет степени окисления (с. о.):
с. о. +1 +3 +4 +5 +6 +7
оксид Cl2
O ClO2
Cl2
O4
Cl2
O6
Cl2
O7
кислота HClO HClO2
HClO2
HClO3
HClO3
HClO4
HClO3
HClO4

Если сопоставить свойства кислот со структурой молекул, то можно отметить следующее: с ростом степени окисления хлора уменьшается число несвязывающих электронных пар и происходит постепенное достраивание кислородного окружения хлора до тетраэдрического.
Увеличение силы кислот HClO – HСlO4
обусловлено тем, что с ростом числа кислородных атомов электронные облака всё больше стянуты к центральному атому и связь Н – О становится всё более полярной.
Окислительные свойства уменьшаются, у оксо-анионов
ClO-
, ClO2
-
, ClO3
-
, ClO4
-
- увеличивается прочность связи кислорода с хлором.
Оксикислоты хлора

Возрастание силы кислот связано с увеличением количества кислорода, который оттягивает на себя электронную плотность и прочность связи Н – О ослабевает.
Возрастание устойчивости связано с увеличением степени окисления хлора и большим количеством электронов, принимающих участие в образовании связи. Во всех соединениях Cl – в sp3
гибридизации.
Самая высокая окислительная способность у хлорноватистой кислоты, за счет атомарного кислорода.
H
С
lO = HCl + O

Реакции разложения
HClO
1.
HClO
→
H
С
l
+
O
2.
2
HCl
+1
O
→
HCl
-
+
HCl
+3
O
2
3. 2
HClO
→
Cl
2
O
+
H
2
O

Cl2
+ H2
O → HCl + HClO
ClF + H2
O → HClO + HF
Cl2
+KOH
хол
→ KCl + KClO + H2
O
Cl2
+ KOH
гор
→ KCl + KClO3
+ H2
O
Гипохлорит калия KClO → KCl + O2
KClO → KCl + KClO2
(
KClO
3
)
(
KClO
4
)
Получение белильной извести.
Cl
2
+
Ca
(
OH
)2
→
CaOCl
2
+
H
2
O
- очень сильный окислитель даже на воздухе разлагается очень сильный окислитель даже на воздухе разлагается
CaOCl2
+
СО
2
+ H2
O → CaCl2
+ CaCO3
+ O
CaOCl2
+ HCl → CaCl2
+ Cl2
+ H2
O
ClO2
– газ жёлтого цвета HClO3
напоминает HNO3
KClO3
- бертолетова соль

Cl2
O6
- тёмно-красная жидкость, получена
2
ClO
2
+
O
3
→
Cl
2
O
6
+
O
2
Cl2
O7
- маслянистая бесцветная жидкость, получается
обезвоживанием HСlO4
2
H
С
lO
4
+
P
2
O
5
→
Cl
2
O
7
+ 2
HPO
3
Окислительные свойства почти не проявляет
KClO4
+ H2
SO4 (
к
)
→ HClO4
+ KHSO4
KClO
4
→
KCl
+
O
2
разложение

Самая высокая окислительная способность у хлорноватистой кислоты.
H
С
lO
=
HCl
+
O
Кислородсодержащие кислоты брома и йода
H5
IO6
можно получить
IF
7
+ 4
H
2
O
→ 7
HF
+
H
5
IO
6

5.
Биогенная роль (фтор и йод как микроэлементы)
Безводный перхлорат магния Mg(ClO4
)2
жадно поглощает воду, образуя кристаллогидраты. Это один из наиболее сильных осушителей. Техническое название ангидрон. Он удобен тем, что после поглощения воды может быть вновь обезвожен нагреванием.
Действуя хлором на сухой гидроксид кальция получают смесь, называемую хлорной или белильной известью, которая состоит из гипохлорита и хлорида кальция.
2Ca(OH)2
+ 2Cl2
= Ca(ClO)2
+ CaCl2
+ 2H2
O
Гипохлорит кальция используется как дезинфицирующее вещество (хлорная известь). Белильная известь – это белый порошок с резким запахом. Применяется для отбеливания тканей и бумаги, дезинфекции в медицине и дегазации в противохимической обороне. Окисляет хлорная известь потому, что входящий в её состав гипохлорит кальция взаимодействует во влажном воздухе с двуокисью углерода.
+1 активный хлор обеспечивает дезинфицирующее св
o
йство
Ca(ClO)2
+ CO2
+ H2
O = 2HClO + CaCO3
↓
хлорноватистая кислота далее разлагается с выделением активного кислорода (атомного). Активный кислород обесцвечивает краски (пигменты) и убивает микробы.
HClO
=
HCl
+
O
H
–
Cl
–
O
KCl
–удобрение (калийная соль).
Раствор
I
2
в водном растворе
KI
,
I2
+ KI – раствор Люголя в медицине.
AgBr
,
AgCl
,
AgI
– в фотографии.
BaCl
2
– ядовитое вещество для борьбы с вредителями с/х.
CaCl
2
– для осушения газов (образуется CaCl2
∙6Н2
О), в медицине
HgCl
2
– сулема сильный яд разбавленные растворы используются для протравливания семян.
AgBr
– в медицине для успокоения нервной системы.
Хлораты NaClO
3
,
Mg
(
ClO
3
)2
,
Ca
(
ClO
3
)2
–
гербициды сильного действия, т. е. уничтожают все растения. В меньших дозах действуют как дефолианты.
NaI
,
KI
отхаркивающие средства при заболеваниях дыхательных путей.
 Cl
2
+
KOH
→
KClO
+
KCl
+
H
2
O Cl
2
+
KOH
→
KClO
+
KCl
+
H
2
O
Жавелева вода
Учебное издание
Апанович
Зинаида Васильевна
Курс лекций по дисциплине
«НЕОРГАНИЧЕСКАЯ ХИМИЯ»
Учебно-методическое пособие
Ст. корректор Ж.И. Бородина
Компьютерная вёрстка: З.В. Апанович
Подписано в печать
Формат 60×84/16. Бумага офсетная. Гарнитура Таймс.
Печать Riso. Усл. печ. л. 8,25. Уч.-изд. л. 9,14
Тираж … экз. Заказ №
Учреждение образования
«Гродненский государственный аграрный университет»
Л.И. №02330/0133326 от 29.06.2004
230028, г. Гродно, ул. Терешковой, 28
Отпечатано на технике издательско-полиграфического отдела
Учреждения образования «Гродненский государственный
аграрный университет».
230028, г. Гродно, ул. Терешковой, 28
|