   Кафедра Кафедра
Инженерной
экологии
ГИДРОЛИЗ
СОЛЕЙ
  №5 №5
 Цель
работы: изучить
условия протекания
процессов
гидролиза
солей и влияние
факторов,
обуславливающих
смещение ионного
равновесия
при гидролизе. Цель
работы: изучить
условия протекания
процессов
гидролиза
солей и влияние
факторов,
обуславливающих
смещение ионного
равновесия
при гидролизе.
Оборудование
и материалы:
штатив с пробирками,
растворы солей,
кислот, щелочей,
индикаторы,
кристаллы
солей, спиртовая
горелка, пипетка.
Выполнение
работы.
Опыт
№1 Смещение
ионного равновесия
в растворах
вследствие
гидролиза В
разные пробирки
внесем небольшое
количество
следующих
соединений:
НС1, NaOH, NaCl,
Ма2СОз, ZnCl2,
Си(СНзСОО)2. Во
все пробирки
приливаем
одинаковое
количество
воды и осторожным
встряхиванием
добиваемся
полного растворения
каждой соли.
Полосками
универсальной
индикаторной
бумаги измерим
рН каждого
раствора. Для
сравнения
такой же бумажкой
измерим рН
дистиллированной
воды. Данные
опыта сведены
в таблицу
|
Формула
соединения
|
Сила
кислоты и
основания
образующих
данную соль
|
Цвет
индикаторной
бумаги
|
Реакция
среды
|
|
Na2CO3
|
|
|
|
|
|
NaGl,
|
|
|
|
|
|
ZnCl2
|
|
|
|
|
|
Cu(CH3COO)2
|
|
|
|
|
Составим
сокращенные
ионные уравнения
гидролиза
солей и объясним
изменение
окраски
индикаторной
бумаги в растворах
солей в сравнении
с окраской ее
в дистиллированной
воде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт
№2 Усиление
гидролиза
одной соли
раствором
другой гидролизирующей
соли
К 3
мл концентрированного
раствора РеС1з
(соль образована
слабым основанием
и слабой
кислотой,
ее гидролиз
протекает в
основном только
по 1-ой ступени)
прильем
немного
концентрированного
раствора Ка2СОз
(соль образована,
напротив, сильным
основанием
и
слабой кислотой,
ее гидролиз
также протекает
в основном
только по 1-ой
ступени) до
образования
устойчивого
осадка. При
этом наблюдается
выделение
пузырьков. В
результате
сливания
двух вышеуказанных
растворов
происходит
образование
соли, полученной
из слабых
оснований
и кислоты. Эта
соль подвергается
полному гидролизу.
Напишем молекулярные
и
ионные уравнения
реакции:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт
№3 Растворение
металлов в
продуктах
гидролиза
солей
В
первую пробирку
нальем 3-4 мл
концентрированного
раствора ZnCl2
и опустим в
нее кусочек
цинка. В другую
пробирку нальем
столько же
концентрированного
раствора Na2COs
и
опускаем
в этот раствор
кусочек алюминия.
Нагревая пробирки,
наблюдаем
растворение
металлов
и выделение
газа в обоих
случаях. Составим
уравнения
реакций и объясним
наблюдаемые
явления.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт
№4 Влияние
температуры
на степень
гидролиза
солей В
две пробирки
нальем по 3-4 мл
концентрированного
раствора ZnCb
и по 2 кацли
индикатора
- метилового
оранжевого.
Одну пробирку
поставим в
штатив, другую
нагреваем
почти
до кипения.
Сравним окраску
индикатора
в обеих пробирках.
После остывания
снова сравним
окраску и объясним
изменение
окраски индикатора
при нагревании
раствора ZnCl2.
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт
№5 Влияние
концентрации
раствора соли
на степень ее
гидролиза
Вносим
в пробирку
немного кристаллов
соли SnCb,
1 каплю 2,5 М НС1 и
10 капель дистиллированной
воды. Встряхиванием
пробирки добиваемся
растворения
кристаллов.
Затем в
пробирку прибавим
еще 10 капель
дистиллированной
воды. Наблюдается
выпадение
осадка SnOHCl.
Следовательно,
разбавление
(уменьшение
концентрации
соли) приводит
к увеличению
степени ее
гидролиза.
Составим
молекулярное
и ионное уравнения:
__________________________________________________________________________________________________________________________________________________________________
Опыт
№6 Подавление
гидролиза соли
В
пробирку с
осадком SnOHCl,
взятую из
предыдущего
опыта, прибавим
3-4 капли 2,5 М раствора
НС1. При этом
происходит
растворение
осадка. Сделаем
выводы относительно
смещения
равновесия
реакции гидролизаОбщий
вывод по работе:
____________________________________________________________________________________________________________________________________________________________________
Общий
вывод по работе:
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
Работу
выполнил Студент
группы
|
Работу
принял Преподаватель
|
Дата
|
К   афедра
Определение
эквивалентной
Лабораторная
работа №1 афедра
Определение
эквивалентной
Лабораторная
работа №1
инженерной
массы металла
по объему
экологии
выделенного
водорода
Цель работы:
ознакомиться
с методикой
определения
и расчета молярной
массы эквивалента
металлов.
Оборудование
и материалы:
штатив, две
бюретки на 50
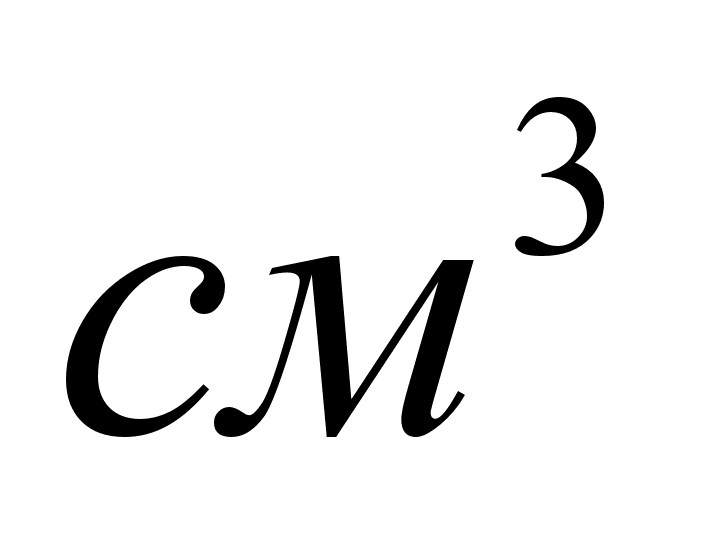 ,
пробирка с
газоотводной
трубкой, термометр,
барометр,
аналитические
весы и разновес,
навеска металла
около 0,01 г, 2,5М раствор
HCl. ,
пробирка с
газоотводной
трубкой, термометр,
барометр,
аналитические
весы и разновес,
навеска металла
около 0,01 г, 2,5М раствор
HCl.
Методика
выполнения
работы.
По объему
вытесненного
водорода можно
определить
молярные массы
эквивалентов
активных металлов
(магния, алюминия,
цинка и т.д.),
способных
вытеснять
водород из
разбавленных
кислот.
Прибор для
определения
молярной
массы эквивалента
металлов,
изображенный
на рисунке,
состоит из:
Двух бюреток
на 50
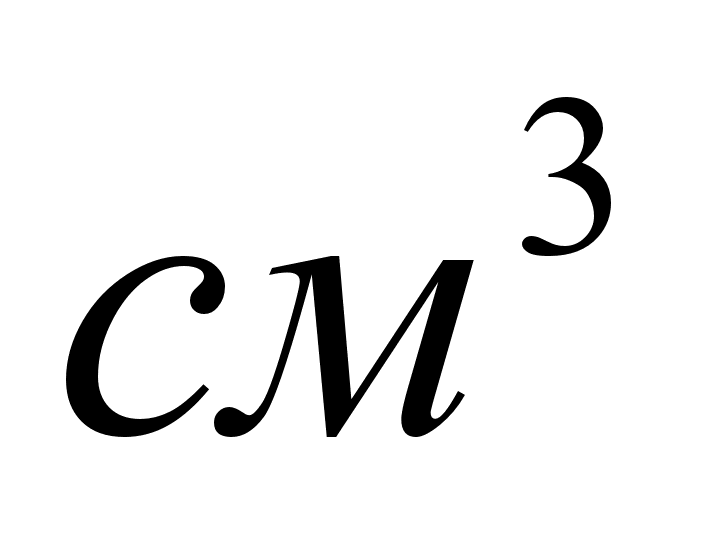 ,
соединенных ,
соединенных
резиновой
трубкой;
Реакционной
пробирки;
Газоотводной
трубки;
Штатива.
Перед началом
работы испытывают
прибор на
герметичность.
Для этого соединяют
верхний конец
правой бюретки
с пробиркой,
опускают левую
бюретку на
15-20 см, и наблюдают
3-5 мин. За положением
уровня воды
в ней. Если прибор
герметичен,
то уровень воды
в бюретке за
это время не
изменится. При
понижении
уровня нужно
исправить
дефект в приборе.
После этого
наливаем в
пробирку 4,5
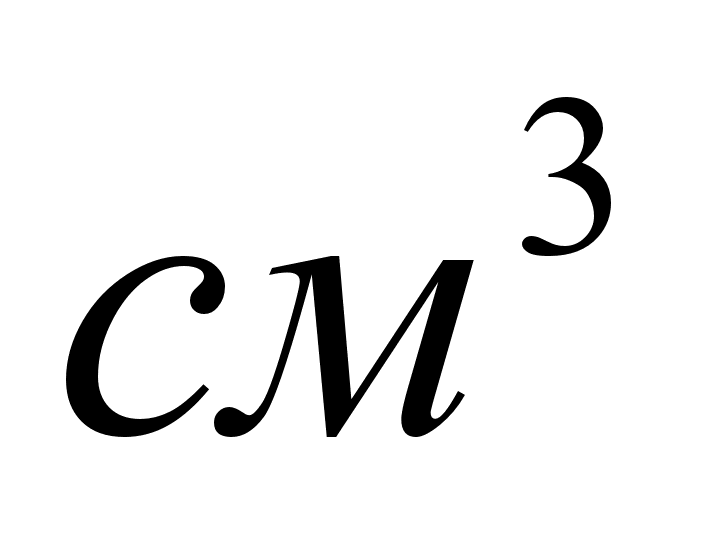 2,5М раствора
хлористо-водородной
кислоты, 5 капель
раствора
2,5М раствора
хлористо-водородной
кислоты, 5 капель
раствора
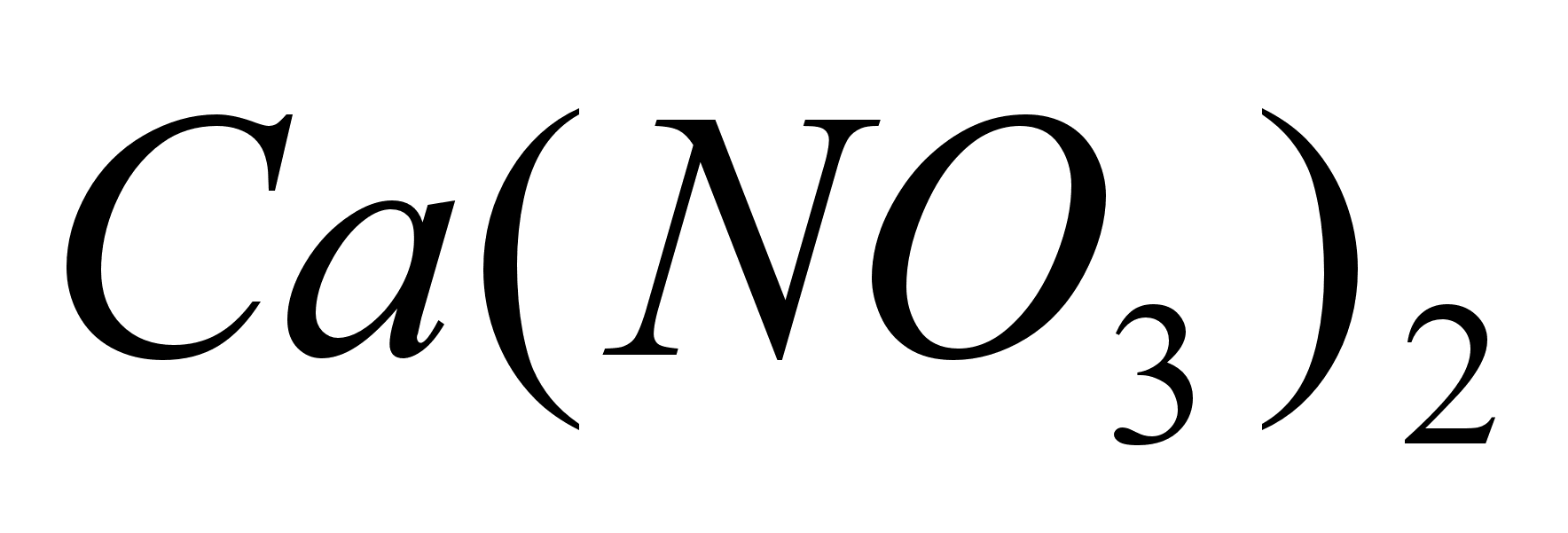 катализатора.
Папиросную
бумагу с навеской
металла смачивают
каплей воды
и приклеивают
к внутренней
стенке пробирки
над кислотой.
Пробирку с
кислотой и
металлом плотно
присоединяют
к прибору; бюретки
устанавливаем
так, чтобы уровни
воды в них были
одинаковы.
катализатора.
Папиросную
бумагу с навеской
металла смачивают
каплей воды
и приклеивают
к внутренней
стенке пробирки
над кислотой.
Пробирку с
кислотой и
металлом плотно
присоединяют
к прибору; бюретки
устанавливаем
так, чтобы уровни
воды в них были
одинаковы.
Записываем
показания
бюретки до
опыта. Затем
встряхиваем
пробирку, и
металл попадает
в кислоту. Тотчас
начинается
выделение
водорода и вода
вытесняется
из правой бюретки
в левую. Левую
бюретку при
этом надо опускать
и во время опыта
держать воду
на одном уровне,
чтобы давление
газа внутри
прибора было
все время близко
к атмосферному.
Пока идет
реакция, мы
записываем
показания
барометра и
термометра;
по таблице
определяем
давление насыщенных
паров воды.
Когда весь
металл растворился,
прекратится
понижение
уровня воды
в бюретке.
Окончательно
точный отчет
показаний
бюретки производится
после охлаждения
прибора до
комнатной
температуры
(через 10-15 мин.)
Результаты
измерений
записываем
в форме:
Масса металла,
 = ,
= ,
 . .
Показания
бюретки до
проведения
реакции,
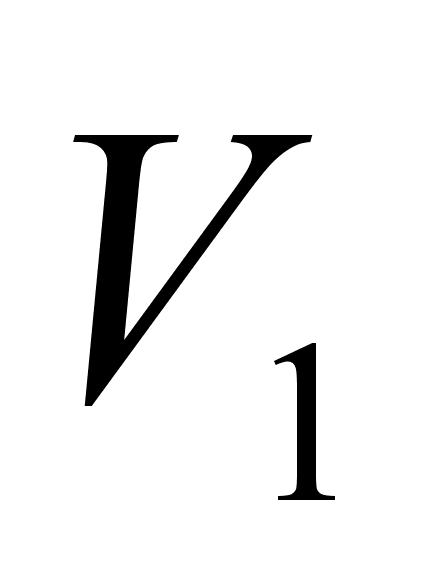 = ,
= ,
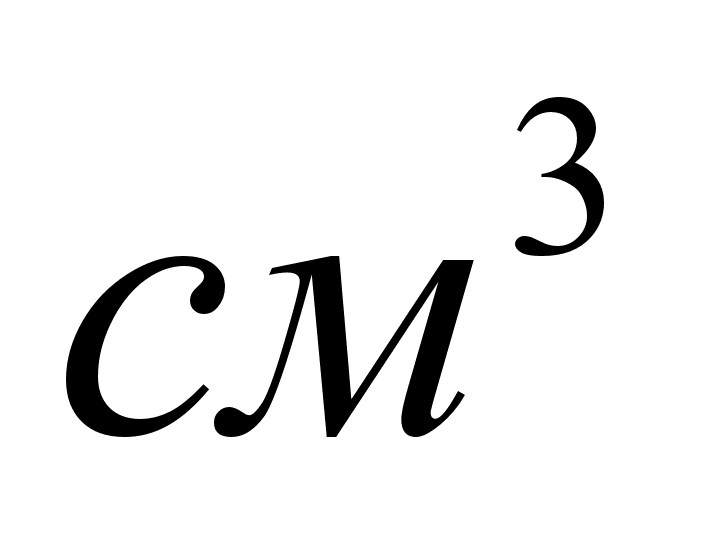
Показания
бюретки после
реакции,
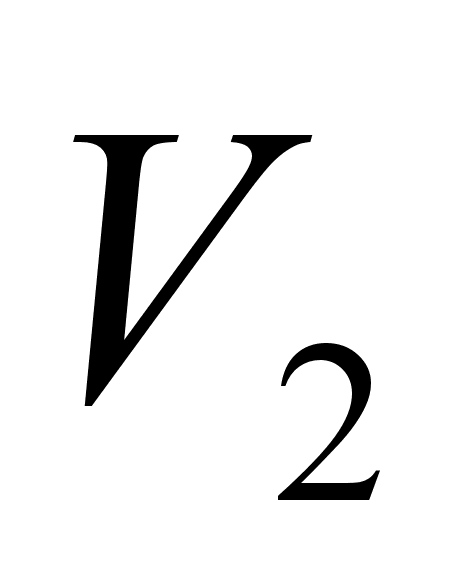 = ,
= ,
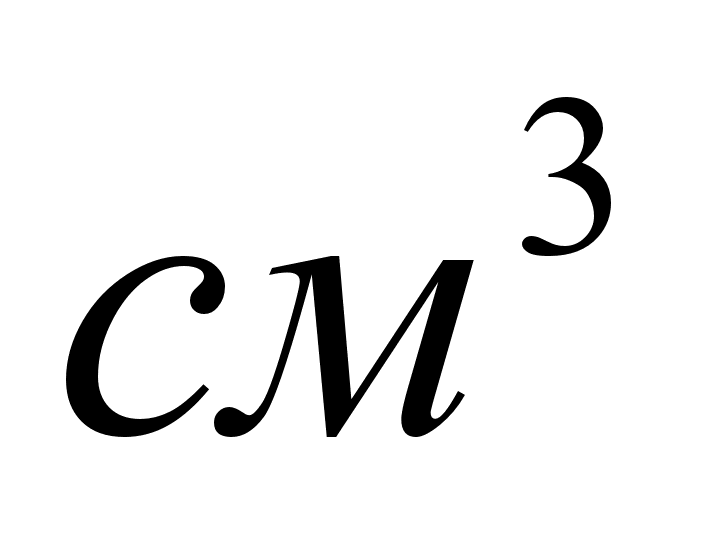
Объем выделившегося
водорода,
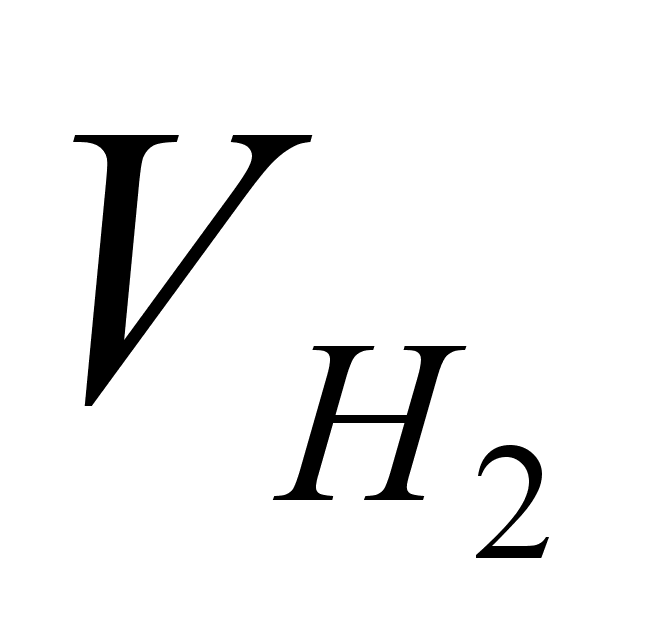 = =
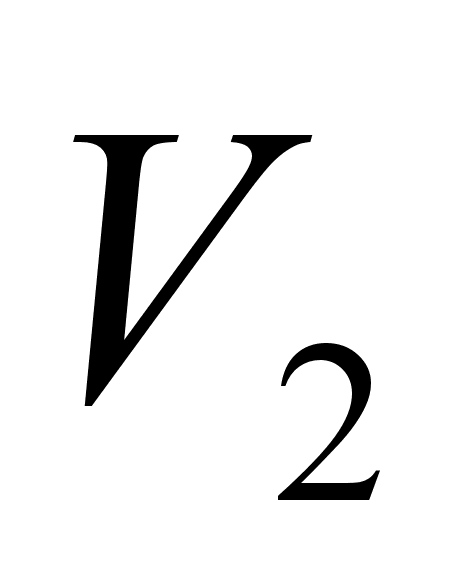 - -
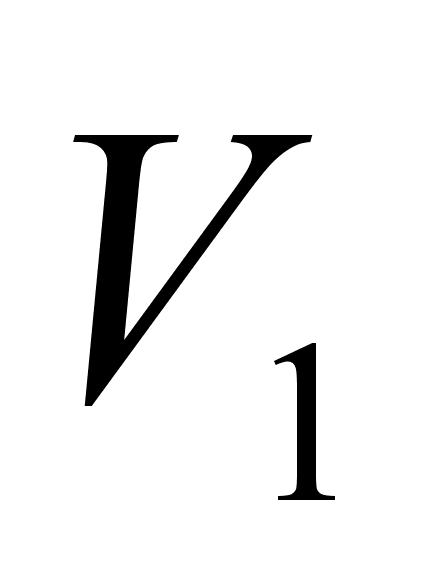 = = ,
= = ,
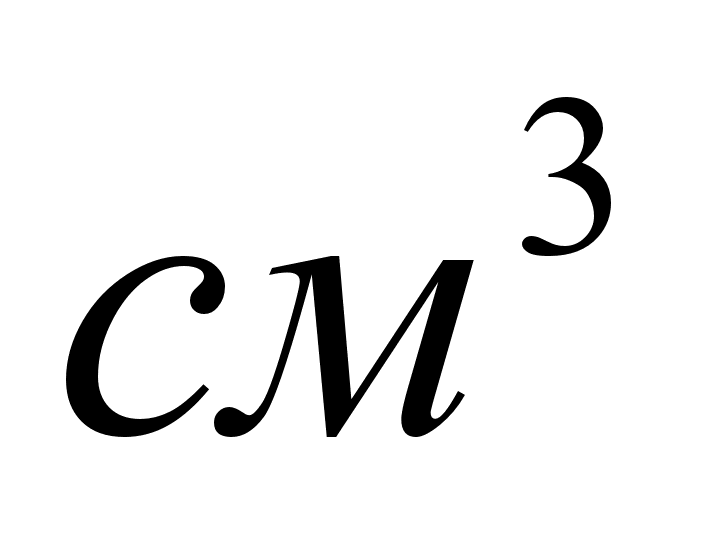
Температура
окружающей
среды
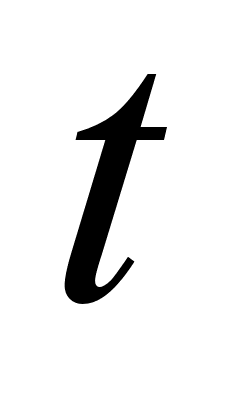 = ,
= ,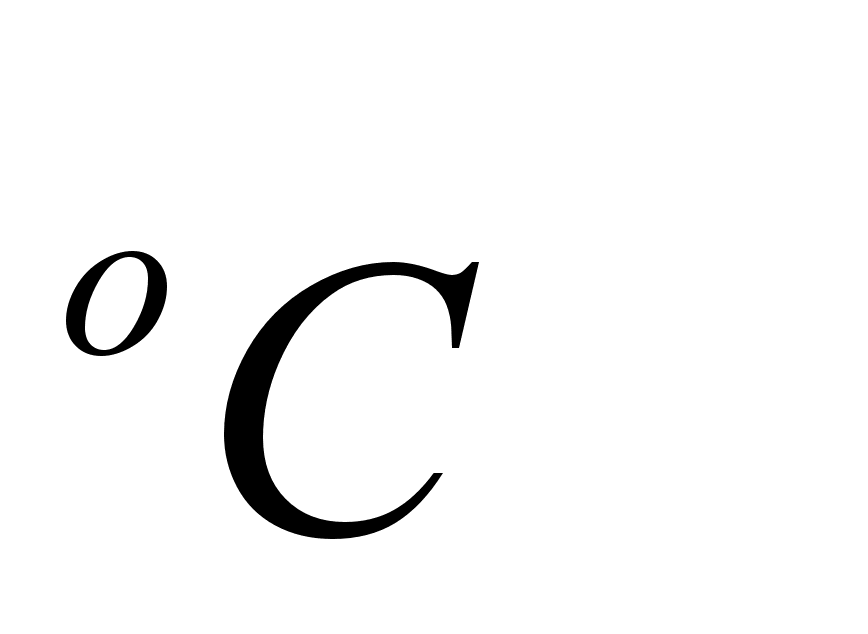
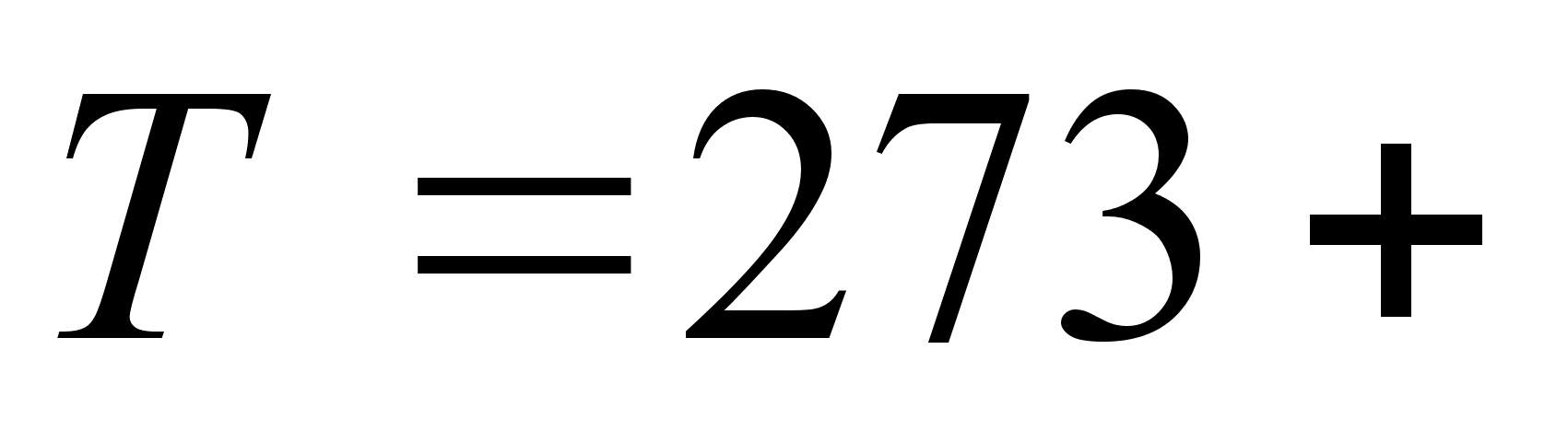 = ,
= ,
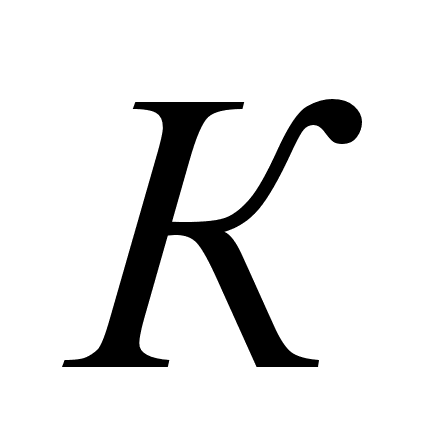
Атмосферное
давление
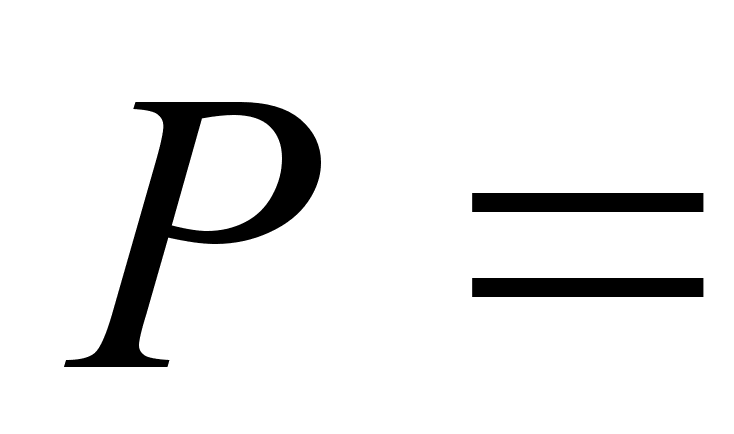 ,
,
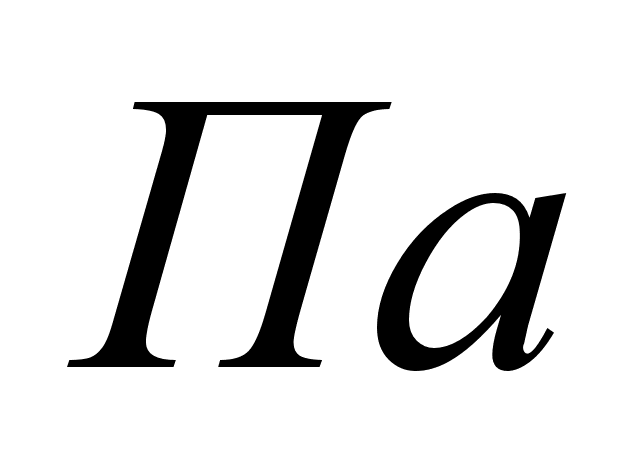
Давление
насыщенных
паров воды
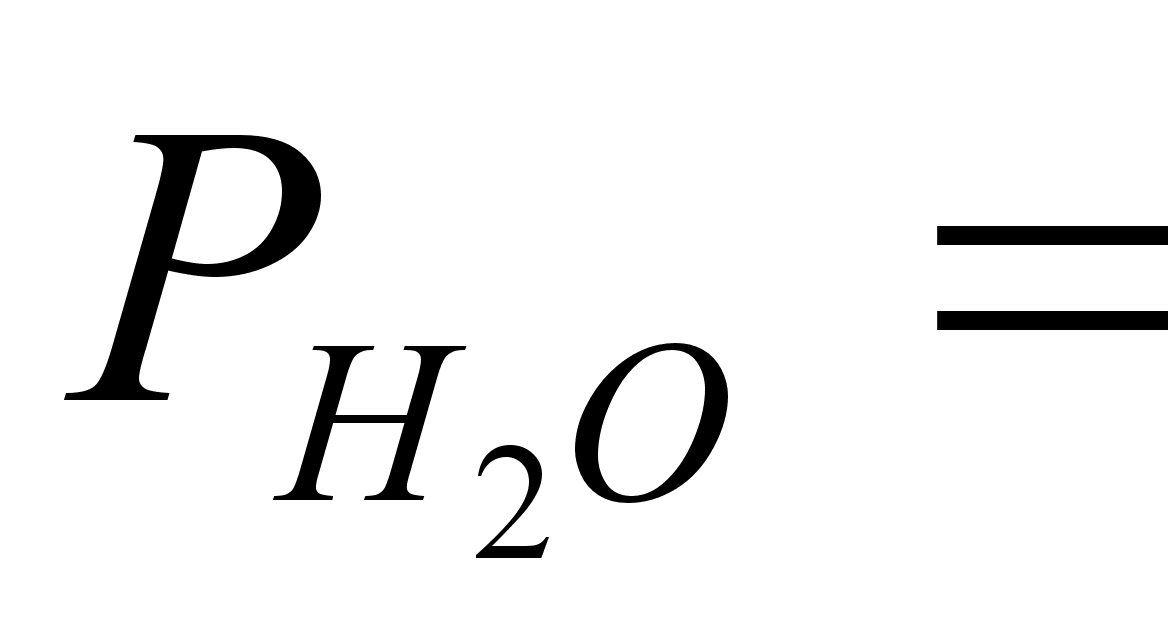 ,
,
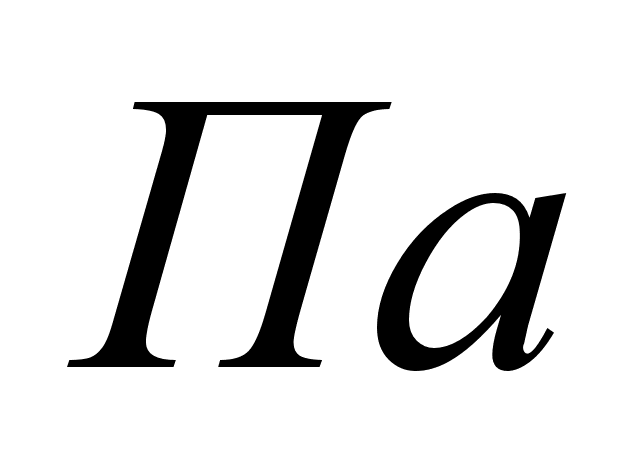
Парциальное
давление водорода
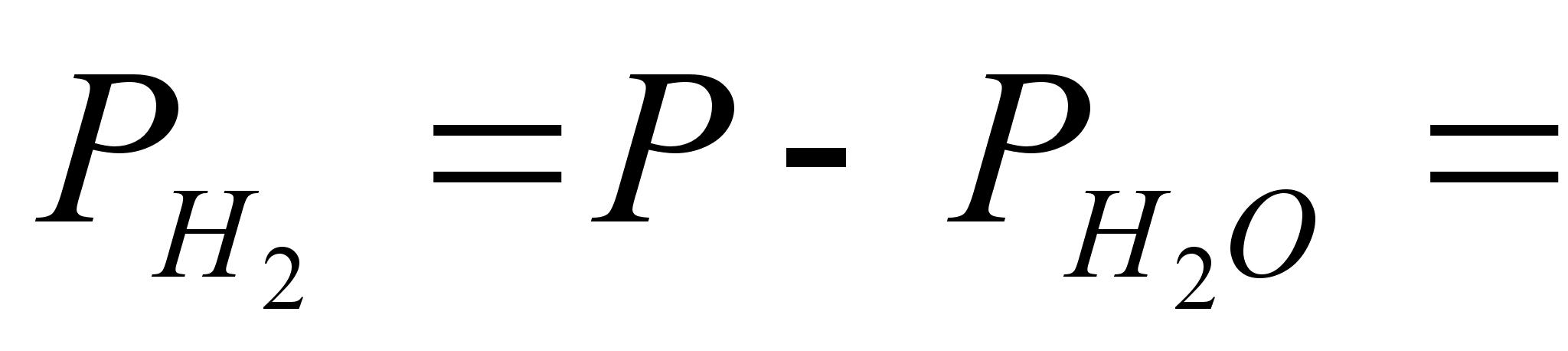 = ,
= ,
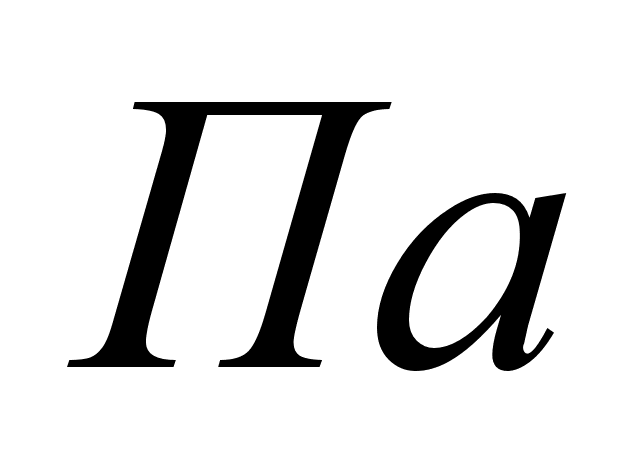
Объем выделившегося
водорода приводим
к нормальным
условиям на
основе уравнения
состояния
идеального
газа, объединяющего
законы Бойля-Мариотта
и Гей-Люссака:
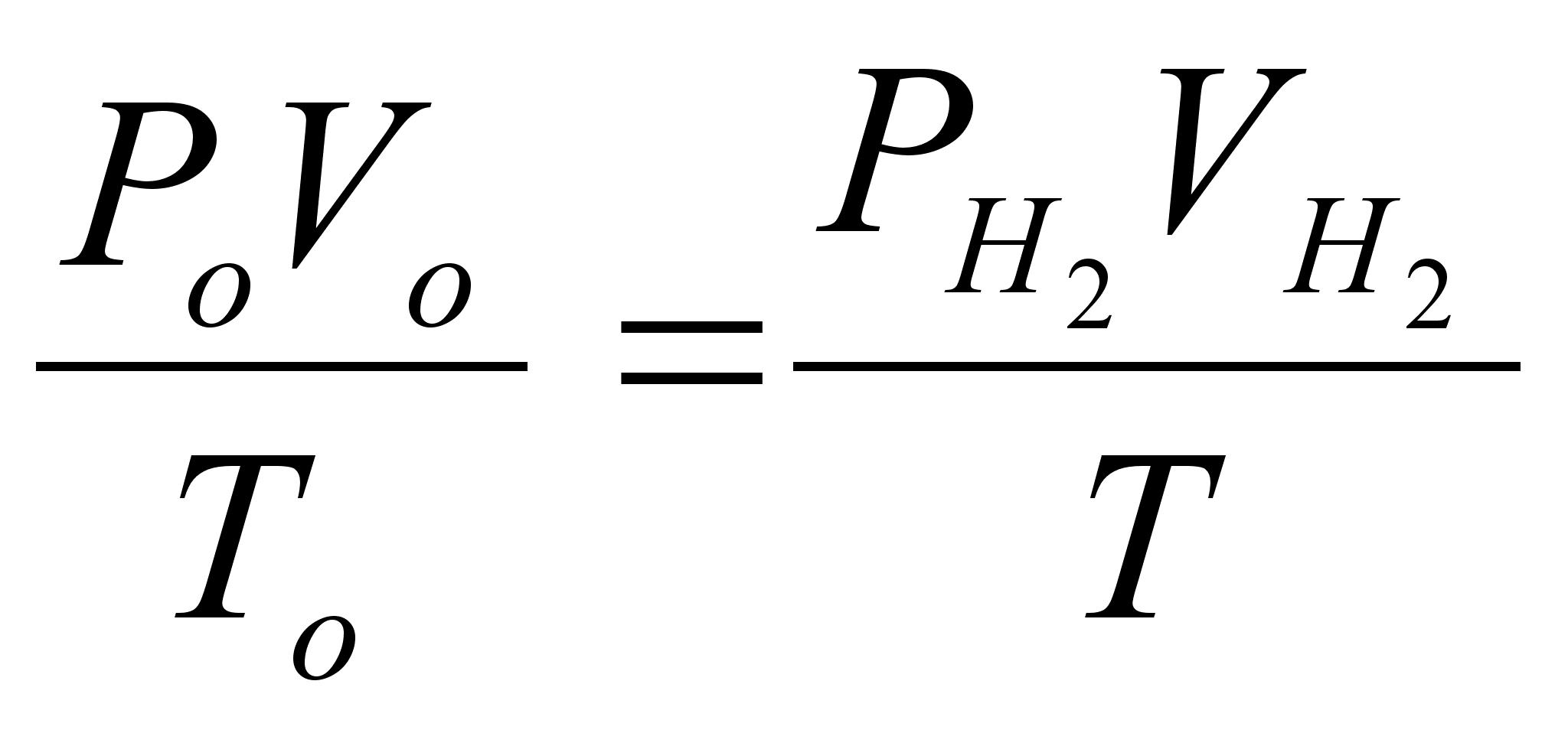 ,
,
где
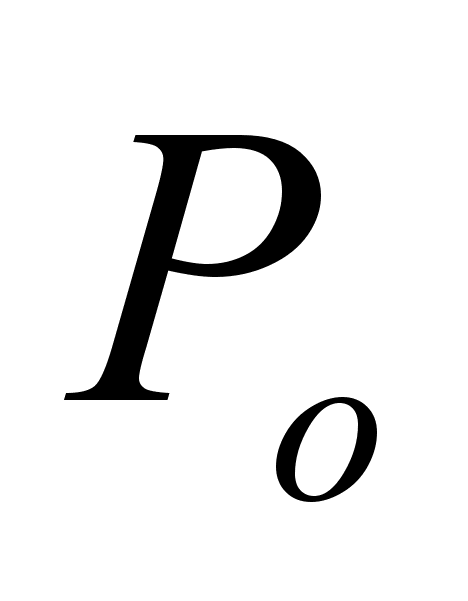 - нормальное
давление, равное
101,325 кПа;
- нормальное
давление, равное
101,325 кПа;
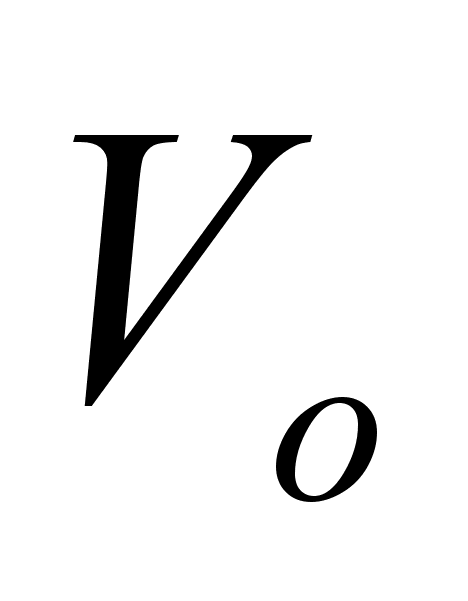 - объем газа
при нормальных
условиях,
- объем газа
при нормальных
условиях,
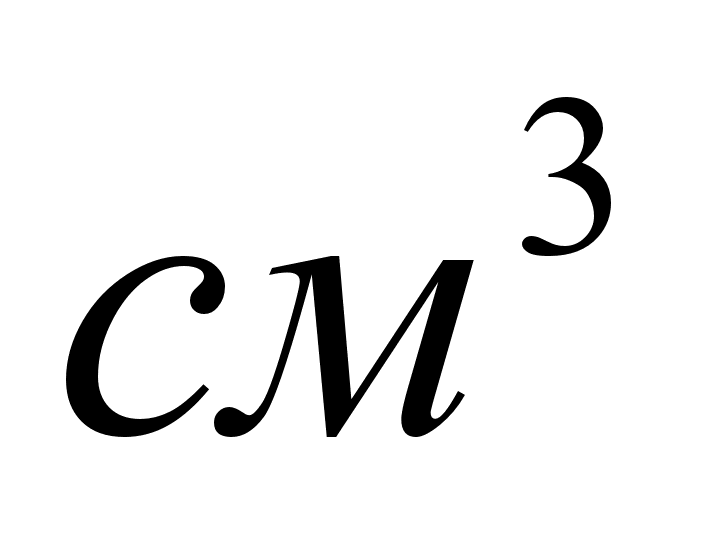 ; ;
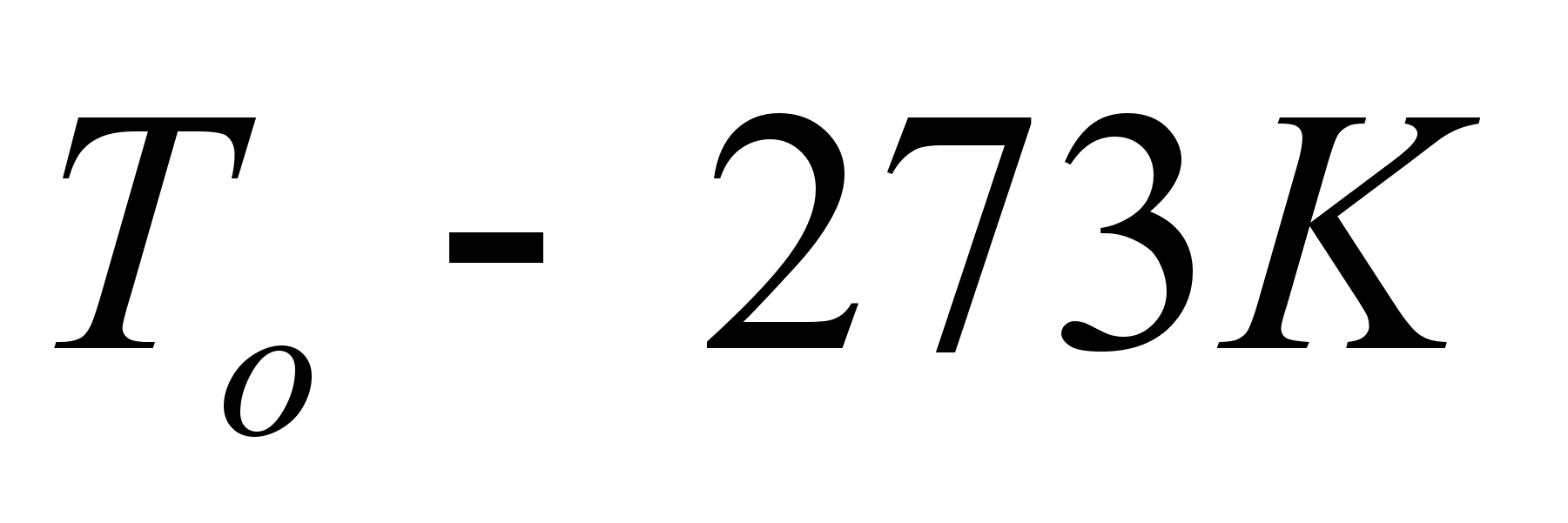 ; ;
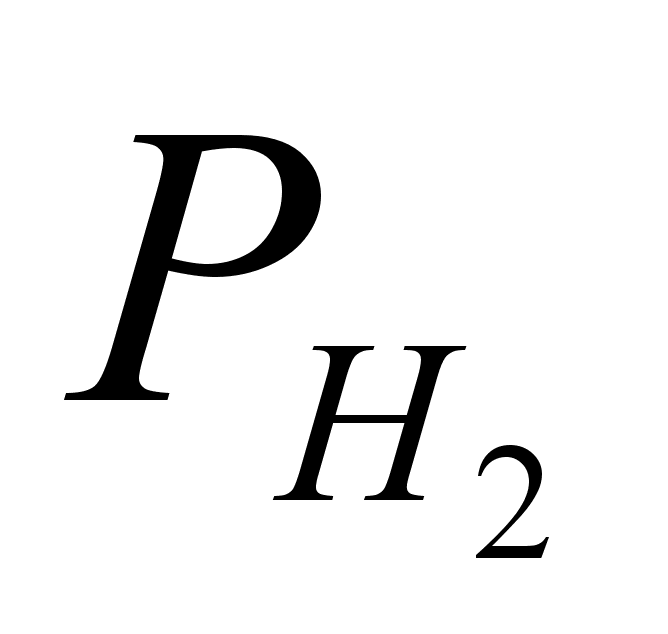 -
парциальное
давление сухого
водорода; -
парциальное
давление сухого
водорода;
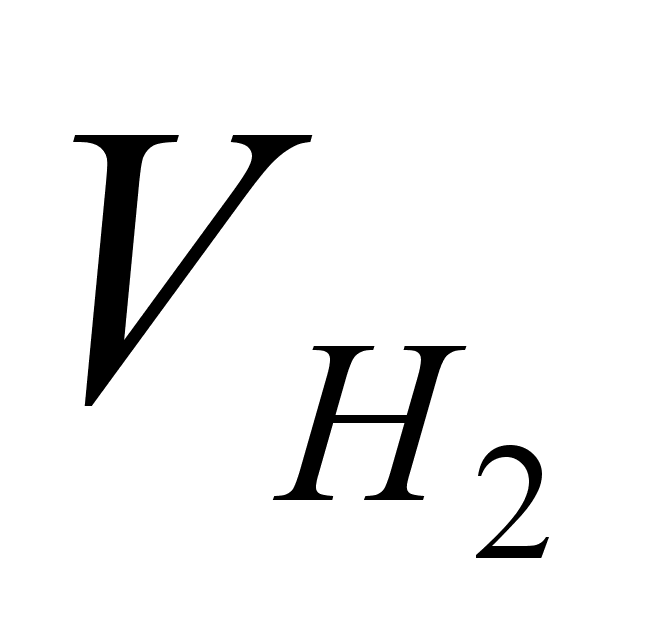 -
объем газа в
условиях опыта; -
объем газа в
условиях опыта;
 -
температура
опыта по абсолютной
шкале температур. -
температура
опыта по абсолютной
шкале температур.
Таким образом,
объем водорода,
приведенного
к нормальным
условиям определяется
по уравнению
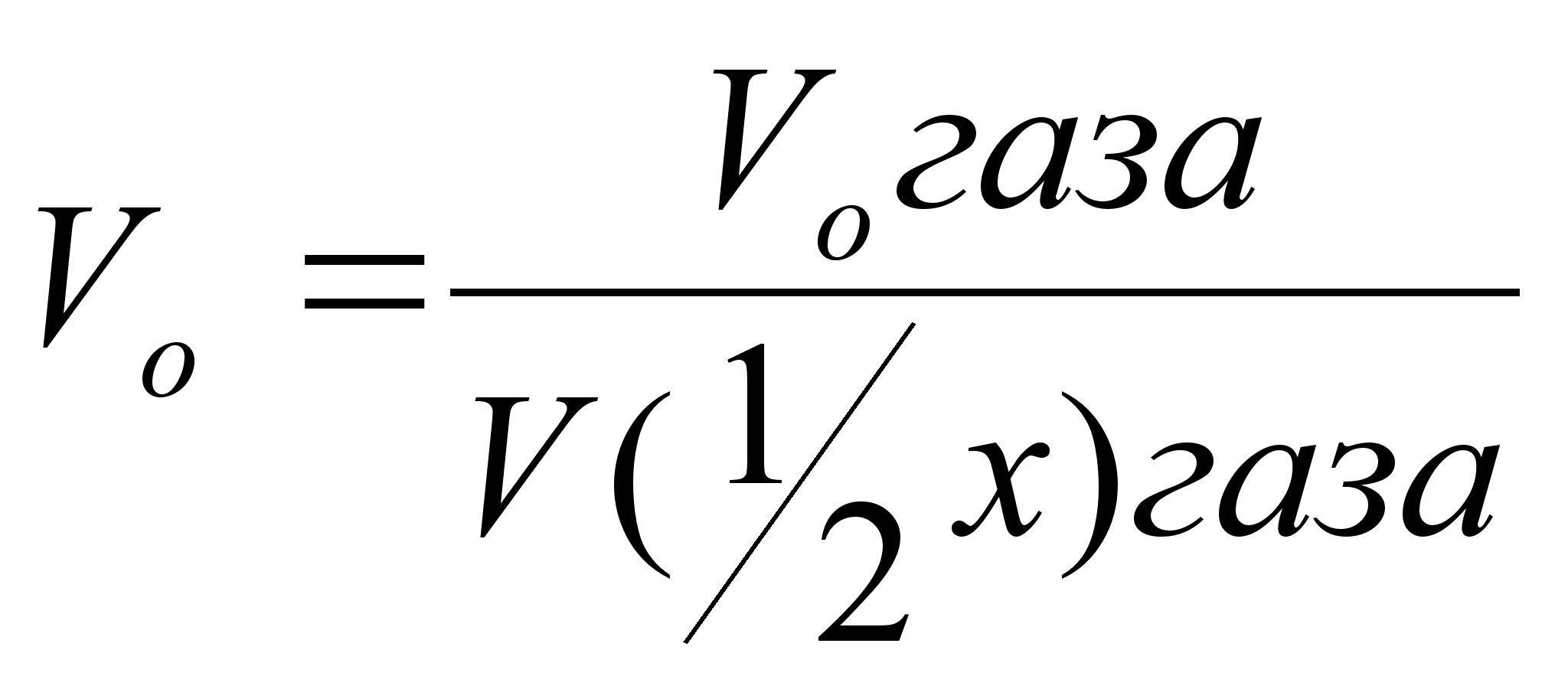 ,
,
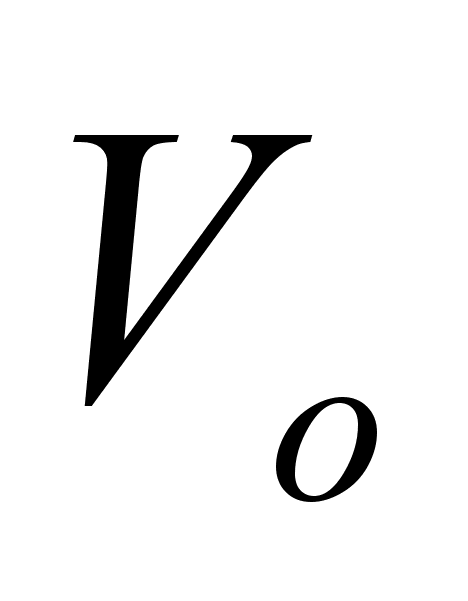 =
= =
=
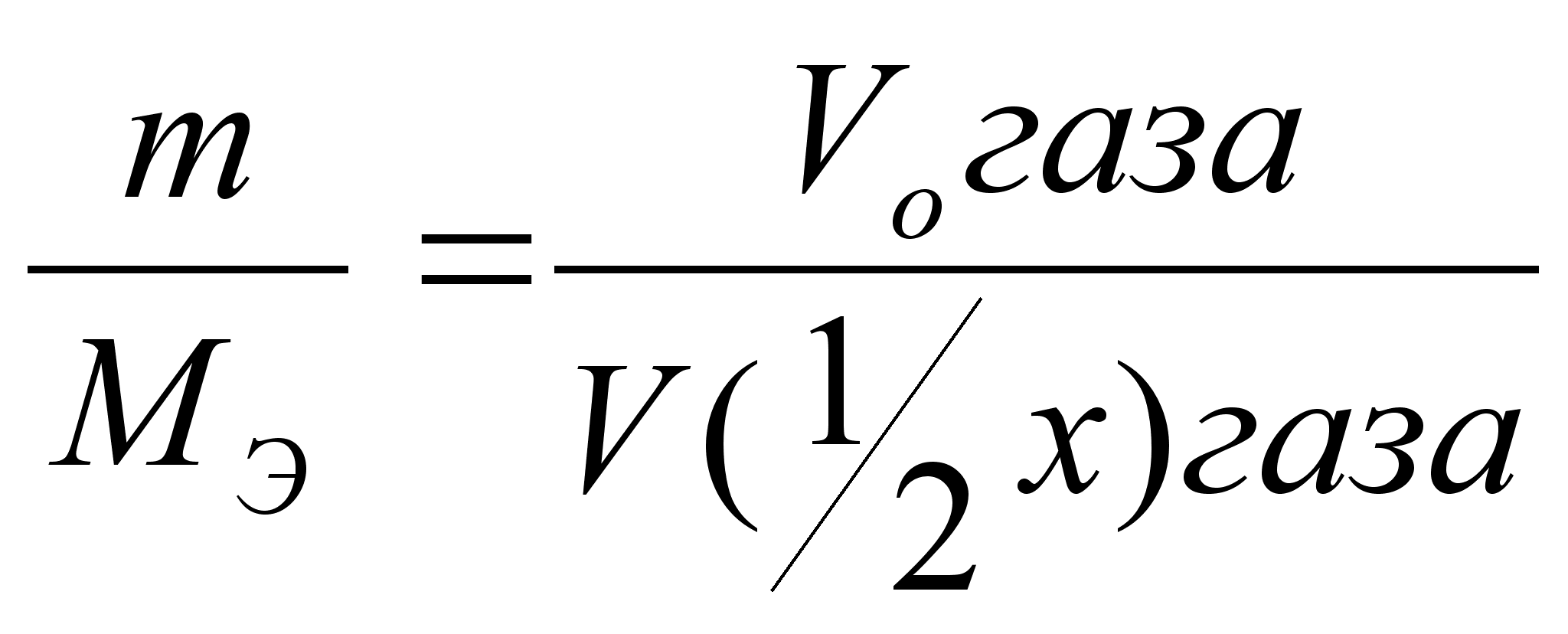 ,
,
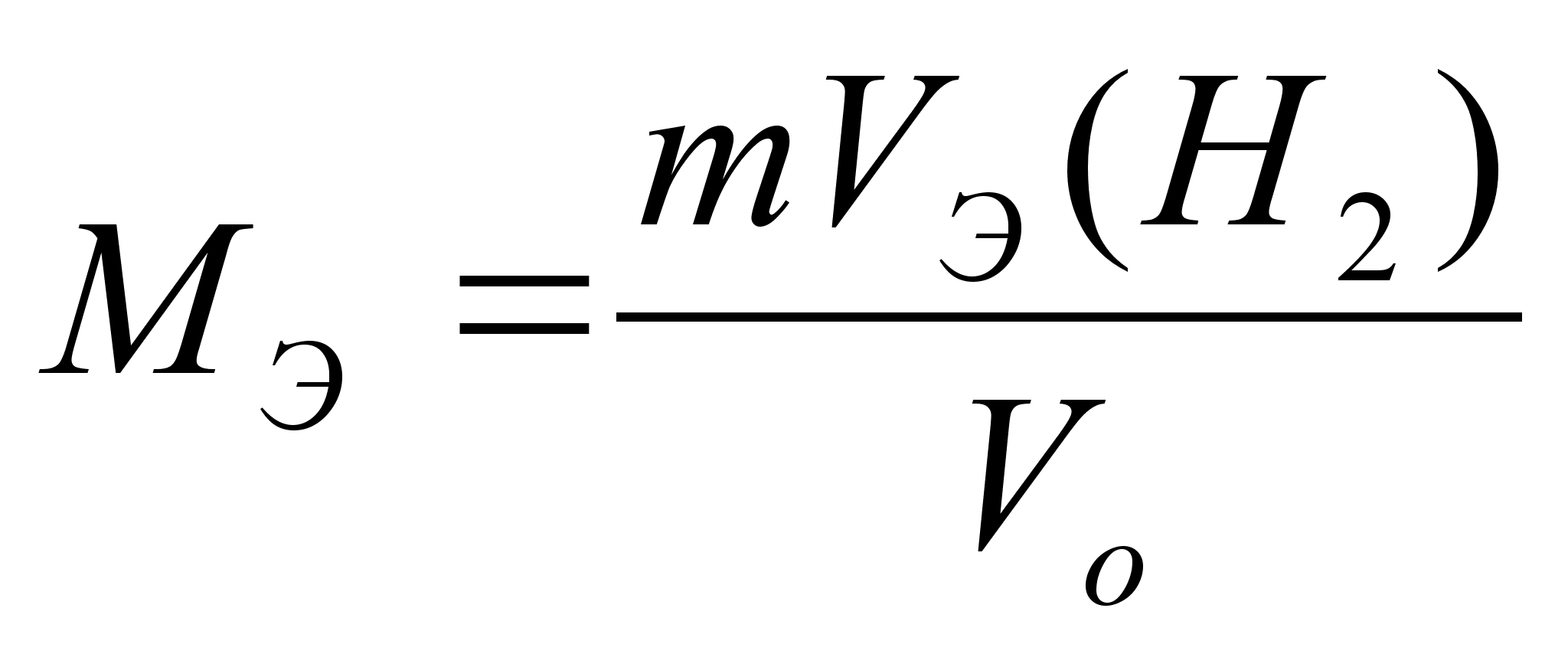 =
= =
=
 ,
где ,
где
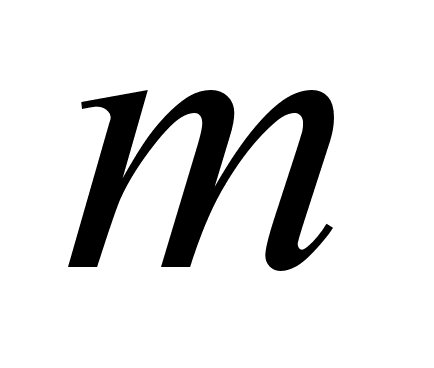 -
масса металла; -
масса металла;
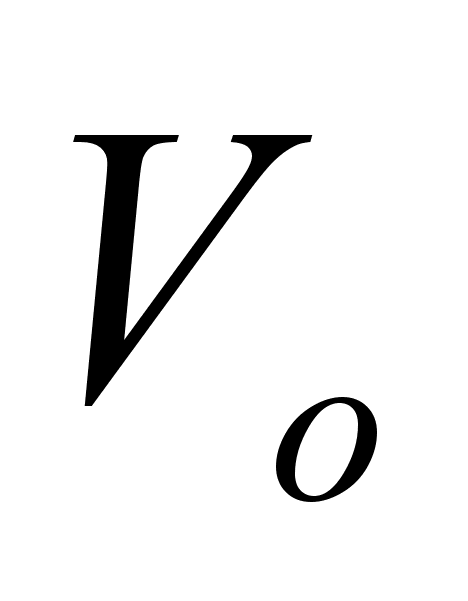 -
объем газа,
приведенный
к нормальным
условиям; -
объем газа,
приведенный
к нормальным
условиям;
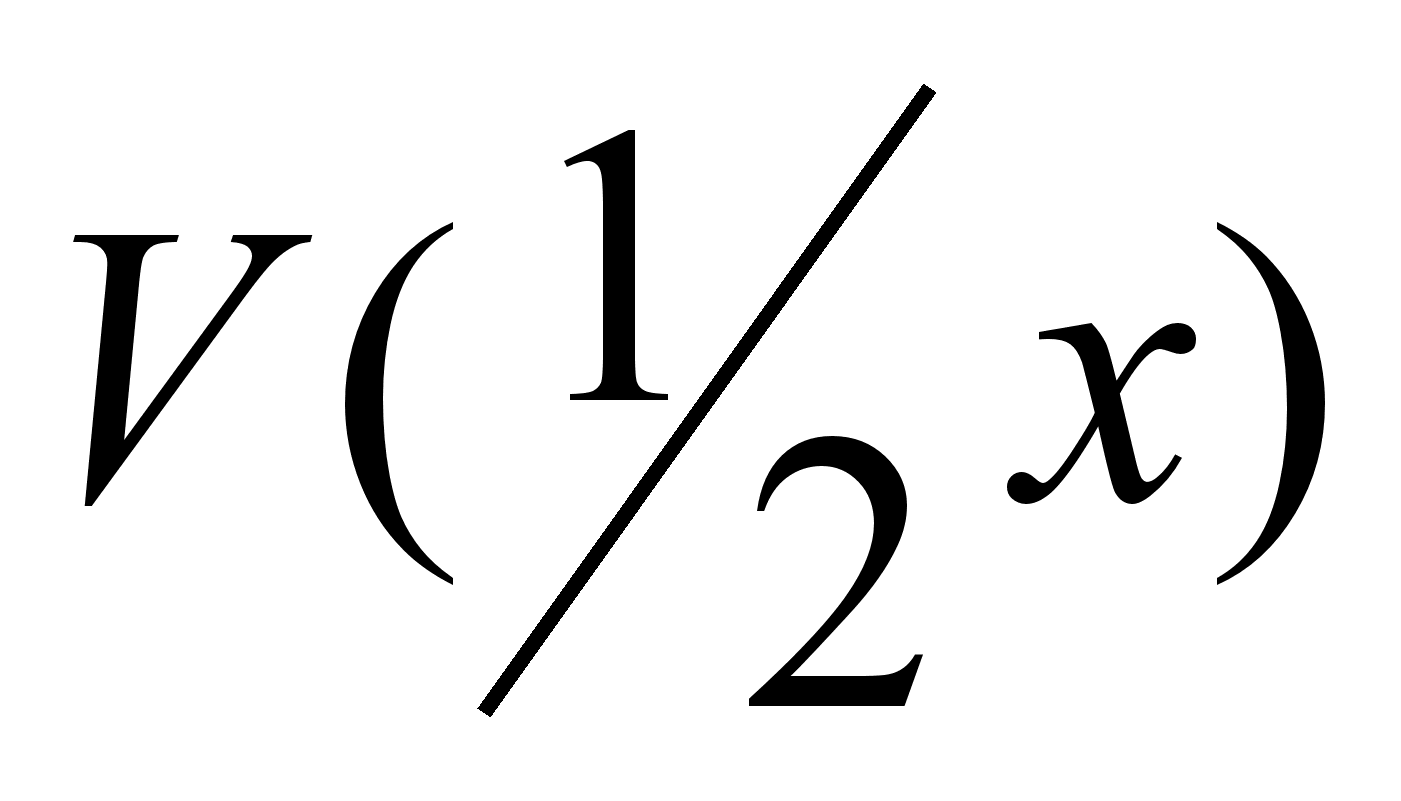 - молярный объем
эквивалента
газа. Молярный
объем эквивалента
водорода,
составляющий
- молярный объем
эквивалента
газа. Молярный
объем эквивалента
водорода,
составляющий
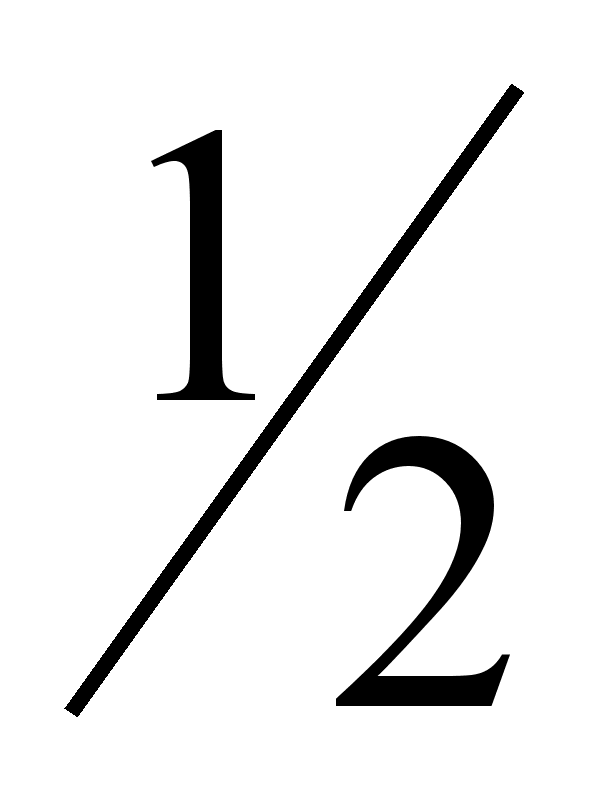 объема его
моля, занимает
при нормальных
условиях
объема его
моля, занимает
при нормальных
условиях
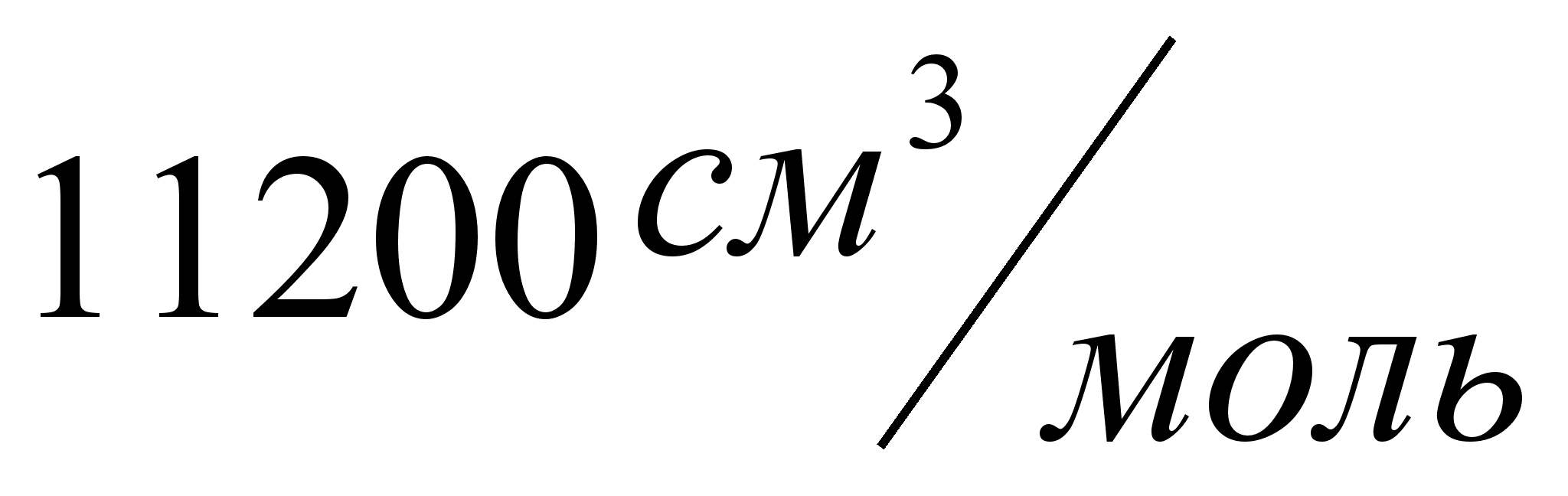 . .
Давление
насыщенного
водяного пара
в равновесии
с водой.
Затем мы
вычисляем
теоретическую
величину молярной
массы эквивалента
металла и находим
относительную
ошибку определения:
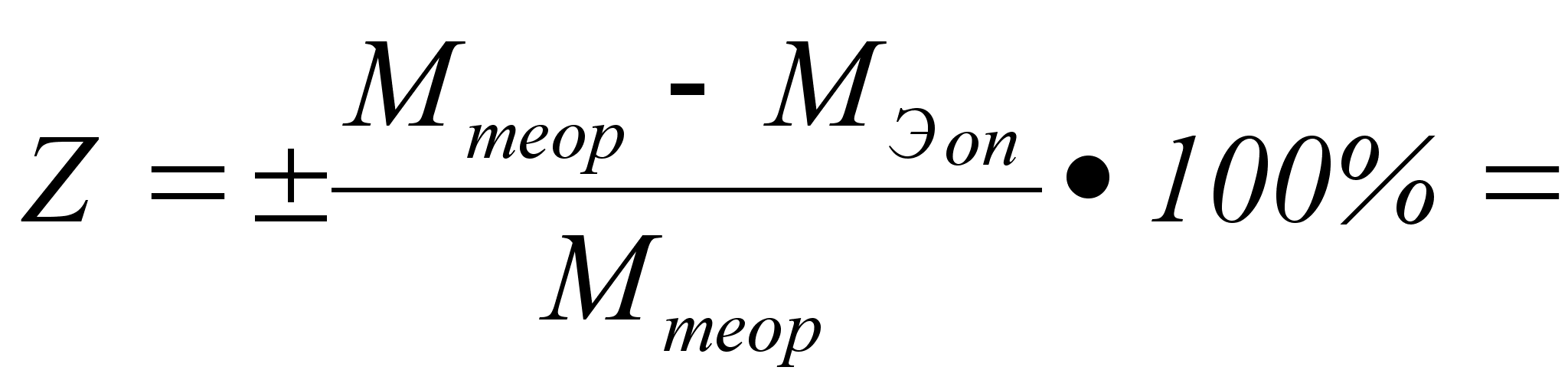
 
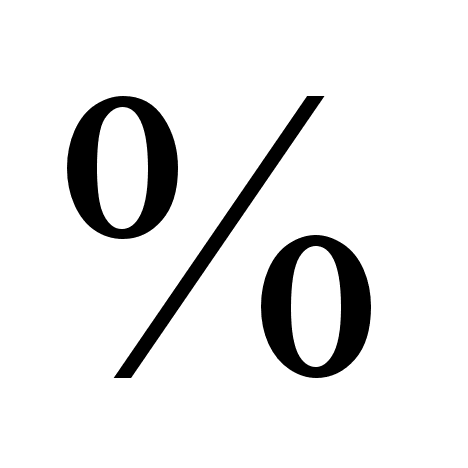
Вывод:
Работу выполнил
учащийся Работу
проверил:
группы ИС-02-Д1
преподаватель
Савельев
Сергей
Владимирович
К   афедра
Зависимость
свойств элементов
Лабораторная
работа №2 афедра
Зависимость
свойств элементов
Лабораторная
работа №2
инженерной
от положения
в периодической
экологии
системы
Д. И. Менделеева
Цель работы:
изучить на
практике, как
изменяются
свойства элементов
и их соединений
от заряда ядра
атома на примере
элементов III
периода.
Оборудование
и материалы:
аппарат киппа,
спиртовая
горелка, коническая
колба на 100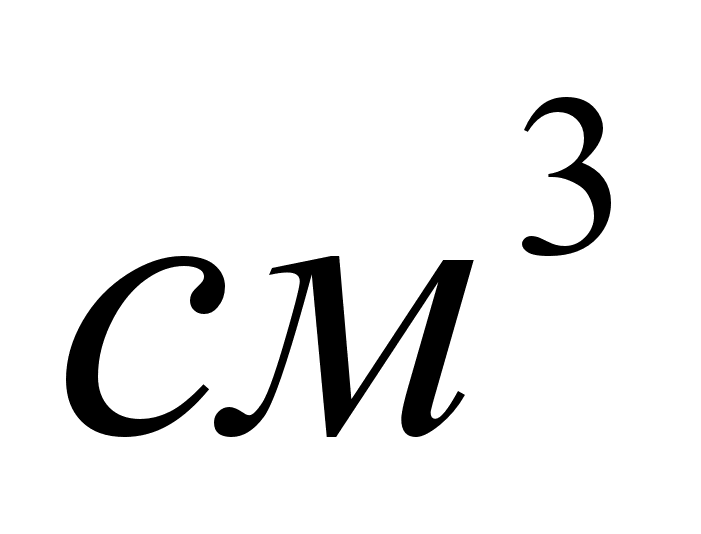 , фарфоровая
чашка, часовое
стекло, 8 пробирок,
фенолфталеин,
метилоранж,
сера цинковая
пыль, натрий,
магний, алюминий.
Растворы: соляной
кислоты, едкого
натрия, хлорида
олова (III),
гидроксида
аммония.
, фарфоровая
чашка, часовое
стекло, 8 пробирок,
фенолфталеин,
метилоранж,
сера цинковая
пыль, натрий,
магний, алюминий.
Растворы: соляной
кислоты, едкого
натрия, хлорида
олова (III),
гидроксида
аммония.
Методика
выполнения
работы.
Опыт №1. Взаимодействие
щелочных металлов
с водой.
Налить в
фарфоровую
чашку немного
воды, опустить
в нее кусочек
натрия и быстро
накрыть чашку
воронкой. После
окончания
реакции прилить
к полученному
раствору 2-3 капли
фенолфталеина.
Составить
уравнения
протекающих
реакций и сделать
вывод относительно
свойств щелочных
металлов.
Опыт №2. Действие
воды на металлический
магний.
Поместить
в пробирку
стружку металлического
магния. Добавить
немного воды
и 2-3 капли фенолфталеина.
Обратить внимание
на то, что цвет
практически
не изменится.
Затем следует
нагреть пробирку.
Отметить изменение
окраски раствора.
Сделать вывод
относительно
щелочных свойств
магния и написать
уравнения
протекающих
реакций.
Опыт №3. Амфотерность
металлического
алюминия.
Поместить
кусочек металлического
алюминия в
пробирку, прилить
немного воды
и 2-3 капли фенолфталеина.
Убедиться в
том, что ни в
обычных условиях,
ни при нагревании
алюминий с
водой не взаимодействует.
Затем поместить
в две другие
пробирки по
кусочку алюминия.
В одну из них
прилить разбавленную
соляную кислоту,
в другую – раствор
крепкой щелочи
NaOH.
Пробирки нагреть.
При этом наблюдается
взаимодействие
алюминия, как
с кислотой, так
и со щелочью.
Написать уравнения
протекающих
реакций и сделать
вывод о свойствах
алюминия.
Опыт №4.
Неметаллические
свойства серы.
Кусочек серы
поместить в
пробирку и
налить немного
воды. Прибавить
сначала 2-3 капли
фенолфталеина,
а затем столько
же метилоранжа.
Отметить, что
сера не взаимодействует
с водой в обычных
условиях. Нагреть
пробирку. Отметить
что после нагревания
взаимодействие
серы с водой
не происходит.
Кусочек серы
положить на
железную ложечку,
поджечь и опустить
в коническую
колбу, в которой
было налито
немного воды
(не касаясь
поверхности
воды). После
сгорания серы
закрыть колбу
пробкой и встряхнуть.
Полученный
раствор разделить
на 3 пробирки
и испытать
различными
индикаторами.
Опыт №5. Амфотерные
свойства гидроксида
олова (II).
Поместить
в пробирку 8-10
капель раствора
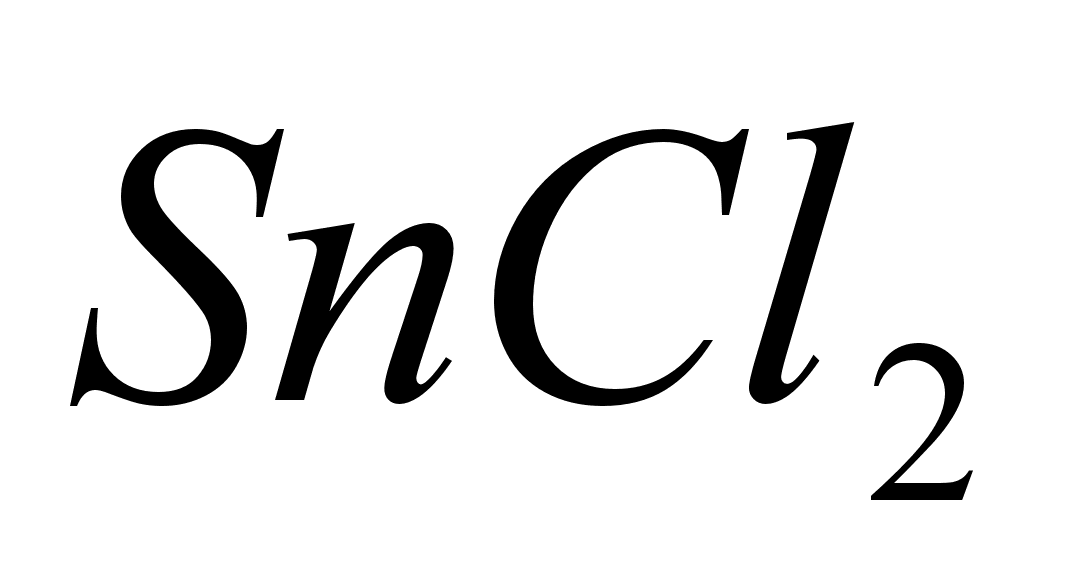 ,
добавить несколько
капель ,
добавить несколько
капель
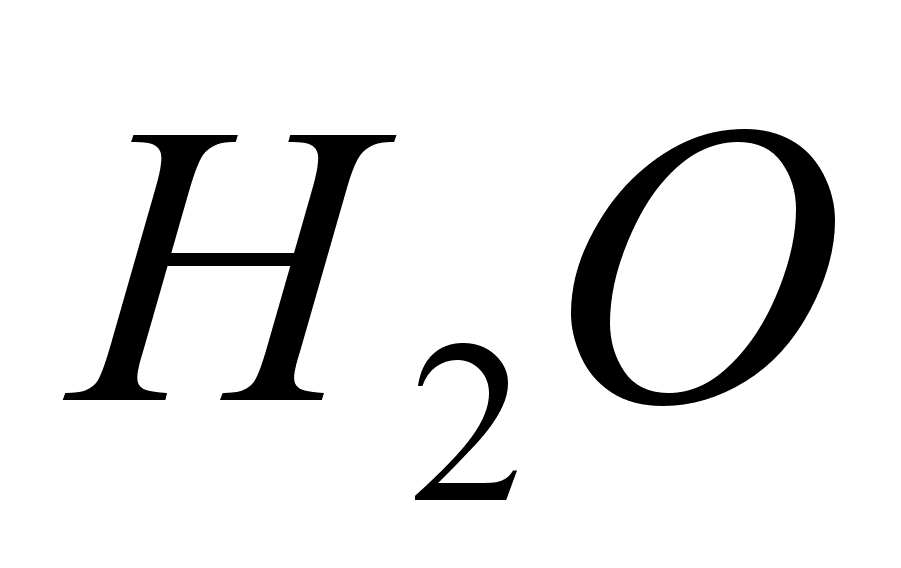 и раствор
и раствор
 в воде, до полного
осаждения
осадка. Распределить
содержимое
на две пробирки
и добиться
растворения
осадка в каждой
из них с помощью:
в одном случае
2М раствора
HCl,
в другом – 2М
раствора NaOH.
Составить
уравнения
реакций, зная,
что при реакции
гидроксида
олова с NaOH
образуется
тетрагидроксостаннат
натрия
в воде, до полного
осаждения
осадка. Распределить
содержимое
на две пробирки
и добиться
растворения
осадка в каждой
из них с помощью:
в одном случае
2М раствора
HCl,
в другом – 2М
раствора NaOH.
Составить
уравнения
реакций, зная,
что при реакции
гидроксида
олова с NaOH
образуется
тетрагидроксостаннат
натрия
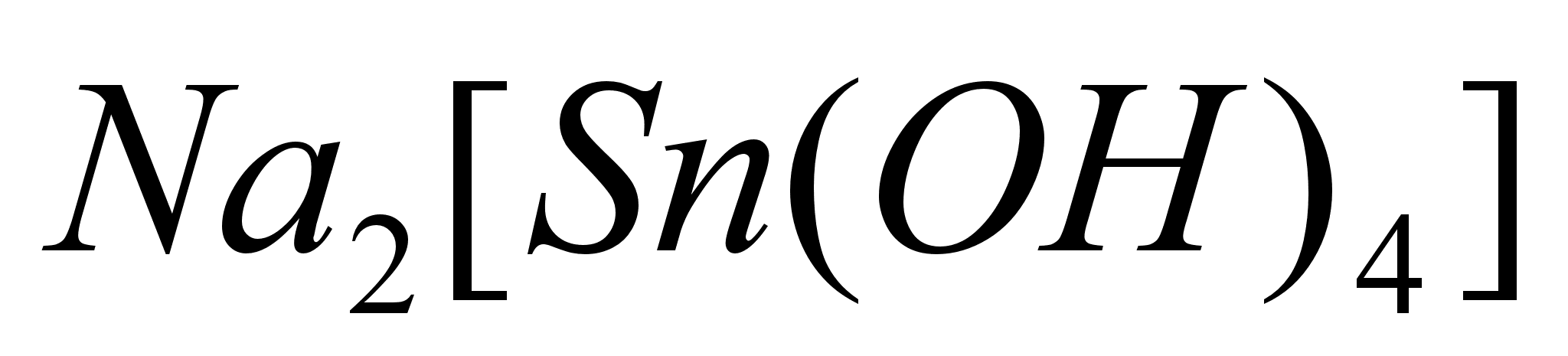
Работу выполнил
учащийся Работу
проверил:
группы ИС-02-Д1
преподаватель
Савельев
Сергей
Владимирович
|