ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Кафедра неорганической химии
РЕФЕРАТ
СЕРЕБРО
Общая характеристика
Выполнил:
Студент 1 курса ХФ, гр. 821
Земляков.Д.И
|
Научный руководитель:
к.х.н., доцент
Чернов Е.Б.
|
Томск 2003
ОГЛАВЛЕНИЕ
ОГЛАВЛЕНИЕ.......................................................................................................................... 2
СЕРЕБРО Ag.............................................................................................................................. 3
ИСТОРИЧЕСКАЯ СПРАВКА................................................................................................. 3
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ.............................................................................. 4
ПЕРЕРАБОТКА СЕРЕБРЯНЫХ РУД И ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО СЕРЕБРА 5
РАФИНИРОВАНИЕ СЕРЕБРА............................................................................................ 10
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА................................................................ 10
ПРИМЕНЕНИЕ....................................................................................................................... 14
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА).............................................................................. 15
Соединения одновалентного серебра................................................................................ 15
Неорганические соединения.............................................................................................. 16
Координационные соединения.......................................................................................... 22
Соединения двухвалентного серебра............................................................. 22
Неорганические соединения.............................................................................................. 23
Координационные соединения.......................................................................................... 24
Соединения трехвалентного серебра.............................................................. 24
СПИСОК ЛИТЕРАТУРЫ....................................................................................................... 26
СЕРЕБРО
Ag
| Базовые
характеристики
|
| Порядковый номер |
47 |
| Атомный вес |
107,870 у.е. |
| Валентность |
I, (II), (III) |
| Заряд |
1+, (2+), (3+) |
| Массовые числа природных изотопов |
107, 109 |
| Электронная структура атома меди |
К
L-М
4s2
4p6
4d10
5s1
|
| Электронная структура атома меди и катиона Ag+
для 4d и 5s-орбиталей |
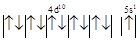
Ag
|
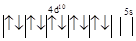
Ag+
|
ИСТОРИЧЕСКАЯ СПРАВКА
Серебро является одним из тех металлов, которые привлекли внимание человека еще в древние времена. История серебра тесно связана с алхимией, поскольку уже в те времена был разработан метод купелирования серебра.
За 2500 лет до н. э. в Древнем Египте носили украшения и чеканили монеты из серебра, считая, что оно дороже золота. В X в. было показано, что между серебром и медью существом аналогия, и медь рассматривалась как серебро, окрашенное в красный цвет. В 1250 г. Винсент Бове высказал предположи что серебро образуется из ртути при действии серы.
В средние века кобалдом
называли руды, которые служили для получения металла со свойствами, отличными от уже известного серебра. Позднее было показано, что из этих минералов добывается сплав серебро — кобальт, и различие в свойствах определялось присутствием кобальта. В XVI в. Парацельс получил хлорид серебра из элементов а Бойль определил его состав. Шееле изучал действие света на хлорид серебра, а открытие фотографии привлекло внимание и кдругим галогенидам серебра. В 1663 г. Глазер предложил нитрат серебра в качестве прижигающего средства. С конца XIX в. комплексные цианиды серебра используются в гальванопластике.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Серебро является редким металлом, его содержание в земной коре равно 1·10-5
вес.%. В природе серебро встречается как самородное, так и в виде соединений — сульфидов, селенатов, теллуратов или галогенидов в различных минералах.
Серебро встречается также в метеоритах и содержится в морской воде.
Серебро в виде самородков встречается в природе реже, чем самородная медь или золото, и часто это бывают сплавы с золотом, медью (медьсодержащее серебро), сурьмой (сурьмусодержащие серебро), ртутью и платиной. Образование самородного серебра связано с действием воды или водорода на сульфид серебра (соответственно на аргентит). Металлическое серебро представляет собой гранецентрированные кубические кристаллы серебристо-белого цвета, часто покрыты черным налетом. Залежи самородного серебра находятся в России, Норвегии, Канаде, Чили, ФРГ и других странах. Наиболее важными минералами серебра являются следующие:
- Кантпит
, (Ag2
S), серые ромбические кристаллы, устойчивые при температуре ниже +179°С. Обе модификации природного сульфида серебра содержат 87,1% Ag, имеют плотность 7,2—7,4 г/см3
и твердость 2—2,5 единицы по шкале Мооса.
- Аргентит
, (Ag2
S), серые кубические кристаллы, устойчивые при температуре выше +179°С. Аргентит — основной источник серебра. В природе он сопутствует самородному серебру, кераргиту (AgCl), церусситу (РbС03
), арсенидам и антимонидам серебра; его залежи часто находятся рядом с сульфидами свинца, цинка и меди.Такие руды находятся в Норвегии, Мексике, Перу, СССР, Чили.
- Галенит
(AgS), добываемый в Румынии, Франции, содержит серебро.
- Прустит
(Ag3
AsS3
или 3Ag2
S -As2
S3
), содержит 65,4% серебра.
- Пираргерит
(Ag3
SbS3
или 3Ag2
S -Sb2
S3
), содержит 68,4% серебра.
- Стефанит
(8(Ag, Cu)2
S-Sb2
S3
), содержит 62,1—74,9% Ag
- Кераргирит
(AgCl), содержит 75,3% серебра.
При окислении аргентита (акантита) Ag2
S образуется сульфат серебра Ag2
SO4
, который будучи частично растворим, вымывается водой. Когда на пути вод, одержащих сульфат серебра, встречается сульфат железа(II), выделяется свободное серебро, а если встречаются хлориды (т.е. ионы Сl-
), то образуется кераргирит:
Ag2
SO4
+ 2FeSO4
- 2Ag + Fe2
(SO4
)3
Ag2
SO4
+ 2NaCl = 2AgCl + Na2
SO4
Если воды, содержащие сульфид серебра, встречают сульфиды других элементов, то образуются скопления двойных сульфидов подобно встречающимся смесям серебро - мышьяк, серебро - сурьма, серебро - медь, серебро - свинец, серебро - германий.
ПЕРЕРАБОТКА СЕРЕБРЯНЫХ РУД И ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО СЕРЕБРА
Примерно 80% от общего мирового количества добываемого серебра получается как побочный продукт переработки комплексных сульфидов тяжелых цветных металлов, содержащих сульфид серебра (аргентит) Ag2
S. При пирометаллургической переработке полиметаллических сульфидов свинца, меди, цинка, серебра последнее извлекается вместе с основным металлом в виде серебро содержащих свинца, меди или цинка.
Для обогащения серебросодержащего свинца серебром применяют процесс Паркеса или Паттинсона.
По процессу Паркеса
серебросодержащий свинец плавят вместе с металлическим цинком. При охлаждении тройного сплава свинец — серебро — цинк ниже 400° отделяется нижний слой состоящий из жидкого свинца, который содержит небольшое количество цинка и серебра, и верхний твердый слой, состоящий из смешанных кристаллов цинк — серебро с небольшим количеством свинца. Образование смешанных кристаллов цинк — серебро основывается на более высокой растворимости серебра в цинке, чем в свинце, и на разделении при охлаждении серебросодержащего цинка и свинца на два слоя. При отгонке цинка (точка кипения которого 907°) из сплава свинец — цинк — серебро остается свинец. который содержит 8—12% серебра и служит для получения сырого серебра путем купелирования. Из тройного сплава свинец- цинк — серебро цинк может быть удален в виде Na2
Zn02
плавлением с Na2
C03
.
По процессу Паттинсона
расплавленный серебросодержащий свинец медленно охлаждается. Свинец, который кристаллизуй первым, отделяется до тех пор, пока расплав не достигнет состава эвтектики с содержанием 2,25% серебра. Эвтектика затвердевает при 304° и служит затем для получения сырого серебра методом купелирования.
При купелировании
свинец, содержащий 2,25—12% серебра, плавится в купелях в печи, куда подают воздух или кислород и поверхность расплавленного металла. Окись свинца (свинцовый глет) РЬО вместе с окислами мышьяка, сурьмы, цинка и меди, образовавшимися при полном окислении серебросодержащего свинца (с большим содержанием серебра), удаляют с поверхности сырого серебра ,который содержит примерно 95% Ag.
Отделение серебра от серебросодержащего свинца возможно также электролитическим путем
, применяя аноды из серебросодержащего свинца, а в качестве электролита — гексафторокремневую кислоту H2
[SiF6
] с гексафторосиликатом свинца Pb[SiF6
]. При электролизе свинец осаждается на катоде, а серебро вместе с золотом, платиной и платиновыми металлами переходят в анодный шлам. Аналогично при электролитическом рафинировании серебросодержащей меди, которую используют в качестве анодов (применяя при этом разбавленную серную кислоту как электролит), на катоде электролитически осаждают медь, а серебро и золото месте с платиновыми металлами также переводят в анодный шлам.
Извлечение серебра, золота и платиновых металлов из анодного шлама легко осуществляется химическим путем. В отличие от золота и платиновых металлов серебро легко растворяется азотной кислоте.
Из нитрата серебра AgNO3
металлическое серебро можно осадить сульфатом железа(II), металлическим цинком, формальдегидом в аммиачной среде или нитратом марганца(II) в щелочной :
3AgNO3
+ 3FeSO4
= 3Ag + Fe(NO3
)3
+ Fe2
(SO4
)3
2AgNO3
+ Zn = 2Ag + Zn(NO3
)2
2[AgNH3
)2
]OH + HCHO = 2Ag + 3NH3
+ HCOONH4
+ H2
O
2AgNO3
+ Mn(NO3
)2
+ 4NaОН =
2Ag + MnO2
+ 4NaNO3
+ 2H2
O
Примерно 20% мирового количества серебра получают переработкой собственно серебряных руд и рекуперацией серебренных изделий пли серебряного лома.
Измельченную, размолотую и обогащенную (в случае низкого содержания серебра) серебряную руду перерабатывают методами цианирования, амальгамирования, хлорирования и др.
В случае переработки методом цианирования тонко измельченную руду (природное серебро, аргентит или кераргирит) смешивают с 0,4%-ным раствором NaCN и перемешивают струей воздуха водном растворе цианида натрия в присутствии кислорода воздухасеребро и аргентит растворяются медленнее, чем керарпирит
2Ag + 4NaCN + H2
0 + 1
/2
02
= 2Na[Ag(CN)2
] + 2NaOH
Ag2
S + 5NaCN + H2
0 + 1
/2
02
= 2Na[Ag(CN)2
] + 2NaOH + NaSGN
AgCl + 2NaCN =Na[Ag(CN)2
] + NaCl
Сульфид серебра Ag2
S растворяется в тетрацианоцинкате(II) натрия по реакции
Ag2
S + Na2
[Zn(CN)4
] = 2Na[Ag(CN)2
] +ZnS
Количество взятого для переработки серебряных руд цианида натрия больше теоретически необходимого, поскольку серебренные руды часто содержат соединения меди, железа и цинка, которые также реагируют с цианидом натрия.
Цианирование осуществляется в деревянных чанах диаметром 10-12 м.
Из растворов комплексных цианидов серебра серебро может быть осаждено в виде металла тонко измельченным металлическим цинком или алюминием. Осаждение металлического серебра из растворов комплексных цианидов серебра металлическим цинком или алюминием осуществляется по уравнениям
2Na[Ag(CN)2
] + Zn = 2Ag + Xa2
[Zn(CX)4
]
3Na[Ag(CN)2
] + Al + 4NaOH + 2H2
O = 3Ag + Ха[А1(ОН)4
(Н2
O)2
]+6NaCN
Сырое серебро плавится, отливается в виде брусков и затем рафинируется электролитическим или химическим методом.
Можно также извлечь комплексный анион [Ag(CN)2
] с помощью анионообменных смол. Применяют анионообменные сульфинированные смолы R2
S04
(предварительно обработанные 5%-ным водным раствором серной кислоты). Реакцию ионного обмена в процессе извлечения анионов [Ag(CN)2
] с помощью анионообменных смол (предпочтительно в виде пористых анионитов) можно представить следующим образом:
R2
S04
+ 2[Ag(CN)2
]-
-> 2R[Ag(CN)2
] + SO2-
Чтобы реакция обмена протекала создают кислую среду (рН — 3,5).
Комплексные цианиды вымывают из анионообменной смолы селективным элюентом, например 2 н. раствором цианида калия или натрия.
Процесс амальгамирования применяют к рудам, содержащим самородное серебро, аргентит или кераргирит, он основывается на образовании амальгамы серебра.
Для амальгамирования тонко измельченные серебряные руды обрабатывают небольшим количеством воды и ртутью (1 вес. ч ртути на 6 вес. ч. серебра).
Сульфид серебра Ag2
S под действием хлорида меди(1) (который образуется при восстановлении хлорида меди(II) ртутью) превращается в хлорид серебра:
Ag2
S + 2CuGl = 2AgCl + Cu2
S 2CuCl2
+ 2Hg = 2CuCl + Hg2
Cl2
Последний под действием ртути и хлорида меди(1) восстанавливается до металлического серебра, которое образует амальгаму с ртутью:
2AgCl + 2Hg = 2Ag+ Hg2
Cl2
AgCl + CuCl = Ag + CuCl2
Амальгаму серебра фильтруют под давлением. При отгонке ртути остается сырое серебро, которое очищают химическим или электрохимическим способом.
При прокаливании смеси сульфида серебра и хлорида натрия (+500…600°С) в окислительной атмосфере образуется хлорид серебра:
Ag2
S + 2NaСl + 2O2
= 2AgCl + Na2
SO4
Для извлечения серебра из AgCl пли из Na[AgCl2
] применяют амальгамирование, осаждение металлического серебра медью и осаждение сульфида серебра из соединения Na2
[Ag2
(S2
03
)2
]
AgCl - NaCl = Na[AgCl2
]
Na[AgCl2
] + Cu = Ag + Na[CuCl2
]
2AgCl + 2Na2
S2
O3
= Na2
[Ag2
.(S2
O3
)2
] + 2NaCl
Na2
[Ag2
(S2
O3
) ]+Na2
S = Ag2
S + 2Na2
S2
O3
Сульфид серебра Ag2
S затем перерабатывают с целью полученияэлементарного серебра.
РАФИНИРОВАНИЕ СЕРЕБРА
Сырое серебро можно рафинировать химическим или электролитическим путем.
В химическом процессе
сырое металлическое серебро растворяют в азотной кислоте, очищенный перекристаллизацией нитрат серебра обрабатывают аммиаком, превращая его в гидроокись диамминосеребра; последнюю восстанавливают сульфитом аммония (берут точно рассчитанное количество) при +70°C до чистого металла серебро плавят над негашеной известью в токе водорода затем в вакууме:
3Ag +4HNO3
=
3AgNO3
+NО + 2Н2
O
AgNO3
+ ЗNН4
ОН = [Ag(XH3
)2
]OH+NН4
NO3
+ 2H2
O
2[Ag(NH3
)2
]OH + (NH4
)2
SO3
+ ЗН2
O =
2Ag+ (NH4
)2
SO4
+ 4NH4
OH
При электролитическом рафинировании применяют аноды из сырого серебра, а в качестве электролита берут раствор нитрата серебра. По мере пропускания постоянного тока через электролит чистое серебро электролитически осаждается на катодах, а металлы активные, чем серебро, переходят (из анодов) в раствор ионов. При этом золото, платина и платиновые металлы остаются в анодном шламе.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Серебро проявляет большее сходство с палладием (за которым он следует в периодической системе), чем с рубидием (с которым он находится рядом в I группе периодической системы и в том же пятом периоде).
Расположение серебра в побочной подгруппе I группы периодической системы определяется электронной структурой атома которая аналогична электронной структуре атома рубидия. Большое различие в химических свойствах серебра и рубидия определяется разной степенью заполненности электронами 4й-орбитали. Атом серебра отличается от атома палладия наличием одного электрона на 5й-орбитали.
По большинству физических и химических свойств серебро приближается к меди и золоту. В подгруппе меди серебро (средний элемент) обладает наиболее низкими температурами плавления и кипения и максимальным значением коэффициента расширения, максимальной тепло- и электропроводностью.
Физико-химические свойства серебра в значительной степени зависят от его чистоты.
Металлическое серебро в компактном полированном виде (бруски, трубки, проволока, пластинки, листы) представляет собой белый блестящий металл, обладающий большой отражательной способностью по отношению к инфракрасным и видимым лучами и более слабой — к ультрафиолетовым лучам. Серебро в виде тонких листочков (они кажутся синими или фиолетовыми в проходящем свете) обладает электрическими и оптическими свойствами, отличными от свойств металлического серебра в слитках.
Коллоидные растворы серебра окрашены в розовый (до коричневого) цвет и могут быть получены восстановлением суспензий Ag2
O водородом при +50°C(или другими восстановителями, например сахаром, окисью углерода, цитратом железа(II), цитратом аммония. хлоридом олова(II), пирогаллолом, фенолом, фосфором в эфире, фосфорноватистой кислотой, формальдегидом, гидразином, фенилгидразином и др.), а также путем создания электрической дуги в воде между двумя серебряными электродами. Длястабилизации коллоидных растворов серебра применяют белки, желатину, гуммиарабик, агар-агар и другие органические вещества, играющие роль защитных коллоидов.
Белковое коллоидное серебро (протаргол и колларгол) применяется как фармацевтический препарат.
В нейтральных или слабо щелочных растворах гидрозоль серебра ведет себя как отрицательный коллоид, а в слабо кислых растворах - как положительный.
Коллоидное серебро является энергичным восстановителем по отношению к Fe2
Cl6
, HgCl2
, KMn04
, разбавленной HN03
, обладает хорошей адсорбционной способностью (по отношению к кислороду, водороду, метану, этану и др.), является катализатором и сильным бактерицидом (до появления антибиотиков применялся при обработке слизистых оболочек) и служит для лечения некоторых трудно излечиваемых кожных болезней. Вода, хранящаяся в серебряных сосудах, стерилизуется и не портится длительное время благодаря наличию иона Ag+
, образующегося в результате контакта воды со стенками посуды.
Металлическое серебро обладает кубической гранецентрированной решеткой с плотностью 10,50 г/см3
при +20°C, температура плавления +960,5°C, температура кипения +2177°C (пары желтовато-синие); оно диамагнитно, является очень хорошим проводником тепла и электричества (удельное сопротивление при +20°C равно 1,59 мком/см).
В числе физико-механических свойств следует отметить пластичность, относительную мягкость (твердость 2,5—3 балла по шкале Мооса), ковкость и тягучесть (легко протягивается и прокатывается), малую прочность. Серебро образует сплавы типа твердых растворов с золотом с палладием и интерметаллические соединения с элементами Li, Mg, Ca, Sr, Ba, Zn, Cd, Hg, Al, Ga, In, Tl, Pr, Sn, Zr, Th, P, Sb, S, Se, а также сплавы типа эвтектик с элементами Bi, Ge, Ni, Pb, Si, Na, Tl
При легировании устраняются основные недостатки серебра, такие, как мягкость, низкая механическая прочность и высокая реакционная способность по отношению к сере и сульфидам. Некоторые газы, например водород, кислород, окись и двуокись углерода, растворяются в серебре, причем растворимость их пропорциональна квадратному корню от давления. Растворимость кислорода в серебре максимальна при +400…450°C (когда 1 объем серебра поглощает до 5 объемов кислорода). Рекомендуется избегать охлаждения серебра, насыщенного кислородом, поскольку выделение этого газа из охлаждаемого серебра может сопровождаться взрывом. При поглощении кислорода или водорода серебро становится хрупким.
Азот и инертные газы с трудом растворяются в серебре при температуре выше -78°C.
С химической точки зрения серебро достаточно инертно, оно не проявляет способности к ионизации и легко вытесняется из соединения более активными металлами или водородом.
Под действием влаги и света галогены легко взаимодействуют с металлическим серебром образуя соответствующие галогениды.
Соляная и бромистоводородная кислоты в концентрированных растворах медленно реагируют с серебром:
2Ag + 4НСl = 2H[AgCl2
] + Н2
2Ag + 4НВr = 2H[AgBr2
] + Н2
Кислород взаимодействует с нагретым до 168° металлическим серебром при разных давлениях с образованием Ag2
O. Озон при +225°С в присутствии влаги (или перекиси водорода) действует на металлическое серебро, образуя высшие окислы серебра.
Сера, реагируя с нагретым до +179°С с металлическим серебром, образует черный сульфид серебра Ag2
S. Сероводород в присутствии кислорода воздуха и воды взаимодействует с металлическим серебром при комнатной температуре по уравнению
2Ag + H2
S +1
/2
O2
- Ag2
S + H2
O
Металлическое серебро растворяется в H2
SO4
(60° Be) при нагревании, в разб. HN03
на холоду и в растворах цианидов щелочных металлов в присутствии воздуха (кислорода или другого окислителя):
2Ag + 2H2
SO4
= Ag2
SO4
+ SO2
+ 2H2
O
3Ag + 4HNO3
+ 3AgNO3
+ NO+ 2H2
O
2Ag + 4NaCN + H2
O + l
/2
O2
=
2Na[Ag(CN)2
] + 2NaOH
Cелен, теллур, фосфор, мышьяк и углерод реагируют с металлическим серебром при нагревании с образованием Ag2
Se, Ag2
Te,Ag3
P, Ag3
As, Ag4
C. Азот непосредственно не взаимодействует с серебром.
Органические кислоты и расплавленные щелочи пли соли щелочных металлов не реагируют с металлическим серебром. Хлорид натрия в концентрированных растворах и в присутствии кислорода воздуха медленно взаимодействует с серебром с образованием хлорида серебра.
В солянокислом растворе серебро восстанавливает некоторые соли металлов, такие, как CuCl2
, HgCL2
, FeI2
. VOC12
.
ПРИМЕНЕНИЕ
В химической промышленности применяются аппараты из серебра (для получения ледяной уксусной кислоты, фенола), лабораторная посуда (тигли или лодочки, в которых плавятся чистые щелочи или соли щелочных металлов, оказывающие разъедающее действие на большинство других металлов), лабораторные инструменты (шпатели, щипцы, сита и др.). Серебро и его соединения применяются в качестве катализаторов в реакциях обмена водород — дейтерий, детонации смеси воздух — ацетилен, при сжигании окиси углерода, окислении спиртов в альдегиды кислоты и др.
В пищевой промышленности применяются серебряные аппараты в которых приготовляют фруктовые соки и другие напитки. В медицине известен ряд фармацевтических препаратов, содержащих коллоидное серебро.
Металлическое серебро служит для изготовления высококачественных оптических зеркал путем термического испарения. Бруски (или электролитический порошок) серебра служат положительными электродами в аккумуляторах, в которых отрицательными электродами являются пластинки из окиси цинка, электролит — едкое кали.
Существенную долю серебра потребляет электротехническая промышленность для серебрения медных проводников и при использовании высокочастотных волноводов. Серебро используется при производстве транзисторов, микросхем и других радиоэлектронных компонентов.
Сплавы серебра широко применяются для изготовления монет, зубных пломб, мостов и протезов, столовой посуды, в холодильной химической промышленности.
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА)
Известны соединения, в которых серебро одно-, двух- и трех- валентно. В отличие от устойчивых соединений одновалентного серебра соединения двух- и трехвалентного серебра немногочисленны и мало устойчивы.
Соединения одновалентного серебра
Известны многочисленные устойчивые соединения (простые и .координационные) одновалентного серебра. Ион одновалентного серебра Ag+
с радиусом 1.55A диамагнитен, бесцветен, гидратирован, легко поляризуется, является окислителем (легко восстанавливается различными восстановителями до металлического серебра) и играет роль катализатора в реакции окисления иона марганца (II) анионом: S2
02-
8
.
Большинство соединений серебра (I) плохо растворимо в воде. Нитрат, перхлорат, хлорат, фторид растворяются в воде, а ацетат и сульфат серебра растворимы частично. Соли серебра (I) белые или слегка желтоватые (когда аннон соли бесцветен). Вследствие деформируемости электронных оболочек иона серебра(I) некоторые его соединения с бесцветными анионами окрашены.
Многие из соединений серебра (I) окрашиваются в серый под действием солнечного света, что обусловлено процессом восстановления до металлического серебра.
У солей серебра(I) мало выражена склонность к гидролизу .При нагревании солей серебра со смесью карбоната натрия и угля образуется металлическое серебро:
2AgNO3
+ Na2
CO3
+ 4С = 2Ag + 2NaNO2
+ 5CO
Известны многочисленные координационные соединения серебра(I), в которых координационное число серебра равно 2, 3 и 4.
Неорганические соединения
Окись серебра
,Ag2
O, получают при обработке растворов AgNO3
щелочами или растворами гидроокисей щелочноземельных металлов:
2AgNO3
+ 2КОН = Ag2
O + 2KNO3
+ Н2
O
Окись серебра представляет собой диамагнитный кристаллический порошок (кубические кристаллы) коричнево-черного цвета с плотностью 7,1 — 7,4 г/см3
,
который медленно чернеет на свету высвобождая кислород, и разлагается на элементы при нагреваний до +200°C:
Ag2
O=2Ag + ½O2
Водород, окись углерода, перекись водорода и многие металлы восстанавливают окись серебра в водной суспензии до металлического серебра:
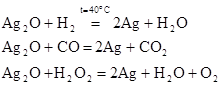
При окислении Ag2
O озоном образуется окись серебра(II) Окись серебра (I) растворяется в плавиковой и азотной кислотах в солях аммония, в растворах цианидов щелочных металлов, в аммиаке и т. д.
Ag2
O + 2HF = 2AgF + Н2
O
Ag2
O + 2HNO3
= 2AgNO3
Ag2
O + 2(NH4
)2
CO3
= [Ag(NH3
)2
]2
CO3
+ 2H2
O +CO2
Ag2
O + 4KCN + H2
O = K[Ag(CN)2
] + 2KOH
Ag2
O + 4NH4
OH =
2[Ag(NH3
)2
]OH + 3H2
Oили
Ag2
O + 4NH3
+ H2
O = 2[Ag(NH3
)2
]OH
При хранении гидроокись диамминсеребра [Ag (NH3
)2
]OH(которая является растворимым основанием с окислительными cсвойствами) превращается в способный взрываться имид серебра;
2[Ag(NH3
)2
]OH = Ag2
NH + 3NH3
+ 2H2
O
Растворы хлоридов щелочных металлов превращают окись серебра(I) в хлорид серебра(I), а при действии избытка HgI2
нaAg2
O образуется Ag2
[HgI4
].
Окись серебра — энергичный окислитель по отношению ксоединениям хрома(III), альдегидам и галогенопроизводным углеводородов:
5Ag2
O + Cr2
О3
=
2Ag2
CrO4
+ 6Ag
3Ag2
O + 2Cr(OH)3
+ 4NaOH = 2Na2
GrO4
+ 6Ag+ 5H2
O
Окисление галогенопроизводных углеводородов приводит кобразованию спиртов, а окисление альдегидов — соответствующих кислот.
Растворы сульфидов щелочных металлов и водные суспензии сульфидов тяжелых металлов превращают окись Ag2
O в сульфид Ag2
S.
Суспензии окиси серебра применяются в медицине как антисептическое средство. Смесь, состоящая из окиси серебра с легко восстанавливающимися окислами (например, меди или марганца). является хорошим катализатором окисления окиси углерода кислородом воздуха при обычной температуре. Смесь состава 5% Ag3
O, 15%Сo2
Оз, 30% СuО и 50% МnO2
, названная «гопкалитом», служит для зарядки противогазов в качестве защитного слоя против окиси углерода.
Гидроокись серебра,
AgOH, образуется в виде неустойчивого белого осадка в результате обработки AgN03
спиртовым раствором калиевой щелочи при рН = 8,5..9 и температуре -45°C.
Соединение AgOH обладает амфотерными свойствами, легко поглощает двуокись углерода из воздуха и при нагревании с Na2
S образует аргентаты эмпирических формул Ag2
O • 3Na2
O и Ag2
O • 3Na2
O.
Основные свойства гидроокиси серебра усиливаются в присутствии аммиака вследствие образования гидроокиси диамминсеребра [Ag (NH3
)2
]OH.
Фторид серебра,
AgF, получают прямым взаимодействием элементов при нагревании, действием плавиковой кислоты на окись или карбонат серебра(I), термическим разложением (+200°C) Ag[Bp] причем наряду с AgF образуется BF3
:
2Ag + F2
= 2AgF + 97,4 ккал
Ag2
CO3
+ 2HF=
2AgF + H2
O + CO2
Ag2
O + 2HF = 2AgF + H2
O
Ag[BF4
] = AgF + BF3
Выделение кристаллов AgF из водного раствора осуществляется путем концентрирования в вакууме в темноте.
Соединение AgF представляет собой расплывающиеся на воздухе бесцветные гранецентрированные кубические кристаллы с плотностью 5,85 г/см3
и температурой плавления +435°C; фторид серебра плохо растворим в спирте, легко растворим в воде (в отличие от остальных галогенидов серебра) и в аммиаке; его нельзя хранить в стеклянной посуде, поскольку он разрушает стекло.
Под действием паров воды и водорода при нагревании фторид серебра восстанавливается до металлического серебра:
2Ag+ Н2
O = 2Ag + 2HF+ ½O2
2AgF + Н2
= 2Ag+ 2HF
Ультрафиолетовые лучи вызывают превращение фторида серебра в полуфторид Ag2
F. Водный раствор фторида серебра служит для дезинфекции питьевой воды.
Известны кристаллогидраты AgF •nH2
О (где п —
1, 2, 4) и фторокислоты H[AgF2
l, H2
[AgF3
], H3
[AgF].
Моногидрат AgF • Н2
О осаждается в виде светло-желтых кубических кристаллов при упаривании в вакууме раствора безводного AgF в воде.
Дигидрат AgF • 2H2
0, представляющий собой твердые бесцветные призматические кристаллы с температурой плавления +42°C, выпадает из концентрированных растворов AgF.
Из раствора, полученного растворением Ag2
O в 20%-ной плавиковой кислоте, выпадают кристаллы AgF • 4Н2
0. При охлаждении раствора AgF в плавиковой кислоте осаждаются бесцветные кристаллы H3
[AgF4
], которые при 0°C в токе воздуха превращаются в белые кристаллы H[AgF2
].
Хлорид серебра,
AgCl, встречается в природе в виде минерала кераргирита
и может быть получен обработкой металлического серебра хлорной водой, взаимодействием элементов при высокой температуре, действием газообразного НСl на серебро (выше +1150°C), обработкой соляной кислотой серебра в присутствии воздуха (кислорода или другого окислителя), действием растворимых хлоридов на серебро, обработкой растворов солей серебра соляной кислотой или раствором какого-либо хлорида.
Соединение AgCl представляет собой диамагнитные белые кубические гранецептрированные кристаллы с т. пл. +455°C и т. кип. +1554°C. Хлорид серебра растворяется в растворах хлоридов (NaCl, KС1, NH4
C1, СаС12
, MnCl2
). цианидов, тиосульфатов, нитратов щелочных металлов и аммиаке с образованием растворимых и бесцветных координационных соединений
AgCl + КСl = K[AgCl2
]
AgCl + 2Na2
S2
O3
+Na3
[Ag(S2
03
)2
] + NaCl
AgCl + 2KCN = K[Ag(CN)2
] + KCl
AgCl+ 2NH3
=
[Ag(NH3
)2
]Cl
Под действием света хлорид серебра восстанавливается (окрашиваясь в фиолетовый, а затем в черный цвет) с высвобождением ребра и хлора:
AgCl=Ag + 1
/2
Cl2
На этой реакции основывается применение хлорида серебра в фотопленках.
Бромид серебра,
AgBr, встречается в природе в виде минерала бромаргирита
. В лаборатории может быть получен в темноте обработкой раствора AgNO3
раствором НВг (или бромида щелочного металла) либо непосредственным взаимодействием бpoма с металлическим серебром. Получение AgBr осуществляется в темноте, чтобы исключить фотовосстановление:
AgNO3
+ KBr=
AgBr + KNO3
Ag + 1
/2
Br2
= AgBr + 27,4 ккал
Соединение AgBr может существовать либо в коллоидной форме либо в виде диамагнитных желтых кубических гранецентрированных кристаллов с плотностью 6,47 г/см3
, т. пл. +434°C и т. кип. +15370
C. Бромид серебра плохо растворим в воде и растворяется в аммиаке тпосульфатах щелочных металлов и в конц. H2
SO4
при нагревании:
AgBr + 2NH4
OH = [Ag(NH3
)2
]Br + 2H2
O
2AgBr + H2
SO4
= Ag2
SO4
+ 2HBr
AgBr + 2Na2
S2
O3
-> Na3
[Ag(S2
O3
)2
] + NaBr
Бромид серебра более чувствителен к свету, чем хлорид серебра, и иод действием света разлагается на элементы:
AgBr=Ag+1
/2
Br2
Бромистое серебро восстанавливается цинком в кислой среде или металлами (такими, как свинец или медь) при нагревании а также сплавлением с безводным карбонатом натрия:
2AgBr +Na2
CO3
= 2Ag + 2NaBr + СO2
На холоду AgBr поглощает аммиак, причем могут образовываться различные аддукты: AgBr • NH3
, 2AgBr • 3NH3
, AgBr • 3NH3
Бромид серебра применяется для изготовления фотопленок и в качестве катализатора при получении монокарбоновых жирных кислот или олефинов с помощью реактива Гриньяра.
Иодид серебра,
AgI. встречается в природе в виде минерала йодагирита в лаборатории может быть получен (в темноте) обратной раствора AgNO3
раствором HI или иодида щелочного металла, путем непосредственного взаимодействия паров иода с металлическим серебром, хлоридом или бромидом серебра при нагревании, действием HI на металлическое серебро на холоду.
AgNO3
+ HI = Agl + HNO3
Ag + V2
I2
= Agl + 29,3 ккал
AgNO3
+ KI = Agl + KNO3
Ag + HI = Agl + l
/2
H2
Иодид серебра может существовать либо в виде прозрачных лучепреломляющих лимонно-желтых гексагональных призматических кристаллов, либо в виде двулучепреломляющих красных октаэдров.
AgNO3
+ KCN = AgCN+KNO3
Цианид серебра
представляет собой бесцветные ромбоэдрические кристаллы с плотностью 3,95 г/см3
и т. пл. +320..350°C. Он плохо растворим в воде, растворяется в аммиаке или растворах солей аммония, цианидов и тиосульфатов щелочных металлов с образованием координационных соединений.
AgCN + 2NH4
OH = [Ag(NH3
)2
]CN +2H2
O
AgCN + KCN = K[Ag(СN)2
]
Уксусная кислота исероводород взаимодействуют с дициано-аргентатами Me1
[Ag(CN)2
] по уравнениям
K[Ag(CN)2
] + HNO3
= AgCN + KNO3
+ HCN
2K[Ag(CN)2
] + 2H2
S = Ag2
S + K2
S + 4HCN
При обработке K[Ag(CN)2
] нитратом серебра образуется дицианоаргентат серебра Ag[Ag(CN)2
], представляющий собой димерную форму моноцианида серебра.
Известны цианоаргентаты типов Me1
2
[Ag(CN)3
] и Me1
2
[Ag(CN)4
].
Оксалат серебра
представляет собой белые моноклинные кристаллы с плотностью 5,029 г/см3
,
он плохо растворим в воде, чувствителен к свету, разлагается при нагревании до +100°C. При +140o
CAg2
C2
O4
разлагается со взрывом.
Периодаты серебра
. Известны следующие периодаты серебра: AgIO4
- оранжевый, Ag2
H3
IO6
— лимонно-желтый. Ag3
IO5
и Ag5
IO6
- черные.
Координационные соединения
Большинство простых соединений одновалентного серебра с неорганическими и органическими реагентами образуют координационные соединения. Благодаря образованию координационных соединений многие плохо растворимые в воде соединения серебра превращаются в легко растворимые. Серебро может иметь координационные числа 2, 3, 4 и 6.
Известны многочисленные координационные соединения у которых вокруг центрального иона серебра скоординированы нейтральные молекулы аммиака или аминов (моно- или диметиламин, пиридин, этилендиампн. анилин и т.д.).
При действии аммиака или различных органических аминов на окись, гидроокись, нитрат, сульфат, карбонат серебра образуются соединения с комплексным катионом, например [Ag(NH3
)2
]+
, [AgEnK]+
, [AgEn2
]+
, [AgPy]+
, [AgPy2
]+
.
Устойчивость комплексных катионов серебра ниже устойчивости соответствующих катионов меди(II).
При растворении галогенидов серебра (AgCl,AgBr,AgI) в растворах галогенидов, псевдогалогенидов или тиосульфатов щёлочных металлов образуются растворимые в воде координационные соединения, содержащие комплексные анионы, например [AgCl2
]-
, [AgCl3
]2-
, [AgCl4
]3-
, Ag Br3
]2-
и т.д.
n-Диметиламинобензилиденродамин образует с концентрированными растворами солей серебра фиолетовый осадок.
С разбавленными растворами солей серебра диметиламинобензил-иденродамин не образует осадка, а только окрашивает раствор в интенсивно фиолетовый цвет.
Соединения двухвалентного серебра
Известно немного соединений двухвалентного серебра. Для них характерна низкая устойчивость и способность разлагаться водой с выделением кислорода.
Неорганические соединения
Окись серебра,AgO, получают действием озона на металличекое серебро или на Ag2
O, AgNO3
или Ag2
SO4
, обработкой раствора AgNO3
раствором K2
S2
O8
, обработкой щелочной суспензии Ag2
O перманганатом калия, анодным окислением металлического серебра с использованием в качестве электролита разбавленного раствора H2
SO4
или NaOH.
Ag2
O +О3
= 2AgO +O2
2AgNO3
+ K2
S2
O8
+ 4KOH = 2AgO + 2K2
SO4
+ 2KNO3
+ 2H2
O
Ag2
O + 2KMnO4
+ 2КОН = 2AgO + 2K2
MnO4
+H2
O
Обработка K2
S2
O8
соединений серебра в слабо кислой cpeде и в присутствии пиридина приводит к образованию оранжевого кристаллического осадка [AgPy]S2
O8
.
Окись серебра
представляет собой диамагнитный серовато черный кристаллический порошок с плотностью 7,48 г!см3
.
Она растворима в H2
SO4
, НClO4
и конц. HNO3
, устойчива при обычной температуре, разлагается на элементы при нагревании до +100o
C, является энергичным окислителем по отношению к SO2
, NH3
Me+
NO2
, обладает свойствами полупроводника.
Фторид серебра,
AgF2
, получают действием газообразного фтора на металлическое серебро при +250..300°C пли на галогениды серебра(I) при +200..300°C.
Ag + F2
= AgF2
+ 84,5 кал
Фторид серебра представляет собой парамагнитный коричневочерный порошок с т. пл. +690°C. Он разлагается под действием воды или влажного воздуха и обладает окислительным действием по отношению к иодидам, спирту, солям хрома(III) и марганца (II)
6AgF2
+ ЗН2
O = 6AgF+ 6HF + O3
Сульфид серебра,AgS, образуется в виде коричневого осадка при обработке раствора AgNO3
в беизоилпропиле раствором серы в сероуглероде.
Нитрат серебра,
Ag(NO3
)2
, получают окислением Ag(NO3
)2
озоном. Это бесцветные кристаллы, разлагающиеся водой:
4Ag(NO3
)2
+ 2Н2
O = 4AgNO3
+ 4HNO3
+ O2
Координационные соединения
Известен ряд координационных соединений двухвалентного серебра типов [Ag(G5
H5
N)4
]X2
и [AgAm2
]X2
(где Am == фенантролин C12
H8
N2
, дипиридил C10
H8
N2
и X = NO-
3
, СlO-
3 ,
ClO-
4
)
Соединения трехвалентного серебра
Известно небольшое число соединений трехвалентного (ребра, например Ag2
O3
,K6
H[Ag(IO6
)2
] •10 H2
O, K7
[Ag(IO6
)2
], Na7
H2
[Ag(TeO6
)2
] •14H2
O и др.
Окись серебра,
Ag2
O3
, образуется в смеси с окисью серебра(II) - анодном окислении серебра или при действии фтора (пли пероcульфата) на соль серебра(I). Черная кристаллическая смесь Ag2
O3
AgO неустойчива, обладает окислительными свойствами и при легком нагревании превращается в AgO.
Диортопериодатоаргеитаты(III),MeI
6
H[Ag(IO6
)2
]•nH2
O,являются диамагнитными солями оранжевого цвета c кристаллами красивой формы; их рассматривают как производные - гипотетической кислоты H7
[Ag(IO6
)2
]. При окислении смеси водных растворов AgNO3
, К5
IO6
и КОН надсернокислым калием K2
S2
O8
образуется коричневый раствор, из которого при концентрировании путем медленного испарения выпадают оранжевые кристаллы K6
H[Ag(IO6
)2
] •10Н2
O, а при быстром упариваииии — K7
[Ag(IO6
)2
] •КОН •8Н2
O. Обработка соединения K6
H[Ag(IO6
)2
] карбонатом натрия приводит к осаждению оранжево-желтых кристаллов Na5
KH[Ag(IO6
)7] •16Н2
O.
Диортотеллураргентаты Me+
6
H3
[Ag(TeO6
)2]•nH2
O Me+
7
H2
[Ag(TeO6
)2
]•nН2
O представляют собой красиво кристаллизующиеся желтые диамагнитные соли — производные гипотической кислоты H9
[Ag(TeO6
)2
].
Окисление водного раствора смеси Ag2
S04
, Na2
CO3
и ТеO2
пероксосульфатом калия K2
S2
O5
приводит к образованию коричневого раствора, из которого при концентрировании путем изотеримического испарения осаждаются желтые кристаллы Na6
H3
[Ag(Te06
)2
] •18Н2
0. При использовании больших количеств корбаната натрия выпадают кристаллыNa7
H2
[Ag(Te06
)2
]•14Н2
СПИСОК ЛИТЕРАТУРЫ
|