Задача 1.
1. Рассчитайте количество
вещества: а) азота массой 14 г; б) кислорода массой 48 г; в) железа массой 112
г; г) фосфора массой 31 г.
Решение:
Единицей измерения
количества вещества в химии является 1 моль – это такое количество вещества,
которое содержит NА
= 6,02*1023 структурных единиц вещества (атомов, молекул, ионов).
Масса одного моля вещества называется молярной (атомной) массой вещества, она
численно равна сумме атомных масс всех элементов, входящих в соединение,
измеряется в г/моль. Количество вещества в молях вычисляют по формуле:
n(В) = 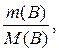
где n(В) – количество вещества;
m(В) – масса вещества,г;
М(В) – молярная масса вещества, г/моль.
а) Молярная масса азота N2: М(N2) = 2*14 = 28 г/моль.
n(N2) =  =
= 
б) М(О2) =
2*16 = 32 г/моль
n(О2)
=  .
.
в) М(Fe) = 56 г/моль
n(Fe) =  .
.
г) М(Р) = 31 г/моль
n(Р) =  .
.
Ответ: а) n(N2) = 0,5 моль; б) n(O2) = 1,5 моль;
в) n(Fe) = 2 моль; г) n(Р) = 1 моль.
Задача
11.
Напишите
электронные формулы атомов элементов с порядковыми номерами 9 и 28.
Распределите электроны этих атомов по квантовым ячейкам. К какому
электронному семейству относится каждый
из этих элементов?
Решение:
Общее
число электронов, входящих в состав атома элемента, равно порядковому номеру этого элемента в таблице Д.И.
Менделеева.
Электронная
формула отображает распределение электронов в атоме по энергетическим уровням и
подуровням (атомным орбиталям). Электронная конфигурация обозначается группами
символов nlх,
где:
n – главное квантовое число, принимает
значения 1, 2, 3… Максимальное значение n для элемента – число электронных
уровней в атоме элемента, равно номеру периода, в котором находится элемент в
таблице. Максимальное количество электронов на каждом уровне равно 2 n2.
l – орбитальное квантовое число,
определяет форму, которую принимает электронное облако (в формуле вместо l записывают обозначения подуровней: s, p, d, f).
х - число электронов в данном подуровне
(орбитали).
Для элементов главных
подгрупп число электронов на внешнем (валентном) уровне равно номеру группы в таблице
Менделеева.
При заполнении
электронных уровней электрон занимает тот энергетический уровень, на котором он
обладает наименьшей энергией – меньшая сумма (n + l) (Правило Клечковского).
Поэтому
последовательность заполнения энергетических уровней и подуровней следующая, 1s2 2s2 2p6 3s2
3p6 4s2 3d10 4p6
5s2 4d10 5p6 6s2 5d1
4f14 5d2-10 6p6 7s2 6d1
5f14…
При распределении
электронов по квантовым ячейкам по правилу Хунда в каждой ячейке может
находиться не более двух элементов, различающихся своими магнитными квантовыми
числами («спинами»). В пределах подуровня сначала в ячейки «заселяется» по
одному электрону с одинаковыми магнитными числами, потом по второму с
противоположными магнитными числами.
Электронное семейство
элемента определяется тем подуровнем, на котором у данного элемента находятся
«валентные» электроны, определяющие химическую природу атома.
1) Фтор 9F – элемент номер 9 таблицы Д.И.
Менделеева. Общее количество электронов равно 9, количество энергетических
уровней n = 2 (номер периода), относится к
главной подгруппе VII группы, следовательно содержит на внешнем уровне 7
электронов. Электронная формула фтора: 9F
1s2 2s2 2p5.
Распределение электронов по
квантовым ячейкам:
n = 1 S
n
= 2 P
Валентные
электроны находятся на заполняющемся р – подуровне, значит, фтор относится к р
– электронному семейству.
2) Никель
28Ni – элемент номер 28. Общее количество электронов равно 28, распределены
они на 4-х энергетических уровнях (относится к 4-ому периоду).
В
соответствии с порядком заполнения орбиталей имеет электронную формулу: 1s2 2s2 2p6
3s2 3p6 3d8 4s2.
|
↑↓
|
|
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
|
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑↓
|
↑
|
↑
|
|
|
↑↓
|
|
|
|
|
|
|
|
|
|
28Ni n=1 s
n=2 p
n=3 d
n=4 f
У
никеля идёт заполнение 3d – подуровня, поэтому он относится к d – электронному семейству.
Задача
21.
Вычислить
тепловой эффект реакции восстановления 1 моль Fe2O3 металлическим алюминием.
Решение:
При
восстановлении протекает реакция Fe2O3 + 2Al → Al2O3 + 2Fe
В
соответствии со следствием из закона Гесса тепловой эффект реакции равен суме
стандартных энтальпий образования исходных веществ (с учётом стеклометрических
коэффициентов в уравнении химической реакции). Стандартные энтальпии
образования простых веществ по определению принимаются равными нулю.
По
справочным таблицам находим значения стандартных энтальпий образования  для веществ, участвующих в реакции:
для веществ, участвующих в реакции:
 = (Fe2O3k) = - 822,16 кДж/моль
= (Fe2O3k) = - 822,16 кДж/моль
 = (Al2O3k)
= - 1675,69 кДж/моль
= (Al2O3k)
= - 1675,69 кДж/моль
 = (Al) = 0 кДж/моль
= (Al) = 0 кДж/моль
 = (Fe) = 0 кДж/моль
= (Fe) = 0 кДж/моль
Тепловой эффект реакции в расчёте на
1 моль Fe2O3:
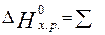
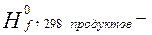 ∑
∑ = (-1675,69 + 2*0) –
= (-1675,69 + 2*0) –
- (-822,16
+ 2*0) = - 853,53 кДж/моль ≤ 0, следовательно, данная реакция
экзотермическая, протекает с выделение 853,53 кДж тепла на 1 моль Fe2O3. Реакция используется в технике (под названием
«алюминотермии»), например, для сварки рельсов.
Ответ: 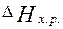 = - 853,53 кДж/моль.
= - 853,53 кДж/моль.
Задача
31.
Теплоты
образования  оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и 33,85 кДж.
Определите
оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и 33,85 кДж.
Определите 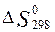 и
и 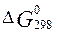 для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
Решение:
Используем
справочные данные значений 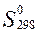 и
и 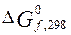 для всех веществ, участвующих в реакциях образования оксидов
азота в соответствии с термохимическими уравнениями.
для всех веществ, участвующих в реакциях образования оксидов
азота в соответствии с термохимическими уравнениями.



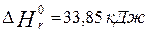
|
Вещество
|
Энтальпия образования 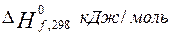
|
Энтропия 
|
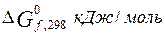
|
|
N2
|
0
|
191,61
|
0
|
|
O2
|
0
|
205,138
|
0
|
|
NO(г)
|
90,37
|
210,76
|
86,55
|
|
NO2(г)
|
33,85
|
240,06
|
51,31
|
1.
Условием самопроизвольного протекания реакции является 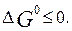 Для обоих оксидов в с.
у.
Для обоих оксидов в с.
у. 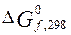 > 0, следовательно, обе реакции образования оксидов из
простых веществ при стандартных условиях протекать не могут.
> 0, следовательно, обе реакции образования оксидов из
простых веществ при стандартных условиях протекать не могут.
Находим
изменение энтропии (с. у.) для реакций образования оксидов по формуле
2. 
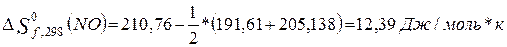

3.
Сравнение тепловых эффектов
эндотермических реакций образования оксидов показывает, что первая реакция
протекает с большим поглощением тепла,
значит она будет протекать при более высокой температуре.
Ответ:
1) Оба оксида термодинамически невозможно получить из простых веществ в
стандартных условиях;
2) 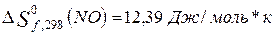
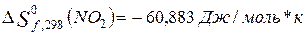
3)
Реакция образования NO протекает при более высокой температуре, чем реакция
образования NO2.
Задача 41.
Окисление
серы и её диоксида протекает по уравнениям:
а) S (К) + О2 (г) = SO2 (г);
б) 2SO2 (г) + О2 (г) = 2SO3 (г).
Как изменятся
скорости этих реакций, если объёмы каждой из систем уменьшить в 4 раза?
Решение:
При
уменьшении объёма системы в 4 раза, происходит увеличение концентрации всех
газообразных веществ в системе в 4 раза.
а) Для
реакции S (К) + О2 (г) = SO2 (г).
Для гетерогенной
реакции в соответствии с законом действующих масс скорость реакции определяется
концентрациями газообразных веществ и определяется по формуле: Vисх. пр. = К1 [O2]
Vисх. обр. = К2 [SO2]
После
сжатия системы в 4 раза:
V пр./ = К1
[4O2] = 4 К1 [O2]
V обр./
= К2 [4SO2]
= 4 К2 [SO4]
Увеличение
скорости реакции:


Скорости
прямой и обратной реакции возрастут в 4 раза.
б) Для
гомогенной реакции 2SO2 (г) + О2 (г) = 2SO3 (г), протекающей в газовой фазе:
Скорости
исходные:
Vисх. пр. = К1 [O2] [SO2]2
Vисх. обр. = К2 [SO3]2
После
сжатия:
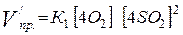 =
64 К1 [O2]
[SO2]2
=
64 К1 [O2]
[SO2]2
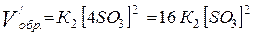
Сравнение
скоростей прямой и обратной реакций:

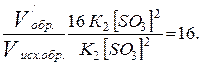
При
сжатии системы в 4 раза скорость прямой реакции возрастёт в 64 раза, а скорость
обратной реакции только в 16 раз, что обусловливает сдвиг равновесия реакции
влево, в сторону образования продуктов реакции, что соответствует принципу Ле
Шателье.
Задача
51.
Вычислите
молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция,
плотность которого 1,178 г/см3.
Решение:
1) На
ходим массу 1 л 20%-ного раствора CaCl2
mр-ра = р * Vр-ра = 1,178
г/см3 * 1000 см3 = 1178 г
2) Находим
массу хлорида кальция m (CaCl2),
содержащегося в 1 л раствора. Из соотношения для определения массовой доли
вещества:
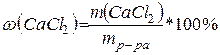 , выводим
, выводим

3)
Находим молярную массу и молярную массу эквивалентов CaCl2, эквивалентное число для CaCl2 zэкв. = 2.
М (CaCl2) = 40 + 2*35,5 = 111 г/моль
Мэ (CaCl2) = 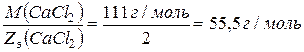
4)
Молярная концентрация раствора равна количеству растворённого вещества в 1 л
раствора. Вычисляется по формуле:

5)
Эквивалентная концентрация (молярная концентрация эквивалентов вещества в
растворе) равна количеству эквивалентов вещества в 1 л раствора. Рассчитывается
по формуле:
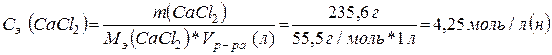
Ответ: С
(СaCl2) = 2,12 моль/л; Сэ (СaCl2) = 4,25 моль/л (н).
Задача
61.
Вычислите
процентную концентрацию водного раствора сахара С12Н22О11,
зная температуру кристаллизации раствора (-0,93 0С). Криоскопическая
константа воды 1,86 град.
Решение:
1)
Находим молярную массу сахара
М (С12Н22О11)
= 12*12 + 1*22 + 12*16 = 358 г/моль.
2) В
соответствии с законом Рауля понижение температуры кристаллизации раствора
зависит только от количества частиц растворённого вещества в растворе и не
зависит от их природы. Для неэлекролитов (сахар – неэлектролит)

Находим
моляльную концентрацию сахара в растворе
Сm (С12Н22О11)
= 
3) В
соответствии с определением моляльной концентрации раствора содержит 0,5 моль сахара
в 1 кг растворителя.
Масса
сахара в 1 кг растворителя будет
m (С12Н22О11) = n (С12Н22О11)
* М (С12Н22О11) = 0,5 моль * 358 г/моль = =
179 г
Масса
раствора: mр-ра = m (Н2О) + m (С12Н22О11)
4)
Массовая (процентная) концентрация раствора равна
 (С12Н22О11)
=
(С12Н22О11)
= 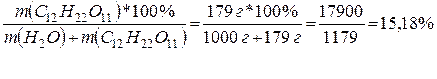
Ответ:  (С12Н22О11)
= 15,18%.
(С12Н22О11)
= 15,18%.
Задача
71.
Реакции
выражаются схемами:
Р + НlO3 + Н2О → Н3РО4
+ НСl
H2S + Cl2 + Н2О → H2SO4 + HCl
Составьте
электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой
реакции укажите какое вещество является окислителем, а какое – восстановителем;
какое вещество окисляется, а какое – восстанавливается.
Решение:
1) 
|
Природа атома и вещества
|
Процессы
|
Электроны
|
НОК
|
Коэффициенты
|
|
окислитель
|
J5+
+ 6е = J1-
Процесс восстановления
|
6
|
30
|
5
|
|
восстановитель
|
Р0 – 5е = Р5+
Процесс окисления
|
5
|
30
|
6
|
В данной
реакции восстановитель фосфор окисляется до ортофосфорной кислоты (Н3РО4),
а окислитель HJO3
(йодноватая кислота) восстанавливается до йодоводородной кислоты (HJ).
2) 

|
Природа атома и вещества
|
Процессы
|
Электроны
|
НОК
|
Коэффициенты
|
|
окислитель
|
Сl0 + е = Cl1-
Процесс восстановления
|
1
|
8
|
8
|
|
восстановитель
|
S2- - 8е = S6+
Процесс окисления
|
8
|
8
|
1
|
Окислитель
хлор Cl2
восстанавливается до соляной кислоты, восстановитель сероводород окисляется до
серной кислоты.