Зміст
Вступ
1. Загальні положення
2. Основи формальної кінетики. Швидкість хімічної реакції
2.1 Метод підбора кінетичного рівняння
2.2 Графічний метод
2.3 Метод Оствальда- Нойеса
Література
Вступ
Тема реферату «Основи формальної кінетики. Швидкість хімічної реакції» з дисципліни «Кінетика і каталіз у ТНР».
Хімічна кінетика, що є розділом фізичної хімії, містить у собі, як окремий випадок, каталіз. Усі проблеми каталізу (включаючи і питання вибору каталізаторів) зводяться до основних проблем хімічної кінетики, тобто до встановлення елементарних хімічних процесів, з яких складається весь процес у цілому, і встановлення закону, по якому протікає процес у часі. Через велику практичну важливість каталітичних процесів, стало прийнятим виділяти цей розділ з хімічної кінетики.
Знання механізму процесу дозволяє описати швидкість хімічної реакції відповідним математичним рівнянням, на основі якого можна зробити кореляцію дослідних даних і їхню екстраполяцію за межі експериментально вивченого інтервалу робочих умов.
З погляду технології на основі даних хімічної кінетики необхідно вирішувати наступні задачі:
1. Установлювати механізм хімічних реакцій.
2. Накопичувати надійні експериментальні дані про швидкості реакцій.
3. Обробляти отримані дані і знаходити зв'язки у формі математичних рівнянь.
4. Проектувати хімічні реактори.
5. Точно визначати режими роботи, методи контролю і необхідне допоміжне устаткування.
Інженер, що працює в цій галузі, займається створенням раціональних схем технологічних процесів, проектуванням нового обладнання для проведення реакцій у промисловому масштабі і модернізацією вже існуючих схем і устаткування.
1. Загальні положення
Розділ фізичної хімії, присвячений закономірностям протікання хімічних процесів у часі, називається хімічною кінетикою.
Метод знаходження рівнянь, що визначають швидкість хімічних реакцій, у які в якості перемінних входять тільки концентрації реагуючих речовин, заснований на використанні основного постулату хімічної кінетики, одержав назву формальної кінетики.
Хімічні реакції протікають з різними швидкостями. Наприклад, реакція нейтралізації протікає практично миттєво, у той час як взаємодія водню з киснем при кімнатній температурі й у відсутності каталізатора протікає надзвичайно повільно. Науку про швидкості хімічних реакцій називають хімічною кінетикою.
Якщо реагенти (або реагенти і каталізатор) знаходяться в різних фазах, то реакція називається гетерогенною; якщо ж реакція протікає в одній фазі, то називається гомогенною. Гомогенні реакції протікають в обсязі, гетерогенні - на поверхні розділу фаз.
На швидкість хіміко-технологічного процесу в основному впливають:
- агрегатний (фазовий) стан і фізико-хімічні властивості вихідних реагентів, проміжних і кінцевих речовин;
- фізико-хімічні властивості середовища, у якому проводяться хімічні і фазові перетворення;
- кінетичні особливості процесу, якось: характер зміни концентрації, розходження заданого і стехіометричного співвідношення реагентів, порядок і молекулярність реакцій, енергія активації, розмір і властивості поверхні розділу фаз реагуючих речовин та продуктів;
- число стадій і необхідність істотної зміни на кожній послідовній стадії таких найважливіших характеристик процесу, як температура, тиск, концентрація, співвідношення реагентів;
- наявність або спеціальне введення хімічних регуляторів перетворень - як ініціаторів, так і інгібіторів;
- використання факторів інтенсифікації протікання процесу (каталізаторів, імпульсів і ін.);
- гідродинамічна характеристика умов контакту реагентів;
- особливості массо- і теплообміну з зовнішнім середовищем;
- комплекс операцій і методів обробки реакційних мас у сполучених з реактором апаратах.
Аналіз переліку факторів показує, що чисто хімічні з них роблять тільки частину загального впливу. Іноді вони визначають у цілому швидкість процесу, наприклад при каталітичному його здійсненні. Для гетерогенних некаталітичних процесів переробки полідисперсних, полімінеральних систем оцінка і виділення в окрему групу хімічних факторів представляє часом важку задачу. Сполучення технологічних стадій (кристалізація - фільтрування, окислювання газу - абсорбція продукту - очищення вихлопного газу й ін.) приводить до того, що швидкість процесу визначається швидкістю стадії, яка лімітує.
2.
Основи формальної кінетики. Швидкість хімічної реакції
При перебігу реакції
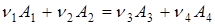 (1) (1)
зліва праворуч концентрація речовин А
1
і А
2
зменшується, а концентрація речовин А
3
і А
4
збільшується.
Швидкість реакції (1) визначається зміною концентрації реагентів за одиницю часу. Для реакцій, що протікають при постійному об'ємі в закритих системах, швидкість реакції виражають рівнянням
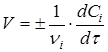 (2) (2)
де vi
і Сi
- відповідно стехіометричний коефіцієнт і концентрація i-го реагенту в момент часу τ
.
Швидкість реакції завжди позитивна. Тому в рівнянні швидкості реакції (2) ставлять знак плюс, якщо швидкість реакції визначають по зміні концентрації кінцевої речовини за одиницю часу, і знак мінус, якщо швидкість визначається по зміні концентрації початкової речовини.
Відповідно до закону діючих мас швидкість реакції V
пропорційна добуткові концентрацій реагуючих речовин у ступенях, рівних їхнім стехіометричним коефіцієнтам у рівнянні швидкості реакції. Для елементарної реакції (1), що протікає зліва праворуч (пряма реакція), швидкість реакції V
виражається рівнянням
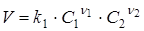 (3) (3)
де k1
- стала пропорційності - константа швидкості прямої реакції;
С
1
і C
2
- концентрації речовин A
1
і А
2
.
Таким чином, рівняння швидкості масопередачі для гомогенного процесу може бути представлене у вигляді
 (4) (4)
Рівняння швидкості масопередачі гетерогенних процесів
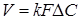 (5) (5)
де  - коефіцієнт масопередачі; - коефіцієнт масопередачі;
F
- поверхня розділу фаз;
∆C
- рушійна сила процесу.
Коефіцієнт масопередачі - це кількість речовини в кілограмах, передана з однієї фази в іншу через поверхню розділу фаз, рівну 1 м
2
, при рушійній силі процесу, яка дорівнює 1 кг/м
3
, протягом 1 год.
При цьому розмірність коефіцієнта масопередачі буде м/год
. Коефіцієнт масопередачі в гетерогенному процесі складна величина, що залежить не тільки від хімічних властивостей реагуючих речовин, але і від їхніх фізичних властивостей, швидкостей потоків, ступеня перемішування, а в ряді випадків від конструктивного оформлення реактора.
Часто швидкість процесу V
виражають зміною кількості dN
и
вихідної речовини або його концентрації dC
и
, кількості або концентрації продукту dN
п
і dC
п
, а також ступеня перетворення β
за час dτ:
   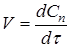 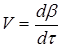
Є розходження в характері зміни швидкостей процесів у залежності від режиму роботи реактора. У реакторах з періодичним завантаженням нової порції реагентів і відводом продуктів реакції концентрації реагентів і швидкість процесу зменшуються в міру його здійснення. По довжині безперервнодіючого проточного реактора ідеального витиснення спостерігається аналогічна залежність. Що стосується реакторів повного змішування, то концентрації в них реагуючих речовин і продуктів підтримуються майже постійними від зони завантаження до зони вивантаження маси з апарата.
Реальний процес хімічних взаємодій є підсумком протікання рівнобіжних і послідовних простих реакцій, кожна з яких йде зі швидкістю, обумовленою особливостями умов процесу в системі.
По числу молекул, що беруть участь в елементарному акті хімічного перетворення, розрізняють реакції мономолекулярні, бімолекулярні і тримолекулярні. Оскільки імовірність одночасного зіткнення трьох часток мала, тримолекулярні реакції зустрічаються рідко.
Однобічна хімічно необоротна елементарна реакція першого порядку може бути представлена рівнянням
А
→ Продукти реакції
Швидкість реакції першого порядку дорівнює:
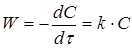 (6) (6)
де  - коефіцієнт швидкості процесу, (константа швидкості реакції); - коефіцієнт швидкості процесу, (константа швидкості реакції);
С
- поточна концентрація речовини А.
Інтегруючи рівняння (6), одержимо
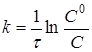 (7) (7)
де С
0
і С - початкова і поточна концентрації речовини А.
Рівняння (7) можна представити у вигляді
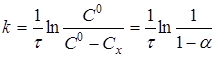 (8) (8)
де Сх
- зміна концентрації речовини А
за час τ
;
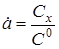 - ступінь перетворення. - ступінь перетворення.
Якщо 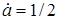 , то , то
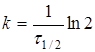 (9) (9)
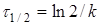 (10) (10)
де 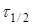 -
час напіврозпаду, тобто час, протягом якого прореагує половина речовини. -
час напіврозпаду, тобто час, протягом якого прореагує половина речовини.
Однобічна хімічно необоротна реакція другого порядку схематично може бути представлена рівнянням
А
1
+ А
2
→ Продукт (продукти) реакції
Швидкість реакції другого порядку дорівнює
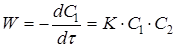 (11) (11)
де С
1
і С
2
– поточні концентрації А
1
і А
2
.
Інтегруючи рівняння (11), одержуємо
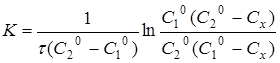 (12) (12)
Якщо С
1
=С
2
=С
, то рівняння (11) прийме вигляд
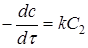 (13) (13)
і після інтегрування
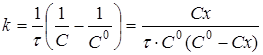 (14) (14)
при С
=С
0/2
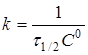 (15) (15)
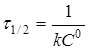 (16) (16)
Час напівперетворення 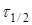 для реакції другого порядку зворотньо пропорційний початковій концентрації реагуючих речовин. для реакції другого порядку зворотньо пропорційний початковій концентрації реагуючих речовин.
У випадку однобічної реакції п-го
порядку
А
1
+ А
2
+ А
3
+ ... → Продукт (продукти) реакції
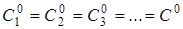 де швидкість реакції дорівнює де швидкість реакції дорівнює
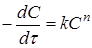 (17) (17)
Інтегруючи рівняння (17), одержимо
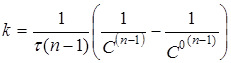 (18) (18)
Якщо С
=С
°/2, то
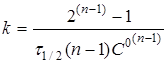 (19) (19)
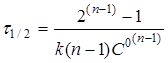 (20) (20)
Час напівперетворення реакції п
-порядку зворотно пропорційній початковій концентрації реагентів у ступені (п-1).
Порядок реакції визначають, використовуючи дослідні дані про зміну концентрації реагуючих речовин з часом. Якщо в реакції бере участь кілька речовин, необхідно визначити приватні порядки стосовно кожної з цих речовин.
Існує кілька способів визначення приватного порядку і порядку реакції.
2.1 Метод підбора кінетичного рівняння
Експериментальні дані залежності концентрації реагуючої речовини від часу підставляють у різні кінетичні рівняння (7), (14) і ін.
Якщо розраховані значення константи швидкості, наприклад, по рівнянню (14) зберігаються постійними (у межах погрішностей досвіду), то порядок досліджуваної реакції буде другим.
2.2 Графічний метод
Порядок реакції зручно визначати графічним методом. Нижче приведені диференціальні рівняння швидкостей реакцій різних порядків і їхнього рішення:
кінетичний рівняння хімічна реакція
| Порядок |
Рівняння швидкості реакції |
Рішення рівняння |
| 1 |
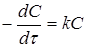 |
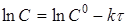 |
| 2 |
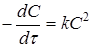 |
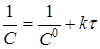 |
| 3 |
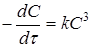 |
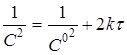 |
Відклавши на осі абсцис час τ, а на осі ординат lgС,
1/C і 1/C
2
, для досліджуваної реакції одержують три лінії. Та з них, що відповідає порядкові даної реакції, буде прямою. Наприклад, якщо реакція має другий порядок, то 1/C
, представлена як функція від τ
, буде прямою, а функції lgС
і 1/C
2
від τ
виявляться кривими.
2.3 Метод Оствальда- Нойеса
Допускають, що швидкість реакції при концентраціях реагентів, пропорційних їхнім стехіометричним коефіцієнтам у рівнянні хімічної реакції (або при надлишку всіх реагентів, крім одного), відповідає рівнянню (18).
Підставляючи в (18) 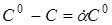 і перетворюючи, маємо і перетворюючи, маємо
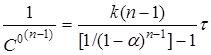 (21) (21)
Для двох кінетичних дослідів, що протікають до одного і того ж ступеня перетворення (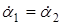 ) )
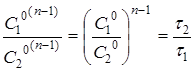 (22) (22)
де С
1
0
і С
2
0
- початкові концентрації реагуючих речовин у досліді (1) і (2);
τ
1
і τ
2
- час протікання реакції в двох дослідах до одного і того ж ступеня перетворення ά.
Після логарифмування рівняння (22) одержують:
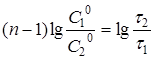 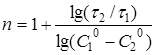 (23) (23)
Рівняння (23) справедливе, якщо реакцію проводять до будь-якого ступеня перетворення.
Порядок реакції п
може бути також розрахований на підставі даних двох кінетичних дослідів з початковими концентраціями реагуючих речовин С
1
0
і С
2
0
по рівнянню
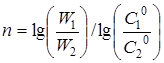 (24) (24)
Література
1. Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ: Учеб. пособие для вузов. Изд. 3-е перераб. и дополн. –М.: Химия, 1985.-592 с.
2. Боре П. Кинетика гетерогенных процессов/ Пер. с француз. –М.: Мир. 1976.-390 с.
3. Еремин Е.Н.Основы химической кинетики. – М.: Высш. шк.,1976.-375 с.
4. Позин М.Е., Зинюк Р.Ю. Физико-химическое основы неорганической технологии: Учеб. пособие для вузов. –Л.: Химия. 1985.-384 с.
5. Царева З.М., Орлова Е.И. Теоретические основы химической технологии. – К.: Вища шк., 1986.-271 с.
6. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. – М.: Химия. 1990.- 352 с.
|