| ОГЛАВЛЕНИЕ
1. Введение.. 2
2. Характеристика исходного сырья. 3
З. Характеристика целевого продукта. 6
4. Физико-химические основы процесса. 7
5. Технологическое оформление процесса синтеза аммиака. 16
6. Охрана окружающей среды в производстве аммиака. 18
Список использованной литературы... 27
Во всех индустриально развитых странах азотная промышленность является в настоящее время одной из основных ведущих отраслей. Доказательством этого служат цифры, характеризующие стремительный рост производство связанного азота. В 1955г во всем мире было произведено аммиака около 8 млн. т, в 1965г - 20 млн. т, в 1975г - 66 млн. т, в 1980г - 100 млн. т, в 1985 - 120 млн. т.
Такое бурное развитие азотной промышленности диктуется в первую очередь необходимостью удовлетворения неудержимо растущего населения земного шара продуктами земледелия. Без минеральных удобрений, и в первую очередь азотных, невозможно решить задачи интенсификации сельского хозяйства.
Производству азотных удобрений и их основы, аммиака, в нашей стране всегда уделялось первостепенное внимание. Среднегодовой прирост темпа аммиака за последние 20 лет составлял 10-19%.
Производство аммиака, как известно, отличается большой энергоемкостью. Историю развития производства аммиака можно рассматривать как борьбу за повышение полезного использования электрической, тепловой, и механической энергии. На первых установках производства аммиака к. п. д. на превышал 10-11%. Использование природного газа в производстве аммиака увеличило общий энергетический к. п. д. до 40%. Современные энерготехнологические агрегаты аммиака практически автономны и имеют производительность 450-500 тыс. т. в год и общий энергетический к. п. д.50-52%. Это обеспечено достижениями химической технологии, химического и энергетического машиностроения, металлургической и приборостроительной промышленности, а также высокой квалификацией строителей, монтажников, эксплуатационников.
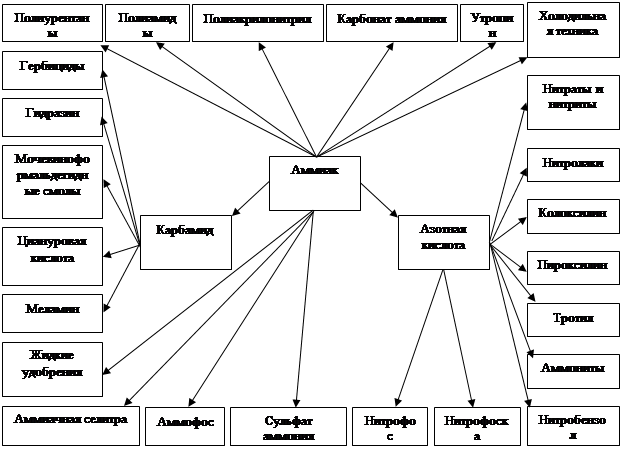
Сырьем для получения продуктов в азотной промышленности является атмосферный воздух и различные виды топлива.
В число постоянных составляющих воздуха входят следующие газы (в% по объему): азот - 78,16; кислород - 20,90; аргон - 0,93; гелий, неон, криптон, ксенон и другие инертные газы - 0,01. В технических расчетах принимают, что воздух содержит 79% азота и 21% кислорода.
Для синтеза аммиака в некоторых схемах необходима азотоводородная смесь в соотношении N2: H2=1: 3. Азот получают разделением воздуха или же совместно с водородом в виде азотоводородной смеси. В других схемах используют и чистый жидкий азот для тонкой очистки синтез - газа от вредных примесей, и газообразный, вводя его в строго корректируемом соотношении в конвертированный газ. В последнем случае воздух подвергают разделению методом глубокого охлаждения.
Поскольку ресурсы атмосферного азота огромны, то сырьевая база азотной промышленности в основном определяется вторым видом сырья - топливом, применяемым для получения водорода или водородсодержащего газа.
В настоящее время основным сырьем в производстве аммиака является природный газ.
Синтез-газ из твердых топлив. Первым из основных источников сырья для получения синтез - газа явилось твердое топливо, которое перерабатывалось в газогенераторах водяного газа по следующим реакциям:
C+H2O ↔ CO +H2; ΔH>0
C+O2 ↔CO2; ΔH<0
Такой способ получения заключается в попеременной подаче через слой крупнокускового твердого топлива (антрацита, кокса, полукокса) воздушного и парового дутья. Синтез - газ получают на стадии парового дутья, а необходимая температура слоя топлива достигается в течение стадии воздушного дутья. Цикл работы генератора составляет 3-5 мин. Полученный водяной газ содержит 50-53% Н2 и ~365 СО.
Для дальнейшего использования в производстве водяной газ необходимо очистить от сернистых соединений и провести конверсию оксида углерода по реакции:
CO+H2O↔CO2+H2; ΔH<0
а затем удалить диоксид углерода полностью в случае его применения для синтеза аммиака.
Недостатками процесса являются его периодичность, низкая единичная производительность газогенератора, а также высокие требования к сырью по количеству и температуре плавления золы, его гранулометрическому составу и другим характеристикам.
Другим направлением является газификация топлива в виде пыли. Этот процесс позволяет использовать практически любые виды топлива. Его особенностями является высокая турболизация в зоне реакции за счет подачи встречных потоков топливной смеси и хорошее смешение парокислородной смеси с топливной пылью.
Синтез - газ из жидких углеводородов. По технологическим схема переработки в синтез - газ жидкие топлива можно разделить на две группы. Первая группа включает топливо, перерабатываемые высокотемпературной кислородной конверсией. Сюда относятся тяжелые жидкие топлива - мазут, крекинг - остатки и т.п. Вторая группа - легкие прямоточные дистилляты (нафта), имеющие конечную температуру кипения не выше 200-220°С; она включает бензин, лигроины, смеси светлых дистиллятов. Вторая группа жидких топлив перерабатывается в синтез - газ каталитической конверсией водяным паром в трубчатых печах.
Достоинством этого метода является возможность получения синтез - газ под давлением, легкость регулирования состава синтез - газа, малый расход электроэнергии. К недостаткам можно отнести высокие требования к углеводородному составу исходного сырья по содержанию в нем непредельных и циклических углеводородов, серы и других примесей, большой удельный расход углеводородов.
Синтез-газ из природного газа. Синтез - газ из углеводородных газов (природного, попутного, газов переработки других топлив) в настоящее время является основным источником получения аммиака. По использованию окислителя и технологическому оформлению можно выделить следующие варианты процесса получения водородосодержащих газов:
· высокотемпературная кислородная конверсия, каталитическая парокислородная конверсия в шахтных реакторах, каталитическая паро-углекислотная конверсия в трубчатых печах.
Окисление метана (основного компонента углбеводородных газов) при получении синтез - газа протекает по следующим основным суммарным реакциям:
CH4+0,5O2 = CO+2H2; ΔH=-35,6 кДж
CH4+H2O = CO+3H2; ΔH=206,4 кДж
CH4+CO2 = 2CO+2H2; ΔH=248,3 кДж
Аналогичным образом осуществляются реакции окисления гомологов метана.
Физические постоянные № 2.
| Молекуляр. вес
|
Мольный объем
|
760 мм рт ст
|
Критические константы
|
| (0 С, 760 мм рт ст)
|
Тпл
|
Ткип
|
Ткр 0С
|
Ркр атм
|
Vкрсм3/моль
|
| 28,0134
|
22403
|
-210
|
-195
|
-47,0
|
33,5
|
90,1
|
Физические постоянные H2
| Молекуляр. вес
|
Мольный объем
|
760 мм рт ст
|
Критические константы
|
| (0 С, 760 мм рт ст)
|
Тпл
|
Ткип
|
Ткр 0С
|
Ркр атм
|
Vкрсм3/моль
|
| 2,0149
|
22412
|
-259,2
|
-252,5
|
-239,9
|
12,8
|
65,0
|
Аммиак в обычных условиях представляет собой бесцветный газ с резким запахом. Хорошо растворим в воде и других растворителях, образует геми - и моногидраты. В жидком состоянии аммиак - бесцветная подвижная ассоциированная жидкость, практически не проводить электрического тока.
Физические постоянные аммиака.
| Молекуляр. вес
|
Мольный объем
|
760 мм рт ст
|
Критические константы
|
| (0 С, 760 мм рт ст)
|
Тпл
|
Ткип
|
Ткр 0С
|
Ркр атм
|
Vкрсм3/моль
|
| 17,0306
|
22049
|
-77,8
|
-33,5
|
132,4
|
111,5
|
72,5
|
Содержание примесей в жидком аммиаке регламентируется ГОСТ 6221-82. Наиболее типичными примесями являются вода, смазочные масла, катализаторная пыль, окалина, карбонат аммония, растворенные газы, (водород, азот, метан).
Аммиак жидкий синтетический должен соответствовать следующим требованиям (ГОСТ 6221 - 82);
| Содержание,%
|
1-й сорт
|
2-й сорт
|
| аммиак, не менее
|
99,9
|
99,6
|
| влага, не более
|
0,1
|
0,4
|
| Примеси, мг/л, не более
|
| масло
|
10,0
|
35,0
|
| железо
|
2,0
|
не нормируется
|
Синтез аммиака из элементов осуществляется по уравнению:
N2+3H2↔2NH3; ΔH<0
Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (ΔH298 = - 91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (ΔH725 =-112,86 кДж/моль). Согласно принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно (ΔS298=-198,13 кдж/моль К) и не благоприятствует протеканию реакции.
Реакция синтеза аммиака протекает с уменьшением объема. Согласно уравнению реакции 4 моль исходных газообразных компонентов образуют 2 моль газообразного продукта. В условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком.
Оценка условий термодинамического равновесия позволяет сделать вывод, что максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низкой температуре. Однако даже при очень высоких температура (выше 1000°С) процесс синтеза в гомогенной газовой фазе практически не осуществим.
Синтез аммиака протекает с заметной скоростью только в присутствие катализатора, причем катализаторами данной реакции служат твердые вещества. Гетерогенный - каталитический синтез аммиака имеет сложный механизм, который может быть описан следующими стадиями:
· диффузия молекул азота и водорода к поверхности катализатора;
· хемосорбция молекул реагентов на поверхности катализатора;
· поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействия между ними;
· десорбция продукта;
· диффузия продукта реакции (аммиака) в газовую фазу.
Исследование кинетики и механизма реакции позволило сделать вывод о том, что лимитирующей стадией процесса является хемосорбция азота. Тогда механизм синтеза аммиака в сокращенной схеме:
N2+Z ↔ ZN2
 ZN2+3H2 ↔ NH3+Z ZN2+3H2 ↔ NH3+Z
N2+3H2 ↔ 2NH3
где Z - свободный центр поверхности катализатора, ZN2 - хемосорбированная частица.
Скорость обратимой реакции получения аммиака из элементов на большинстве известных катализаторов описывается уравнением Темкина-Пыжева:
где k1 и k2 - константы скоростей образования и разложения аммиака; PN, PH, PNH - парциальные давления азота, водорода, аммиака; α - постоянная,
удовлетворяющая неравенству 0<α<1 и характеризующая степень покрытия поверхности катализатора азотом.
При проведении процесса при атмосферном давлении величина а для промышленных катализаторов в интервале температур 400-500°С равна 0,5.
Скорость реакции синтеза аммиака зависит от температуры, давления и реакционной смеси. Оптимальными считают такие значения указанных параметров, при которых скорость процесса максимальна. Чтобы определить оптимальную температуру синтеза Тm, надо продифференцировать по температуре кинетическое уравнение (1), приравнять полученное выражение нулю и найти Тm. Выполнив эти действия, получим формулу: Из формулы (2) следует, что с увеличением содержания в циркуляционном газе аммиака и уменьшением содержания азотоводородной смеси оптимальная температура падает.
Из уравнения Темкина-Пыжева видно, что скорость прямой реакции синтеза пропорциональна P1,5, а скорость обратной реакции пропорциональна P0,5. Отсюда очевидно, что с ростом давления наблюдаемая скорость процесса увеличивается.
И термодинамические, и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза). Конденсация аммиака также улучшается при высоком давлении. Вместе с тем повышение давления увеличивает расход электроэнергии на компрессию, повышает требования к машинам и аппаратам.
Присутствие инертных примесей в реакционной смеси снижает общее давление, и с увеличением содержания метана, аргона и гелия в смеси уменьшает скорость реакции синтеза. Анализируя кинетическое уравнение (1), видим, что скорость прямой реакции обратно пропорциональна парциальному давлению аммиака, а для обратной реакции характерна прямая пропорциональность. Таким образом, с повышением содержания аммиака общая скорость реакции падает. Увеличение объемной скорости смеси приводит к уменьшению скорости прироста содержания аммиака и, тем самым, к увеличению средней скорости и повышению производительности процесса.
Реакция синтеза аммиака обратимая, поэтому полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Условия равновесия процесса и кинетические закономерности его протекания на железных катализаторах обуславливают возможность превращения в аммиак только 20-40% исходной реакционной смеси. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза.
Чтобы выделить аммиак, азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения аммиака. Достичь полной конденсации аммиака не удается; небольшая часть его остается в азотоводородной смеси. Не прореагировавшая азотоводородная смесь с остаточным аммиаком вновь возвращается на синтез аммиака.
Обоснование выбора давления процесса синтеза аммиака.
Выбор давления процесса синтеза аммиака диктуется рядом соображений. Термодинамические и кинетические факторы (равновесное содержание аммиака и скорость реакции) свидетельствуют в пользу высоких давлений. Конденсация аммиака из газовой смеси также облегчается при высоких давлениях. Однако при этом имеет место значительный расход энергии на компрессию и повышенные требования к машинам, аппаратам и арматуре. При пониженных давления упрощается аппаратурное оформление процесса, снижается расход энергии на компрессию, при этом несколько увеличиваются энергозатраты на циркуляцию газа и выделение аммиака.
В качестве критерия оптимальности в работе были приняты приведенные затраты, которые складываются из себестоимости продукта и доли капиталовложений с учетом нормального коэффициента эффективности
3 = С + Е К/П
где 3 - приведенные затраты, руб/т; С - себестоимость аммиака, руб/т; К - капитальные затраты на агрегат, руб.; Е - нормативный коэффициент эффективности, год-1; П-производительность агрегата по аммиаку, т/год.
Проведенные расчеты показали, что при принятых исходных данных наиболее экономичным является среднее давление порядка 30 Мпа. Приведенные затраты с понижением давления увеличиваются, что связано с большими энергоматериальными и капитальными затратами на стадиях выделения аммиака из газовой смеси.
Известно, что по мере увеличения объемной скорости газового потока содержание аммиака в выходящем газа уменьшается. Однако производительность катализатора увеличивается с увеличением скорости газа, так как снижение процентного содержания аммиака в выходящем газе компенсируется влиянием увеличения количества образующегося аммиака.
Катализаторы синтеза аммиака. Высокую каталитическую активность в синтезе аммиака проявляют металлы VI, VII и VIII групп периодической системы. Наибольшей активностью обладают Fe, Ru, Re, Os. В промышленности нашли применение железные катализаторы, получаемые сплавлением оксидов железа с активаторами (промоторами) и последующими восстановлением оксидов железа. В качестве активаторов применяются оксиды кислотного и амфотерного характера - Al2О3. SiО2. TiО2 и др., а также оксиды щелочных и щелочноземельных металлов-К2О, Na20, CaO, MgO и др.
По своему действию промотирующие добавки делятся на две группы:
· структурообразующие (Аl2Оз, SiO2, TiO2, MgO и др.), способствующие получению катализатора с высокоразвитой поверхностью, и модифицирующие (К20, Na2O, CaO и др.), обуславливающие высокую активность поверхности катализатора.
Количество и соотношение добавляемых промоторов оказывает решающее значение в получении промышленных катализаторов высокой активности и устойчивости.
Кроме промотирующих соединений в катализаторе содержится небольшое количество примесей (S, Р, Сu, Ni и т.д.), снижающих его активность, поэтому сырье для приготовления катализатора должно быть возможно более чистым.
Активность катализатора, его структура и состав поверхности в значительной степени определяются условиями восстановления.
Процесс восстановления катализатора можно описать суммарным уравнением:
Fe3O4 + 4H2 → 3Fe + 4H2O; H>0
Катализатора синтеза аммиака необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе в сумме не должна превышать 5 10-5%.
Кислородосодержащие соединения (H2O, СО, СО2) и кислород, присутствующие в азотоводородной смеси, являются сильными каталитическими ядами, снижающими активность катализатора обратимо. Их отравляющее действие пропорционально содержанию в них кислорода. Если в составе свежего газа имеются Кислородосодержащие примеси или масло, газ следует вводить в цикл перед вторичной конденсацией для удаления вредных соединений конденсирующимся NH3.
Для получения катализатора высокой активности при восстановлении необходимо предотвращать повышение концентрации паров воды в газовой фаза. Поэтому процесс восстановления катализатора проводят при высокой объемной скорости, низком давлении, постепенном повышении температуры и высокой степени очистки газа восстановителя, поступающего на катализатор.
В промышленных колоннах катализатор восстанавливают циркуляционной азотоводородной смесью при объемной скорости 5000-10000ч-1 и давлении 50-100 ат. Концентрация водяного пар в газе, выходящем из колонны синтеза, не должна превышать 3000 см3/м3.
Основные условия высокой стабильной производительности установок синтеза аммиака:
· высокая степень очистки азотоводородной смеси от каталитических ядов и инертных примесей;
· поддержание соотношения N2: H2 близкого к 1: 3;
· оптимальная температура процесса по длине каталитической зоны;
· снижение содержания аммиака на входе в контактный аппарат;
· совершенная конструкция контактного аппарата (колонна синтеза).
Основные принципы управления процессом синтеза аммиака.
Эксплуатация систем синтеза аммиака сложна из-за наличия многочисленных прямых и обратных связей между регулируемыми и регулирующими параметрами процесса.
Наибольшая эффективность достигается при оптимизации таких параметров процесса, как давление, температурный режим, объемная скорость, состав газа, подаваемого в реактор синтеза аммиака, по основным компонентам (Н2, N3, NНз) и примесям (яды, инерты):
1) Факторы, изменение которых приводит к изменению давления в системе. Изменение температурного уровня в реакторе влечет за собой изменение одновременно двух величин: равновесного содержания аммиака и скорости реакции. Причем увеличение температуры приводит к снижению равновесного содержания и ускорению реакции синтеза аммиака. Поэтому в промышленных условиях, обеспечивающих предельную для данных условий степень превращения (близкую к равновесной), подъем температуру приводит к пропорциональному снижению степени превращения. Изменение газовой нагрузки на входе в реактор влияет на давление в системе следующим образом: при уменьшении нагрузки степень конверсии увеличивается, что вызывает повышение температуры в зоне катализа и, в свою очередь, к увеличению давления в системе. И наоборот, увеличение газовой нагрузки на реактор (в известных пределах) приводит к снижению давления в системе. Кроме того, при повышении объемных скоростей, с одной стороны, снижается степень конверсии, а с другой - температурный уровень в зане катализа и увеличивается производительность реактора по аммиаку. Последнее связано с тем, что уменьшение производительности реактора от снижения концентрации аммиака в выходящем газе компенсируется увеличением объемной скорости, так как в процентах это увеличение значительно больше снижения концентрации аммиака.
Расход свежего синтез - газа в соотношении N2: H2=1: (2,5-3) зависит от режима работы, активности катализатора, заданной производительности установки. Синтез - газ, удаляемый из систему в виде аммиака и продувочных и танковых газов, непрерывно поступает от компрессора. При избытке синтез-газа давление в реакторе синтеза повышается до допустимого предела компрессора, а избыток его сбрасывается. Если же расход синтез - газа уменьшается (или недостаточен), вращение компрессора уменьшается и давление в системе снижается до достижения баланса между поступающим на синтез газом и получающимся аммиаком. I
Скорость реакции синтеза аммиака зависит от состава газовой смеси. оптимальным составом при равновесии, согласно закону действующих масс, является стехиометрический. Отклонение от равновесия ведет к более низкому значению оптимального соотношения вследствие влияния кинетических факторов. Максимальная скорость реакции в промышленных условиях наблюдается при соотношении Н2: N2=2,5-2,8. Поэтому в промышленных условиях при работе систем синтеза с предельным выходом аммиака (близким к равновесному) отклонение состава от оптимального соотношения приводит к снижению скорости процесса синтеза и, соответственно, к увеличению давления.
Увеличение содержания аммиака в газе на входе в реактор (повышение температуры вторичной конденсации) приводит к увеличению давления, так как снижается скорость реакции синтеза за счет торможения процесса продуктом реакции (аммиаком). Уменьшение начальной концентрации аммиака приводит более высоким степеням превращения и соответственно к снижению давления в системе.
Изменение содержания инертных газа в синтез - газе на входе в реактор приводит к изменению давления в системе за счет изменения эффективного давления, определяемого по уравнению:
Рэфф=Робщ(1-i) 2
где i - содержание инертных газов, доли от общего объема.
Изменение эффективного давления приводит соответственно к изменению степени конверсии и скорости реакции синтеза аммиака. Причем с ростом содержания инертных газов давление в системе синтеза увеличивается, а при их снижении - уменьшается.
Изменение активности катализатора также приводит к изменению давления в системе.
Температура, скорость процесса, чистота синтез - газа является основными причинами, приводящими к изменению активности катализатора. Так, при работе даже на чистом синтез - газе активность катализатора, подвергшегося действию высоких температур (530°С) в течении длительного времени, снижается необратимо за счет постоянно протекающих в катализаторе ре-кристаллизационных процессов.
Оптимальным в системе синтеза аммиака является возможно более низкое давление, обеспечивающее заданную производительность агрегата по аммиаку с учетом затрат на выделение продукта из циркуляционного газа.
2) Изменение температурного уровня в зоне катализатора возможно за счет следующих факторов.
Изменение давления. При повышении давления температурный уровень в реакторе повышается, так как возрастает степень превращения и соответственно тепловыделение, идущее на повышение температуры. Уменьшение давления приводит к снижению температуры.
Изменение расхода свежего синтез - газа. При поступлении избыточного давления свежего синтез - газа наблюдается рост давления и соответственно повышение температуры в зоне катализа. При уменьшении расхода синтез - газа снижаются давление и температурный уровень в реакторе.
Изменение газовой нагрузки на реактор. При снижении газовой нагрузки увеличивается степень конверсии и соответственно повышается температурный уровень в реакторе. Наоборот, увеличение газовой нагрузки снижает температуру в реакторе.
Содержание аммиака на входе в реактор. Уменьшение содержания аммиака повышает температурный уровень в зоне катализатора, так как при этом увеличивается степень конверсии, а увеличение содержания аммиака во входящем газе наоборот снижает температурный уровень в реакторе.
Содержание инертных газов в синтез - газе. Уменьшение содержания инертных газов приводит к повышению эффективного давления и соответственно повышение скорости процесса и степени конверсии, в результате чего температурный уровень в реакторе повышается. При увеличении содержания инертных газов температурный уровень в реакторе понижается.

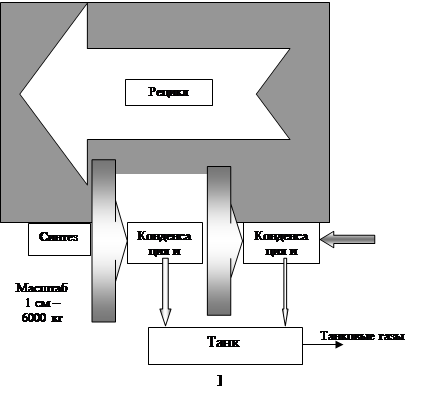
Технологическая схема процесса
1 - Подогреватель газа.2 - Колонна синтеза аммиака.3 - Подогреватель воды.4 - Выносной теплообменник.5 – Циркуляционное колесо компрессора.6 – Сепаратор жидкого аммиака.7 – Блок аппарата воздушного охлаждения.8 – Конденсационная колонна.9 - Конденсационная колонна продувочных газов.10 – испаритель жидкого аммиака на линии продувочных газов.11 – Сборник жидкого аммиака.12 – Испаритель жидкого аммиака на линии танковых газов.13 – Сепаратор.14 – Промежуточная дренажая ёмкость.15 – Испарители житкого аммиака.16 – Магнитный фильтр.
5. Технологическое оформление процесса синтеза аммиака
Принципиальная технологическая схема синтеза аммиака в агрегате мощность 1360 т/сут на отечественном оборудовании.
Свежая азотоводородная смесь после очистки метанированием сжимается в центробежном компрессоре до давления 32 Мпа и после охлаждения в воздушном холодильнике (на схеме не показан) поступает в нижнюю часть конденсационной колонны 8 для очистки от остаточных примесей СОз, Н2О и следов масла. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, освобождается при этом от водяных паров и следов СО2. и масла, насыщается аммиаком до 3-5% и смешивается с циркуляционным газом. Полученная смесь проходит по трубкам теплообменника конденсационной колонны и направляется в межтрубное пространство выносного теплообменника 4, где нагревается до 185-1950С за счет теплоты газа, выходящего из колонны синтеза. Затем циркуляционный газ поступает в колонны синтеза 2.
В колонне синтеза газ проходит снизу вверх по кольцевой щели между корпусом колонны и кожухом насадки и поступает в межтрубное пространство внутреннего теплообменника, размещенного в горловине корпуса колонны синтеза. В теплообменнике циркуляционный газ нагревается до температуры начала реакции 400-440°С за счет теплоты конвертированного газа и затем последовательно проходит четыре слоя катализатора, в результате чего концентрация аммиака в газе повышается до 15%. Пройдя через центральную трубу, при температуре 500-515°С азотоводородоаммиачная смесь направляется во внутренний теплообменник, где охлаждается до 330°С. дольней шее охлаждение газовой смеси до 215°С осуществляется в трубном пространстве подогревателя питательной воды 3, в трубном пространстве выносного теплообменника 4 до 65°С за счет холодного циркулирующего газа, идущего по межтрубному пространству, и затем в аппаратах воздушного охлаждения 7 до 40°С, при этом часть аммиака конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в сепараторе 6, а затем смесь, содержащая 10-12% NH3, идет на циркуляционное колесо компрессора 5 азотоводородной смеси, где сжимается до 32 Мпа.
Циркуляционный газ при температуре 50°С поступает в систему вторичной конденсации, включающую конденсационную колонну 8 и испарители жидкого аммиака 15. В конденсационной колонне газ охлаждается до 18°С и в испарителя за счет кипения аммиака в межтрубном пространстве до - 5°С. Из трубного пространства испарителей смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение жидкого аммиака от газа и смешение свежей азотоводородной смеси с циркуляционным газом. Далее газовая смесь проходит корзину с фарфоровыми кольцами Рашига, где отделяется от капель жидкого аммиака, поднимается по трубкам теплообменника и направляется в выносной теплообменник 4, а затем в колонну синтеза.
Жидкий аммиак из первичного сепаратора проходит магнитный фильтр 16, где из него выделяется катализаторная пыль, и смешивается с жидким аммиаком из конденсационной колонны 8. Затем его дросселируют до давления 4 Мпа и отводят в сборник жидкого аммиака 11. В результате дросселирования жидкого аммиака до 4 Мпа происходит выделение растворенных в нем газов Н2, N2, O2, CH4. Эти газы, называемые танковыми, содержат 16-18% NН3. Поэтому танковые газы направляют в испаритель 12 с целью утилизации аммиака путем его конденсации при - 25°С. Из испарителя танковые газы и сконденсировавшийся аммиак поступает в сепаратор 13 для отделения жидкого аммиака, направляемого в сборник жидкого аммиака 11.
Для поддержания в циркуляционном газе постоянного содержания инертных газов, не превышающего 10%, производится продувка газа после первичной конденсации аммиака (после сепаратора 6). Продувочные газы содержат 8-9% NН3, который выделяется при температуре - 25... -30°С в конденсационной колонне 9 и испарители 10 продувочных газов. Смесь танковых и продувочных газов после выделения аммиака используется как топливный газ.
Крупнотоннажное производство аммиака характеризуют следующие выбросы в окружающую среду:
1) газовые, содержащие в своем составе аммиак, оксиды азота и углерода и другие примеси
2) сточные воды, состоящие из конденсата, продуктов промывки реакторов и систем охлаждения;
3) низко потенциальную теплоту.
Относительная концентрация токсичных примесей производства аммиака в виде оксида углерода и оксидов азота в отходящих газах невысока, но когда происходит восстановление оксидов азота до элементного азота, для устранения даже незначительных выбросов разрабатываются специальные мероприятия. Полное исключение токсичных выбросов возможно при использовании каталитической очистки в присутствии газа-восстановителя.
В результате воздушного охлаждения и замены поршневых компрессоров турбокомпрессорами значительно уменьшилось потребление воды на 1 т МНз, что привело к существенному снижению количества сточных вод (а в 50 раз).
Низкопотенциальную теплоту удается утилизировать повышением ее потенциала: это достигается вводом некоторого количества высокопотенциальной теплоты. Но этот путь получения механической энергии связан с увеличением загрязненности воздушного бассейна дымовыми газами. Одним из способов уменьшения выбросов и повышения эффективности производства аммиака является применение энерготехнологической схемы с парога-зовым циклом, в котором в качестве рабочей теплоты используется не только теплота водяного пара, но и продуктов сгорания топлива.
Операторная схема
колонна синтеза
теплообменники
теплообменники
сеператор первой ступени
сеператор второй ступени
сборник жидкого NH3
сепаратор
Блок схема
колонна синтеза
сеператор первой ступени
сеператор второй ступени
танк
Исходные данные для расчета
| Содержание NH3 газа после колонны синтеза% по объему
|
15
|
| Давление газа, Мпа
-в сепараторе I ступени
-в сепараторе II ступени
Давление газа, ат.
-в сепараторе I ступени
-в сепараторе II ступени
|
29
31
295,72
316,0
|
| Температура газа, °С
-после водяного воздушного охлаждения
-после аммиачного холодильника
|
30
-8
|
| Растворимость азотоводородной смеси в жидком аммиаке нм3/кг(NH3)
-в сепараторе I ступени
-в сепараторе II ступени
|
0,087
0,0176
|
| Концентрация NH3 в танковых газах% (по объему)
|
39
|
| Базис расчета, кг NH3 на выходе из танка
|
3600
|
Расчет концентраций аммиака в потоке по формуле ларсена и блэка
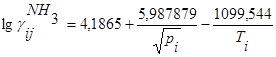 , где , где
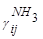 - концентрация аммиака в потоке% (по объему) - концентрация аммиака в потоке% (по объему)
pi и Ti давление, ат. и температура, К газа
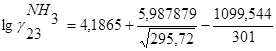 =0,883, =0,883, 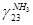 =101,181=7,65%=0,0765 =101,181=7,65%=0,0765
 =0,374 =0,374 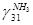 =100,714=2,37%=0,0237 =100,714=2,37%=0,0237
Материальный баланс
По колонне синтеза:
По азотоводороднои смеси
1) 
По сепаратору I ступени:
По азотоводороднои смеси
2) 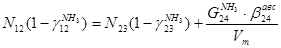
По аммиаку
3) 
По сепаратору II ступени:
По азотоводородной смеси
4) 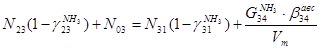
По аммиаку
5) 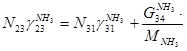
По танку:
По азотоводородной смеси
6) 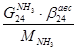 + +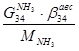 = =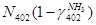
По аммиаку
7) 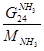 + +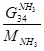 = =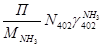
П - расчетное количество аммиака.
b - растворимость авс в жидком аммиаке
Соответствие переменных потокам:
| Наименование потока
|
Усл. обозн.
|
Хi
|
Размерн.
|
Значение
|
| 1
|
Поток, поступающий в колонну синтеза
|
N31
|
X1
|
КМОЛЬ
|
1951,6
|
| 2
|
Поток газа после колонны синтеза
|
N12
|
X2
|
КМОЛЬ
|
1737,3
|
| 3
|
Поток газа после сепаратора I ступени
|
N23
|
X3
|
КМОЛЬ
|
1595,7
|
| 4
|
Поток свежей азотоводородной смеси
|
N03
|
X4
|
КМОЛЬ
|
432,7
|
| 5
|
Поток танковых газов
|
N402
|
X5
|
КМОЛЬ
|
6,609
|
| 6
|
Поток жидкого NH3 после сепаратора I ступени
|
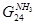
|
X6
|
КГ
|
2355,7
|
| 7
|
Поток жидкого NH3 после сепаратора II ступени
|
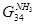
|
X7
|
КГ
|
1289,5
|
Получаем уравнения
1) 1,0237X1-1,15X2=0
2) 0,85X2-0,9235X3-0,001281X6=0
3) 0,15X2-0,0765X3-0,0588X6=0
4) - 0,9763X1+0,9235X3+X4-0,000786X7=0
5) - 0,0237X1+0,0765X3-0,0588X7=0
6) - 0,61X5+0,001281X6+0,000786X7=0
7) - 0,39X5+0,0588X6+0,0588X7=94,12
Составим матрицу коэффициентов при Х и столбец свободных членов:
| X1
|
X2
|
X3
|
X4
|
X5
|
X6
|
X7
|
Св. члены
|
| 1,0237
|
-1,15
|
0
|
0
|
0
|
0
|
0
|
0
|
| 0
|
0,85
|
-0,9235
|
0
|
0
|
-0,001281
|
0
|
0
|
| 0
|
0,15
|
-0,0765
|
0
|
0
|
-0,0588
|
0
|
0
|
| -0,9763
|
0
|
0,9235
|
1
|
0
|
0
|
-0,000786
|
0
|
| -0,0237
|
0
|
0,0765
|
0
|
0
|
0
|
-0,0588
|
0
|
| 0
|
0
|
0
|
0
|
-0,61
|
0,001281
|
0,000786
|
0
|
| 0
|
0
|
0
|
0
|
-0,39
|
0,0588
|
0,0588
|
211,76
|
Решаем систему уравнений матричным методом в программе Excel, умножая матрицу, обратную матрице коэффициентов но вектор свободных членов.
Заполняем таблицу потоков.
1. Расчет количеств азота и водорода в АВС.
N03=X4=432,7 кмоль
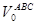 =N03×Vm=432,7×22,4 = 9692,48 м3 =N03×Vm=432,7×22,4 = 9692,48 м3
Отношение H2: N2 =3: 1Wоб(H2) =0,75Wоб(N2) =0,25
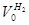 =0,75 × 9692,48 = 7269,36 м3 =0,75 × 9692,48 = 7269,36 м3
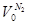 =0,25 × 9692,48 = 2423,12 м3 =0,25 × 9692,48 = 2423,12 м3
m(H2) =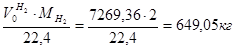
m(N2) =
Общая масса АВС
m(АВС) =m(H2) +m(N2) =649,05+3028,90=3677,95
Массовые доли азота и водорода:
Wмас(H2) = 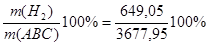 =17,6% =17,6%
Wмас(N2) =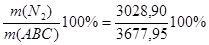 =82,4% =82,4%
2. Расчет количеств водорода, азота и аммиака в танковых газах.
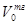 =N402×Vm=6,609×22,4 = 148,04 м3 =N402×Vm=6,609×22,4 = 148,04 м3
Количество водорода и азота:
NАВС=N402(1-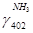 ) =6,609×(1-0,39) =4,031кмоль ) =6,609×(1-0,39) =4,031кмоль
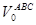 =NАВС×Vm=4,031×22,4 = 90,30 м3 =NАВС×Vm=4,031×22,4 = 90,30 м3
 =0,75 × 90,30 = 67,72 м3 =0,75 × 90,30 = 67,72 м3
 =0,25 × 90,30 = 22,57 м3 =0,25 × 90,30 = 22,57 м3
m(H2) =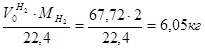 Wмас( Wмас(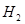 ) = ) =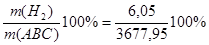 =0,16% =0,16%
m(N2) =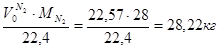 Wмас( Wмас(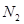 ) = ) =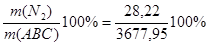 =0,77% =0,77%
Количество аммиака в танковых газах.
NNH3=N402×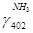 =6,609×0,39=2,577кмоль =6,609×0,39=2,577кмоль
V(NH3) =NNH3×Vm=2,577×22,4=57,73 м3
m(NH3) = 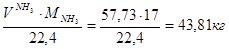 Wмас( Wмас(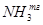 ) = ) =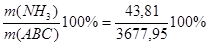 =1,19% =1,19%
Количество жидкого аммиака.
m(NH3) =3600 кг Wмас( ) = ) =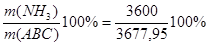 =97,88% =97,88%
N(NH3) =211,76 кмоль
V(NH3) =N(NH3) ×Vm=211,76×22,4=4743,42 м3
Общая расходная масса
Må= =3600+43,81+6,05+28,22=3678,08 кг =3600+43,81+6,05+28,22=3678,08 кг
Масса танковых газовэ
mтг= Må-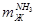 =3678,08-3600=78,08 кг =3678,08-3600=78,08 кг
Wмас(т. г) =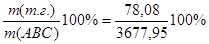 =2,12% =2,12%
Невязка
D=mавс - Må=3677,95-3678,08=0,13 Wмас(невязки) @0
Общий расходный объем(при н. у)
Vå=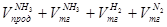 =4743,42+57,73+67,72+22,57=4891,44 м3 =4743,42+57,73+67,72+22,57=4891,44 м3
Материальный баланс системы
Базис расчета 3600 кг NH3
| Приход
|
Расход
|
| Наименование
|
М3, н. у.
|
кг
|
% масс
|
Наименование
|
М3, н. у.
|
кг
|
% масс
|
| АВС
|
9692,48
|
3677,95
|
100
|
Жидкий NH3
|
4743,42
|
3600
|
97,88
|
| В том числе
|
Танковые газы
|
148,04
|
78,08
|
2,12
|
| Азот
|
2423,12
|
3028,90
|
82,4
|
Азот
|
22,57
|
28,22
|
0,77
|
| Водород
|
7269,36
|
649,05
|
17,6
|
Водород
|
67,72
|
6,05
|
0,16
|
| Аммиак
|
57,73
|
43,81
|
1, 19
|
| Всего
|
9692,48
|
3677,95
|
100
|
Всего
|
4891,44
|
3677,95
|
100
|
| Невязка
|
0,13
|
Расчет основных технологических показателей
Выход аммиака
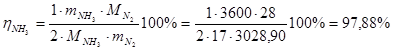
Расходные коэффициенты по сырью.
По азоту
а) теоретический
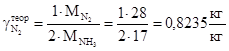
б) практический
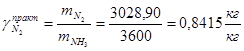
По водороду
а) теоретический

б) практический

1. А.М. Кутепов, Т. И - Бондарева, М.Г. Беренгартен, Общая химическая технология, М., Высшая школа, 1990
2. Справочник азотчика, М., Химия, 1987
3. Ф.А. Андреев, С.И. Карган, Л.И. Козлов, В.Ф. Приставко, Технология связанного азота, М., Химия, 1966
4. Г.Н. Кононова, В.В. Сафонов, Е.В. Егорова, Расчёт материального баланса химико-технологических систем интегральным методом, М., МИТХТ, 1999
|