| ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены.
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C2
H4
+ 2KMnO4
+ 2H2
O 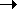 CH2
OH–CH2
OH + 2MnO2
+ 2KOH (охлаждение) CH2
OH–CH2
OH + 2MnO2
+ 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3
CH=CHCH2
CH3
+ 8KMnO4
+ 12H2
SO4
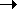 5CH3
COOH + 5C2
H5
COOH + 8MnSO4
+ 4K2
SO4
+ 17H2
O (нагревание) 5CH3
COOH + 5C2
H5
COOH + 8MnSO4
+ 4K2
SO4
+ 17H2
O (нагревание)
2) 5CH3
CH=CH2
+ 10KMnO4
+ 15H2
SO4
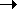 5CH3
COOH + 5CO2
+ 10MnSO4
+ 5K2
SO4
+ 20H2
O (нагревание) 5CH3
COOH + 5CO2
+ 10MnSO4
+ 5K2
SO4
+ 20H2
O (нагревание)
3) CH3
CH=CHCH2
CH3
+ 6KMnO4
+ 10KOH 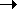 CH3
COOK + C2
H5
COOK + 6H2
O + 6K2
MnO4
(нагревание) CH3
COOK + C2
H5
COOK + 6H2
O + 6K2
MnO4
(нагревание)
4) CH3
CH=CH2
+ 10KMnO4
+ 13KOH 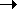 CH3
COOK + K2
CO3
+ 8H2
O + 10K2
MnO4
(нагревание) CH3
COOK + K2
CO3
+ 8H2
O + 10K2
MnO4
(нагревание)
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины.
Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3
C 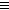 CH + 8KMnO4
+ 12H2
SO4 CH + 8KMnO4
+ 12H2
SO4
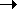 5CH3
COOH + 5CO2
+ 8MnSO4
+ 4K2
SO4
+ 12H2
O (нагревание) 5CH3
COOH + 5CO2
+ 8MnSO4
+ 4K2
SO4
+ 12H2
O (нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1
–CO–CO–R2
), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C2
H2
+ 8KMnO4
= 3K2
C2
O4
+2H2
O + 8MnO2
+ 2KOH
В кислотной среде окисление идет до углекислого газа:
C2
H2
+ 2KMnO4
+3H2
SO4
=2CO2
+ 2MnSO4
+ 4H2
O + K2
SO4
Гомологи бензола.
Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6
H5
CH3
+2KMnO4
= C6
H5
COOK + 2MnO2
+ KOH + H2
O (при кипячении)
C6
H5
CH2
CH3
+ 4KMnO4
= C6
H5
COOK + K2
CO3
+ 2H2
O + 4MnO2
+ KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты.
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2
H5
OH + K2
Cr2
O7
+ 4H2
SO4
= 3CH3
CHO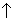 + K2
SO4
+ Cr2
(SO4
)3
+ 7H2
O (нагревание) + K2
SO4
+ Cr2
(SO4
)3
+ 7H2
O (нагревание)
С избытком окислителя (KMnO4
, K2
Cr2
O7
) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2
–CH2
OH, при нагревании в кислотной среде с раствором KMnO4
или K2
Cr2
O7
легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2
–COOH, HOOC–COOH и др.).
Альдегиды.
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4
, K2
Cr2
O7
, [Ag(NH3
)2
]OH. Все реакции идут при нагревании:
3CH3
CHO + 2KMnO4
= CH3
COOH + 2CH3
COOK + 2MnO2
+ H2
O
3CH3
CHO + K2
Cr2
O7
+ 4H2
SO4
= 3CH3
COOH + Cr2
(SO4
)3
+ 7H2
O
CH3
CHO + 2[Ag(NH3
)2
]OH = CH3
COONH4
+ 2Ag + H2
O + 3NH3
Формальдегид с избытком окислителя окисляется до углекислого газа.
|